酿酒酵母温度敏感性突变株的选育
岳希洁 蒋雪薇 罗晓明 周 慧 刘永乐 陈代文 周志明
(1. 长沙理工大学化学与生物工程学院,湖南 长沙 410004;2. 连南瑶族自治县奇乡生物科技有限公司,广东 清远 513300)
酿酒酵母温度敏感性突变株的选育
岳希洁 蒋雪薇 罗晓明 周慧 刘永乐 陈代文 周志明
(1. 长沙理工大学化学与生物工程学院,湖南 长沙410004;2. 连南瑶族自治县奇乡生物科技有限公司,广东 清远513300)
酿酒酵母;紫外诱变;温度敏感性突变株;自溶
酿酒酵母(Saccharomycescerevisiae)作为一种模式生物,具有安全可靠、遗传背景清晰等优点,被认为是外源基因最理想的真核生物表达系统[1-2]。由于其不能有效释放外源基因所表达的蛋白[3-4],故在工业中的应用存在着明显的局限性。近年来国内外开展了一些利用酵母细胞膜通透性提高外源蛋白分泌的研究,多集中在两个方面:① 采用物理方法处理[5-7],通过超声波、高压脉冲及光照等方法对细胞膜结构产生破坏,提高胞内物质及外源蛋白的分泌能力;② 利用基因工程的手段[8-10],重组或改造外源基因中的信号肽,增强外源蛋白的分泌能力。这两类方法中,机械处理对仪器设备要求较高、工业化生产难度大[11-12];基因工程手段则处理过程较为繁琐,技术难度较大[13]。相比之下,传统的遗传育种相对简便得多,但其研究少见报道,主要集中条件致死突变株的研究上,特别是高渗胁迫突变株的研究[14]。条件致死突变株除高渗胁迫突变株外,还有温度敏感性突变株。温度敏感性突变株(Temperature-sensitive mutant,Ts)是一种比较常用的条件致死突变株[15],其温度敏感性突变位点经常发生在细胞膜上,诱变筛选突变位点在细胞膜上的温度敏感性突变株亚致死类型,可以通过改变温度促使酵母适度自溶,产生细胞膜通透,促进胞内物质释放到胞外[16]。本试验拟以酿酒酵母二倍体(2n)及单倍体(n)为出发菌株,采用紫外诱变的方法,以胞内蛋白质、核酸渗透率及胞外1,6-二磷酸果糖(Fructose-1, 6-diphosphate,FDP)浓度为考察指标,筛选出温度敏感性突变株亚致死类型,利用其适度自溶特性,简便高效地构建能有效释放胞内产物的宿主系统,为酵母工程菌工业化的应用提供一条新的思路。
1 材料和方法
1.1材料与仪器
1.1.1菌种
酿酒酵母菌(Saccharomycescerevisiae)Y1:长沙理工大学食品与发酵研究所分离并保藏。
1.1.2培养基
酵母菌活化培养基:麦芽汁琼脂培养基,参照文献[17]242-244制备;
酵母菌生孢子培养基:McClary培养基,参照文献[18]制备;
酵母菌完全培养基:YEPD培养基,参照文献[17]242-244制备;
种子液培养基:葡萄糖10 g,蛋白胨20 g,酵母膏 10 g,蒸馏水1 000 mL,pH值为6,于121 ℃,湿热灭菌20 min;
发酵培养基:葡萄糖30 g,磷酸二氢钾27.2 g,磷酸氢二钾 45.6 g,氯化镁2 g,于121 ℃,湿热灭菌20 min。
1.1.3仪器
显微成像系统:Eclipse E200型,尼康仪器(上海)有限公司;
紫外分光光度计,UV1800型,日本岛津公司;
高速离心机:TGL-16G台式,常州诺基仪器有限公司。
1.2方法
1.2.1菌悬液的制备菌株Y128 ℃、160 r/min培养12 h,无菌生理盐水离心洗涤3次,制成108CFU/mL的菌悬液备用。
1.2.2紫外(UV)诱变致死率曲线的测定取10 mL菌悬液于无菌皿中,搅拌状态下,进行不同剂量的紫外照射,紫外照射条件:紫外灯30 W、垂直照射距离30 cm,分别照射10,20,30,40,50,60 s;计算致死率并确定最佳的诱变剂量。
1.2.3温度敏感性突变株筛选及鉴定方法将诱变后的酵母悬液进行梯度稀释,涂平板,影印接种于两组平板上(2n采用麦芽汁平板,n采用麦氏平板),分别于28,37 ℃培养48 h,挑选28 ℃平板上生长良好,37 ℃平板上微生长或不生长的菌株进入复筛;对应点接初筛挑选的菌株于两组平板上,先点接的平板于37 ℃培养,后点接的28 ℃培养,再次筛选37 ℃微生长或不长的菌株为目标菌[19]。
1.2.4酵母核酸、蛋白质渗透率测定方法将培养12 h的菌悬液接种于发酵培养基中,接种量10 mL/100 mL,37 ℃培养,2 h后取两份10 mL发酵液,一份紫外分光光度法测其在600 nm处的吸光值,另一份进行80 ℃水浴5 min,然后1×104r/min离心20 min,取其上清液,分别测定其在260,280 nm处吸光值,OD260、OD280与OD600比值分别计为胞外核酸、蛋白质的渗透率。
1.2.5FDP含量及提高率的测定FDP含量测定方法参照文献[20]。FDP提高率按式(1)计算:
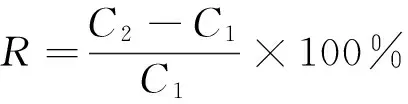
(1)
式中:
R——FDP提高率,%;
C1——出发菌株胞外FDP含量,μg/mL;
C2——诱变筛选菌株胞外FDP含量,μg/mL。
2 结果与分析
2.1酿酒酵母单倍体(n)的制备
将酿酒酵母二倍体(2n)接种于麦氏培养基上培养1周,筛选获得其单倍体(n),并通过显微镜下观察,检验酵母菌二倍体生孢子情况,其单倍体(n)子囊孢子见图1。由图1可知,在麦氏培养基上培养时,酵母菌二倍体(2n)营养细胞易转变生成子囊,这时细胞核进行减数分裂,形成4个子囊孢子。
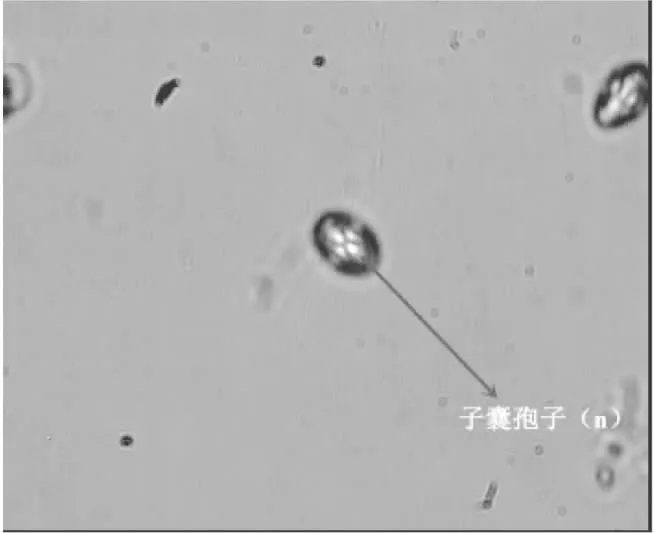
图1 酿酒酵母子囊孢子
2.2紫外诱变条件确定
紫外是一种应用广泛、效果明显的物理诱变剂,具有诱变频率高、不易回复突变等优点,是工业微生物育种中最常用和有效的诱变剂之一[21]。酿酒酵母的营养体多以二倍体(2n)的形式存在,但其单倍体(n)的突变率相对较髙,且单倍体(n)突变株经重新结合形成二倍体(2n)后,诱变所获得的性状能较稳定的遗传下去,因此,考虑以酵母二倍体(2n)、单倍体(n)同时作为诱变出发菌株,对其进行紫外诱变,结果见图2、3。由图2可知,随着紫外诱变时间的延长,酵母二倍体(2n)致死率逐渐升高,通常情况下取致死率70%~80%为最佳,因此可以确定酵母二倍体(2n)的紫外照射时间为30 s。酵母单倍体(n)由于孢子壁的保护作用,其耐紫外线能力要远远强于酵母细胞,同样,根据其诱变致死率曲线(图3),确定紫外照射时间为4.5 min。

图2 酿酒酵母二倍体(2n)致死率曲线
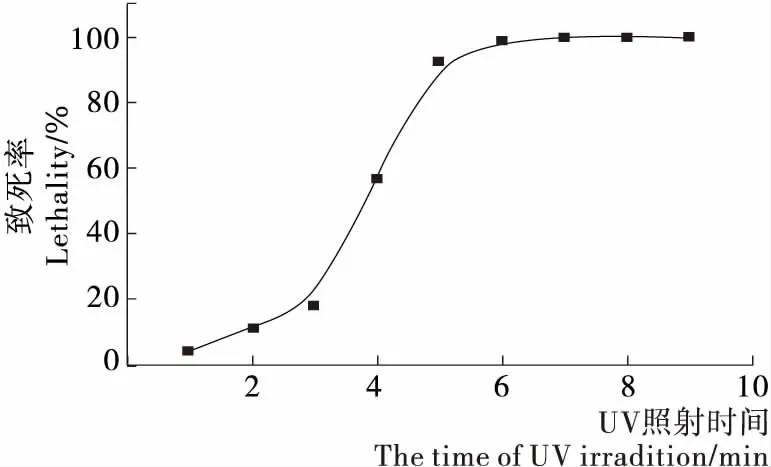
图3 酿酒酵母单倍体(n)致死率曲线
2.3温度敏感性突变株的筛选及生长特征鉴定
2.3.1酿酒酵母温度敏感性突变株影印培养法初筛以温度为筛选条件,通过影印培养法对诱变菌株中的温度敏感性突变株进行初筛,结果见图4。图4中左右两个平板上菌落一一对应,圆圈标出为突变株,不同温度培养时,其生长状况出现较大差异,即28 ℃生长正常,37 ℃无法生长或生长微弱,根据37 ℃平板对照培养情况,可以筛选出无法生长或生长微弱的菌株为温度敏感性突变株,经初筛,二倍体(2n)及单倍体(n)共筛选出20株。
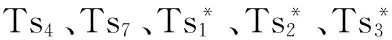
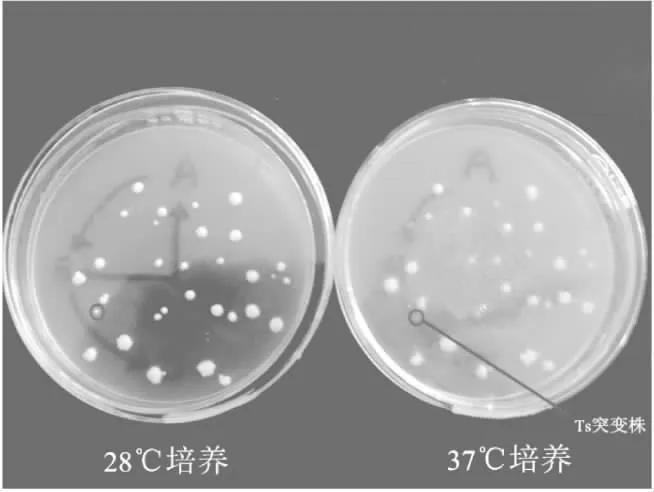
Ts突变株:温度敏感性突变株
Ts突变株:温度敏感性突变株
2.4温度敏感性突变株自溶程度考察
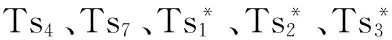
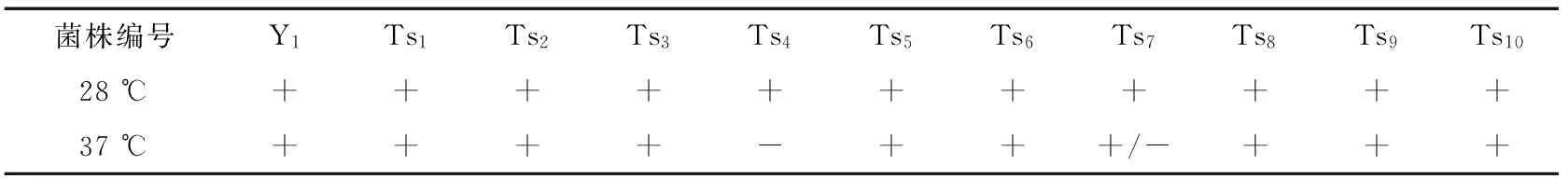
表1 酿酒酵母二倍体(2n)突变菌株生长谱†
†Y1为出发菌株;Tsn为二倍体菌株;-不生长;+/-生长微弱;+生长良好。

表2 酿酒酵母单倍体(n)突变菌株生长谱†
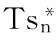

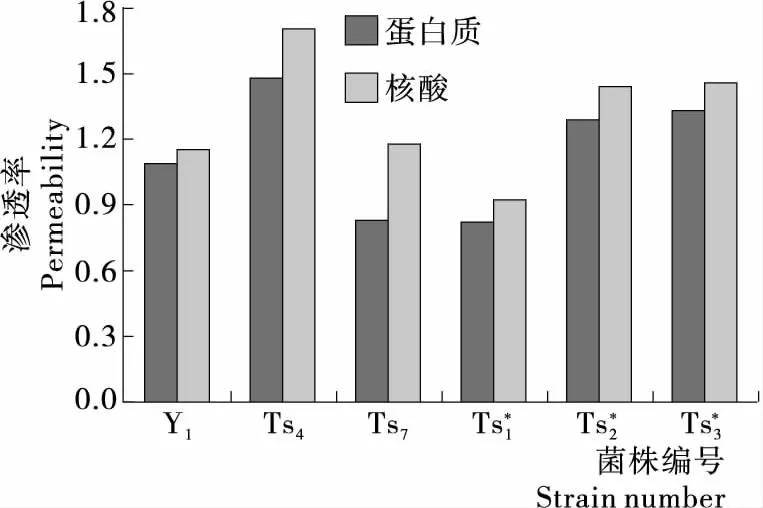
图6 突变株蛋白质、核酸渗透率
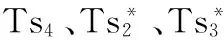
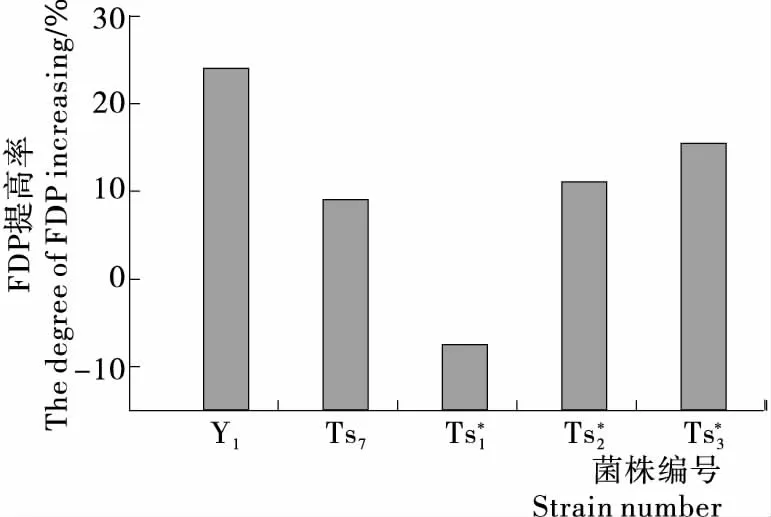
图8 突变株胞外FDP提高率
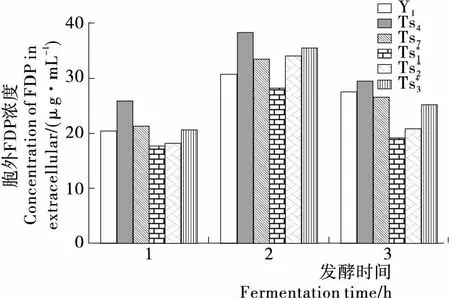
图7 突变株胞外FDP浓度
3 结论
高通透性细胞膜是增强酿酒酵母对胞内物质分泌能力的重要因素。通过简单的诱变处理,筛选出对温度较为敏感的条件自溶性菌株——温度敏感性突变株,可以较大程度提高酿酒酵母对外源蛋白的分泌能力。由于温度控制简便的特点,所筛选的目标菌株将具有良好的工业应用潜力。温度敏感性突变株条件性自溶对于改变细胞膜壁的通透性有着重要的意义,可有效促进胞内产物的胞外渗透,较好地简化了胞内产物的提取工艺。
[1] 何秀萍. 国内酿酒酵母分子遗传与育种研究 40年[J]. 微生物学通报, 2014, 41(3): 450-458.
[2] BUSER C. Toward sub-second correlative light and electron microscopy of Saccharomyces cerevisiae[J]. Methods in Cell Biology, 2010, 96: 217-234.
[3] 刘文, 胡巍, 王洪海. 酵母表达基因工程产物特性分析[J]. 生物工程进展, 2001, 21(2): 74-76.
[4] 姚春阳, 沈旭, 庄金秋. 巴斯德毕赤酵母表达系统的研究进展[J]. 黑龙江畜牧兽医, 2008(2): 26-28.
[5] FONSECA R A S, SILVA RAFAEL R, KALIL S J, et al. Different cell disruption methods for astaxanthin recovery by Phaffia rhodozyma[J]. African Journal of Biotechnology, 2011, 10(7): 1 165-1 171.
[6] 谢阁, 杨瑞金, 卢蓉蓉, 等. 利用高压脉冲电场诱导啤酒酵母细胞释放蛋白质与核酸[J]. 食品与发酵工业, 2008, 34(3): 44-47.
[7] 李冰, 王颖, 徐炳政, 等. 超声波辅助提取酵母源类金属硫蛋白工艺的优化[J]. 食品与机械, 2014, 30(3): 194-197.
[8] 李毅, 李子杰, 高晓冬. 木糖异构酶酿酒酵母孢子“微胶囊”的构建及酶学性质分析[J]. 食品与发酵工业, 2015, 41(4): 6-11.
[9] 暴立娟, 宋庆凤, 李杰. 重组木聚糖酶的安全高效表达与应用研究[J]. 食品工业科技, 2011(1): 156-158.
[10] SUDA Y, RODRIGUEZ R K, COLUCCIO A E, et al. A screen for spore wall permeability mutants identifies a secreted protease required for proper spore wall assembly[J]. PLoS One, 2009, 4(9): e7184.
[11] 史敬灼, 沈晓茜, 司彦娜. 基于 Lyapunov 稳定性的超声波电机模型参考自适应转速控制[J]. 微电机, 2014, 47(2): 37-39.
[12] 刘建, 胡孟春, 唐登攀, 等. 基于 LabVIEW 的脉冲辐射探测器灵敏度标定系统[J]. 仪表技术与传感器, 2014(4): 25-27.
[13] KAISA K, BRBEL H H, MARIE-F G G. Investigation of limiting metabolic steps in the utilization of xylose by recombinant Saccharomyces cerevisiae using metabolic engineering[J]. Yeast, 2005, 22(5): 359-368.
[14] 彭郦, 曾新安. 高糖胁迫对生长期酿酒酵母生理代谢的影响[J]. 现代食品科技, 2011, 27(4): 397-399.
[15] 施巧琴, 吴松刚. 工业微生物育种学[M]. 3版. 北京: 科学出版社, 2009: 22.
[16] 郭科, 周兵. 酵母 Ndi1p 突变表达文库的建立和温度敏感株的筛选[J]. 中国生物化学与分子生物学报, 2012, 28(10): 966-970.
[17] 沈萍, 陈向东. 微生物学实验[M]. 4版. 北京: 高等教育出版社, 2007.
[18] 杜连祥, 路福平. 微生物学实验技术[M]. 北京: 中国轻工出版社, 2006: 355.
[19] 张莉, 王婧, 杨婷, 等. 产β-葡萄糖苷酶酿酒酵母菌株紫外诱变选育及酶学性质分析[J]. 食品工业科技, 2015, 36(20): 220-224.[20] 李文莉, 缪冶炼, 陈介余, 等. 木质素降解物对酿酒酵母的毒性[J]. 生物加工过程, 2015, 13(1): 82-88.
[21] 苗兰兰, 张东杰, 王颖. 复合诱变高产金属硫蛋白酵母菌株的筛选[J]. 食品科学, 2013, 34(19): 261-264.
[22] 姚咏嫦. 插入式超声对酵母细胞膜通透性影响的研究[J]. 广东化工, 2006, 33(1): 42-44.
Breeding of temperature-sensitive mutant from Saccharomyces cerevisiae
1YUE Xi-jie11JIANGXue-wei11LUOXiao-ming11ZHOUHui11LIUYong-le12CHENDai-wen22ZHOUZhi-ming2
(1.CollegeofChemistry&Bioengineering,ChangshaUniversityofScience&Technology,Changsha,Hunan410004,China; 2.LiannanYaoautonomousCountyQixiangBIO-SCICO.,Ltd,Qingyuan,Guangdong513300,China)
清远市科技计划项目(编号:2013A024,2014A023);湖南省科技计划项目(编号:2013FJ4036)
岳希洁,女,长沙理工大学在读硕士研究生。
蒋雪薇(1972—),女,长沙理工大学副教授,博士。
E-mail:jxw_72@sina.com
2016—06—15
10.13652/j.issn.1003-5788.2016.08.003

