水泡性口炎病毒与Monocyte及MoDC的互作研究
邹胜利,聂作明,吴祥甫,方心葵,孙 涛
(1.浙江理工大学生物化学研究所,杭州 310018;2.上海交通大学上海市兽医生物技术重点实验室,上海 200240)
水泡性口炎病毒与Monocyte及MoDC的互作研究
邹胜利1,聂作明1,吴祥甫1,方心葵2,孙涛2
(1.浙江理工大学生物化学研究所,杭州 310018;2.上海交通大学上海市兽医生物技术重点实验室,上海 200240)
为了探究水泡性口炎病毒(Vesicular stomatitis virus ,VSV)与天然宿主免疫细胞的互作关系,实验用M蛋白第51位甲硫氨酸残基缺失后的重组病毒(VSVΔM51-GFP)和第51位甲硫氨酸敲除、第221位缬氨酸突变为苯丙氨酸、第226位丝基酸突变为精氨酸的重组病毒(VSV-MT-GFP)以及野生型重组病毒(VSV-GFP)感染猪单核细胞(Monocyte)和单核细胞诱导的树突状细胞(Monocyte-derived dendritic cell,MoDC),通过空斑实验制作病毒生长曲线,用激光共聚焦显微镜和流式细胞仪检测细胞的感染状况,ELISA检测细胞培养上清中的细胞因子表达变化。结果表明,VSV、VSVΔM51、VSV-MT均可感染Monocyte和MoDC,且Monocyte的感染率仅为8.38%。3种病毒在MoDC中可以大量复制,但无法在Monocyte中扩增。且与野生型VSV相比,VSVΔM51、VSV-MT细胞致病性依次减弱。VSV能有效激活TNF-α、IL-8、IFN-α相关免疫细胞因子在MoDC中的表达,且M蛋白突变程度越大,病毒激活能力越强。
水泡性口炎病毒;单核细胞;MoDC;互作;基质蛋白M
0 引 言
水泡性口炎(vesicular stomatitis,VS)是由水泡型口炎病毒(vesicular stomatitis virus,VSV)引起的一种人畜共患急性传染病,可通过多种媒介广泛传播。VSV属于弹状病毒科水泡病毒属成员,按其血清型可分为新泽西型和印第安纳型[1],基因组为一条单链RNA分子,分别编码N、NS、M、G、L 5种主要结构蛋白,其中M和G蛋白定位于病毒粒子包膜蛋白。M蛋白由229个氨基酸组成,能使核衣壳同含有G蛋白的包膜或细胞膜发生相互联系,故M蛋白被认为是一种桥连分子和重要的致病因子[2]。树突状细胞[3](Dendritic Cell)是目前已知功能最强大的抗原递呈细胞,作为机体适应性T细胞免疫应答的始动者,DC细胞能够显著刺激初始T细胞的增殖。病毒感染DC后,能够不同程度引起MHC II、TNF-α、IL-12、和CD80/86等细胞因子及表面蛋白的变化。病毒感染致使细胞因子分泌的改变可以反映出细胞免疫的倾向性。IFN-α的分泌可以促进动物体内未成熟DC的成熟[4],TNF-α的分泌可诱导DC主要组织相容性复合物的表达,可以提高DC细胞的抗原递呈能力。IL-8是一种强有力的细胞趋化因子和活化因子,是激活中性粒细胞的吞噬功能和溶酶体活性,此外对T淋巴细胞也有一定的趋化作用[5]。
近年来,VSV相继被人们应用于HIV、乳腺癌[6]等疾病的疫苗研究[7]。2014年,起源于非洲的埃博拉病毒引起全球恐慌,近日,加拿大公共卫生署的科研人员成功研发出基于口炎病毒载体的VSV-EBOV埃博拉疫苗[8],已投入临床实验,并表现出强大的临床效果。
而此前对VSV与M蛋白的研究数据主要来源于小鼠,在BALB/c小鼠实验中已经证明基质蛋白M与细胞感染有关,但其在天然宿主致病机制中的作用并不清楚。与小鼠相比,VSV在天然宿主中与免疫细胞的互作模型回归本体动物,使研究结果更具有参考意义。观察DC感染病毒后的功能和表型变化,可帮助人们探究VSV传播机制,通过比较M蛋白突变后病毒的致病性和免疫原性变化,也可为VSV病毒弱化和载体疫苗提供参考。
1 材料与方法
1.1材料与试剂
1.1.1病毒株与细胞
表达绿色荧光蛋白的野生型重组VSV(VSV-GFP)、M蛋白第51位甲硫氨酸缺失的重组病毒VSVΔM51-GFP、以及在VSVΔM51-GFP基础上将第221位缬氨酸突变为苯丙氨酸、第226位丝基酸突变为精氨酸的重组病毒(VSV-MT-GFP)、猪肾细胞系(IBRS2)和非洲绿猴肾细胞(VERO)、Monocyte及MoDC均由上海交通大学兽医生物技术重点实验室分离制备和诱导。采血用猪为上海交通大学实验动物中心的中型西双版纳猪。
1.1.2主要试剂及仪器
细胞培养用RPMI-1640培养基、DMEM培养基和胎牛血清以及MHC II、CD80荧光抗体购自赛默飞。低吸附24孔细胞培养板购自美国康宁公司,细胞磁珠分选设备及CD14抗体购自德国Miltenyi公司,流式细胞仪分别用到BD公司FACSCalibur和Beckman Coulter公司的CytoFLEX型号,激光共聚焦显微镜为德国徕卡TCS SP5 II型号,TNF-α、IL-8、IFN-α检测试剂盒购自北京四正柏生物科技有限公司。其他常用试剂为国产分析纯。
1.2实验方法
1.2.1猪Monocyte及MoDC的分离及诱导
从猪心脏静脉丛取血120 mL,加适量1 %肝素抗凝,缓慢移入装有17 mL淋巴细胞分离液的50 mL离心管中,2000 r/min离心20 min,使离心机自然减速。将上层与中层之间的乳白色单个核细胞层用吸管吸出,加入红细胞裂解液裂解5 min后再加DPBS缓冲液2000 r/min离心5 min,进行细胞计数后按照每107个细胞加入10 μL CD14磁珠抗体,室温孵育10 min,加DPBS缓冲液离心后加入3 mL的无血清RPMI-1640培养基过柱,将磁性分选柱从磁场中移走,用含10% FBS得到Monocyte细胞。将得到的Monocyte细胞计数,用RPMI-1640培养基调整细胞密度至2×106/mL,加入猪IL-4和GM-CFS,使二者工作浓度为10 ng/mL,将细胞移至表面低吸附24孔细胞培养板,诱导5 d。
1.2.2MoDC的鉴定
把经过诱导培养的MoDC细胞从低吸附24孔板中轻轻吹打洗出,用DPBS洗1遍,用MHC II及CD80荧光抗体避光染色20 min,1000 r/min离心2 min,加入500 μL DPBS重悬,上流式细胞仪检测MHC II和CD80含量。
1.2.3病毒在IBRS2、Monocyte及MoDC细胞的多步生长曲线
按MOI(multiplicity of infection)=1,用VSV-GFP、VSVΔM51-GFP和VSV-MT-GFP分别感染IBRS2、Monocyte及MoDC细胞,孵育1 h后,用DPBS洗3遍,在接种病毒后的2、8、12、24、48 h收集细胞上清,并依次按1∶103;1∶104;1∶105;1∶106;1∶107;1∶108稀释后,感染12孔细胞培养板中的VERO细胞,37℃孵育1h后用PBS洗涤,按1∶1加入含有10% FBS的DMEM培养基和1 %低熔点琼脂糖凝胶,等凝胶冷却凝固后,放置在5 %的二氧化碳培养箱中培养16~24 h,待空斑形成后用微波炉加热,弃去培养基和琼脂糖凝胶,加入1 %的结晶紫染色液染色2 min后洗去染色液,晾干后选取合适的孔对空斑进行计数,根据病毒稀释倍数计算病毒滴度,制作病毒多步生长曲线。
1.2.4Monocyte和MoDC细胞病毒感染检测
分别按MOI=1将3种病毒接种MoDC细胞,按MOI=1和MOI=10接种Monocyte细胞。病毒孵育1 h后,用DPBS洗3遍,培养12 h。用流式细胞仪检测细胞病毒感染率,随后用激光共聚焦显微镜对感染病毒后MoDC及Monocyte观察GFP荧光。
1.2.5细胞因子的检测
按MOI=1将3种病毒接种MoDC细胞,孵育1 h后,用DPBS洗3遍,12 h后收集细胞培养上清,用ELISA试剂盒检测TNF-α、IL-8和IFN-α。实验用RPMI-1640培养基作为空白对照,用未感染病毒的MoDC上清作为阴性对照。具体操作方法参照检测试剂盒说明书。
2 结 果
2.1MoDC诱导后的鉴定
Monocyte诱导过程中,在显微镜下可以看到细胞逐渐聚集成团,从第三天开始逐渐呈现出典型的毛刺状突起,呈现出MoDC细胞表型。将诱导得到的MoDC细胞用MHC II及CD80荧光抗体避光染色20 min,上流式细胞仪检测。用未经荧光抗体染色的阴性细胞设门,如图1所示,MHC II及CD80/86表面标志的双阳性比例可达到86%左右,成熟的DC细胞高表达MHC II类分子和CD80/86共刺激分子[9],表明诱导得到的细胞成熟度和一致性较高。
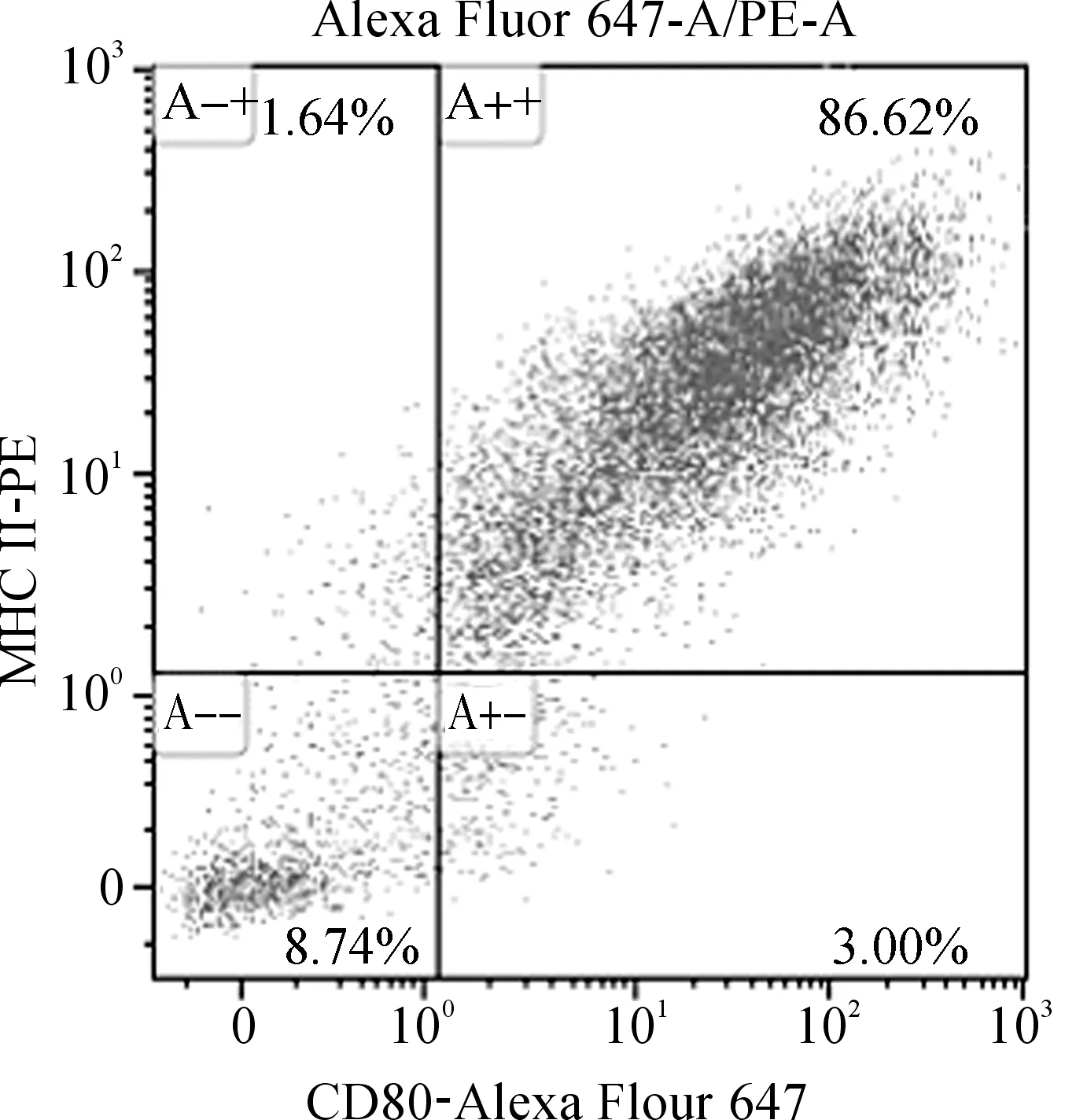
图1 MoDC的纯度鉴定
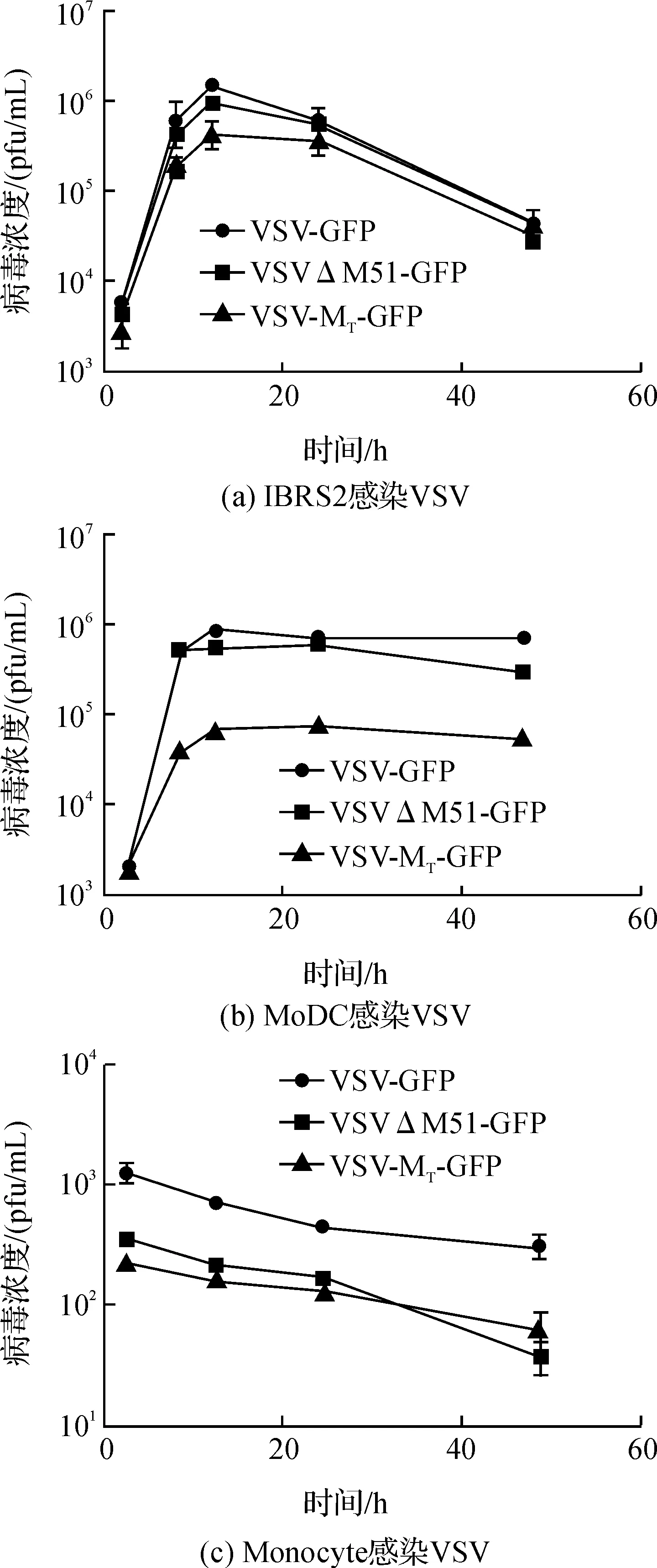
图2 病毒在细胞中的生长曲线
2.2 3种病毒在IBRS2、Monocyte及MoDC中生长动力学特征
IBRS2作为一种猪肾细胞系,常用于很多猪瘟病毒的增殖,本实验以IBRS2细胞作为病毒在普通细胞中繁殖状况。通过空斑试验对接毒后的细胞培养上清中的病毒含量进行定量,得到其各自的生长曲线。观察病毒在IBRS2、Monocyte及MoDC中的生长曲线,如图2(a)和(b)所示,3种病毒在IBRS2和MoDC均可进行复制,IBRS2细胞在12 h时上清病毒浓度达到最大值,且随着时间增加细胞逐渐凋亡,病毒滴度快速降低。MoDC细胞在感染病毒12 h后病毒滴度达到最大值,随后病毒滴度维持在一定水平,下降趋势缓慢。如图2(c),多次重复空斑实验表明病毒在Monocyte培养上清中的浓度并未增加。
2.3病毒在Monocyte和MoDC中的感染状况
为了验证Monocyte这一DC前体细胞能否被VSV有效感染,用VSV-GFP分别在MOI=1和MOI=10的条件下感染Monocyte 12h后,进行激光共聚焦显微镜和流式细胞仪检测感染状况。如图3所示,重组病毒VSV-GFP感染Monocyte后,可以看到少量细胞发出GFP荧光,表明VSV可以感染Monocyte。用未感染VSV病毒的Monocyte细胞做为阴性对照,如图4所示,在MOI=1时,Monocyte感染率为8.38%,当感染细胞的病毒浓度提高十倍(MOI=10),其感染率仅提高至16.56%。相比之下,VSV对MoDC的感染率明显高于Monocyte,接种VSV-GFP 8 h后MoDC感染率可达到54%。
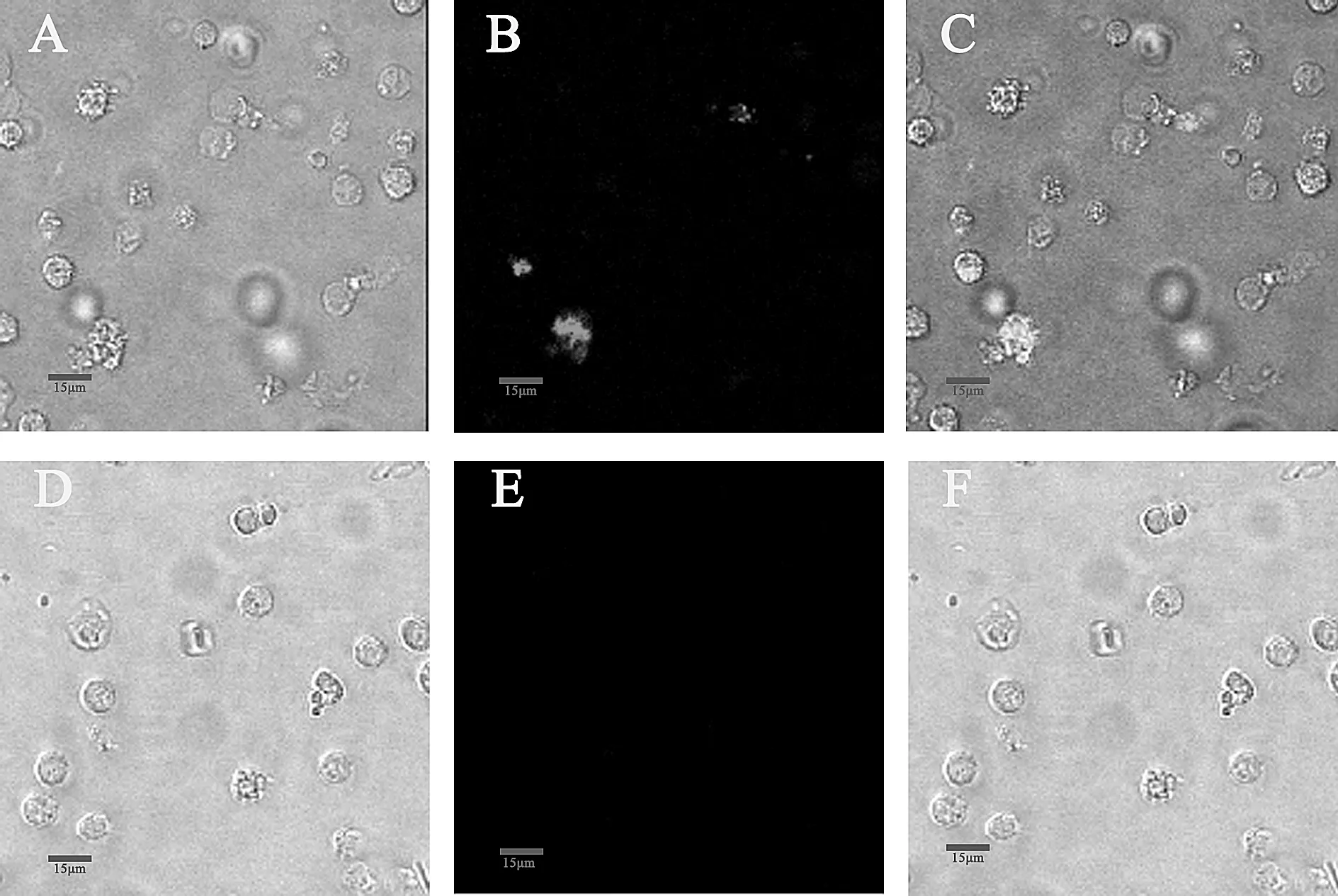
图3 Monocyte 的共聚焦荧光图像注:A、D为白光模式,B、E为488nm蓝色激发光,C、F为自光模式和488nm蓝色激发光的合并。
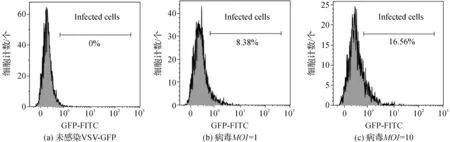
图4 Monocyte病毒感染率
2.4VSV感染MoDC细胞对细胞因子分泌的改变
用ELISA检测试剂盒对细胞培养上清中的TNF-α、IL-8及IFN-α进行检测,结果发现TNF-α、IL-8和IFN-α在感染前后发生了较大的变化。TNF-α和IFN-α在3种接毒MoDC上清中的浓度依次为VSV
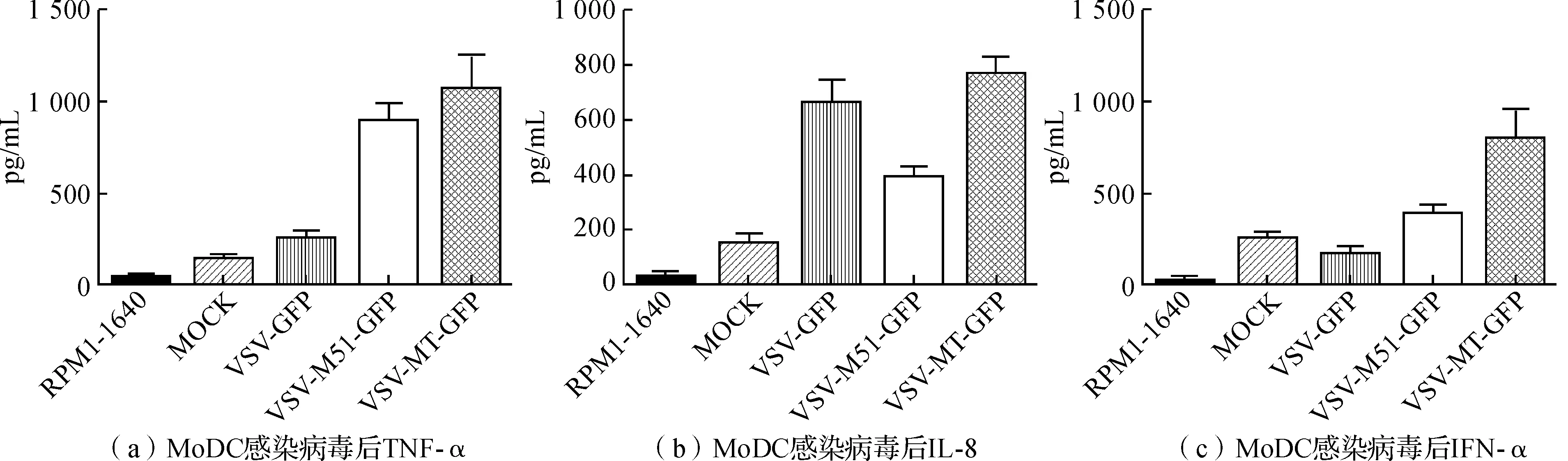
图5 MoDC感染病毒后细胞因子的表达变化
3 讨 论
通过病毒的生长曲线可以证实,VSV在体外可以感染DC细胞。通过比较3种病毒的上清滴度,可知3种病毒在DC细胞中复制能力依次为VSV、VSVΔM51和VSV-MT,M蛋白作为VSV中重要的毒力因子,未突变的M蛋白可阻遏宿主细胞的mRNA从细胞核向细胞外的转运,一定程度上抑制感染的细胞产生干扰素[10],可使病毒躲过宿主的免疫系统得以复制的同时,降低对宿主细胞杀伤性。在空斑实验中,野生型的重组病毒VSV形成的空斑较大且清晰,而VSV-MT形成的空斑斑痕相对模糊,毒力明显弱于野生型VSV。
与病毒在MoDC中的表现不同,多次空斑实验均表明VSV无法在Monocyte中复制,激光共聚焦实验和流式细胞仪检测说明Monocyte的感染率明显低于MoDC。在研究登革热病毒的实验中发现登革热病毒在Monocyte细胞中同样无法扩增[11],表明部分病毒难以进入Monocyte,而Singleton在研究猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)中发现PRRSV在Monocyte中的可以大量复制。以VSV为载体的疫苗虽然在动物实验中都产生了很好的保护效果,但由于减毒重组活载体疫苗有在体内复制的特点,其安全性受到质疑,因此,对Monocyte能被VSV感染却无法复制的机制研究可为人们在VSV疫苗研制中提供思路。
VSV感染DC后能够通过相关细胞因子的表达和分泌激活DC细胞,发挥其抗原递呈作用。病毒的免疫源性与致病性一般表现为对应关系,当VSV M蛋白突变后,其致病性下降,免疫原性往往随之下降。而本研究中与野生型VSV和VSVΔM51相比,VSV-MT在表现出低复制和低毒性的特点的同时,却能够更大程度地激活DC细胞发挥作用,M蛋白作为参与宿主细胞凋亡的重要病毒因子,在MoDC细胞中因其突变产生稳定差异将为研究与M蛋白相关的VSV载体疫苗提供参考和依据。
[1] MARTINEZ I, BARRERA J C, RODRIGUEZ L L, et al. Recombinant vesicular stomatitis (Indiana) virus expressing New Jersey and Indiana glycoproteins induces neutralizing antibodies to each serotype in swine, a natural host[J]. Vaccine,2004,22(29/30):4035-4043.
[2] FANG X, ZHANG S, SUN X, et al. Evaluation of attenuated VSVs with mutated M or/and G proteins as vaccine vectors[J]. Vaccine,2012,30(7):1313-1321.
[3] LANG P A, MERYK A, PANDYRA A A, et al. Toso regulates differentiation and activation of inflammatory dendritic cells during persistence-prone virus infection[J]. Cell Death and Differentiation,2015,22(1):164-173.
[4] PLEVIN R E, KNOLL M, MCKAY M, et al. The role of lipopolysaccharide structure in monocyte activation and cytokine secretion[J]. Shock,2016,45(1):22-27.
[5] GILLE C, STEFFEN F, LAUBER K, et al. Clearance of apoptotic neutrophils is diminished in cord blood monocytes and does not lead to reduced IL-8 production[J]. Pediatric Research,2009,66(5):507-512.
[6] EBERT O, HARBARAN S, SHINOZAKI K, et al. Systemic therapy of experimental breast cancer metastases by mutant vesicular stomatitis virus in immune-competent mice[J]. Cancer Gene Therapy,2005,12(4):350-358.
[7] FLANAGAN E B, ZAMPARO J M, BALL L A, et al. Rearrangement of the genes of vesicular stomatitis virus eliminates clinical disease in the natural host: new strategy for vaccine development[J]. Journal of Virology,2001,75(13):6107-6114.
[8] GARBUTT M, LIEBSCHER R, WAHL-JENSEN V, et al. Properties of replication-competent vesicular stomatitis virus vectors expressing glycoproteins of filoviruses and arenaviruses[J]. Journal of Virology,2004,78(10):5458-5465.
[9] CHAKRABORTY K, CHATTERJEE S, BHATTACHARYYA A. Modulation of phenotypic and functional maturation of murine bone-marrow-derived dendritic cells (BMDCs) induced by cadmium chloride[J]. International Immunopharmacology,2014,20(1):131-140.
[10] SIMON I D, VAN ROOIJEN N, ROSE J K. Vesicular stomatitis virus genomic RNA persists in vivo in the absence of viral replication[J]. Journal of Virology,2010,84(7):3280-3286.
[11] SCHMID M A, DIAMOND M S, HARRIS E. Dendritic cells in dengue virus infection: targets of virus replication and mediators of immunity[J]. Frontiers in Immunology,2014,5(657)647-647.
(责任编辑: 许惠儿)
Study on Interactions of Vesicular Stomatitis Virus with Monocyte and MoDC
ZOUShengli1,NIEZuoming1,WUXiangfu1,FangXinkui2,SUNTao2
(1.School of Life Science, Zhejiang Sci-Tech University, Hangzhou 310018, China; 2. Shanghai Municipal Veterinary Key Laboratory, Shanghai Jiao Tong University, Shanghai 200240, China)
In order to explore the interactions between VSV (Vesicular stomatitis virus) and immune cells of natural host, three recombinant VSVs, including the wild-type VSV-GFP, the VSV with M51 deletion (VSVΔM51-GFP) and the VSV with triple mutations of M51 deletion, V221F and S226R (VSV-MT-GFP), were used to infect the pig monocyte and monocyte-derived dendritic cell. The plaque experiment was done to make virus growth curve. Then confocal laser scanning microscope and Flow cytometry were used to assess the cell infection status. The change in cytokines expression in MoDC was detected by ELISA assay kit. The results show that three viruses can infect monocyte and MoDC, and virus infection rate of Monocyte is only 8.38%. The three viruses are unable to replicate in quantity in monocyte, but cannot proliferate in monocyte. Compared with wild-type VSV, the pathogenicity of VSVΔM51 and VSV-MTdecreases successively. They can effectively activate the expression of TNF-α, IL-8, IFN-α in MoDC, and the virus activation capacity is positively correlated with the degree of M protein mutation.
vesicular stomatitis virus; dendritic cell; MoDC; interaction; matrix protein M
10.3969/j.issn.1673-3851.2016.09.019
2015-01-29
国家自然科学基金项目(31272562)
邹胜利(1990-),男,河南驻马店人,硕士研究生,主要从事分子生物学方面的研究。
Q255
A
1673- 3851 (2016) 05- 0749- 05 引用页码: 090701

