由一框图看知识迁移在化学化工实验中的应用
田勤奋,庄建东
(福建农林大学材料工程学院,福建福州350002)
由一框图看知识迁移在化学化工实验中的应用
田勤奋,庄建东
(福建农林大学材料工程学院,福建福州350002)
迁移是一种学习对另一种学习的影响,这种影响有积极的,叫正迁移;有消极的,叫负迁移。当然,我们需要积极的迁移,防止或避免消极的迁移。基于此,举例证明正迁移的应用。
迁移;反应方程;作用
前言
化学实验在化学教学中占有重要的地位,科学合理的实验教学可以培养学生的观察能力, 知识迁移能力,创新思维能力,是培养学生科研能力的必要途径。
1 实图例
图1所示图例作为框图推断并不鲜见,但由此进行知识的迁移,就能把化学化工的很多知识有机联系起来,也能把很多知识点有效开发出来[1,2]。当然,这些开发并不是无病呻吟,不是为做题而做题,而是有实际意义的。

图1 框图推断
2 原设计思路
比较卤素单质氧化性的强弱,如图1中A、D、 E是卤素单质[3],以上全为水溶液中的置换反应,则A、D、E的氧化性由强到弱的顺序是什么。一定条件下,E和D按物质的量之比为5∶1在水中恰好反应。
图1涉及的反应有3个:①涉及的反应是由A 制D;②涉及的反应是由E制D;③涉及的反应是由E制A。说明的问题是A比D强,E比D强,E比A强。从而推理,E强于A强于D。具体到本文的氧化性,由①可看出A比D强,由②可看出E比D强,由③可看出E比A强,所以E>A>D,如果对号入座,那么E是Cl2,A是Br2,B是I2,反应方程式是
2.1 迁移一:比较金属单质还原性强弱
如A、D、E是金属单质,以上全为水溶液中的置换反应,那么金属单质的活泼性或还原性顺序也应为E>A>D[3]。如以上B、F、G的溶液全为硝酸盐,那么E可制A,A可制D,E当然可制D。具体E可为Zn,A可为Fe或Cu,D为Cu或Ag。
2.2 迁移二:比较酸性顺序
①如以上反应都在水溶液中进行,3%~5% 的A溶液是食品调味剂的主要成分,E与AgNO3反应产生白色沉淀,D的溶液与FeCl3相遇显紫色,则酸性顺序肯定是E>A>D。具体E是HCl,A是CH3COOH,D是Al(OH)3。B、G、F为相对应的盐溶液。②把上例中D还可换为H2SiO3,从而比较酸性HCl>CH3COOH>H2SiO3。B、G、F仍为相对应的盐溶液。③如E是造成胃酸过多的物质,A、D是常用的治疗胃酸过多的物质,写出①②③的离子方程式。
解析:导致胃酸过多的物质是盐酸,通常治疗胃酸过多的物质是NaHCO3和Al(OH)3。根据由强制弱的顺序,E是盐酸,A是NaHCO3溶液,D 是Al(OH)3。这三种物质在水中的pH由大到小是Al(OH)3>NaHCO3>HCl。B是偏铝酸盐,F是盐酸盐,G是碳酸盐。所以对应的离子方程式:

本例设计得特别好,既和生活密切相关,又体现了巧合,因为有了巧合,就有了尖锐的矛盾冲突,就有了戏剧性。另外,①离子方程式很难写,其是复分解反应,不是双水解反应。这个方程式还可以说明酸性HCO>>Al(OH),还能说明233和不共存。在考试中有很强的针对性。
2.3 迁移三:比较碱性顺序(溶液中进行)
(1)如E是离子化合物,其阳离子、阴离子各含有10个电子。D是白色沉淀,不溶于水,25℃ 0.1mol/ L的A的水溶液pH约为11。问D是什么物质?如何区别?
解析:碱性强弱肯定是E>A>D。E是强碱,其阴阳离子各有10个电子,是NaOH;A是弱碱,其电离常数约为1×10-5,因此是NH3·H2O,D可能是Mg(OH)2或Al(OH)3。区别方法:给白色沉淀上滴过量NaOH,如沉淀消失为Al(OH)3,如不消失为Mg(OH)2。本例也很实用。
(2)如把D换为蓝色沉淀,写出给B的溶液中加入过量A的离子方程。
解析:蓝色沉淀应为Cu(OH)2。说明碱性NaOH>NH3·H2O>Cu(OH)2。
(3)如把D换为黑色沉淀,同样的道理则是制银氨溶液。

(4)如把D换为红褐色沉淀,则D是Fe(OH)3。
2.4 迁移四:比较难溶电解质的溶解度或溶度积Ksp大小
在化学上一般情况下发生的反应是:强酸制弱酸,强碱制弱碱,强氧化剂制弱氧化剂,强还原剂制弱还原剂,溶解度大的制溶解度小的,Ksp大的制Ksp小的。
(1)B、G、F都是稀的钠盐溶液,A、D、E可能是AgCl、AgBr、AgI悬浊液,问具体A是什么,D是什么,E是什么。写出①②③的离子方程式。
解析:根据上面总结的强弱规律,E应是溶度积大的AgCl,A是AgBr,D是溶度积最小的AgI。B、F、G都是对应的卤素盐溶液。
(2)已知B是蓝色溶液,A、D均为黑色沉淀。A和D都分别是简单的二元化合物,都含有相同的阴离子,其阴离子与非氧化性酸反应放出臭鸡蛋味的气体。A和D中的金属元素的单质是生活中最常见金属。写出①②③的离子方程式。
解析:蓝色溶液B应是CuSO4,臭鸡蛋味气体应是H2S,生活中最常见的金属单质有Fe、Al、Cu。而FeS、CuS是二元化合物,Al2S3在水溶液中不存在。因此,根据由强制弱,由大制小的原则,A应是FeS,D应是CuS,E可以是硫化钠,F是硫酸钠,G是硫酸亚铁。

在这里要强调:FeS可与稀H2SO4反应制H2S气体,而CuS则不与稀H2SO4反应,原因是CuS的Ksp太小,在稀H2SO4不溶解。
2.5 迁移五
一些巧合的考试中最常见的氧化还原反应:如B是离子化合物,含非极性共价键,A、E、D参与光合作用
解析:参与光合作用的物质有CO2、H2O、O2、C6H12O6。离子化合物含非极性共价键,最有名的是Na2O2。

2.6 迁移六:化工生产,冶炼金属单质
(1)如B是共价化合物,其沸点比结构相似的同类化合物高很多,G是黑色具有磁性的化合物,E为可燃性气体。以上反应均需高温。
解析:B显然是水,由于氢键,其沸点比H2S、H2Se高许多,G是Fe3O4,E为可燃性气体,可考虑H2、CO。

(2)如E、B都是黑色固体,E、D都是单质,D为红色,以上反应均需高温。
解析:E是黑色固体单质,是碳;D为红色固体单质,可为Cu;常见的黑色固体有CuO、MnO2、C、Fe3O4、FeS,因此B是CuO。

2.7 迁移七:化工生产,工业上腐蚀电路板的反应
如B为工业上腐蚀电路板的液体,A、E均为金属单质,在周期表中位置相邻,且原子序数E>A,以上反应都在溶液中进行[5]。
解析:腐蚀电路板的核心反应为:Cu+2FeCl3=CuCl2+2FeCl2,那么A为Cu,E为Zn,它们在周期表中相邻。
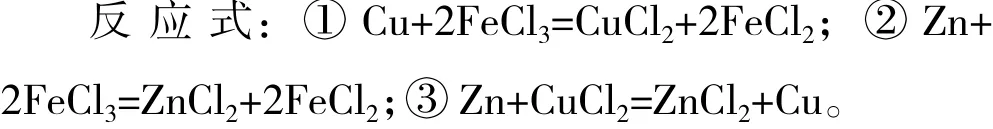
3 结论
上述图例涉及反应众多,应用广泛,可比较酸性强弱、碱性强弱、氧化性还原性强弱、溶解度溶度积大小,是化学化工上经常比较的对象,核心是由强制弱、由大制小。实际学习应用中要注意联系,进行总结,方能举一反三,融会贯通。
[1]徐芬.浅谈在化学教学中如何培养学生的学习迁移能力[J].新课程学习:基础教育,2010,5(12):167.
[2]李京兰,通讯员,毛会彬.化学,注重知识迁移能力[N].烟台日报,2014-06-14.
[3]戴宁.浅谈金属单质的氧化性[J].四川教育学院学报,2010,26(5):110-111.
[4]江秀英.金属元素及其化合物专题复习[J].试题与研究:高中文科综合,2008(5):24-30.
[5]周荣明,陈明伟,印仁和,等.金属纳米微粒导电墨水的研究进展[J].电镀与精饰,2009,31(3):16-21.
The Application of Transfer from a Diagram in the Chemical Experiment
Tian Qin-fen, Zhuang Jian-dong
(College of Materials Engineering, Fujian Agriculture and Forestry University, Fujian Fuzhou 350002)
Transfer is one kind of study to another kind of study influence, this kind of influence has the positive, which is called the positive movement; and it also has the negative, which is called the negative migration. Of course, we need positive migration to prevent or avoid negative transfer. Based on this, an example was given to demonstrate the application of positive migration.
Transfer; Reaction; Equation
Q93-3
A
2096-0387(2016)04-0053-03
由国家自然科学基金青年基金项目支持(项目编号21303244)。
田勤奋(1986-),女,陕西宝鸡人,硕士,实验师,研究方向:实验教学及实验室管理。
庄建东(1984-)男,福建福州人,博士,副教授,研究方向:功能材料。。

