云斑天牛补充营养寄主小果蔷薇及野蔷薇挥发性成分测定
卓志航,杨 伟,徐丹萍,杨春平,杨 桦
(1.四川农业大学 林学院,四川 温江 611130; 2.四川农业大学 食品学院, 四川 雅安 625014)
·生命科学·
云斑天牛补充营养寄主小果蔷薇及野蔷薇挥发性成分测定
卓志航1,杨伟1,徐丹萍2,杨春平1,杨桦1
(1.四川农业大学 林学院,四川 温江611130; 2.四川农业大学 食品学院, 四川 雅安625014)
为揭示云斑天牛(Batocerahorsfieldi(Hope)对补充营养寄主的选择机制,实现对该虫的生态控制提供理论指导。采用顶空固相微萃取(headspace solid phase micro-extraction, HS-SPME)结合气相色谱-质谱联用(gas chromatograph-mass spectrometry,GC-MS)技术,分析了小果蔷薇(RosacymosaTratt.)及野蔷薇(RosamultifloraThunb.)及野蔷薇中的挥发性成分。结果显示:小果蔷薇挥发性成分主要包括5类16种,并以C15H24为主,野蔷薇挥发性成分主要包括7类23种,并以C15H24为主;小果蔷薇和野蔷薇同时包含3类8种挥发性成分,其中野蔷薇醛类(最高)和萜烯类相对含量较高,小果蔷薇醇类(最高)和醛类相对含量较高;野蔷薇芳香烃类(最低)和呋喃类相对含量较低,小果蔷薇酚类(最低)和萜烯类相对含量较低。研究表明,云斑天牛补充营养寄主小果蔷薇和野蔷薇挥发性成分主要是萜烯类、呋喃类、酚类、醇类、醛类、酯类、烃类和芳香烃类,其中醛类和醇类相对含量较高,芳香烃类和酚类相对含量均较低。
云斑天牛;小果蔷薇;野蔷薇;顶空固相微萃取;气相色谱-质谱联用
植物挥发性物质是寄主植物释放的气味物质,是多种微浓度的挥发性次生物质组成的复杂混合物。植食性昆虫在寻找寄主阶段,主要通过嗅觉感受器对寄主植物特异性的气味进行识别,进而达到对植物的筛选和寄生[1-2]。云斑天牛(Batocerahorsfieldi(Hope)隶属鞘翅目(Coleoptera)天牛科(Cerambycidae),是用材林、经济林和防护林的重要蛀干害虫。由于该虫以幼虫在寄主树干内钻蛀危害,且幼虫蛀道向上延伸较深,从而导致该虫防控不佳[3-4]。目前,对云斑天牛寄主和补充营养寄主挥发性成分虽有部分报道,但尚未有任何有力的植物源引诱剂成功研发。为此,本文采用顶空固相微萃取(HS-SPME)结合气相色谱-质谱联用(GC-MS)技术,测定云斑天牛补充营养寄主小果蔷薇和野蔷薇的挥发性成分,为揭示云斑天牛对补充营养寄主的选择机制提供理论依据,为筛选对云斑天牛具有生物活性的植物源引诱剂,为实现对该虫的生态控制提供理论指导。
1 材料与方法
1.1材料
小果蔷薇及野蔷薇:2015年6月中上旬,采自四川省德阳市罗江县。选择色泽较好、较嫩、无病虫害、无霉变、无开口裂缝和刻槽,且新鲜健康的小果蔷薇和野蔷薇。采样时间:18∶00~18∶30(此时云斑天牛成虫活跃度较高,成虫取食补充营养寄主、交配及刻槽等行为较为积极)。样品采集于冰盒内,带回实验室。选择较为新鲜小果蔷薇和野蔷薇样品,分别将样品洗净并沥干,沥干后即用粉碎机分别对样品进行粉碎待用。
1.2仪器设备
Agilent 7890A-5975C气相色谱-质谱联用仪,配有HP-5MS弹性石英毛细管柱(30m×0.25mm, 0.25μm),美国安捷伦公司;Supleco固相微萃取装置(65μm DVB/PDMS),美国Supelco公司等。
1.3挥发性成分检测
挥发性成分的提取和检测条件参照蒋丽等[5]的方法并进行优化改进。取粉碎后的样品5g置于15mL顶空进样瓶中密封。40℃条件下平衡30min后,将SPME手柄顶端的萃取头插入进样瓶,吸附30min后取出萃取头插入到GC-MS仪的气相色谱进样口,推出纤维头,250℃解析5min。样品放入顶空进样瓶前,在上述同样条件下进行挥发性成分检测,即检测顶空进样瓶空瓶挥发物质作为对照,以除去杂质干扰。
1.4GC-MS分析条件
色谱柱:HP-5MS弹性石英毛细管柱(30m×0.25mm,0.25μm)。升温程序:柱温35℃(保留1min),以2℃/min升到100℃,保持1min,以10℃/min升到200℃,保持5min。
离子源为电子轰击电离源(electron impact,EI);离子源温度 230℃;电子能量70eV;接口温度280℃;质量扫描范围50~550amu。
1.5数据分析
检测的未知化合物(挥发性成分)与NIST.11 library相匹配,匹配度大于800(最大值为1 000)的鉴定结果予以确认,并以峰面积归一化法确定各化合物的相对含量(未知化合物在该时间和条件下的含量占该时间和条件下的百分比)。
2 结果与分析
由表1可以看出,小果蔷薇挥发性成分主要包括5类16种,分别是:7种萜烯类,相对含量为1.689%;3种醇类,相对含量为55.519%;4种醛类,相对含量为21.624%;1种酯类,相对含量为20.421%;1种酚类,相对含量为0.747%。小果蔷薇中,挥发性成分含量最高的3种物质依次是:芳樟醇、水杨酸甲酯和反式-2-己烯醛;相对含量最低的3种物质依次是:d-杜松烯、一种萜烯和大根香叶烯。
由表2可以看出,野蔷薇挥发性成分主要包括7类23种,分别是:10种萜烯类,相对含量为5.861%;2种烃类,相对含量为3.613%;1种芳香烃类,相对含量为0.679%;1种醇类,相对含量为1.605%;4种醛类,相对含量为81.387%;3种酯类,相对含量为5.858%;2种呋喃类,相对含量为0.997%。野蔷薇中,挥发性成分含量最高的3种物质依次是反式-2-己烯醛、乙酸叶醇酯和(E,E)-2,4-己二烯醛;相对含量最低的3种物质依次是:d-杜松烯、α-石竹烯cis-反式-α-法呢烯。
由表1和表2可以看出,小果蔷薇和野蔷薇共含8类31种挥发性成分,分别是:萜烯类12种、烃类2种、芳香烃1种、醇类3种、醛类6种、酯类4种、酚类1种、呋喃类2种。此外,小果蔷薇和野蔷薇均以醛类、醇类和萜烯类相对含量较高,其中小果蔷薇醇类含量为最高,野蔷薇醛类、芳香烃类、呋喃类和酚类相对含量较低,其中小果蔷薇酚类相对含量最低,野蔷薇芳香烃类相对含量最低。小果蔷薇和野蔷薇均含有的挥发性成分共3类8种分别是:芳樟醇、反式-2-己烯醛、壬醛、右旋萜二烯、α-荜澄茄油萜、1-石竹烯、大根香叶烯和d-杜松烯。其中,野蔷薇(最高)和小果蔷薇反式-2-己烯醛、壬醛,右旋萜、二烯α-荜澄茄油萜、1-石竹烯、大根香叶烯和d-杜松烯。其中,野蔷薇(最高)和小果蔷薇反式-2-己烯醛相对含量较高;d-杜松烯相对含量均最低。小果蔷薇挥发性成分相对含量中有70.446 %与野蔷薇相同,小果蔷薇挥发性成分种类中有50.000%与野蔷薇相同;野蔷薇挥发性成分相对含量中有82.906 %与小果蔷薇相同;野蔷薇挥发性成分种类中有34.782%与小果蔷薇相同。综上,以相对含量较低法计算(即相同成分相对含量较低值相加),小果蔷薇和野蔷薇挥发性成分有22.585 %完全相同。另外,小果蔷薇和野蔷薇挥发性成分共含有20种分子式,其中分子式为C15H24的萜烯类种类最多(合计13种),其次是分子式为C10H16的萜烯类(合计4种);而分子式为C6H10O的醛类相对含量最高(合计96.001%),其次是分子式为C10H18O的醇类(合计56.043%)。小果蔷薇中,分子式为C15H24的萜烯类种类最多(6种),分子式为C7H10O的醛类相对含量最低(0.224%),分子式为C10H18O的醇类相对含量最高(54.438%)。野蔷薇中,分子式为C10H16的萜烯类种类最多(7种),分子式为C11H20O2的酯类相对含量最低(0.203%),分子式为C6H10O的醛类相对含量最高(76.930%)。
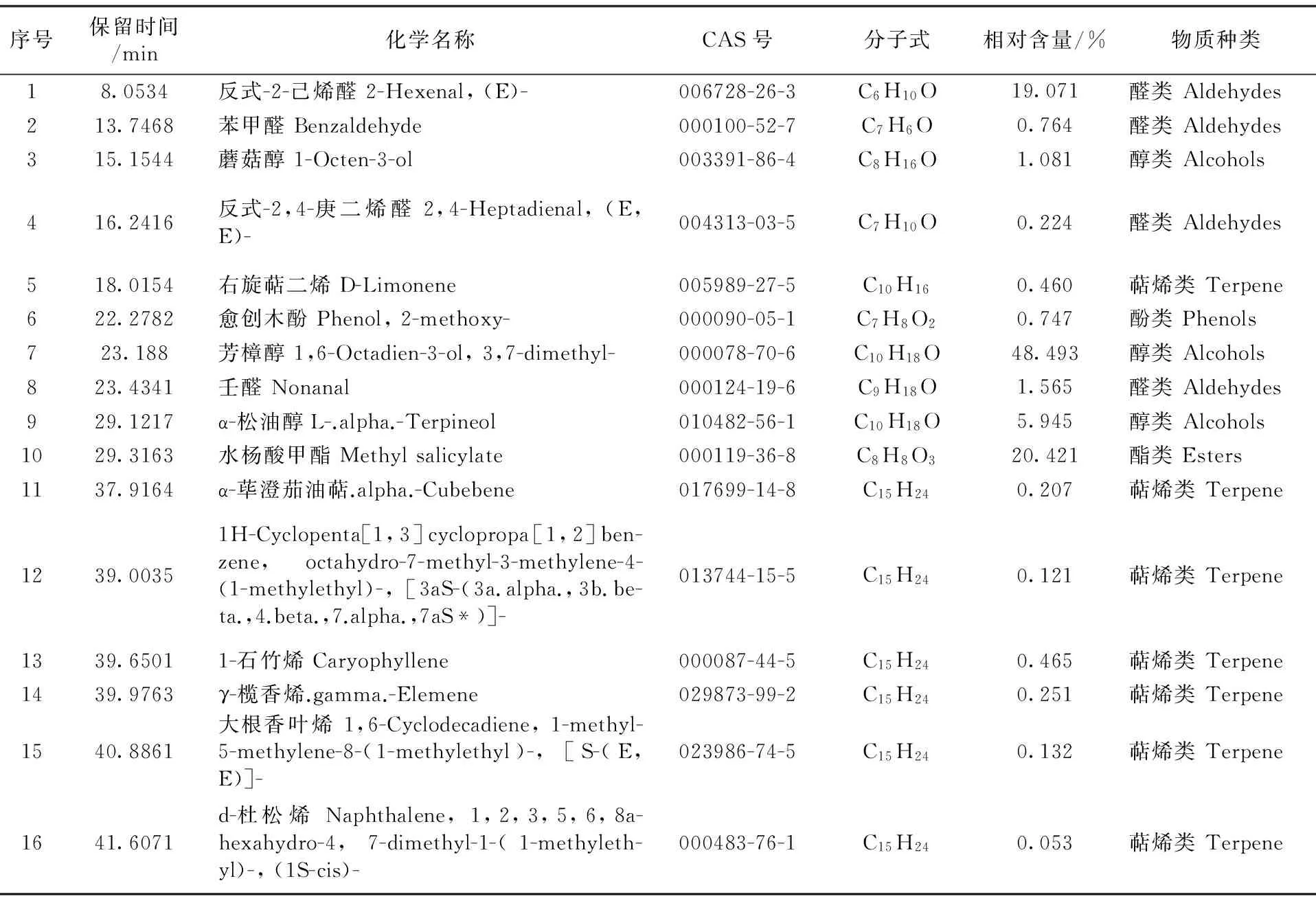
表1 小果蔷薇挥发性成分及相对含量

表2 野蔷薇挥发性成分及相对含量
3 讨 论
昆虫对植物挥发性物质的识别是一个复杂的过程。研究表明,寄主挥发性物质中的多个活性成分以特定的浓度和比例形成的混合物对昆虫行为具有调节作用[1,6-10],此外植物挥发性成分中还存在某些单个的挥发性活性成分,这些单个的成分能与其他活性成分相互作用,从而充当加强或抑制因子的作用[1,6,11-13]。植物释放的挥发性成分含量虽然受植物生理状况、虫害、环境因子、季节、叶片成熟度、机械损伤及空间分布的影响,但其各成分之间的比例却是很稳定的[11,14-16]。本研究通过顶空固相微萃取结合气相色谱-质谱联用技术,发现小果蔷薇和野蔷薇挥发性成分中萜烯类种类最多,醛类次之,而酚类和芳香烃类种类较少,萜烯类、醇类、酯类和醛类物相对含量较高,烃类、芳香烃类、酚类和呋喃类相对含量较低,这与很多研究相似,如李继泉等研究发现复叶槭(Acernegundo)释放挥发性物质多为萜烯类、醇类、醛类和芳香族化合物等[17];云斑天牛寄主杨树(Populussp.)释放挥发性物质也多为萜烯类、醇类、醛类和芳香族化合物等[6]。本研究发现小果蔷薇和野蔷薇共含8类31种挥发性成分,其中小果蔷薇5类16种,野蔷薇7类23种,所有挥发成分种类组成及比例即为小果蔷薇及野蔷薇化学指纹图谱,它们是诱导寄主昆虫的化学信号物质,能对寄主昆虫的定位、取食、交配和产卵等行为进行调节。另外,小果蔷薇与野蔷薇成分中,有3类8种成分相同,其中萜烯类5种,醌类2种,醇类1种,且小果蔷薇挥发性成分相对含量中有50.000%与野蔷薇相同,野蔷薇挥发性成分相对含量中有34.782%与小果蔷薇相同(小果蔷薇和野蔷薇挥发性成分有22.585 %完全相同),说明小果蔷薇和野蔷薇化学指纹图谱有重叠相似部分,其中以萜烯类最明显,这8种挥发性成分可能是对寄主昆虫行为具有调节作用的一般气味成分,但仍需生物检测等予以验证。其余的23种挥发性成分中,由于在小果蔷薇和野蔷薇中并非同时含有,因此可能存有特异性气味成分,这种特异性气味成分具有不同的标志且具有高度的特异性,因而对寄主昆虫定位等行为具有显著的影响,但所有成分仍需生物检测予以生物活性认证。
[1]梁潇予. 云斑天牛对补充营养寄主的选择性研究 [D]. 雅安: 四川农业大学, 2007.
[2]BARATA N, MUSTAPARTA H, PICKETT J A, et al. Encoding of host and non-host plant odours by receptor neurones in the eucalyptus woodborer, Phoracantha semipunctata (Coleoptera: Cerambycidae) [J]. Journal of Comparative Physiology, 2002, 188(2): 121-133.
[3]李娟, 王满囷, 张志春, 等. 云斑天牛成虫对植物气味的行为反应 [J]. 林业科学, 2008, 44(6): 168-170.
[4]李建庆, 杨忠岐, 梅增霞, 等. 云斑天牛的风险分析及其防控对策 [J]. 林业科学研究, 2009, 22(1): 148-153.
[5]蒋丽, 王雪莹, 杨洲, 等. 自然发酵与接种发酵泡菜香气成分分析 [J]. 食品科学, 2011, 32(22): 276-279.
[6]诸葛飘飘. 杨树云斑天牛成虫寄主定位中的信息化学物质 [D]. 武汉: 华中农业大学, 2009.
[7]LE MÉTAYER M, MARION-POLL F, SANDOZ J C, et al. Effect of conditioning on discrimination of oilseed rape volatiles by the honeybee:Use of a combined gas chromatography-proboscis extension behavioural assay [J]. Chemical Senses, 1997, 22(4): 391-398.
[8]NOJIMA S, LINN C J, MORRIS B, et al. Identification of host fruit volatiles from hawthorn (Crataegus spp.) attractive to hawthorn-origin Rhagoletis pomonella flies [J]. Journal of Chemical Ecology, 2003, 29(2): 321-336.
[9]BIRKETT M A, AGELOPOULOS N, JENSEN K M, et al. The role of volatile semiochemicals in mediating host location and selection by nuisance and disease-transmitting cattle flies [J]. Medical and Veterinary Entomology, 2004, 18(4): 313-322.
[10] TASIN M, BCKMAN A C, CORACINI M, et al. Synergism and redundancy in a plant volatile blend attracting grapevine moth females [J]. Phytochemistry, 2007, 68(2): 203-209.
[11] AGELOPOULOS N G, CHAMBERLAIN K, PICKETT J A. Factors affecting volatile emissions of intact potato plants, Solanum tuberosum: variability of quantities and stability of ratios [J]. Journal of Chemical Ecology, 2000, 26(2): 497-511.
[12] HERN A, DORN S. A female-specific attractant for the codling moth, Cydia pomonella, from apple fruit volatiles [J]. Naturwissenschaften, 2004, 91(2): 77-80.
[13] GUERIN P M, STDLER E, BUSER H R. Identification of host plant attractants for the carrot fly, Psila rosae [J]. Journal of Chemical Ecology, 1983, 9(7): 843-861.
[14] HEDIN P A. Seasonal variaton in the emission of volatiles by cotton plants growing in the field [J]. Environmental Entomology, 1976, 5: 1234-1238.
[15] BADI H N, YAZDANI D, ALI S M, et al. Effects of spacing and harvesting time on herbage yield and quality/quantity of oil in Thyme, Thymus vulgari L [J]. Industrial Crops and Products, 2004, 19: 231-236.
[16] ZHANG X, LINIT M J. Comparison of oviposition and longevity of Mdnochamus alternates and M. carolinensis (Coleoptera: Ceralnbycidae) under laboratory conditions [J]. Environmental Entomology, 1998, 27: 885-891.
[17] 李继泉, 樊慧, 金幼菊, 等. 光肩星天牛取食后复叶槭挥发物的释放机制 [J]. 北京林业大学学报, 2002, 24(5/6): 170-174.
(编辑徐象平)
Determination of volatileComponentsinBatocerahorsfieldi(Hope) host plantRosacymosatratt. andRosamultiflorathunb.
ZHUO Zhi-hang1, YANG Wei1, XU Dan-ping2, YANG Chun-ping1, YANG Hua1
(1.College of Forestry, Sichuan Agricultural University, Wenjiang 611130, China; 2.College of Food Science, Sichuan Agricultural University, Yaan 625014, China)
The volatile components inB.horsfieldihost plantR.cymosaandR.multiflorawere determined to explore the selection mechanismB.horsfieldimade on host plants and provide theoretical guidance for ecological control on it. Headspace solid phase micro-extraction (HS-SPME) combined with gas chromatograph-mass spectrometry (GC-MS) were selected to determine volatile components inB.horsfieldihost plantR.cymosaandR.multiflora. The results showedR.cymosacontained 5 species 16 kinds of volatile components and they were C15H24mainly,R.multifloracontained 7 species 23 kinds of volatile components and they were C15H24mainly,R.cymosaandR.multifloracontained 3 species 8 kinds of volatile components synchronously, the relative content of aldehyd volatile components were same inR.cymosaandR.multifloracompletely. The relative content of aldehydes (highest) and terpene was higher inR.multiflora, the relative content of alcohols (highest) and aldehydes was higher inR.cymosa, the relative content of aromatic hydrocarbons (lowest) and furans was lower inR.multiflora, the relative content of phenols (lowest) and terpene was lower inR.cymosa.The results showed that the volatile components inB.horsfieldihost plantR.cymosaandR.multiflorawere mainly terpene, furans, phenols, alcohols, aldehydes, esters, hydrocarbon, and aromatic hydrocarbons; the relative content of aldehydes and alcohols was higher, and the relative content of aromatic hydrocarbons and phenols was lower.
Batocerahorsfieldi(Hope);Rosacymosatratt.;Rosamultiflorathunb.; HS-SPME; GC-MS
2014-12-04
国家自然科学基金资助项目(31270694);四川农业大学“211”工程双支计划基金资助项目(00370101)
卓志航,男,四川资阳人,四川农业大学博士研究生,从事昆虫生理生化及分子生物学研究。
杨伟,男,四川雅安人,四川农业大学教授,从事森林昆虫学及资源昆虫学研究。
S718.7
A
10.16152/j.cnki.xdxbzr.2016-04-015

