氨基树脂表面活化提高固定化核酸酶P1连续催化性能
何林姣,刘晓静,黄金莎,庄伟,3,应汉杰,3
氨基树脂表面活化提高固定化核酸酶P1连续催化性能
何林姣1,2,刘晓静1,2,黄金莎1,2,庄伟1,2,3,应汉杰1,2,3
(1南京工业大学材料化学工程国家重点实验室,江苏 南京 210009;2南京工业大学制药与生物工程学院国家生化工程技术研究中心,江苏 南京 211816;3南京工业大学江苏先进生物与化学制造协同创新中心,江苏 南京 211816)
考察了固定化酶常用载体-氨基树脂几何结构及表面活化过程对固定化核酸酶P1性能的影响,并进行了动力学和连续催化稳定性研究。FESEM、BET及FTIR等表征发现,氨基树脂具有大量酶可利用的孔,在固定化过程中核酸酶P1主要利用的孔径范围为4~30 nm。相对游离的核酸酶P1而言,所得固定酶耐酸、耐热性增强;米氏动力学研究表明各组固定酶对底物的亲和力下降,最大反应速率下降;后交联组的重复利用性相对物理吸附、化学交联组明显增强。优化的固定化条件为:酶和载体比例为3:20(质量比),酶浓度为0.8 g·L-1,酶液pH为6.0,固定时间为10 h,在优化条件下所得固定酶的单位载体酶活为10013 U·g-1。同时设计及优化柱连续反应器操作条件,确定反应温度为65℃,进料流量为0.75 ml·min-1,使得产品的核苷酸浓度维持30 g·L-1(水解率为60%)以上的累计时长达120 h,有利于核酸酶P1连续生产核苷酸的工业化应用。
氨基树脂;核酸酶P1;交联;表面活化;柱连续反应器
引 言
近年来,由于生物催化具有底物特异性和绿色化学的优势而受到关注,然而游离酶生物催化在工业化应用中存在稳定性、工业环境耐受性、重复利用性差及分离困难等因素,使得其在工业应用上受到限制。解决酶催化工业应用的关键技术就是固定化[1-2]。
核苷酸是核酸的单体分子,广泛分布于生物体内各器官、组织的细胞核及细胞质中,并作为核酸的组成成分参与生物的遗传、发育、生长等基本生命活动,是一类具有重要生理功能的物质,在农 业[3]、医药[4]、食品[5]、饲料[6]和营养保健品[7-8]领域用途广泛。目前核苷酸的生产方法有水解法(包括酶解法、酸解及碱解)[9]、发酵法[10]、化学合成法及自溶法[11]等,化学合成法用到有毒的化工原料,与提倡绿色产品的理念相违背;微生物发酵法目前仅有肌苷酸和鸟苷酸实现了工业化生产;自溶法产物浓度低,总收率较低,提取困难;酶解法利用核酸水解酶水解酵母核酸,由于原料来源丰富、价格低廉、绿色无污染,仍是目前核苷酸生产的主要方法[12]。
核酸酶P1(E.C.3.1.30.1)是酶法生产5′-核苷酸的主要工业用酶,它是由桔青霉产生的一种能将单链DNA和RNA水解为5′-核苷酸的磷酸二酯 酶[13-14]。游离核酸酶P1釜式反应酶解酵母核酸的工艺虽然已经被广泛应用,但由于酶利用率低、产物底物双抑制、产品分离纯化困难等问题,导致核苷酸游离酶生产工艺效益不高,因此研究者一直致力于核苷酸的固定化酶连续生产以期提高其生产效 益[15]。Rokugawa等[9,16-17]以离子作用先将纯化的核酸酶Pl固定在钛化纤维素上,酶活回收率为83%,随后又分别以钛化离子交换树脂和钛化无机载体(包括大孔硅胶珠、大空玻璃珠和浮石等)为载体固定化核酸酶P1,其酶活回收率均大于50%,同时设计固定床柱反应器水解1%的RNA,底物完全水解且可连续运行24 d以上。Shi等[18-20]以共价和交联法先后将核酸酶Pl粗酶固定在纤维素及壳聚糖微球上,其酶活回收率均大于50%。Li等[21]利用大孔吸附树脂交联核酸酶P1,明显提高了酶的热稳定性。杨大令等[22]及石陆娥[23]用酶膜反应器实现了核酸 RNA 的连续水解生产核苷酸,平均核酸水解率达80%以上,且可将多个膜反应器串联连续使用10次。但酶膜反应器水解一定时间后膜出现堵塞,需要再生处理,且维护费用较高,难以实现工业化[24]。因此寻求稳定性高、载酶量大、易于连续生产的载体是实现核苷酸高效生产的必要前提。
氨基功能化树脂作为一种人工合成的介孔多聚物,具有机械强度高、稳定性好、载酶量大[25]、易于分离、可重复使用等优点,已经被广泛用作固定化酶载体[26-28]。张丰华等[29]比较了环氧基和氨基树脂两种载体对β-半乳糖苷酶固定性能的影响,结果表明氨基功能载体酶固定化率(氨基树脂的负载率是72%,比环氧树脂高出3倍)、热稳定性及重复利用性均高于环氧基树脂。Li等[30]用聚乙烯亚胺活化弱碱性阴离子树脂,可逆并选择性地从粗酶液中固定核酸酶P1,同时进行了连续低浓度的核糖核酸水解。然而该固定酶仍旧存在固定量及酶活性偏低、稳定性不够等问题。因此可从树脂的孔径、固定方法的选择出发,寻找酶活性高、稳定性好的制备固定酶的方法[25]。
本文将采用氨基功能化树脂对核酸酶P1固定化进行研究,通过调控固定化条件,设计连续酶解反应器及优化连续酶解工艺参数,同时还将考察其酶学性质、储存稳定性及重复利用性,以解决游离酶稳定性、重复利用及分离困难等难题,实现复合物连续酶解核酸的稳定工艺。
1 实验部分
1.1 实验试剂及仪器
核酸酶P1粗酶液和核糖核酸(RNA≥90%)均购自同凯兆业有限公司;50%戊二醛(C5H8O2)购自上海阿拉丁试剂,为分析纯;磷酸氢二钾(K2HPO4)、磷酸二氢钾(KH2PO4)、醋酸(HAc)、醋酸钠(NaAc)、氢氧化钠(NaOH)等均购自上海凌峰化学试剂有限公司,为分析纯;实验用水为商业可用纯净水。
本实验所用固定化酶载体HA树脂为南京工业大学国家生化中心应汉杰课题组提供,该树脂的主要理化性质见表1。

表1 HA树脂的理化性质
主要仪器:紫外可见分光光度计(UV-2000, UNICO, USA),恒流泵(BT300-1J,兰格,保定),离心机(Centrifuge 5810R, Eppendorf, Germany),节能型智能恒温槽(DC-2015,新芝,宁波),中空纤维超滤机(MW 6000,大川,天津),高效液相色谱仪(1200,Agilent,USA)。
1.2 核酸酶P1初步纯化
核酸酶P1来自桔青霉发酵液,首先用中空纤维超滤机将约100 L的粗酶液浓缩至1/100。然后将浓缩液在70℃下热处理15 min,冷却至室温后8600离心10 min除去在热处理过程中形成的沉淀[13]。纯化酶的蛋白浓度为1.04 g·L-1,比酶活为2.169×106U·g-1。
1.3 酶的固定化
载体活化:100 g载体加入400 ml,0.1 mol·L-1pH 8.0的PBS缓冲液,搅拌15 min后,测pH维持 pH 7.8~8.2,1 h后过滤抽干;处理后的载体加入400 ml,2%的戊二醛PBS缓冲液,25℃下搅拌1 h,过滤,用去离子水洗涤载体至水清[25],得到的活化载体记为HA-GA。
固定酶(物理吸附法):取1 g空白HA载体于三角瓶中,加入一定量的酶液,并调节酶液pH,120 r·min-1室温搅拌,一定时间后分离上清并用水洗去表面结合松散的蛋白,抽滤干燥,冰箱4℃保存。同时考察不同酶量、酶浓度、酶液pH及固定时间对酶固定化效果的影响[31],收集剩余固定液以备检测蛋白浓度,得到的固定酶记为HA-E。
固定酶(交联法):取1 g活化好的载体HA-GA于三角瓶中,加入一定量的酶液,其余操作同物理吸附法,记为HA-GA-E。
固定酶(后交联法):取1 g活化好的载体HA-GA于三角瓶中,加入一定量的酶液,并调节酶液pH,120 r·min-1室温搅拌,一定时间后加入1%的戊二醛水溶液[50%(质量)],继续搅拌1 h后分离上清并水洗抽滤干燥,冰箱4℃保存,记为HA-GA-E-GA。
1.4 蛋白固定量检测
采用考马斯亮蓝法[32],以牛血清白蛋白为标品测定蛋白量,依据式(1)计算蛋白固定量。
loading capacity (mg·g-1)(1)
式中,为固定化所用的酶溶液的体积,ml;0为固定化之前酶溶液的蛋白含量,g·L-1;为固定化之后酶溶液中蛋白含量,g·L-1;为加入酶溶液中载体质量,g。
1.5 酶活测定
核酸酶P1的活力测定采用紫外法[13,15,33]。将一定体积的底物溶液(5% RNA与0.2 mol·L-1pH 5.0 的醋酸缓冲液1:1混合)于70℃恒温水浴,10 min后加入一定量的游离酶或固定酶,70℃保温15 min后加入等体积核酸沉淀剂(0.25%钼酸铵-2.5%过氯酸),冰水浴10 min后离心、取上清液,用蒸馏水稀释一定倍数,测定其260 nm处的吸光值260。以先加沉淀剂者作为对照,其他操作同前。在上述条件下,每分钟所生成的核苷酸在260 nm处的吸光值的差值为1.0时定义为1个酶活力单位。其计算公式如下
式中,1为游离酶酶活,U·ml-1;2为固定酶酶活,U·g-1;为反应液的总体积,ml;为游离酶的稀释倍数;为离心上清液的稀释倍数;为加入游离酶的体积,ml;为加入固定酶的质 量,g。
固定酶酶活回收率计算公式如下
activity recovery (%)(4)
1.6 核苷酸含量的HPLC法检测
精密称取4种核苷酸的标品配制成质量浓度约为0.1 g·L-1的标准品水溶液;将经预处理的样品用水稀释至约0.1 g·L-1,并用0.22 μm微孔膜进行过滤。
色谱柱:美国赛分科技有限公司Sepax HP-C18柱(5 μm,250 mm×4.6 mm);流动相:A:20 mmol·L-1的NH4H2PO4溶液+3.5%(体积)甲醇 (用超纯水配制);B:甲醇,梯度洗脱;流速:1 ml·min-1;温度:室温;检测波长:254 nm;进样量:20 μl[34]。
1.7 固定酶催化的最适pH、温度及动力学研究
参照酶活测定方法,调节反应底物缓冲液pH 3.6~7.0,反应温度30~80℃,其余操作不变,考察pH及温度对各种固定酶催化效果的影响。
保持反应pH、温度相同,设置不同浓度底物2~12 g·L-1,反应一段时间取样检测核苷酸生成量,计算其产物生成速率,以产物生成速率对底物浓度作图,米氏动力学方程拟合计算米氏常数m及最大反应速率max[35-36]。
1.8 固定化酶的重复利用性研究
在每一批次催化完成后,将固定化酶滤出,用去离子水洗涤,然后用于下一批次的催化,以此类推,得出固定化酶的重复利用效果。
1.9 固定化酶的连续催化
(1)取按上述优化条件固定的酶50 g装入到直径2.7 cm,高22 cm的玻璃柱内,测得固定化酶的床层高11 cm。
(2)将5%的RNA溶液(50 g·L-1)以一定流量由上至下流经固定酶床层,每隔一段时间取1 ml流出液,用HPLC测其核苷酸生成量[37]。
1.10 表征
采用场发射高分辨率扫描电子显微镜(FESEM,Hitachi S-4800)观察纳米材料的形貌和微观结构,样品制备方法:将少量经真空冷冻干燥的树脂微球剖开并固定在载物台的导电胶上进行表征;通过红外光谱分析仪(PerkinElmer,Spectrum BX II)在4000~400 cm-1范围扫描得到红外光谱;氮气吸附-脱附曲线采用全自动氮吸附比表面和孔隙分析仪(TristarⅡ3020,Micromertics)测试,并分别通过BET方程和BJH模型计算得到材料的比表面积、孔容和孔径数据。
2 结果与讨论
2.1 氨基树脂微球形貌结构表征
图1是对氨基树脂微球的形貌表征结果。如图1(a)所示,通过FESEM表征可看出树脂微球样品呈球状形貌,直径约0.5 mm。图1(b)为树脂微球横截面的FESEM图,可见微球内部结构蓬松、孔道丰富。图1(c),(d)分别是对微球表面和截面的放大,可清晰看出孔道和内部多孔结构的存在,这在N2吸附-脱附表征中也可以证明。

图1 氨基树脂微球形貌结构表征的FESEM图谱
2.2 氨基树脂固定核酸酶P1
固定条件在很大程度上决定了酶分子在载体表面的构象变化,影响固定酶的活性及稳定性。本实验优化了HA氨基树脂固定核酸酶P1的条件。
蛋白表面电荷丰富,与载体间静电作用的强弱会显著影响固定化酶的吸附量和稳定性。调控pH是调节表面电荷的关键因素之一。结果如图2所示,蛋白负载量随pH增加而增加,但在pH 5.0~7.0之间变化不明显,说明在该条件下吸附和共价交联反应已经达到平衡,pH对蛋白负载量无明显影响;单位载体酶活随pH增加呈现急剧的先增后减趋势,在pH 6.0时取得最大酶活值,说明pH对酶活影响较大,这与游离核酸酶P1的耐受范围为pH 4.0~7.0有关[13],故选择固定液最适pH为6.0。
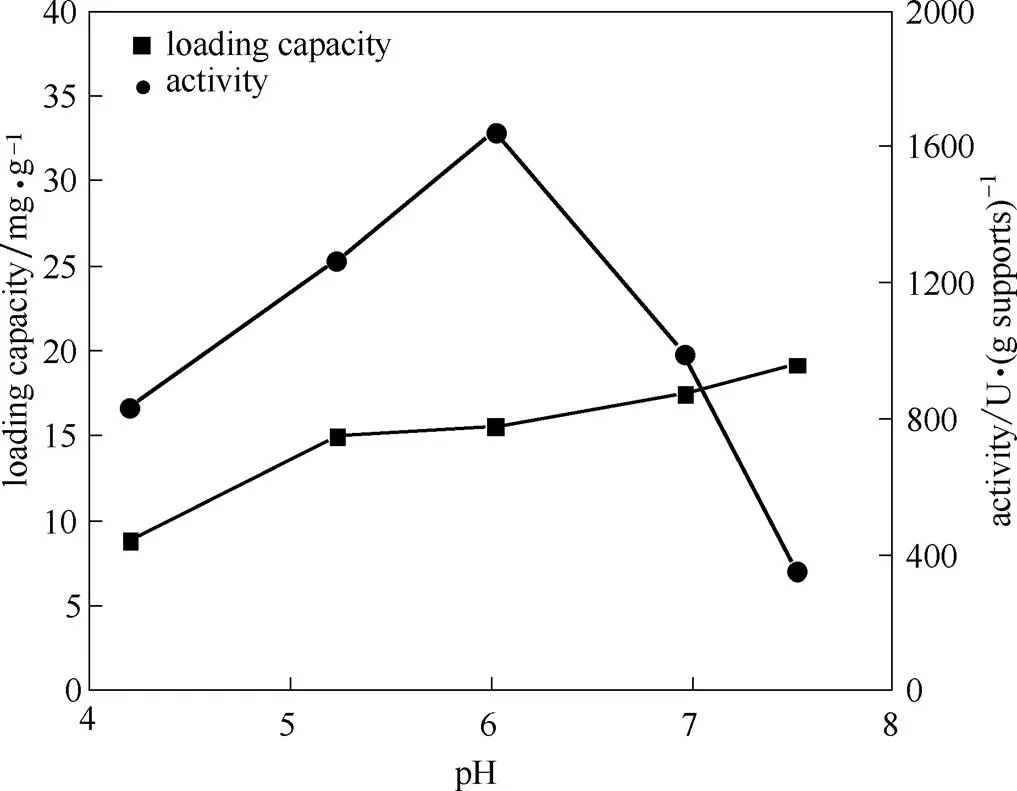
图2 酶液pH对核酸酶P1固定效果的影响
氨基树脂微球具有介孔材料大孔道、高比表面积、高孔容、酶负载量大的特性。考察酶加量对固定酶性能的影响,不仅可以充分利用载体表面活性位点,而且可以避免蛋白堆叠作用对固定酶酶活及稳定性造成的消极影响。结果如图3所示,蛋白负载量随酶加量增加而增加,最终达到吸附饱和;单位载体酶活随酶加量增加呈现缓慢的先增后减趋势,在酶加量为150 mg·(g载体)-1时取得最大酶活值,说明该固定量下蛋白处于最佳构象状态[38]。
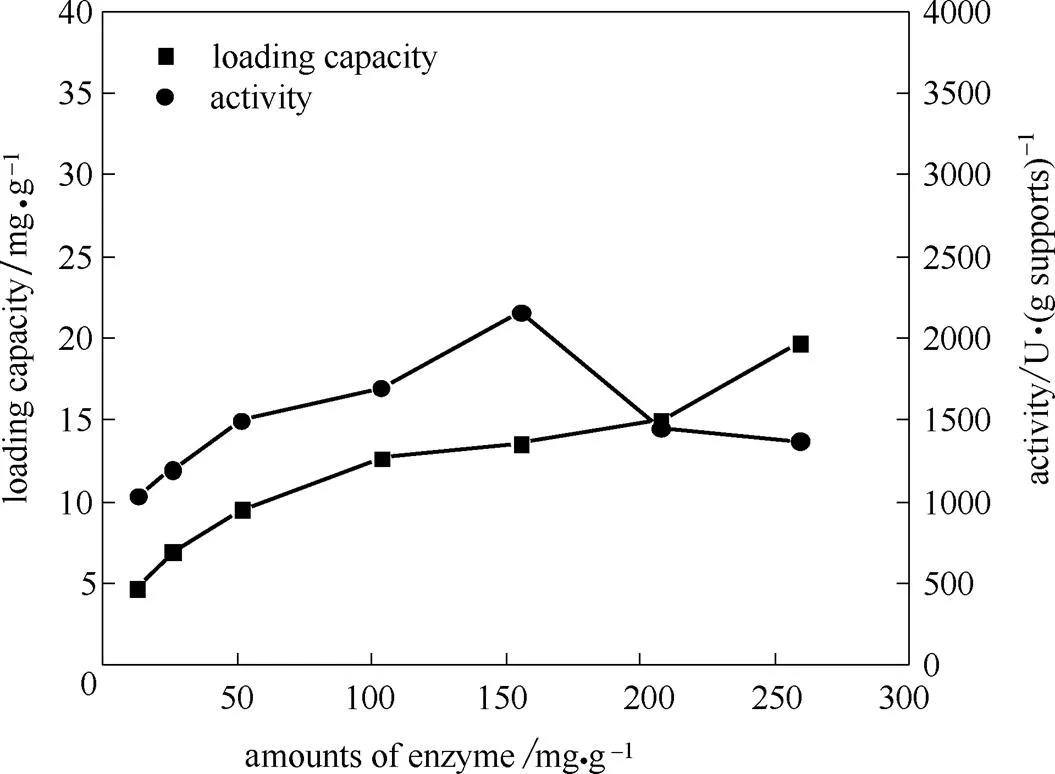
图3 酶加量对核酸酶P1固定效果的影响
固定过程中,酶浓度高低会影响载体表面位点对酶分子结合的选择性。考察相同酶加量下不同酶浓度对酶固定化效果的影响,结果如图4所示,酶浓度对蛋白负载量几乎没有影响,而对单位载体酶活影响强烈。单位载体酶活随酶浓度降低先急剧上升而后趋于稳定,当酶浓度降低至0.8 g·L-1时,取得最大单位载体酶活[39]。
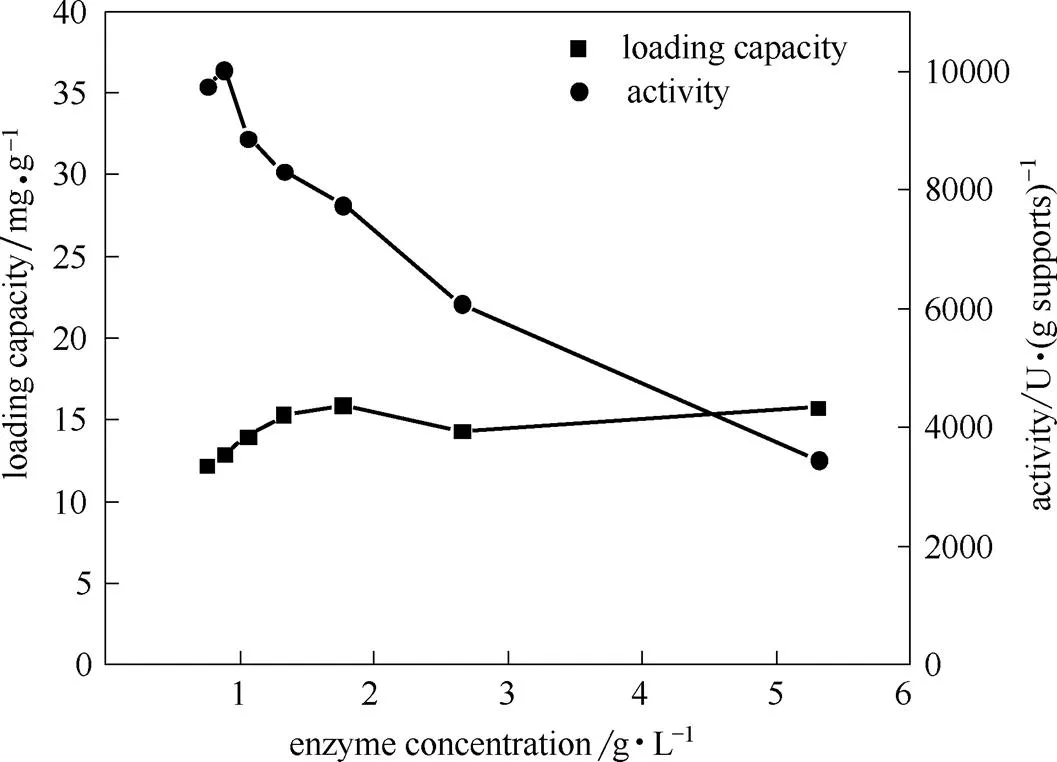
图4 酶浓度对核酸酶P1固定效果的影响
固定时间的长短对酶分子在载体表面保持稳定构象具有积极作用。结果如图5所示,随固定时间的延长,蛋白负载量呈现缓慢的先增后减趋势,表明载体表面结合位点在2 h时已达到饱和状态,随时间延长,表面依靠蛋白与蛋白相互作用连接的过载蛋白分子开始脱落,而单位载体酶活增加较明显,当固定时间为10 h时取得最大值,说明表面过载蛋白的脱落更有利于酶活性的发挥和蛋白构象的保持[40]。

图5 固定时间对核酸酶P1固定效果的影响
验证实验在优化条件下所得固定酶的单位载体酶活为10013 U·g-1,酶活回收率为35.7%。固定化核酸酶P1制备前人已有很多报道,数据对比如表2所示,其中与本文采用同样类别载体树脂的Li 等[30]利用聚乙烯亚胺(PEI)活化树脂固定核酸酶P1,制备的固定酶单位载体酶活为530 U·g-1,本实验所得固定酶相比前人工作,虽然酶活回收率有所下降,但单位载体酶活相比Li等高出约18倍,体现了本文表面活化的显著效果。
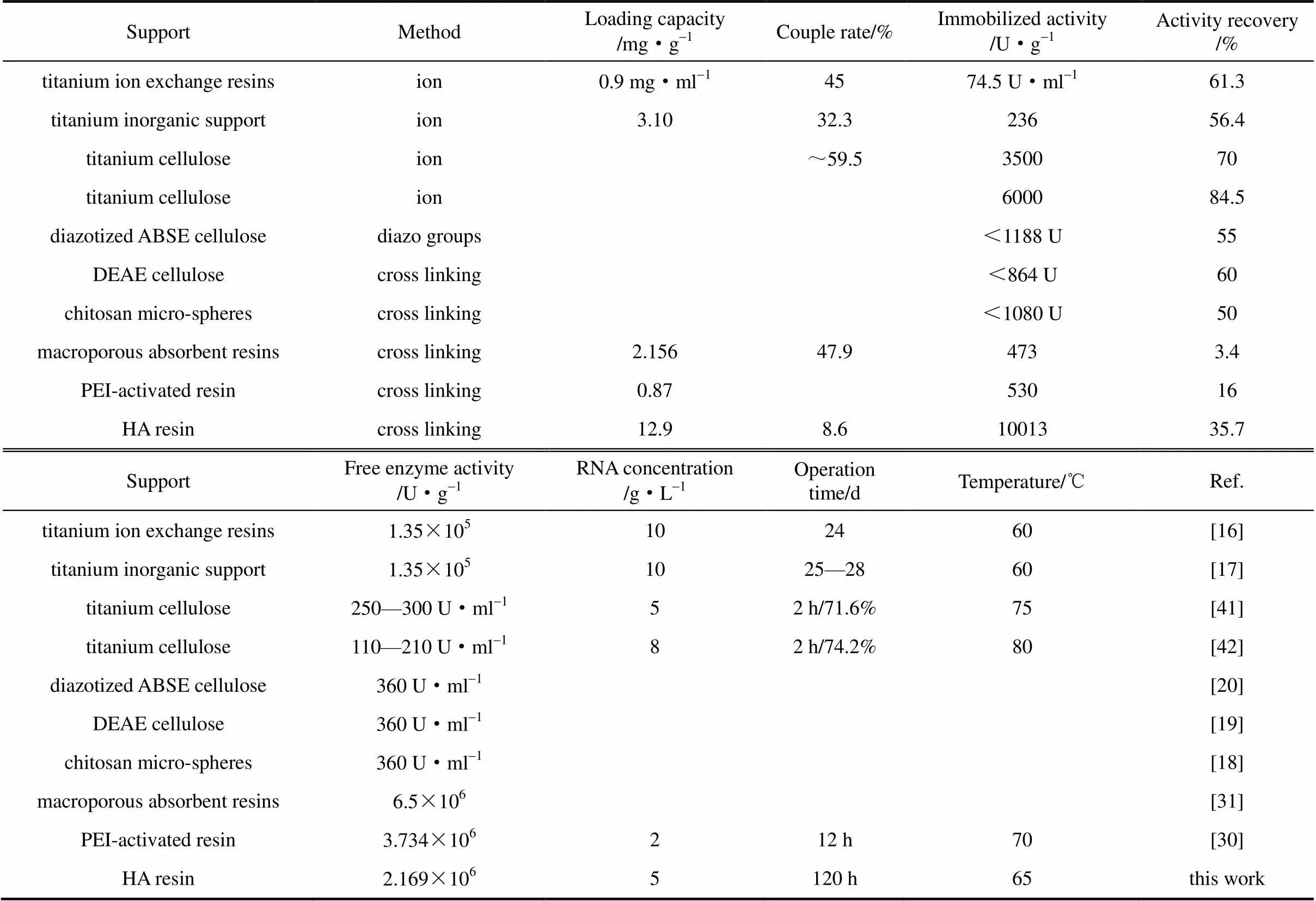
表2 核酸酶P1固定化酶文献对比
树脂微球的粒径尺寸、孔道结构及孔径大小变化都可以反映酶在载体表面的状态并对酶的扩散及固定化量产生显著影响。图6为固定过程载体的氮气吸-脱附等温线和孔径分布曲线,从图6(a)可以看出样品的氮气吸附等温线是Ⅰ型和Ⅳ型的耦合,说明具有介孔和微孔复合结构。从图6(b)中可看出空白HA载体的孔径分布集中在4~30 nm,戊二醛修饰后(HA-GA)孔径在20~30 nm之间的数量明显减少,连接酶后(HA-GA-E)孔径分布曲线左移,小孔数目增加,说明固定核酸酶P1主要利用的孔尺寸为4~30 nm(核酸酶P1的尺寸为5.7 nm×4.3 nm×2.3 nm[43])。样品的比表面积、最可几孔径和孔容列于表3中,可以发现表面活化会降低比表面积、孔径和孔容,但是孔分布范围基本不变。固定化核酸酶P1后,不仅会造成比表面积、孔径和孔容的降低,而且由于酶会使大孔变小孔,造成孔分布区间中小孔的比例大幅提升。
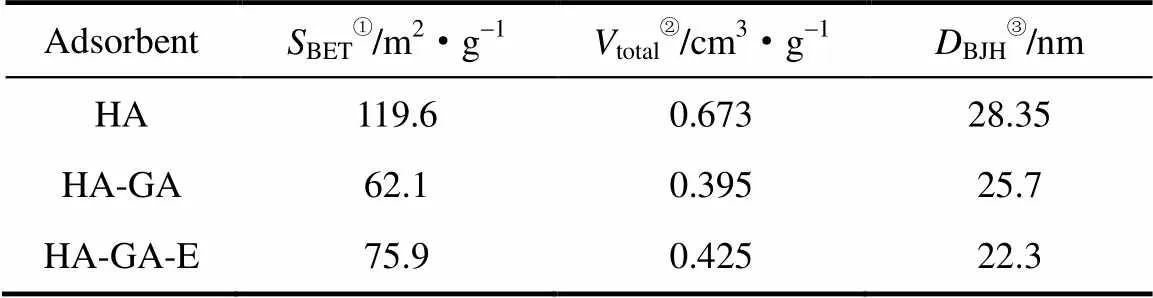
表3 固定过程载体的结构参数
① The specific surface areas were calculated from the adsorption data in the relative pressure range of 0.05 to 0.3 using the BET method;
② The total pore volume was estimated from the amount adsorbed at a relative pressure of 0.90;
③ Pore sizes at maxima of the pore size distribution calculated based on the adsorption branch using the BJH method.
图7为HA树脂固定化核酸酶P1过程的FTIR图谱,戊二醛修饰后(HA-GA)的图谱在3500 cm-1处的NH2,2850 cm-1处的NH吸收峰强度均减弱,1715 cm-1处的CHO峰强增加,表明戊二醛通过一个醛基与HA表面NH2形成席夫碱而成功实现连接[25]。连接酶后(HA-GA-E)的图谱在1715 cm-1处的CHO峰消失,3500 cm-1处的NH2峰增加,说明酶蛋白分子与戊二醛上另一个CHO反应,同时引入部分氨基残基。
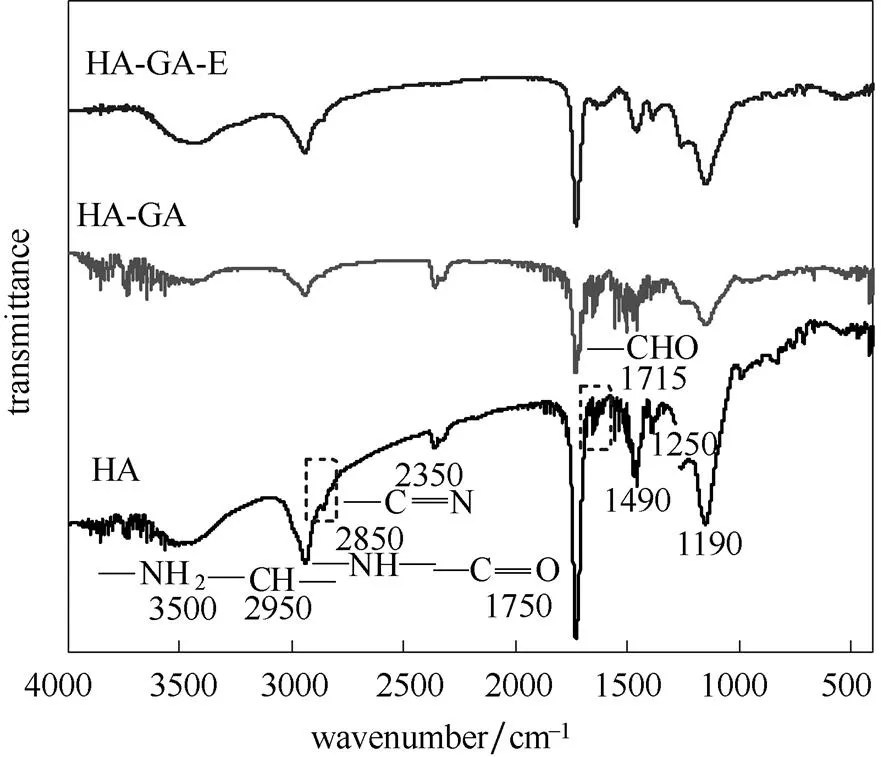
图7 固定过程的FTIR图谱
2.3 HA树脂固定核酸酶P1酶学性质研究
图8考察了pH及温度对酶催化活性的影响,从图8(a)可以看出,游离酶反应的最适pH为5.5,而固定酶的最适pH为5.0,表现出耐酸性增强耐碱性下降。分析原因可能是载体表面的氨基中和了溶液中的质子,使得固定酶分子周围的微环境酸性降低,表现出酸耐受性增强,同理,表面氨基增强了固定酶分子微环境的碱性,表现出耐碱性下降。从图8(b)可以看出,各种酶反应的最适温度均为75℃,且耐热性都有不同程度的提高,物理吸附法、交联法、后交联法耐热性依次增强,这与载体及戊二醛提高酶构象稳定性有关。
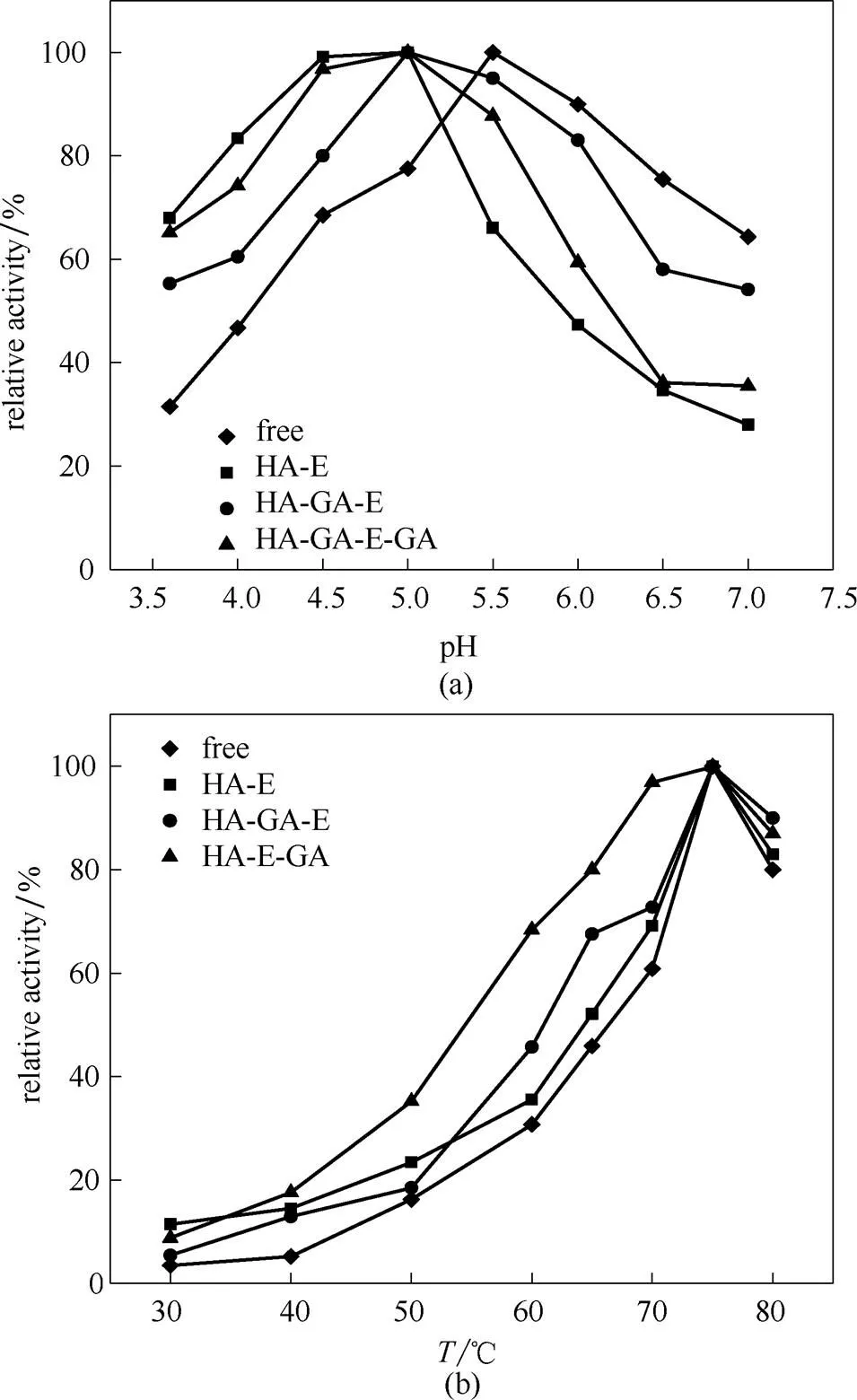
图8 酶催化活性影响因素的考察
图9为酶催化的动力学曲线比较,动力学参数统计如表4所示,拟合相关性2均大于0.9,说明该酶反应动力学符合米氏动力学方程。固定酶的米氏常数m相对游离酶均增加,最大反应速率max均降低,表明固定酶对底物的亲和力下降,最大反应速率下降。这主要是由于固定化一定程度上降低了酶与底物接触的机会,且限制了底物与产物的传质速率,同时固定化过程也会引起酶构象变化[36]。
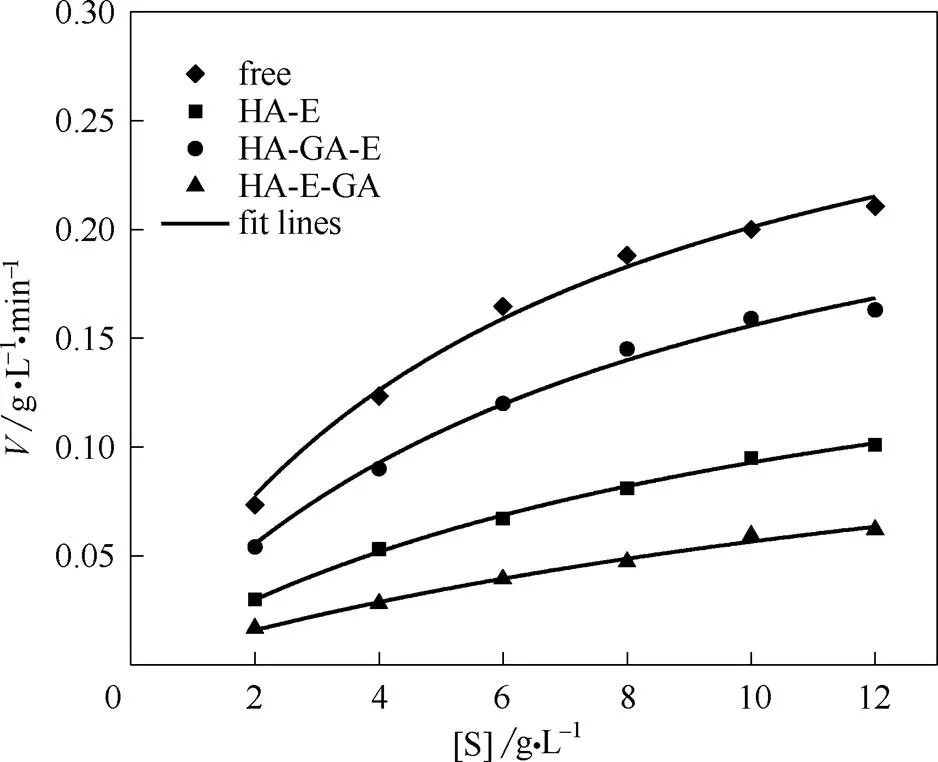
图9 不同形式酶的催化动力学曲线比较

表4 不同形式酶的催化反应参数比较
图10为HA树脂不同方法固定核酸酶P1的重复利用性,随使用次数增加,固定酶酶活保留率均降低,其中后交联组重复使用8批次后,仍保留初始酶活的50%以上,稳定性相对物理吸附组及交联组明显增强,说明后交联能显著增强固定酶的稳定性。
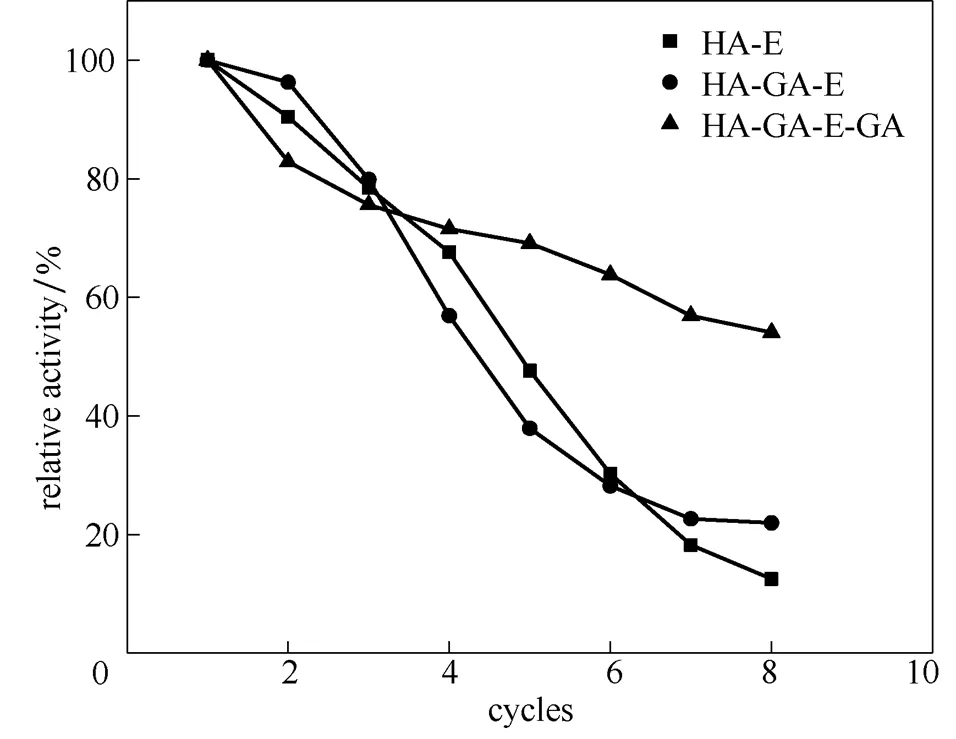
图10 HA树脂不同方法固定核酸酶P1的重复利用性
2.4 HA树脂固定核酸酶P1柱连续反应器设计及优化
为实现固定化酶连续催化降解核酸,本实验在前人基础上设计出柱连续反应器,简要示意图见图11,其中柱1起过滤、脱色及脱除加热过程中料液中产生的气体的作用,柱2为固定酶催化降解RNA的反应柱。相比前人工作,本实验设计了底物预处理装置,可以延缓因反应过程中产生的沉淀或杂质而堵塞反应柱。
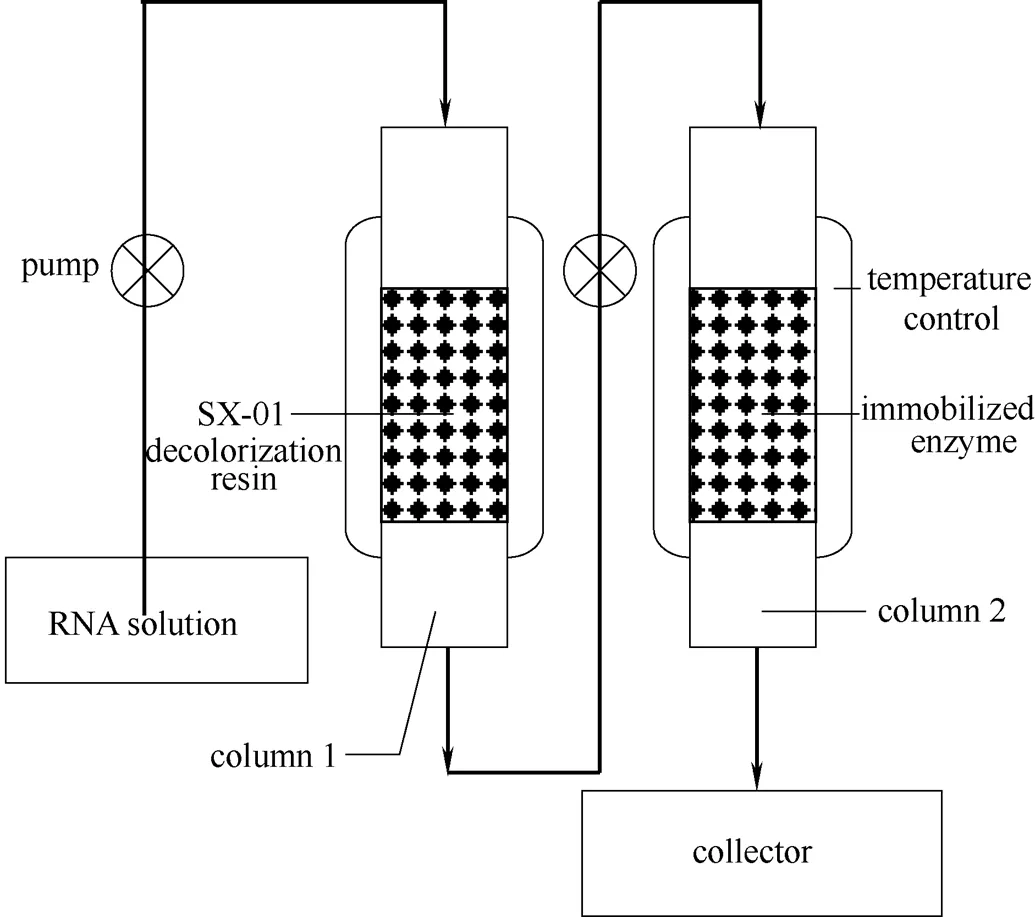
图11 柱连续反应器示意图
图12为固定化酶连续固定床反应器操作条件优化。图12(a)考察了反应温度对连续催化的影响,随着催化时间延长,各温度下生成核苷酸浓度逐渐下降,70℃下生成核苷酸浓度维持35 g·L-1的时间仅30 h,后期急剧下降。相比其他温度条件,65℃时生成核苷酸浓度维持时间更长,因为降低反应温度可以减缓核酸酶P1酶活下降速率,故长时间连续催化应该降低反应温度。从图12(b)可以看出,进料流量增加,核苷酸浓度增长加快,但随着酶解时间延长,核苷酸浓度急剧下降。当进料流量为0.75 ml·min-1时,产品的核苷酸浓度比较稳定。
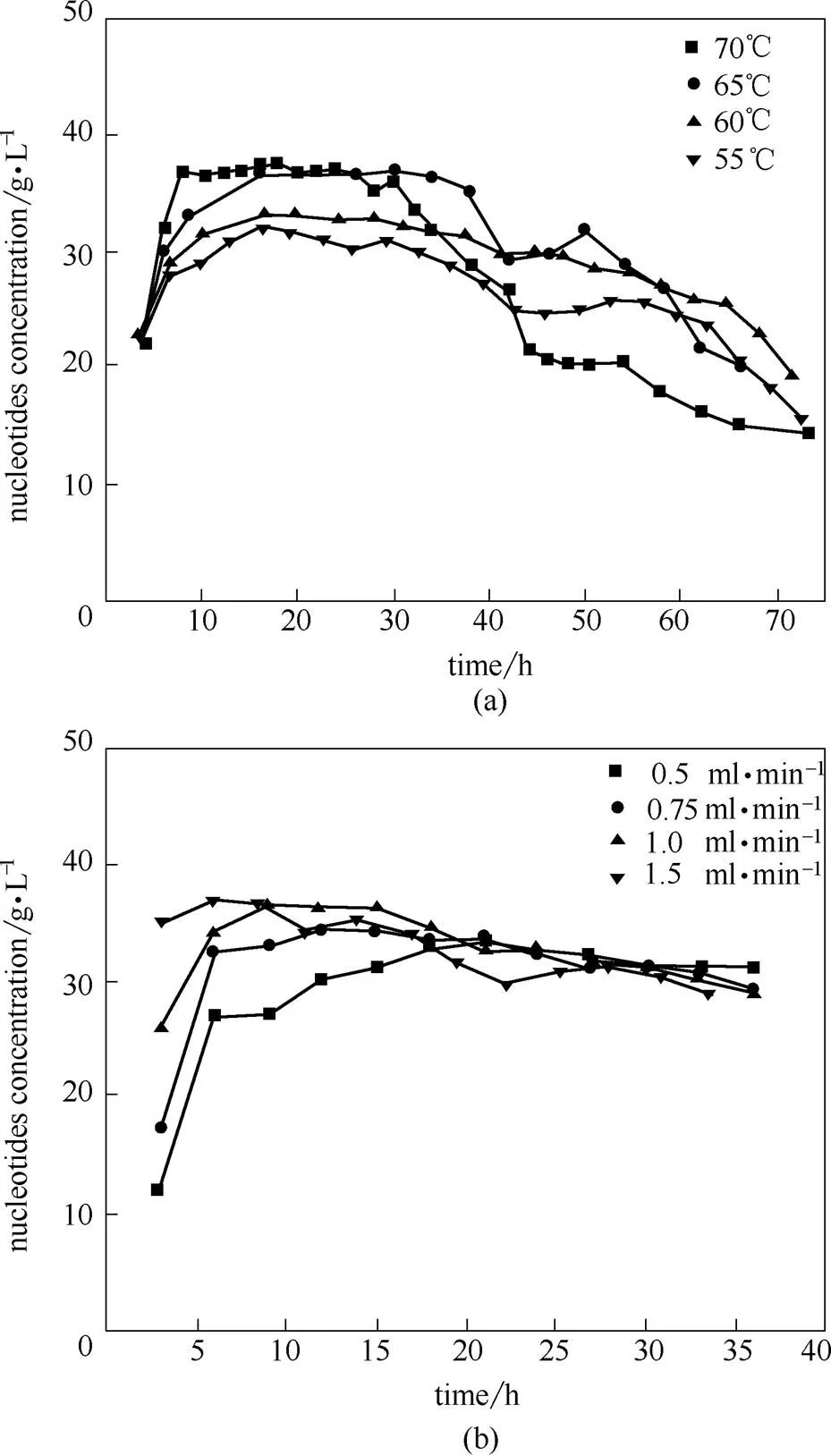
图12 优化固定酶连续固定床反应器的反应温度(a)和进料流量(b)
图13为优化条件下固定酶连续水解5% RNA的稳定性,连续酶解一定时间后,产品浓度下降,故需下柱洗涤固定酶微球之间及微球内部微孔的杂质[37]。连续4次上柱催化反应,产品的核苷酸浓度维持30 g·L-1(水解率为60%)以上的累计时长达120 h,可见本实验得到的固定酶稳定性良好。相比前人工作(如表2所示),本实验连续酶解的底物浓度由0.5%提高到5%,提浓10倍仍能保持良好的稳定性。2014年Li等[30]用聚乙烯亚胺活化弱碱性阴离子树脂固定核酸酶P1连续降解2%的核糖核酸累积运行12 h。本实验设计的固定床反应器相比Li等底物处理浓度提高1.5倍,连续运行时间提高10倍以上,这都归功于反应器设计中柱1的过滤、脱色及脱气功能。
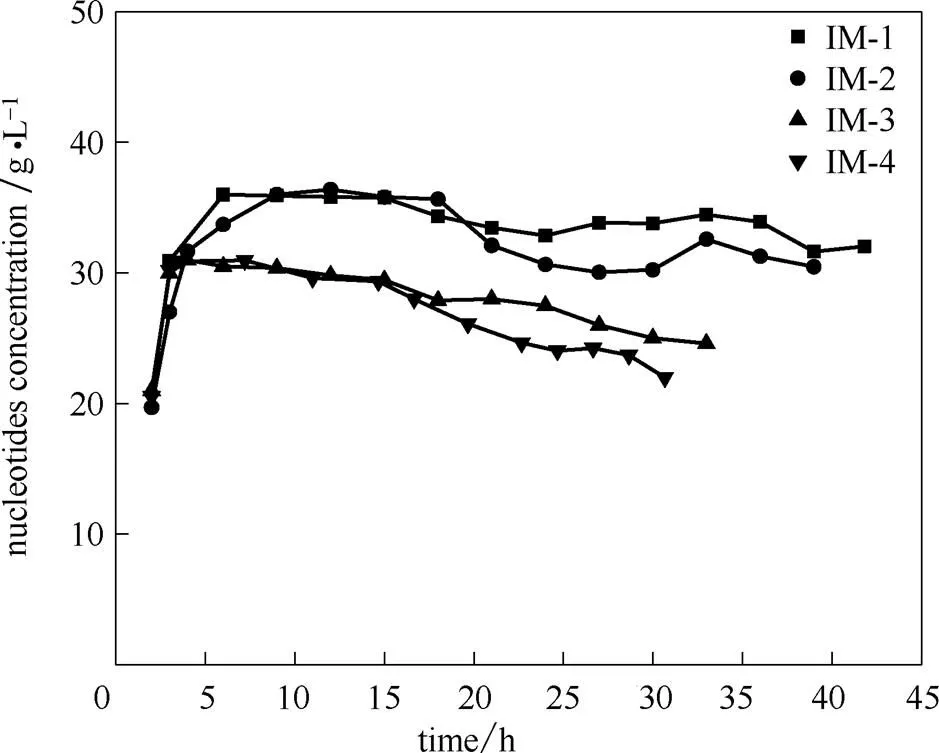
图13 优化条件下固定酶连续水解RNA的稳定性
3 结 论
(1)选取HA氨基树脂作为固定化核酸酶P1的载体,FESEM、BET及FTIR图谱证明该树脂微球直径为0.3~0.5 mm,固定化过程主要利用的孔径范围为4~30 nm。
(2)优化HA氨基树脂固定核酸酶P1的固定条件:酶和载体比例为3:20(质量比),酶浓度为0.8 g·L-1,酶液pH为6.0,固定时间为10 h,在优化条件下所得固定酶的单位载体酶活为10013 U·g-1。同时比较物理吸附、化学交联及后交联3种固定方法所得固定酶的酶学性质,相对游离的核酸酶P1,最适反应pH向酸性偏移,热稳定性增强,固定酶对底物的亲和力下降,最大反应速率下降,后交联组的重复利用性相对物理吸附组及交联组明显增强。
(3)设计及优化HA树脂固定核酸酶P1柱连续反应器操作条件,确定连续催化反应温度为 65℃,进料流量为0.75 ml·min-1,使得产品核苷酸浓度维持30 g·L-1(水解率为60%)以上的累计时长达120 h。
References
[1] LIESE A, HILTERHAUS L. Evaluation of immobilized enzymes for industrial applications [J]. Chemical Society Reviews, 2013, 42 (15): 6236-6249.
[2] SHELDON R A, VAN PELT S. Enzyme immobilisation in biocatalysis: why, what and how [J]. Chemical Society Reviews, 2013, 42 (15): 6223-6235.
[3] 吴振强, 李姗, 罗宁. 农用核苷酸的开发进展 [J]. 土壤肥料, 2004, (4): 3-6.
WU Z Q, LI S, LUO N. The review for nucleotide developmental progress in agriculture [J]. Soils and Fertilizers, 2004, (4): 3-6.
[4] 孙慧颖, 方虹, 陈宝荣. 5′-核苷酸酶对肝癌、冠心病的临床意义 [J]. 中外医疗, 2009, (25): 162.
SUN H Y, FANG H, CHEN B R. Clinical significance of 5′- nucleotide enzyme in liver cancer and coronary heart disease [J]. China Foreign Medical Treatment, 2009, (25): 162.
[5] 房兴利. 呈味核苷酸的生产及其应用 [J]. 中国调味品, 1993, (10): 1-4.
FANG X L. Production and application of the flavor nucleotide [J]. Chinese Condiment, 1993, (10): 1-4.
[6] 李宽. 酵母核苷酸在养猪生产上的应用 [J]. 饲料与畜牧, 2013, (1): 47-50.
LI K. Application of yeast nucleotides in swine production [J]. Feed and Animal Husbandry, 2013, (1): 47-50.
[7] 方芳, 李婷, 安颖. 乳中核苷酸的分析及其对婴幼儿营养功能的研究 [J]. 食品研究与开发, 2015, 36 (8): 135-139.
GANG F, LI T, AN Y. Nucleotides in dairy and its nutritional effect on the infant [J]. Food Research and Development, 2015, 36 (8): 135-139.
[8] 魏晓琨, 王玥, 丁庆豹,等. 乳品中的核苷酸及其对婴儿的生物学功效 [J]. 中国乳品工业, 2008, 36 (1): 35-43.
WEI X K, WANG Y, DING Q B,. Nucleotides in dairy and the related biology function to infants [J]. China Dairy Industry, 2008, 36 (1): 35-43.
[9] ROKUGAWA K, FUJISHIMA T, KUNINAKA A,. Studies on immobilized enzymes (1): Immobilization of nuclease P1 on cellulose [J]. Journal of Fermentation Technology, 1979, 57 (6): 570-573.
[10] 任玉岭. 发酵法生产核苷酸类物质研究概况 [J]. 微生物学通报, 1975, (3): 27-33.
REN Y L. Study on the production of nucleotides in fermentation process [J]. Microbiology, 1975, (3): 27-33.
[11] KIM J H, LEE B H, LEE J S. Production of ribonucleotides by autolysis ofgrown on Korean ginseng steaming effluent [J]. Journal of Bioscience and Bioengineering, 2002, 93 (3): 318-321.
[12] 张志军, 温明浩, 王克文, 等. 核苷酸生产技术现状及展望 [J]. 现代化工, 2004, 24 (11): 19-23.
ZHANG Z J, WEN M H, WANG K W,. Present situation and prospect production technology of nucleotide [J]. Modern Chemical Industry, 2004, 24 (11): 19-23.
[13] 吕浩, 应汉杰. 核酸酶P1的纯化和酶学性质研究 [J]. 南京工业大学学报(自然科学版) , 2002, 24 (6): 66-69.
LÜ H, YING H J. Purification and characterization of nuclease P1[J]. Journal of Nanjing University of Technology (Natural Science Edition), 2002, 24 (6): 66-69.
[14] MAEKAWA K, TSUNASAWA S, DIBO G,. Primary structure of nuclease P1from penicillium-citrinum [J]. European Journal of Biochemistry, 1991, 200 (3): 651-661.
[15] YING Q Q, SHI L E, ZHANG X Y,. Characterization of immobilized nuclease P1[J]. Applied Biochemistry and Biotechnology, 2007, 136 (1): 119-126.
[16] ROKUGAWA K, FUJISHIMA T, KUNINAKA A,. Studies on immobilized enzymes (2): Immobilization of nuclease P1on ion-exchange resins by titanium complex method [J]. Journal of Fermentation Technology, 1980, 58 (5): 423-429.
[17] ROKUGAWA K, FUJISHIMA T, KUNINAKA A,. Studies on immobilized enzyme (3): Immobilization of nuclease P1on inorganic supports by titanium complex method [J]. Journal of Fermentation Technology, 1980, 58 (6): 509-515.
[18] SHI L E, TANG Z X, YI Y,. Immobilization of nuclease P1on chitosan micro-spheres [J]. Chemical and Biochemical Engineering Quarterly, 2011, 25 (1): 83-88.
[19] SHI L E, YI Y, TANG Z X,. Nuclease P1immobilized on deae cellulose [J]. Brazilian Journal of Chemical Engineering, 2010, 27 (1): 31-39.
[20] SHI L E, TANG Z X, YI Y,. Study of immobilization of nuclease P1on paper cellulose [J]. Biotechnology & Biotechnological Equipment, 2010, 24 (3): 1997-2003.
[21] LI B, CHEN Y, CHEN X,. A novel immobilization method for nuclease P1on macroporous absorbent resin with glutaraldehyde cross-linking and determination of its properties [J]. Process Biochemistry, 2012, 47 (4): 665-670.
[22] 杨大令, 吴迪, 张守海,等. 分体式中空纤维酶膜反应器制备5′-核苷酸的研究 [J]. 食品工业科技, 2007, 28 (11): 167-169.
YANG D L, WU D, ZHANG S H,. Preparation of 5′-nucleotide by split type hollow fiber enzyme membrane reactor [J]. Science and Technology of Food Industry, 2007, 28 (11): 167-169.
[23] 石陆娥. 酶膜生物反应器制备核苷酸的研究 [D]. 杭州: 浙江工业大学, 2007.
SHI L E. Enzymatic production of 5'-nucleotides using enzyme membrane bioreactor [D]. Hangzhou: Zhejiang University of Technology, 2007.
[24] 何义进, 华洵璐, 匡群,等. 核酸水解酶及酶解法生产核苷酸研究进展 [J]. 辽宁大学学报, 2012, 39 (2): 110-117.
HE Y J, HUA X L, KUANG Q,. the development of studies on nucleic acid hydrolysis and its application in the nucleotide production [J]. Journal of Liaoning Unversity, 2012, 39 (2): 110-117.
[25] BARBOSA O, ORTIZ C, BERENGUER-MURCIA Á,. Glutaraldehyde in bio-catalysts design: a useful crosslinker and a versatile tool in enzyme immobilization [J]. RSC Adv., 2014, 4 (4): 1583-1600.
[26] BARBOSA O, TORRES R, ORTIZ C,. Heterofunctional supports in enzyme immobilization: from traditional immobilization protocols to opportunities in tuning enzyme properties [J]. Biomacromolecules, 2013, 14 (8): 2433-2462.
[27] 马驰宇, 黄晓娟, 黄丽洋, 等. 氨基树脂固定胃蛋白酶的方法及性质研究 [J]. 精细与专用化学品, 2010, 18 (7): 41-44.
MA C Y, HUANG X J, HUANG L Y,. Study on immobilization method and characters of pepsin by amino resin [J]. Fine and Specialty Chemicals, 2010, 18 (7): 41-44.
[28] 尹春丽, 曹姗姗, 许乐, 等. 氨基树脂固定化-腺苷甲硫氨酸合成酶的研究 [J]. 化学与生物工程, 2014, 31 (9): 17-20.
YIN C L, CAO S S, XU L,. Study on immobilization-adenosylmethionine synthetase on amino resin [J]. Chemical and Bioengineering, 2014, 31 (9): 17-20.
[29] 张丰华, 孙宁, 张伟, 等. 环氧基和氨基树脂固定化β-半乳糖苷酶的比较研究 [J]. 中国农业科技导报, 2014, 16 (5): 47-52.
ZHANG F H, SUN N, ZHANG W,. Comparison epoxy and amino resin carriers in immobilization of β-galactosidase [J]. Journal of Agricultural Science and Technology, 2014, 16 (5): 47-52.
[30] LI B, CHEN Y, CAO Z,. Reversible, selective immobilization of nuclease P1from a crude enzyme solution on a weak base anion resin activated by polyethylenimine [J]. Journal of Molecular Catalysis B: Enzymatic, 2014, 101: 92-100.
[31] LI B, CHEN Y, CHEN X,. A novel immobilization method for nuclease P1on macroporous absorbent resin with glutaraldehyde cross-linking and determination of its properties [J]. Process Biochemistry, 2012, 47 (4): 665-670.
[32] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72 (1): 248-254.
[33] ZHAO N, REN H, LI Z,. Enhancement of nuclease P1production byYL104 immobilized on activated carbon filter sponge [J]. Applied Microbiology and Biotechnology, 2015, 99 (3): 1145-1153.
[34] 霍小敏, 屠春燕, 宋敏慧, 等. HPLC法测定酵母RNA降解的4种核苷酸 [J]. 南京工业大学学报, 2002, 24 (4): 61-64.
HUO X M, TU C Y, SONG M H,. Determination of four nucleotides degraded from the RNA of yeast by HPLC [J]. Journal of Nanjing University of Technology, 2002, 24 (4): 61-64.
[35] LYU F, ZHANG Y, ZARE R N,. One-pot synthesis of protein-embedded metal-organic frameworks with enhanced biological activities [J]. Nano Letters, 2014, 14 (10): 5761-5765.
[36] TAVARES A P, SILVA C G, DRAZIC G,. Laccase immobilization over multi-walled carbon nanotubes: kinetic, thermodynamic and stability studies [J]. Journal of Colloid and Interface Science, 2015, 454: 52-60.
[37] LI B, CHEN Y, CAO Z,. Reversible, selective immobilization of nuclease P1from a crude enzyme solution on a weak base anion resin activated by polyethylenimine [J]. Journal of Molecular Catalysis B: Enzymatic, 2014, 101: 92-100.
[38] PRETEL E, SANCHEZ I E, FASSOLARI M,. Conformational heterogeneity determined by folding and oligomer assembly routes of the interferon response inhibitor NS1 protein, unique to human respiratory syncytial virus [J]. Biochemistry, 2015, 54 (33): 5136-5146.
[39] HERMANOVA S, ZAREVUCKA M, BOUSA D,. Graphene oxide immobilized enzymes show high thermal and solvent stability [J]. Nanoscale, 2015, 7 (13): 5852-5858.
[40] NEL A E, MADLER L, VELEGOL D,. Understanding biophysicochemical interactions at the nano-bio interface [J]. Nature Materials, 2009, 8 (7): 543-557.
[41] 宋荣钊, 王春林, 梁锋. 固定化5′-磷酸二酯酶及其在核苷酸生产中的应用 [J]. 微生物学通报, 1991, 18 (4): 211-214.
SONG R Z, WANG C L, LIANG F. Immobilization of 5′-phosphodiesterase and its application in nucleotides production [J]. Microbiology China, 1991, 18 (4): 211-214.
[42] 刘红, 潘红春, 丁洪, 等. 核酸酶P1固定化研究 [J]. 食品与发酵工业, 1994, (4): 44-48.
LIU H, PAN H C, DING H,. Studies on the immobilization of nuclease P1[J]. Food and Fermentation Industries, 1994, (4): 44-48.
[43] VOLBEDA A, LAHM A, SAKIYAMA F,. Crystal-structure of Penicillium citrinum P1nuclease at 2.8-A resolution [J]. Embo Journal, 1991, 10 (7): 1607-1618.
Fortified continous catalytic properties of immobilized nuclease P1with surface activated HA amino resin
HE Linjiao1,2, LIU Xiaojing1,2,HUANG Jinsha1,2, ZHUANG Wei1,2,3, YING Hanjie1,2,3
(1Sate Key Laboratory of Materials-Oriented Chemical Engineering, Nanjing Tech University, Nanjing 210009, Jiangsu, China;2National Engineering Research Center for Biotechnology, School of Biological and Pharmaceutical Engineering, Nanjing Tech University, Nanjing 211816, Jiangsu, China;3The Synergetic Innovation Center for Advanced Materials, Nanjing Tech University, Nanjing 211816, Jiangsu, China)
The effect of HA amino resin (immobilized enzyme widely-used carrier) geometry and surface activated process on the immobilized nuclease P1’s properties was studied. In addition, the dynamic analysis and continuous catalytic properties were also investigated. FESEM, BET and FTIR characterization were utilized to verify that HA amino resin had a great deal of enzymes available hole and the scope of the main hole was 4—30 nm in the immobilized process. Compared with free nuclease P1, the acid resistance and heat resistance of the immobilized enzymes were improved. The study on Michael’s Mention kinetics indicated that the substrate affinity and maximum reaction rate of immobilized enzymes decreased; the reusability of after crosslinking group was significantly enhanced compared to physical adsorption and chemical crosslinking groups. The optimized conditions of immobilization were as follows: the enzyme to carrier ratio of 3:20 (mass ratio), enzyme concentration of 0.8 g·L-1and 10 h immobilized time at pH 6.0. Under these conditions, the immobilized enzyme activity was about 10013 U·g-1. Furthermore, the operating conditions of column flow reactor were designed and optimized. The continuous running time of the reactor was up to 120 h at 30 g·L-1products nucleotide concentration (hydrolysis rate of 60%), when the reaction temperature was 65℃ with substrate flow rate of 0.75 ml·min-1. This work would be beneficial to the application of nuclease P1in nucleotide continuous industrial production.
amino resin; nuclease P1; crosslinking; surface activation; column flow reactor
Q 814
10.11949/j.issn.0438-1157.20160280
date: 2016-03-09.
Prof. YING Hanjie, yinghanjie@njtech.edu.cn
supported by the National Basic Research Program of China (2013CB733501), the National Natural Science Foundation of China (21506090), the Natural Science Foundation of Jiangsu Province (BK20130929) and Priority Academic Program Development of Jiangsu Higher Education Institutions.
A
0438—1157(2016)09—3850—11
国家重点基础研究发展计划项目(2013CB733501);国家自然科学基金项目(21506090);江苏省自然科学基金项目(BK20130929);江苏高校优势学科建设工程项目。
2016-03-09收到初稿,2016-04-28收到修改稿。
联系人:应汉杰。第一作者:何林姣(1990—),女,硕士研究生。

