聚甲氧基二甲醚+水+正己烷三元体系的液液相平衡
庄志海,张建强,刘殿华
聚甲氧基二甲醚+水+正己烷三元体系的液液相平衡
庄志海,张建强,刘殿华
(华东理工大学化学工程联合国家重点实验室,上海 200237)
聚甲氧基二甲醚(PODE)是一种极具应用前景的清洁柴油调和组分。研究了293.15 K、常压下PODE1+水+正己烷、PODE2+水+正己烷、PODE3+水+正己烷、PODE4+水+正己烷这4组三元体系的液液相平衡。PODE1-4组分的萃取选择性系数远大于1,表明正己烷作为萃取剂从水溶液中萃取PODE1-4是可行的;经Hand结线关联检验,各体系的相平衡数据具有较高的一致性;采用NRTL和UNIQUAC热力学模型对相平衡数据进行拟合,均方根差计算(RMSD)结果和三元相图分析结果表明NRTL和UNIQUAC都能较好地描述三元体系的液液相平衡。
萃取;正己烷;聚甲氧基二甲醚;水溶液;相平衡
引 言
聚甲氧基二甲醚(polyoxymethylene dimethyl ethers,PODE)[1-2]是一种新型清洁柴油调和组分,其化学简式表示为CH3O(CH2O)CH3(其中≥1,一般取值小于10),十六烷值平均高达76,并且具有较高的含氧量(42%~51%)。PODE3-4与柴油理化性质相近,互溶性好且稳定,适合用作柴油调和组分,据报道[3-8]在柴油中添加5%~30%的PODE3-4可以在不改动发动机结构的基础上大幅度降低尾气中NO和颗粒污染物的排放,并且提高燃油效率;低聚合度组分PODE1和PODE2可以循环至反应器,提高PODE3-4的反应选择性。以甲醛溶液和甲醇为原料的酸催化合成PODE的反应工艺[9-16]流程简单,原料价廉易得,具有良好的发展前景,但产物组成中含有水和原料甲醇、甲醛,直接采用精馏分离[17]不仅能耗高,而且会导致产物中甲醛发生自聚反应堵塞管道。采用萃取工艺能够有效避免水对聚甲氧基二甲醚体系分离的不利影响。目前关于PODE萃取分离的文献较少,而且基本是分离工艺流程的概念设计[18-19],因此需要补充大量的相平衡研究数据。
关于聚甲氧基二甲醚的多元系统液液相平衡,除了PODE1、PODE2-4外尚未见到相关文献报道。Albert 等[20]对甲缩醛(PODE1)+水二元系统和甲缩醛+水+甲醇三元系统常压下的液液相平衡数据进行测定,并且采用UNIQUAC模型对液液相平衡数据进行拟合,得到了较好的拟合效果。Kuhnert等[21]采用改进的UNIFAC对PODE1+甲醛+水三元体系进行拟合,得到了相应的二元交互作用参数。
本研究采用正己烷作为萃取剂,测定了常压、温度为293.15 K下PODE1+水+正己烷、PODE2+水+正己烷、PODE3+水+正己烷、PODE4+水+正己烷这4组三元体系的液液相平衡数据,并分别采用活度系数模型NRTL(non-random two liquids,非随机双液体)模型[22]和UNIQUAC(universal quasi chemical,通用似化学)模型[23]进行关联,回归出二元交互作用参数,为分离含水PODE体系的萃取设备模型建立和设计提供必要的液液相平衡数据。
1 实验材料和方法
1.1 材料
甲缩醛(PODE1),上海锦悦化工有限公司提供,实验室精馏塔分馏提纯,纯度为99.8%(质量分数);正己烷(-hexane),上海凌峰化学试剂有限公司提供,纯度为99.5%(质量分数);乙醇,上海凌峰化学试剂有限公司提供,纯度为99.5%(质量分数);PODE2-4,实验室精馏塔分馏制备,纯度为98.5%(质量分数)。以上试剂均采用4A沸石分子筛进行干燥。单组分卡尔费休滴定液,国药集团化学试剂有限公司提供;去离子水,华东理工大学提供,经过实验室3次蒸馏后使用。
1.2 液液相平衡装置
液液相平衡装置如图1所示。装置接入恒温循环水浴保证相平衡的等温条件,温控误差为±0.1℃;装置上、下接口都设置有氟橡胶密封的取样口防止有机物质挥发,并且可以通过注射器分别抽取上、下层样品,保证萃取液和萃余液样品不相互污染。
为了测定相平衡时间,进行了预实验,不同体系搅拌2 h后静置分层,每隔2 h进行上、下层取样分析,组成经色谱至少分析3次求平均值,不同时间点样品各组成质量分数波动不超过0.1%,预实验结果表明静置时间为2 h时体系已达到相平衡状态。相平衡实验装置具体操作方法如下:将液液相平衡温度设置至293.15 K,温度稳定后,向瓶中加入萃取剂和原料液,开启磁力搅拌,搅拌2 h后停止,静置分层2 h,萃取相和萃余相清澈透明,两相界面清晰可见,进行上、下层取样分析。
1.3 分析方法
水含量测定:采用卡尔费休水分仪[梅特勒托利多(中国)有限公司,V30]分析,滴定剂为单组分卡尔费休试剂,每次滴定前用纯水校正卡尔费休试剂滴定度3次,取平均值。水含量测定误差为0.05%(质量分数)。
PODE1-4和正己烷含量测定:采用气相色谱内标法定量,内标物为无水乙醇;气相色谱(Perkin Elmer,Clarus 580)采用毛细管柱Elite-Wax(30 m× 0.32 mm×0.25mm);分析条件为进样器温度250℃,检测器温度250℃,空气流速400 ml·min-1,氢气流速40 ml·min-1;柱箱升温程序设置为45℃保持3 min,然后以20℃·min-1的升温速率加热到220℃并保持3 min。PODE1-4和正己烷含量测定误差为0.1%(质量分数)。
实验中对相平衡的样品各组分分析至少3次,取平均值。
2 实验结果与讨论
2.1 液液相平衡数据测定
常压下,在液液相平衡装置中设置温度20℃,测定PODE1+ 水 + 正己烷、PODE2+水 +正己烷、PODE3+ 水 +正己烷、PODE4+水+正己烷这4组三元体系液液相平衡共轭相组成,实验数据见表1,并且计算了PODE的萃取选择性。
计算公式[24]如下
由表1可知,在实验浓度范围内萃余相中只有少量正己烷,PODE1+ 水 +正己烷体系中正己烷质量分数最高3.5%,PODE2+ 水 +正己烷、PODE3+水 +正己烷、PODE4+ 水 +正己烷三体系中绝大多数萃余相中正己烷质量分数低于1%,说明以正己烷为萃取剂从水溶液中提取PODE1-4过程中只有少量正己烷萃取剂损失在萃余相中,大部分正己烷萃取剂可以回收。由于PODE分子结构中存在—CH2O—,与水有一定的互溶性,随萃取相中PODE含量增加水含量有所增加;萃取相中的水含量远小于萃余相中的水含量,大大减小水对后续精馏过程的不利影响;所有PODE纯组分的选择性系数在23全组成浓度范围内远大于1,并且随23减小而增大。
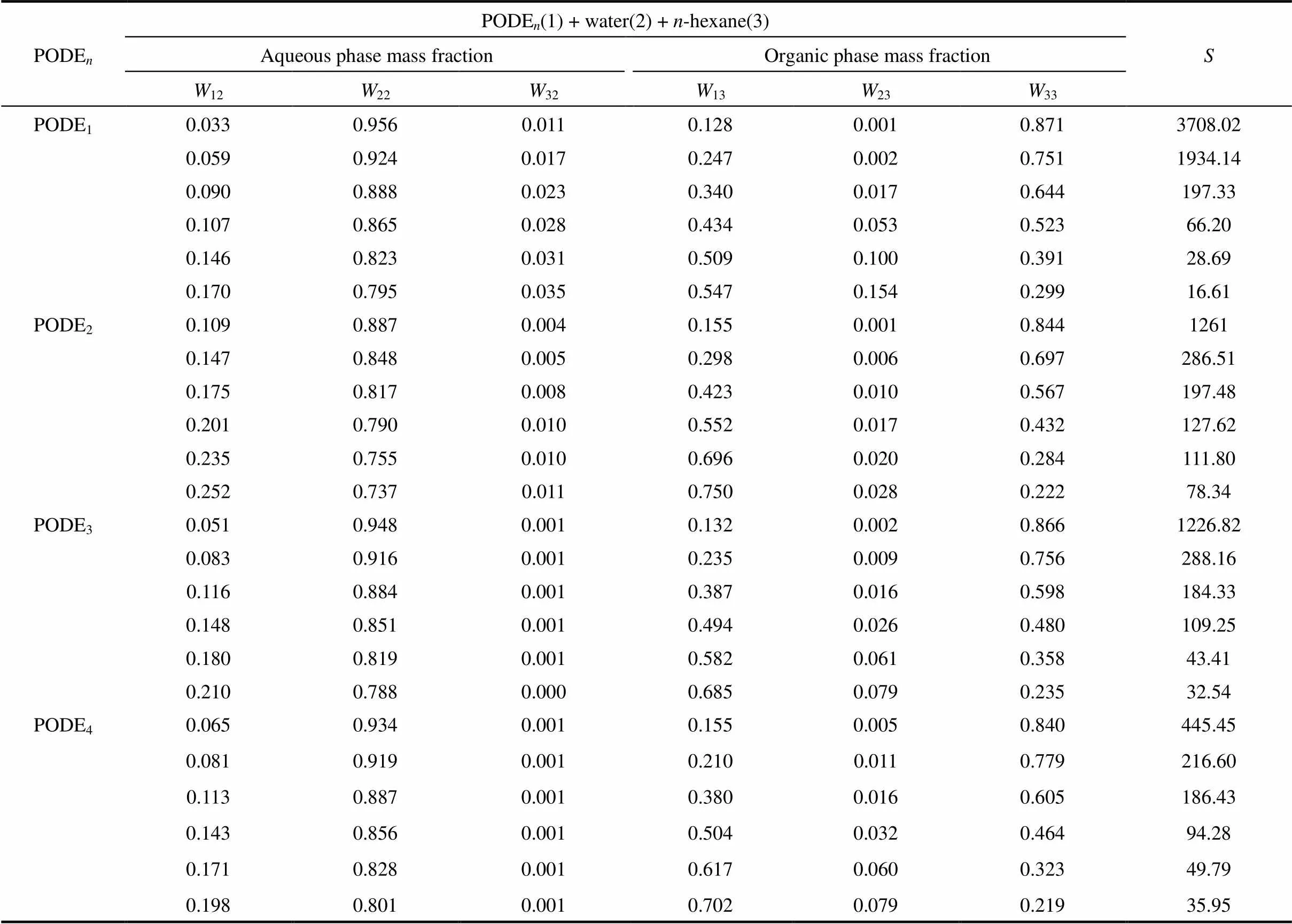
表1 温度293.15 K下PODEn+水+正己烷三元体系相平衡实验数据 Table 1 Experimental liquid-liquid equilibrium data for ternary systems [PODEn(1) + water(2) + n-hexane(3)] at 293.15 K
2.2 液液相平衡数据一致性检验
对实验数据进行一致性检验是评价数据可靠性的一种重要方法。采用Hand结线关联法[25]对所测数据进行了一致性检验。
Hand结线关联式如下
式中,12和22分别是萃余相中PODE和水的质量分数;13和33分别是萃取相中PODE和正己烷的质量分数;和分别为Hand结线方程的截距和斜率,可以通过实验数据线性拟合得出。
Hand结线方程参数值和拟合的相关指数2见表2。图2是4组三元体系的Hand结线的拟合图像。拟合结果都呈现出明显的线性关系,相关指数2接近1,残差平方和较小,说明所测的4组三元体系的液液相平衡数据符合Hand结线关联式,具有较高的一致性。

表2 PODEi+水+正己烷(i=1,2,3,4) 4组三元体系Hand结线关联拟合参数 Table 2 Hand equations parameters for ternary systems[PODEi + water + n-hexane(i=1,2,3,4)]
2.3 液液相平衡数据拟合
2.3.1 活度系数模型
NRTL模型和UNIQUAC模型均能预测多元体系的液液相平衡。NRTL是基于局部组成概念的活度系数方程,该模型适用范围广,不仅适用于完全互溶物系,也适用于部分互溶物系;NRTL是一个三参数方程,参数包括组分和的二元交互作用参数和以及参数(=),根据Renon规则,正己烷-水的为0.2,正己烷-PODE的为0.3,水-PODE的为0.3。
UNIQUAC模型是在Guggenheim似化学溶液理论和Wilson局部组成概念理论基础上建立的,该模型比NRTL模型复杂,可以应用于非极性、各类极性组分的多元混合物和分子大小悬殊的聚合溶液,又称为通用化学模型。该模型引入分子的形状和大小对活度系数方程的影响,配位数=10。方程中的r和q是各分子结构常数,r是组分的量纲1体积分数,q是组分的量纲1表面积参数,可以通过Bondi法计算出,结果见表3。

表3 UNIQUAC活度系数方程中r值和q值 Table 3 Values of UNIQUAC parameters r and q
2.3.2 液液相平衡数据关联
在Aspen Plus软件中输入各二元交互作用初值和三元体系液液相平衡实验数据,分别采用NRTL方程和UNIQUAC方程进行拟合;采用NRTL活度系数方程拟合时,需输入值。
计算过程中采用最小二乘法,使目标函数[26]式(5)最小。
式中,代表不同组分数,为相数,为液液相平衡共轭组成结线数;表示实验测得的组分含量,表示模型拟合得到的组分含量。
液液相平衡数据的关联效果采用均方根偏差(RMSD)[27-28]进行分析。均方根偏差是通过比较实验值和模型拟合值的差异得到的,公式如下
拟合得到的NRTL和UNIQUAC活度系数模型的二元交互作用参数以及均方根偏差值见表4。并且在一张三角相图中绘制同一体系(PODE1-4+水 + 正己烷)实验数据和NRTL方程拟合数据结果以及UNIQUAC方程拟合数据结果,如图3~图6所示。
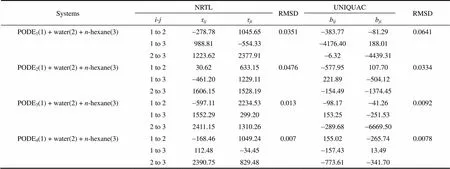
表4 NRTL模型参数τij、UNIQUAC模型参数bij和均方根偏差 Table 4 NRTL and UNIQUAC model interaction parameters and root-mean square deviation (RMSD) for ternary systems (PODEn + water + n-hexane)
根据图3~图6可知,在实验浓度范围内液液相平衡数据整体关联较好。因此NRTL和UNIQUAC活度系数方程均能描述PODE1+ 水 +正己烷、PODE2+水 +正己烷、PODE3+水 +正己烷、PODE4+ 水 + 正己烷三元体系的液液相平衡。
由图3和图4可知,当萃取相中PODE组分浓度较高(质量分数大于50%)时萃取相实验值与拟合结果有一定偏差。由图5和图6可知,PODE3+水 + 正己烷和PODE4+水 + 正己烷体系关联结果较好,RMSD值低于0.015。
3 结 论
(1)在常压、温度为293.15 K条件下测量了PODE1+ 水 + 正己烷、PODE2+ 水 + 正己烷、PODE3+水 + 正己烷、PODE4+水 + 正己烷这4组三元体系的液液相平衡数据。根据相平衡数据分析,PODE1-4组分的选择性系数远大于1,正己烷作为萃取剂从水溶液中萃取PODE1-4是可行的,并且大部分萃取剂可以回收,大幅度降低PODE体系中的水含量,避免水对后续精馏过程的不利影响。
(2)采用NRTL和UNIQUAC活度系数方程对相平衡数据进行关联,并回归出NRTL方程和UNIQUAC方程的二元交互作用参数,结果表明,NRTL和UNIQUAC活度系数方程均能较好地描述PODE1-4+水 + 正己烷三元体系的液液相平衡。
致谢:感谢华东理工大学化学工程联合国家重点实验室提供的Aspen Plus软件授权。
符 号 说 明

bij——组分i和组分j的UNIQUAC二元交互参数,J·mol-1 DPODE, Dwater——分别为PODE和水的分配系数 OF——目标函数 RMSD——均方根偏差 ri,qi——分别是组分i的量纲1体积分数和量纲1表面积参数 S——PODE的萃取选择性系数 W——质量分数 aij——NRTL方程中的非随意参数 τij——组分i和组分j的NRTL二元交互参数,J·mol-1 上角标 cal——计算值 exp——实验值 下角标 x——不同组分数 y——相数 z——共轭组成
References
[1] BURGER J, Siegert M, Ströfer E,. Poly(oxymethylene) dimethyl ethers as components of tailored diesel fuel: properties, synthesis and purification concepts[J]. Fuel, 2010, 89(11): 3315-3319.
[2] Zhao Y P, XU Z, Chen H,. Mechanism of chain propagation for the synthesis of polyoxymethylene dimethyl ethers[J]. Journal of Energy Chemistry, 2013, 22(6): 833-836.
[3] Liu H Y, Wang Z, Wang J X,. Improvement of emission characteristics and thermal efficiency in diesel engines by fueling gasoline/diesel/PODEblends[J]. Energy, 2016, 97: 105-112.
[4] Liu H Y, Wang Z, Zhang J,. Study on combustion and emission characteristics of polyoxymethylene dimethyl ethers/diesel blends in light-duty and heavy-duty diesel engines[J]. Applied Energy, 2015(in press). doi: 10.1016/j.apenergy.2015. 10. 183.
[5] Liu J L, Wang H, Li Y,. Effects of diesel/PODE (polyoxymethylene dimethyl ethers) blends on combustion and emission characteristics in a heavy duty diesel engine[J]. Fuel, 2016, 177: 206-216.
[6] Knippenberg S, Hajgató B, François J P,. Theoretical study of the fragmentation pathways of norbornane in its doubly ionized ground state[J]. Journal of Physical Chemistry A, 2007, 111(42): 10834-10848.
[7] Boyd R H. Some physical properties of polyoxymethylene dimethyl ethers[J]. Journal of Polymer Science, 1961, 50(153): 133-141.
[8] Iannuzzi S E, Barro C, Boulouchos K,. Combustion behavior and soot formation/oxidation of oxygenated fuels in a cylindrical constant volume chamber[J]. Fuel, 2016, 167: 49-59.
[9] Li H J, Song H L, Xia C G,. Designed SO42-/Fe2O3-SiO2solid acids for polyoxymethylene dimethyl ethers synthesis: the acid sites control and reaction pathways[J]. Applied Catalysis B: Environmental, 2015, 165: 466-476.
[10] Wu Y J, Li Z, Xia C G. Silica-gel-supported dual acidic ionic liquids as efficient catalysts for the synthesis of polyoxymethylene dimethyl ethers[J]. Industrial & Engineering Chemistry Research, 2016, 55(7): 1859-1865.
[11] Wu J B, Zhu H Q, Qin Z F,. High Si/Al ratio HZSM-5 zeolite: an efficient catalyst for the synthesis of polyoxymethylene dimethyl ethers from dimethoxymethane and trioxymethylene[J]. Green Chemistry, 2015, 17(4): 2353-2357.
[12] Wang F, Zhu G L, Xia C G,. Mechanistic study for the formation of polyoxymethylene dimethyl ethers promoted by sulfonic acid-functionalized ionic liquids[J]. Journal of Molecular Catalysis A: Chemical, 2015, 408: 228-236.
[13] 施敏浩, 刘殿华, 赵光, 等. 甲醇和甲醛催化合成聚甲氧基二甲醚[J]. 化工学报, 2013, 64(3): 931-935.
Shi M H, Liu D H, Zhao G,. Catalytic synthesis of polyoxymethylene dimethyl ethers from methanol and formaldehyde [J]. CIESC Journal, 2013, 64(3): 931-935.
[14] Zhang J Q, Fang D Y, Liu D H. Evaluation of Zr-alumina in production of polyoxymethylene dimethyl ethers from methanol and formaldehyde: performance tests and kinetic investigations[J]. Industrial & Engineering Chemistry Research, 2014, 53(35): 13589-13597.
[15] Zheng Y Y, Tang Q, Wang J F,. Synthesis of a green fuel additive over cation resins[J]. Chemical Engineering & Technology, 2013, 36(11): 1951-1956.
[16] Zheng Y Y, Tang Q, Wang J F,. Molecular size distribution in synthesis of polyoxymethylene dimethyl ethers and process optimization using response surface methodology[J]. Chemical Engineering Journal, 2015, 278: 183-189.
[17] 苗剑, 史高峰, 王国英, 等. 基于Aspen Plus的聚甲氧基二甲醚精馏过程模拟分析[J]. 计算机与应用化学, 2015, 32(1): 119-123.
Miao J, Shi G F, Wang G Y,. Simulation of distillation process for polyoxymethylene dimethyl ethers by Aspen Plus[J]. Computers and Applied Chemistry, 2015, 32(1): 119-123.
[18] Burger J, Ströfer E, Hasse H. Production process for diesel fuel components poly(oxymethylene) dimethyl ethers from methane-based products by hierarchical optimization with varying model depth[J]. Chemical Engineering Research and Design, 2013, 91(12): 2648-2662.
[19] 韦先庆, 王清洋, 黄小科, 等. 一种制备聚甲氧基二甲醚的系统装置及工艺: 102701923A [P]. 2012-10-03.
Wei X Q, Wang Q Y, Huang X K,. System device and process for preparing polyoxymethylene dimethyl ethers: 102701923A [P]. 2012-10-03.
[20] Albert M, Hahnenstein I, Hasse H,. Vapor-liquid and liquid-liquid equilibria in binary and ternary mixtures of water, methanol, and methylal[J]. Journal of Chemical & Engineering Data, 2001, 46(4): 897-903.
[21] Kuhnert C, Albert M, Breyer S,. Phase equilibrium in formaldehyde containing multicomponent mixtures: experimental results for fluid phase equilibria of (formaldehyde+(water or methanol)+methylal)) and (formaldehyde+water+methanol+methyla) and comparison with predictions[J]. Industrial & Engineering Chemistry Research, 2006, 45(14): 5155-5164.
[22] Renon H, Prausnitz J M. Local compositions in thermodynamic excess functions for liquid mixtures[J]. AIChE Journal, 1968, 14(1): 135-144.
[23] Abrams D S, Prausnitz J M. Statistical thermodynamics of liquid mixtures: a new expression for the excess Gibbs energy of partly or completely miscible systems[J]. AIChE Journal, 1975, 21(1): 116-128.
[24] Ince E, Kirbaslar S I, Sahin S. Liquid-liquid equilibria for ternary systems of water+formic acid+dibasic esters[J]. Journal of Chemical & Engineering Data, 2007, 52(5): 1889-1893.
[25] Gilani H G, Gilani A G, Shekarsaraee S,. Liquid phase equilibria of the system (water+phosphoric acid+1-octanol) at=(298.2, 308.2, and 318.2) K[J]. Fluid Phase Equilibria, 2012, 316: 109-116.
[26] Wang C, Guo J, Cheng K,. Ternary (liquid+liquid) equilibria for the extraction of ethanol, or 2-propanol from aqueous solutions with 1,1′-oxybis(butane) at different temperatures[J]. Journal of Chemical Thermodynamics, 2016, 94: 119-126.
[27] Beneti S C, Lanza M, Mazutti M A,. Experimental (liquid+liquid) equilibrium data for ternary and quaternary mixtures of fatty acid methyl and ethyl esters (FAME/FAEE) from soybean oil[J]. Journal of Chemical Thermodynamics, 2014, 68: 60-70.
[28] Bilgin M. (Liquid+liquid) equilibria of (heptane, or hexane, or cyclohexane+toluene+1,3-dimethyl-2-imidazolidinone) ternary systems at=298.15 K[J]. Journal of Chemical Thermodynamics, 2010, 42(4): 530-535.
Liquid-liquid equilibria for ternary systems polyoxymethylene dimethyl ethers + water +-hexane
ZHUANG Zhihai, ZHANG Jianqiang, LIU Dianhua
(State Key Laboratory of Chemical Engineering, East China University of Science and Technology, Shanghai 200237, China)
Polyoxymethylene dimethyl ethers (PODE) are promising diesel additive which can be synthesized from aqueous formaldehyde solutions and methanol. Formaldehyde+methanol has been found as an economical and feasible way for the production of PODEdue to the cheap raw materials. In this study the extraction process is chosen to obtain PODEfrom aqueous solution. A reliable thermodynamic model for a good system description is important for extraction equipment modeling, development and design. Liquid-liquid equilibria(LLE) data are valuable in studies of the applicability of thermodynamic model. In this work, LLE was analytically determined at 293.15 K for the following four systems: (PODE1+ water +-hexane), (PODE2+ water +-hexane), (PODE3+ water +-hexane) and (PODE4+ water +-hexane), respectively. Based on high selectivity of PODE1-4over water and the PODEmass fraction in the organic phase was much larger than that in aqueous phase, it was found that washing with-hexane was an effective way of extracting PODEfrom the aqueous phase without losing any significant amount of PODEto the extract phase. The isothermal experimental data were shown a good linear fit in Hand plots with2being approximately unity. The well-known NRTL and UNIQUAC thermodynamic models were applied to correlate the experimental data, and the results of root mean square deviation calculation (RMSD) and ternary phase diagram analysis indicated that NRTL and UNIQUAC models all shown good predictive capabilities.
extraction;-hexane; polyoxymethylene dimethyl ether; aqueous solution; phase equilibria
LIU Dianhua, dhliu@ecust.edu.cn
date: 2016-03-31.
TQ 013.1
A
0438—1157(2016)09—3545—07
10.11949/j.issn.0438-1157.20160391
2016-03-31收到初稿,2016-05-14收到修改稿。
联系人:刘殿华。第一作者:庄志海(1990—),男,硕士研究生。

