广西莪术叶斑病病原鉴定及生物学特性研究△
蒋妮,刘丽辉,胡凤云,刘威,刘凡
(广西药用植物园,广西 南宁 530023)
广西莪术叶斑病病原鉴定及生物学特性研究△
蒋妮*,刘丽辉,胡凤云,刘威,刘凡
(广西药用植物园,广西 南宁 530023)
目的:明确广西莪术叶斑病病原菌种类,掌握其生物学特性。方法:依据柯赫氏法则进行致病性测定和病原菌验证,通过形态学特征观察、rDNA-ITS序列分析来确定病原菌;设置不同的培养基、温度、PH值、湿度,观测菌丝生长及孢子萌发,进行生物学特性研究。结果:病原菌为大豆拟茎点种腐病菌(Phomopsis longicolla);菌株在PDA培养基生长良好,加了莪术汁的PDA培养基更利于生长及产孢,温度20~30 ℃、PH值5~6条件下适宜菌丝生长及孢子萌发,RH为80%时孢子萌发率最高。结论:广西莪术叶斑病病原菌鉴定为Phomopsislongicolla;中温、潮湿、偏弱酸性环境条件适宜该菌生长。
广西莪术;病害;病原鉴定;生物学特性
广西莪术CurcumakwangsiensisS.G.Leset C.F.Liang,为姜科姜黄属多年生草本植物,是中药莪术的三大基源植物之一,又称桂莪术、毛莪术。以根茎作为中药莪术使用,具有破瘀行气、消积止痛之功效;块根作为中药郁金(习称“桂郁金”)使用,有行气化瘀、清心解郁、利胆退黄的功能;近期文献报道莪术油还具有抗肿瘤、抗病毒等作用[1-2]。广西作为广西莪术的道地药材产区,传统种植于钦州灵山县、贵港市等地,南宁市隆安县也有栽培,全区种植面积上万亩。近年来随着药材及其他作物种植结构的调整,以及周边环境的不断变化,广西莪术叶斑病发生严重。病害发生早期多从叶尖或叶缘处出现黄褐色斑点,随着病原菌的不断侵染,病斑逐渐向叶中脉扩展,引起叶片大面积枯黄,后期植株早衰死亡,严重影响广西莪术的栽培生产。国内外关于广西莪术病害的研究尚未见报道,叶斑病为广西莪术病害的首次报道。因此,明确广西莪术叶斑病病原菌种类及其生物学特性,能够对该病害的预防与控制提供科学依据。
1 材料和方法
1.1 采样与分离
2013年6月,在广西隆安县城厢镇小林村广西莪术种植基地,采集具有典型症状的莪术病叶及健康叶片,用清水洗净病叶表面,进行病原菌的分离及纯化[3]:在病健交界处剪取20块长宽4~5 mm的病叶组织,用75%的酒精消毒2~3 s,0.1%升汞消毒2 min,无菌水冲洗3遍,置于灭菌滤纸上,吸干水后将病叶组织分别接到装有PDA培养基的培养皿上,共20 皿,在26 ℃恒温条件下培养,4天后挑取组织块周围的菌丝转皿培养、纯化,对分离物归类、编号、转管保存。
1.2 致病性测定
采取针刺方式进行。将纯化的菌株接种至马铃薯葡萄糖琼脂培养基(PDA),在28℃、RH为65%霉菌培养箱内扩繁培养5 d,用打孔器制成直径为9 mm的菌片备用。用无菌接种针在健康的广西莪术叶片上刺成面积约为1 cm2的伤口,用接种铲将菌片接至伤口,保湿培养3~4 d,观察发病情况。根据柯赫氏法则,对发病叶片进行再分离,显微镜下观察分离病菌与原接种菌株是否相同[3]。以接种PDA培养基作为对照,在室温(20 ℃~25 ℃)下保湿培养5天,记录发病情况。
1.3 形态学鉴定
将分离纯化后的病原菌在PDA上培养5 d,在菌落边缘取菌丝块接种于无菌广西莪术叶片,在25 ℃、12 h/12 h光照/黑暗交替条件下培养,20 d后,在光学显微镜下进行病原菌形态学观察和测量,包括子座大小、分生孢子器形态及排列、分生孢子形态及大小等。
1.4 核糖体rDNA-ITS序列分析
采用SDS法提取病原菌株的基因组DNA[4]。采用真菌核糖体基因转录间隔区(ITS)通用引物ITS4(5′TCCTCCGCTTATTGATATGC 3′)和ITS5(5′ GGAAGTAAAAGTCGTAACAAGG 3′)(上海捷瑞生物工程有限公司合成),扩增该菌的rDNA-ITS序列。扩增产物的纯化和序列测定委托北京诺赛生物科技有限公司进行,所得到的核苷酸序列与GenBank中相关菌株进行同源性比较[5]。
1.5 不同培养基对菌丝生长的影响
选用5种培养基(编号1号~5号)观察菌丝生长情况:1号PDA培养基(1000 mL清水+200 g马铃薯+20 g蔗糖+20 g琼脂)、2号PDA莪术汁培养基(1000 m1清水+200 g马铃薯+10 g莪术汁+20 g蔗糖+20 g琼脂、)、3号燕麦培养基(清水l000 mL+30 g燕麦+25 g琼脂)、4号燕麦马铃薯培养基(1000 mL清水+200 g马铃薯+30 g燕麦+20 g琼脂+20 g蔗糖)、5号玉米培养基(清水1000 mL+50 g玉米粉+10 g琼脂),清水琼脂培养基做对照。在病原菌菌落边缘取直径5 mm的菌饼移植到上述培养基,25 ℃恒温培养,培养72 h、96 h、120 h时分别采用十字交叉法测量菌落直径,并计算平均值。每个处理重复3次。
1.6 不同温度对菌丝生长和孢子萌发的影响
将直径为5 mm的病原菌菌饼移植到PDA莪术汁培养基平板上,在5、10、15、20、25、30、35 ℃ 7个不同温度条件下培养,120 h后测量菌落直径,每个处理重复3次。以pH为6的1%莪术叶片汁配制孢子悬浮液(15×40倍视野镜下20~25个孢子),滴于凹玻片上,分别放置于10、15、20、25、30、35、40 ℃下进行培养,48h后观察其萌发率,每处理重复3次。
1.7 PH值对菌丝生长和孢子萌发的影响
用灭菌的NaOH和HCl分别调节莪术汁PDA培养基pH值至2、3、4、5、6、7、8、9,并制成平板,接入5 mm的病原菌菌饼,25 ℃恒温培养,接种后120h测量菌落直径,每处理重复3次。配置1%莪术叶片汁孢子液(15×40倍视野镜下20~25个孢子),以灭菌的NaOH和HCl调节上述培养基pH值为l、2、3、4、5、6,7、8、9、10、1l的梯度。将孢子液滴于凹玻片上,25 ℃恒温培养,48 h后观察其萌发率。每处理重复3次。
1.8 湿度对孢子萌发的影响
在干燥器内用不同浓度的硫酸将干燥器分别调制成相对湿度为90、80、70、60、50、20、10%的梯度湿度,将1%莪术叶片汁孢子悬浮液(15×40倍视野镜下20~25个孢子)滴于凹玻片上,分别放置于上述各相对湿度的干燥器中,25 ℃恒温培养,48 h后观察孢子萌发率,每处理重复3次。
2 结果和分析
2.1 病害症状
发病植株的症状主要表现在叶片,病原菌主要侵染植株的中上部叶片,一般先侵染嫩叶。病害发生早期多从叶尖或叶缘处开始出现淡黄色的水渍状斑点,病健交界明显,随着病原菌的不断侵染,病斑逐渐向叶中脉扩展,形成边缘褐色、中间暗褐色并凹陷的“V”形大病斑,病斑上可见黑色小颗粒(分生孢子器),后期叶片枯黄、植株死亡。
2.2 病原菌分离、纯化及致病性测定
将病组织置于PDA平板,25 ℃恒温培养3~4 d后,所有病组织均长出菌落,对各菌落进行编号、纯化,其中产孢真菌用单孢分离法对进行纯化,不产孢真菌采用多次挑取菌落边缘菌丝转皿纯化,共得到22个纯化菌株。在室内将所有菌株离体接种至健康的广西莪术叶片,保湿培养5 d后,仅编号为v-3菌株接种后发病,对照未发病。发病叶片表现出明显的黄褐色病斑,对发病叶片进行再分离,获得与原分离菌株一致的病原菌。根据柯赫氏法则,V-3菌株为该病的致病菌株。
2.3 病原菌的形态特征
菌株V-3在PDA培养基上生长良好,菌落圆形,菌丝白色、有隔,疏松绒毛状,2周后培养基背面产生黑色球形至不规则形分生孢子器,直径200~500 μm,但挑取分生孢子器在显微镜下难观察到分生孢子。接种病原菌的莪术叶片,培养15 d后可产生分生孢子器;在显微镜下可观察到两种类型分生孢子,其中α型分生孢子长纺锤形,无色,单孢,含有l-2个油球,大小为(5.2~28.2)μm×(1.5~7.1)μm;β型分生孢子无色,线形,一端稍弯曲,单孢,l-3个油球,大小为(2.5~12.2)μm×(1.0~3.1)μm。根据上述形态特征,认为该病原菌为拟茎点霉属(Phomopsissp.)真菌。
2.4 病原菌核糖体DNA-ITS序列分析
采用通用引物ITS1/ITS4对V-3菌株的rDNA—ITS序列进行PCR扩增,扩增产物经琼脂糖凝胶电泳检测,得到1个大小约为500 bp的片段,经序列测定,确定该片段全长451 bp,1~51 bp为部分18SrDNA,52~01 bp为ITS1,202~351 bp为5.8SrDNA,352~401 bp为ITS4,402~451 bp为部分5.8SrDNA(图1)。将上述测序结果在GenBank中进行同源性分析,该病原菌株与(Phomopsissp.)同源性达99%。结合形态鉴定确定该病原菌为拟茎点霉属真菌(Phomopsissp.)。

ACCTGCGGAGGGATCATTGCTGGAACGCGCTTCGGCGCACCCAGAAACCCTTTGTGAACTTATACCTATTGTTGCCTCGGCGCAGGCCGGCCTCTTCACTGAGGCCCCCTGGAGACAGGGAGCAGCCCGCCGGCGGCCAACCAAACTCTTGTTTCTACAGTGAATCTCTGAGTACAAAACATAAATGAATCAAAACTTTCAACAACGGATCTCTTGGTTCTGGCATCGATGAAGAACGCAGCGAAATGCGATAAGTAATGTGAATTGCAGAATTCAGTGAATCATCGAATCTTTGAACGCACATTGCGCCCTCTGGTATTCCGGAGGGCATGCCTGTTCGAGCGTCATTTCAACCCTCAAGCCTGGCTTGGTGATGGGGCACTGCTCTCTGACGGGAGCAGGCCCTGAAATCTAGTGGCGAGCTCGCTAGGACCCCGAGCGTAGTAGTTATATCTCGTTCTGGAAGGCCCTGGCGGTGCCCTGCCGTTAAACCCCCAACTTCTGAAAATTTGACCTCGGATCAGGTAGGAATACCCGCTGAACTTAAGCATATCAATA
图1病原菌ITS-rDNA片段序列图
2.5 培养基对菌丝生长的影响
试验结果(图2)表明,菌丝在PDA培养基(1号)、莪术汁PDA培养基(2号)燕麦马铃薯培养基(4号)上生长120h后,菌落平均直径分别为80.5mm、88.5mm、75.8mm,显著大于其他培养基,其中2号培养基菌株生长最旺盛,菌丝呈白色絮状且较1号培养基的菌丝稍致密,菌落突起。5号玉米培养基上菌丝生长最差。
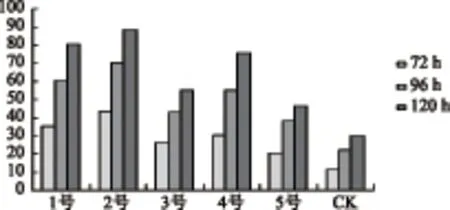
图2 不同培养基对菌丝生长的影响
2.6温度对菌丝生长和孢子萌发的影响
图3-a显示:该菌丝生长温度范围为10 ℃~35 ℃,最适宜温度范围为20 ℃~30 ℃,以25 ℃条件下菌丝生长最好,平均直径为62.0mm,显著大于其他温度条件下培养的菌落直径,在5 ℃、40 ℃下不能生长。图3-b显示:分生孢子在10 ℃~35 ℃范围内均能萌发,20 ℃~30 ℃适宜孢子萌发,其中25 ℃条件下,萌发率最高,为80.2%。,5 ℃、40 ℃条件下不能萌发。
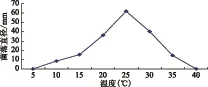
图3-a 不同温度对菌丝生长的影响
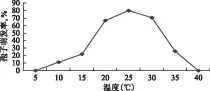
图3-b 不同温度对孢子萌发的影响
2.7 不同pH值对菌丝生长和孢子萌发的影响
图4-a结果表明:菌丝在pH值3~9条件下能生长,适宜的pH值范围为4~7,pH值为5条件下生长最好,pH值分别为1、2、10、11条件下不能生长。图4-b结果表明:分生孢子在pH值3~10的条件下均可萌发,适宜pH值范围4~7,pH值为5条件下萌发最好,pH值分别为1、2、11条件下无法萌发。
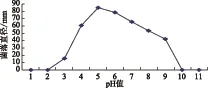
图4-a 不同pH值对菌丝生长的影响
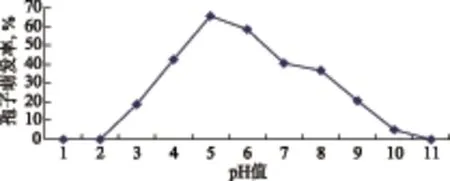
图4-b 不同pH值对孢子萌发的影响
2.8湿度对孢子萌发的影响
图5显示,孢子在相对湿度(RH)为50%-100%条件下均可萌发,RH 70%~90%适宜萌发,RH80%萌发最好,(RH)低于50%,孢子不能萌发。
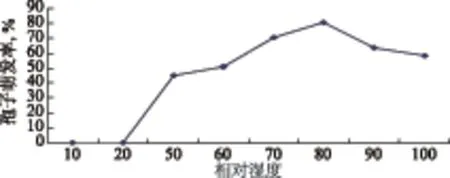
图5 不同湿度对孢子萌发的影响
3 小结与讨论
拟茎点霉属真菌是一类重要的植物病原真菌,大豆拟茎点种腐病菌能引起多种植物病害,目前报道的寄主植物除大豆外,还为害三叶草、绿豆、豌豆、花生、大蒜、洋葱、辣椒、番茄、三裂叶豚草、苍耳、小地锦草、皱叶酸模等[6]。笔者在传统形态学鉴定的基础上,通过对广西莪术叶斑病病原菌的rDNA-ITS进行分析比对,从分子生物学水平上进一步明确拟茎点霉属真菌—大豆拟茎点种腐病菌(Phomopsislongicolla)为广西莪术叶斑病的病原真菌,发现该致病菌侵染广西莪术为首次报道。
通过对广西莪术叶斑病病原菌的生物学特性研究发现,该病原菌对营养的要求不严格,在多种培养基上均能生长良好,以PDA、莪术汁PDA培养基最为适合;菌丝生长及孢子萌发适宜温度为20~30 ℃,偏弱酸性条件利于孢子萌发;孢子萌发需要一定的湿度,RH<50%不萌发,RH为80%时孢子萌发率最高。可见,该病原菌喜中温、潮湿、偏弱酸性环境,在田间控制病害时应考虑病原菌的生物学特性进行。同时,关于该病原菌对碳氮源的利用等生物学特性,以及该病害的田间防治技术还有待进一步研究。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:193.
[2] 曾建红,陈旭,蒋小军,等.广西莪术挥发油抗肿瘤活性成分GC-MS研究[J].中华中医药杂志,2008,增刊:10.
[3] 方中达.植病研究方法[M].北京:中国农业出版社,1998.
[4] Graham G C,Mayser S P,Henry R J.A simplified method for the preparation of fungal genomic DNA for PCR and RAPD analysis[J].Biotechniques,1994,16(1):48-50.
[5] Thompson J D,Gibson T J,Plewniak F,et a1.The CLUSTAL windows interface:flexible strategies for multiple sequence alignment aided by quality analysistools[J].Nucleic Acids Research,1997,24:4876-4882.
[6] 张建成,顾建锋,徐瑛,等.大豆拟茎点种腐病的研究进展及其检疫意义[J].植物检疫,2005,19(3):163-167.
IdentificationofCurcumakwangsiensisLeafSpotPathogenandObservationofItsBiologicalCharacteristics
JIANG Ni*,LIULihui,HUFengyun,LIUWei,LIUFan
(GuangxiBotanicalGardenofmedicineplant,Nanning530023,China)
Objective:The study is aimed to iendtify the organism that leads to theCurcumakwangsiensisleaf spot andgrasp the biological characteristics of the pathogen.Methods:The fungus was isolated from infected plants according to Koch’s Rule.The identification of the pathogen was carried out mainly based on the morphological characters and molecular analysis of internal transcribed spacer(ITS)sequences;The effects of temperature,humidity,PH and nutrition on mycelial growth and conidialgermination of the pathogen were also investigated.Results:The morphological characters of the pathogenic isolate were in agreement withPhomopsissp.When compared with sequences in GenBank,the ITS sequence of the pathogen was 99% similar to that ofP.longicolla.On the condition of PH5~6,20~30 ℃ the fungal isolates grow bette and the more conidiums germinate.PDA medium with rhizomazedoariae juice was the optimum medium.Conclusion:The pathogen causingC.kwangsiensisleaf spot was identifidied asP.longicolla.The fungal isolates grow better on the condition of medium temperature,humidity and weak acid environment.
Curcumakwangsiensis;disease;pathogen identification;biological characteristic
2015-03-09)
广西中医药科技专项(GZKZ1133);南宁市科技成果推广及产业化示范项目(201101074C)
*
蒋妮,副研究员,研究方向:药用植物栽培病虫害防治;Tel:(0771)5602461,E-mail:jiangni292@126.com
10.13313/j.issn.1673-4890.2016.5.017

