儿茶酚香豆素清除自由基能力测定及作用机制探索△
陆俊霞,李珂珂,王平,崔攀,陈丽荣,弓晓杰*
(1.大连大学 环境与化学工程学院,辽宁 大连 116622;2.大连大学 医学院,辽宁 大连 116622;3.中国科学院 大连化学物理研究所 药用资源开发实验室,辽宁 大连 116023)
儿茶酚香豆素清除自由基能力测定及作用机制探索△
陆俊霞1,3,李珂珂2,王平3,崔攀3,陈丽荣1,弓晓杰2*
(1.大连大学 环境与化学工程学院,辽宁 大连 116622;2.大连大学 医学院,辽宁 大连 116622;3.中国科学院 大连化学物理研究所 药用资源开发实验室,辽宁 大连 116023)
目的:测定儿茶酚香豆素清除自由基的能力,并研究其作用机制。方法:测定系列不同浓度的4-取代、8-含氮氢键受体和单甲基化儿茶酚香豆素衍生物对DPPH、ABTS·+自由基的清除率,绘制浓度-清除率曲线,结合文献报道的酚类化合物清除自由基的作用机制,研究儿茶酚类香豆素清除自由基的作用机制。结果:所有被测儿茶酚香豆素化合物都具有良好的抗氧化活性,其对ABTS·+自由基的清除能力强于对DPPH的清除能力。当引入含氮氢键受体,形成分子内氢键后,其对DPPH自由基的清除能力减弱,而对ABTS·+的清除能力没有明显变化。当儿茶酚香豆素被单甲基化后,其清除自由基的活性明显下降。结论:儿茶酚类香豆素清除DPPH自由基的作用机制和酚羟基的氢原子转移有关,而清除ABTS·+的作用方式可能是质子丢失,电子转移。
儿茶酚香豆素;自由基;作用机制
活性氧种(ROS)介导的氧化应激与多种疾病的发生密切相关,如帕金森和老年痴呆症等[1-2]。ROS的累积甚至会导致DNA双键断裂、蛋白肽链断裂和基因突变[3]。因此,ROS的清除对于预防和治疗氧化应激导致的机体氧化损伤、维护人类健康具有重要的意义[4]。探究化合物抗氧化活性作用机制为获得高活性的抗氧化剂提供了可靠的理论依据。儿茶酚类香豆素具有显著的抗氧化活性,但是,目前对酚类化合物清除自由基的作用机制研究尚未清楚[5]。本研究采用DPPH、ABTS·+模型对系列儿茶酚香豆素的抗氧化活性进行评价,并在此基础上探索儿茶酚香豆素清除这两类自由基的作用机制。
1 材料与仪器
1.1 材料
七叶亭和瑞香素(天津希恩思生化科技有限公司,纯度>97%),其他系列的24个儿茶酚香豆素衍生物均为合成品(纯度>98%),化学结构及名称见图1;1,1-二苯基-2-三硝基苯肼[DPPH,梯希爱(上海)化成工业发展有限公司];2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS,美仑生物);实验用水为Millipore 纯化水。
1.2 仪器
Synergy H1 型全功能微孔板检测酶标仪(美国博腾仪器有限公司);Millipore 纯水仪(美国Millipore 公司);96孔板(美国Conring公司);可调量程移液器(Eppendorf Research plus)。
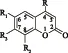
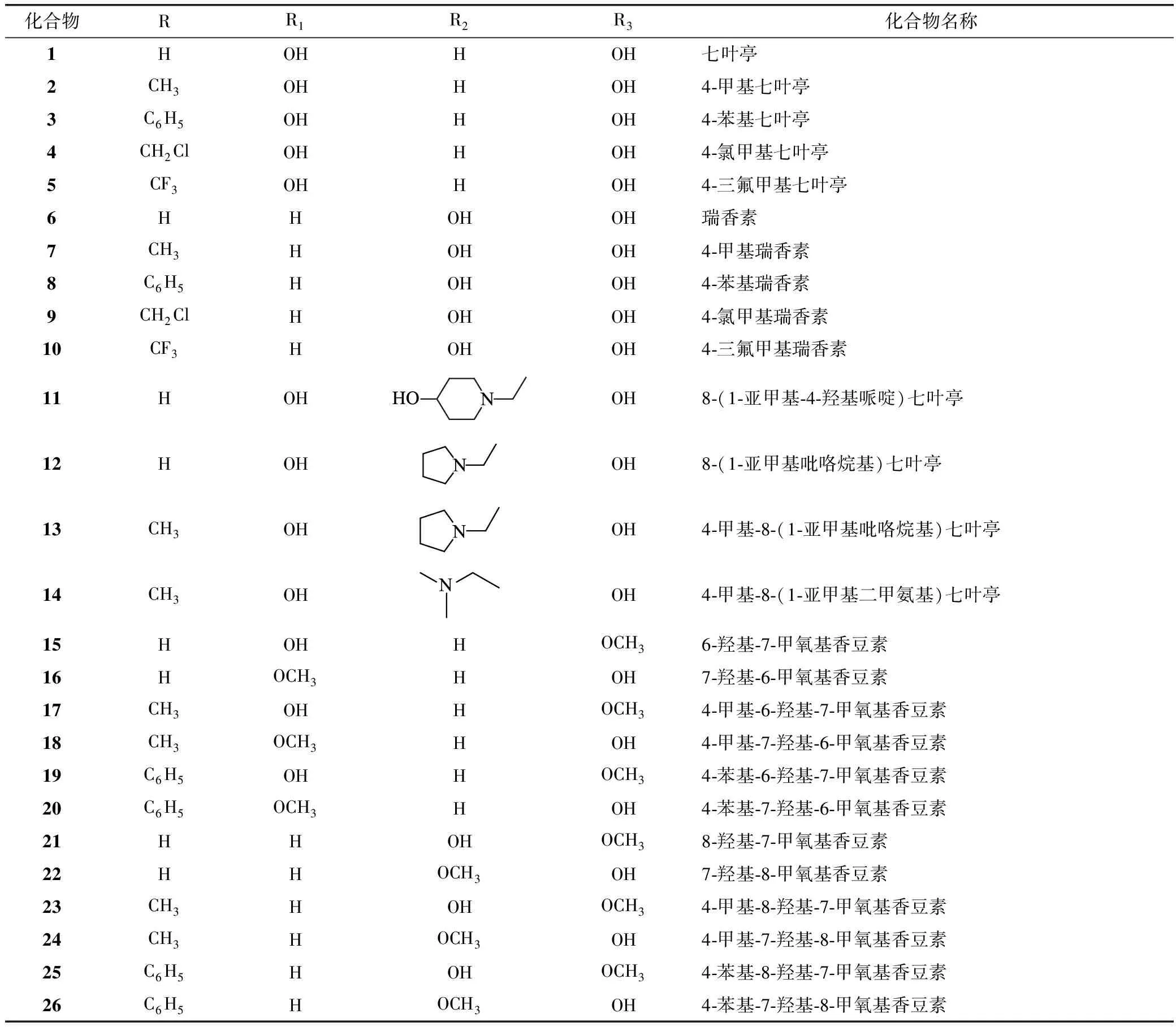
化合物RR1R2R3化合物名称1HOHHOH七叶亭2CH3OHHOH4⁃甲基七叶亭3C6H5OHHOH4⁃苯基七叶亭4CH2ClOHHOH4⁃氯甲基七叶亭5CF3OHHOH4⁃三氟甲基七叶亭6HHOHOH瑞香素7CH3HOHOH4⁃甲基瑞香素8C6H5HOHOH4⁃苯基瑞香素9CH2ClHOHOH4⁃氯甲基瑞香素10CF3HOHOH4⁃三氟甲基瑞香素11HOHOH8⁃(1⁃亚甲基⁃4⁃羟基哌啶)七叶亭12HOHOH8⁃(1⁃亚甲基吡咯烷基)七叶亭13CH3OHOH4⁃甲基⁃8⁃(1⁃亚甲基吡咯烷基)七叶亭14CH3OHOH4⁃甲基⁃8⁃(1⁃亚甲基二甲氨基)七叶亭15HOHHOCH36⁃羟基⁃7⁃甲氧基香豆素16HOCH3HOH7⁃羟基⁃6⁃甲氧基香豆素17CH3OHHOCH34⁃甲基⁃6⁃羟基⁃7⁃甲氧基香豆素18CH3OCH3HOH4⁃甲基⁃7⁃羟基⁃6⁃甲氧基香豆素19C6H5OHHOCH34⁃苯基⁃6⁃羟基⁃7⁃甲氧基香豆素20C6H5OCH3HOH4⁃苯基⁃7⁃羟基⁃6⁃甲氧基香豆素21HHOHOCH38⁃羟基⁃7⁃甲氧基香豆素22HHOCH3OH7⁃羟基⁃8⁃甲氧基香豆素23CH3HOHOCH34⁃甲基⁃8⁃羟基⁃7⁃甲氧基香豆素24CH3HOCH3OH4⁃甲基⁃7⁃羟基⁃8⁃甲氧基香豆素25C6H5HOHOCH34⁃苯基⁃8⁃羟基⁃7⁃甲氧基香豆素26C6H5HOCH3OH4⁃苯基⁃7⁃羟基⁃8⁃甲氧基香豆素
图1儿茶酚香豆素衍生物的化学结构及名称
2 方法
2.1 DPPH法
参照文献报道的方法稍作修改[6]。主要实验步骤:添加180 μL DPPH乙醇液和20 μL不同浓度的待测物的二甲基亚砜(DMSO)溶液于96孔板,室温避光反应30 min,测定其在517 nm处的吸光度,记作Asample。对照组为:180 μL DPPH乙醇液和20 μL DMSO,吸光度值记为Acontrol;180 μL乙醇液和20 μL待测物,吸光度值记为Ablank。每个样品平行测定2次,根据公式(1)计算不同浓度样品对DPPH自由基的清除率。最后,采用GraphPad Prism 6 软件绘制清除率-浓度对数曲线。
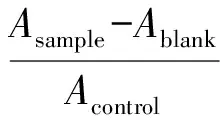
(1)
2.2 ABTS法
参照文献报道的方法稍作修改[7]。主要实验步骤:7 mmol·L-1ABTS的磷酸缓冲溶液(PBS;1 mmol·L-1,pH=7.4)和2.45 mmol·L-1K2S2O4的PBS溶液,两者按1∶1混合,室温避光保存12~16 h,吸收值稳定后将溶液稀释至吸光度介于0.8~0.9,即为ABTS·+自由基工作液。取180 μL ABTS·+工作液和20 μL不同浓度待测物的DMSO溶液于96孔板,室温充分反应10 min,测定其在734 nm处的吸光度值,记作Asample。对照组为180 μL ABTS·+工作液和20 μL DMSO,其吸光度值记为Acontrol;180 μL PBS和20 μL待测物,吸光度值记为Ablank。每个样品平行测定2次,根据公式(1)计算不同浓度样品对ABTS·+自由基的清除率,采用GraphPad Prism 6软件绘制ABTS·+清除率-浓度对数曲线。
2.3 Gaussian 09计算方法
采用Gaussian 09密度泛函理论(Density Functional Theory,DFT)对儿茶酚香豆素酚羟基键的解离能进行计算[8-10]。首先在B3LYP/6-31+G(d)水平,对儿茶酚香豆素类化合物粒子进行几何构型优化,然后频率计算298 K时的热力学能参数,最后根据公式(2)计算羟基键的解离能[11]。
BDE(kJ·mol-1)=(HAr-O·+HH·-HAr-OH)×2 565.5
(2)
式中:HAr-OH、HAr-O·、HH·分别为298 K时,儿茶酚香豆素分子均裂前后分子和自由基的能量。
3 结果与讨论
3.1 4-取代儿茶酚香豆素对DPPH、ABTS·+自由基的清除能力
不同结构的4-取代儿茶酚香豆素(化合物1~10),清除DPPH、ABTS·+自由基的结果如图2和图3所示。10种儿茶酚香豆素化合物均具有良好的自由基清除能力,其中七叶亭类(1~5)化合物对DPPH自由基的清除能力强于瑞香素类(6~10);而对ABTS·+的清除率,两者相当。这可能是由于氢键的影响,在七叶亭化合物中,分子内氢键只存在于邻酚羟基之间;在瑞香素类衍生物中,不仅邻二酚羟基间能形成分子内氢键,而且8-OH和内酯环氧也能形成分子内氢键,8-羟基氢由于同时受到7-羟基氧、内酯环氧和8-羟基氧的共同作用而被钝化,不易给出氢,表现出较弱的自由基清除能力。因此,七叶亭类衍生物对自由基的清除能力比瑞香素类强。根据酚类化合物清除自由基的作用机制,儿茶酚香豆素清除DPPH自由基的作用机制可能为氢原子转运[12-13]。同时,儿茶酚香豆素对ABTS·+的清除能力(约90%)高于对DPPH自由基的清除能力(约60%),故测定ABTS·+的清除率更能体现出酚类化合物的抗氧化活性。
3.2 含氮七叶亭对DPPH、ABTS·+的清除能力
化合物11~14在七叶亭C-8位引入含氮氢键受体基团,与7-OH形成分子内氢键,仍表现出良好的抗氧化活性。图4中,化合物11~14清除DPPH自由基的能力弱于母体化合物。这可能是由于分子内氢键影响酚羟基的解离能,进而影响其对DPPH自由基的清除能力。这再一次说明,儿茶酚类化合物清除自由基的作用机制为酚羟基氢原子转运。图5显示,七叶亭类化合物中引入大小不同的含氮基团,其清除ABTS·+的能力等同于母体化合物。氢键的存在及氢键作用力的强弱对七叶亭类化合物清除ABTS·+的抗氧化活性没有显著的影响。依此推测,儿茶酚类香豆素清除ABTS·+的作用机制可能是丢失质子,电子传递。因为从电子效应的角度考虑,氮具有较强的电负性,为吸电子基团;从共轭效应的角度考虑,氮原子含有一对孤电子对,为供电子基团。当含氮基团和7-位羟基氢形成分子内氢键时,氮作为氢键的电子供体,此时氮以电子效应为主,其与苯环相连接的亚甲基表现出一定的电负性,容易给出氢。而含氮杂环的空间位阻较大,排斥氮和邻酚羟基形成分子内氢键,其发挥抗氧化活性的仍然是酚羟基占主导地位。

注:A.化合物1和6;B.化合物2和7;C.化合物3和8;D.化合物4和9;E.化合物5和10;下同。图2 4-取代儿茶酚香豆素对DPPH自由基的清除率
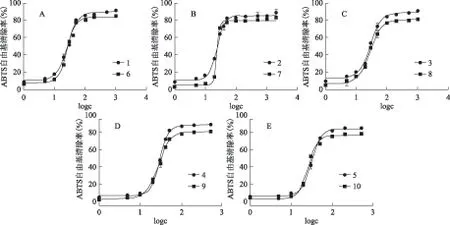
图3 4-取代儿茶酚香豆素对ABTS·+的清除率
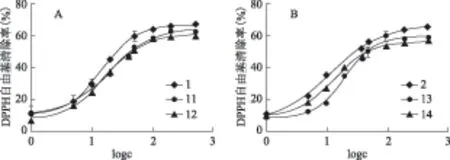
注:A.化合物1、11、12;B.化合物2、13、14;下同。图4 含氮七叶亭衍生物对DPPH的清除率
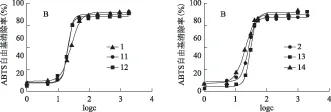
图5 含氮七叶亭衍生物对ABTS·+的清除率
3.3 儿茶酚香豆素单甲基化产物清除自由基的能力
为了深入理解和验证儿茶酚类香豆素清除DPPH自由基的作用机制,测定并比较分析了系列儿茶酚香豆素及其单甲基化产物对DPPH自由基的清除能力,并根据酚类化合物清除自由基的作用机制,采用gaussain 09密度泛函理论对酚羟基的解离能(Bond Dissociation Energy,BDE)进行计算。结果见表1、2。
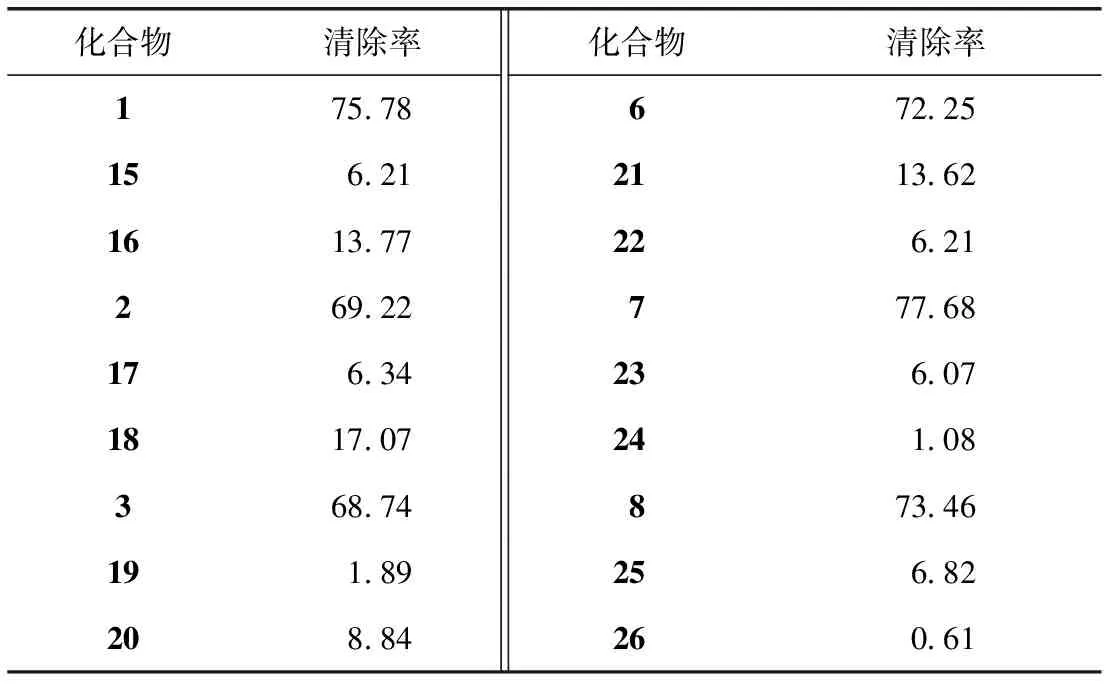
表1 1 mmol·L-1香豆素类化合物对DPPH自由基清除率 (%)
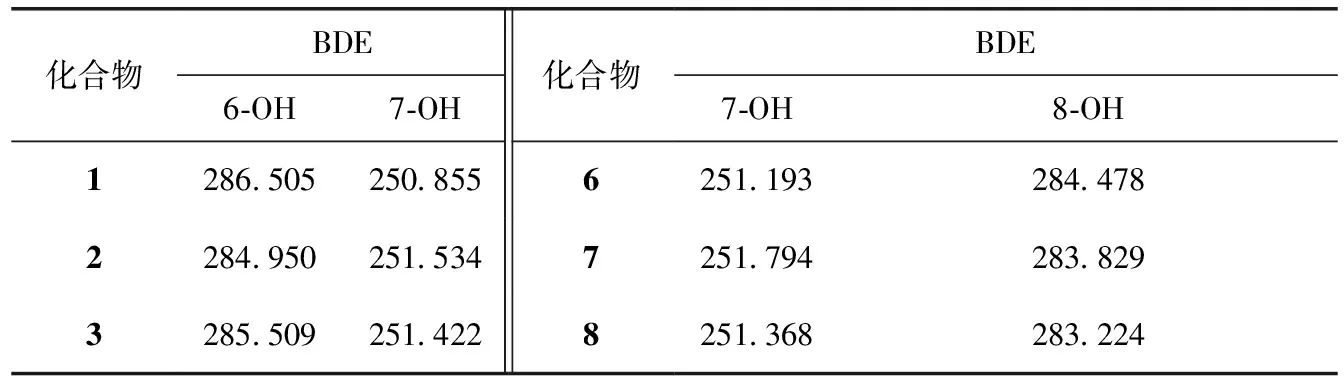
表2 儿茶酚香豆素化合物的酚羟基解离能(BDE) /kJ·mol-1
如表2所示,儿茶酚香豆素被选择性甲基化后,其抗氧化活性显著降低,但是仍具有以下的结构-抗氧化活性关系,7-OH>8-OH>6-OH。对酚羟基的解离能计算结果如表3所示,同一化合物的酚羟基解离能满足BDE6-OH>BDE7-OH,BDE8-OH>BDE7-OH,而且同分异构体之间,7,8-二羟基的解离能介于6,7-二羟基之间。根据BDE值,儿茶酚香豆素清除自由基的能力为7-OH6,7>7-OH7,8>8-OH>6-OH。这虽然不能作为比较七叶亭类和瑞香素类化合物抗氧化活性的充分条件。但是,可以得出含有7-OH的单酚香豆素具有较高抗氧化活性的结论,这与实验结果相匹配。基于以上的对比分析和计算,表明酚类香豆素化合物清除DPPH自由基的作用方式为酚羟基的氢原子转移到自由基上。至于儿茶酚类香豆素和单酚类香豆素间显著的抗氧化活性差异,这可能是由于邻酚羟基之间存在协同作用。
4 结论
儿茶酚香豆素是一类良好的抗氧化剂,其对DPPH、ABTS·+自由基具有显著的清除能力,对ABTS·+的清除率强于对DPPH自由基的清除率,ABTS·+法更能体现化合物的抗氧化活性。比较七叶亭和瑞香素类化合物抗氧化活性,其中,对DPPH自由基的清除率,七叶亭类化合物的作用能力高于瑞香素类化合物,其作用机制为酚羟基氢原子转运,氢键的形成通过改变羟基的解离能进而影响其抗氧化活性。对ABTS·+的清除活性,七叶亭类化合物的作用能力等同于瑞香素类化合物,氢键对清除率没有显著的影响,但是与给出质子的能力相关。因此,儿茶酚香豆素清除ABTS·+的作用机制可能是丢失质子,电子传递。此研究和讨论为儿茶酚香豆素化合物的理性结构优化提供了可靠的理论依据,对获得高活性的候选抗氧化药物具有理论指导作用。
[1] Droge W.Free radicals in the physiological control of cell function[J].Physiol Rev,2002,82(1):47-95.
[2] Jones D P.Redefining oxidative stress[J].Antioxid Redox sign,2006,8(9-10):1865-1879.
[3] Lin H C,Tsai S H,Chen C S,et al.Structure-activity relationship of coumarin derivatives on xanthine oxidase-inhibiting and free radical-scavenging activities[J].Biochem Pharmacol,2008,75(6):1416-1425.
[4] Berg D,Youdim M B,Riederer P.Redox imbalance[J].Cell Tissue Res,2004,318(1):201-213.
[5] Acker S A van,Groot M J de,Berg D J van den,et al.A quantum chemical explanation of the antioxidant activity of flavonoids[J].Chem Res Toxicol,1996,9(8):1305-1312.
[6] Wu Y D,Lai D K.A density functional study of substituent effects on the O-H and O-CH(3) bond dissociation energies in phenol and anisole[J].J Org Chem,1996,61(22):7904-7910.
[7] Kou X,Chen Q,Li X,et al.Quantitative assessment of bioactive compounds and the antioxidant activity of 15 jujube cultivars[J].Food Chem,2015,173:1037-1044.
[8] Smith D M,Dupuis M,Vorpagel E R,et al.Characterization of electronic structure and properties of a bis (histidine) heme model complex[J].J Am Chem Soc,2003,125(9):2711-2717.
[9] Koppel I A,Burk P,Koppel I,et al.Gas-phase acidities of some neutral Brønsted superacids:A DFT and ab initio study[J].J Am Chem Soc,2000,122(21):5114-5124.
[10] Lu X,Ma J,Sun R,et al.Substituent effects of iron porphyrins:Structural,kinetic,and theoretical studies[J].Electrochim Acta,2010,56(1):251-256.
[11] Wright J S,Johnson E R,DiLabio G A.Predicting the activity of phenolic antioxidants:theoretical method,analysis of substituent effects,and application to major families of antioxidants[J].J Am ChemSoc,2001,123(6):1173-1183.
[12] Foti M C,Daquino C,Geraci C.Electron-transfer reaction of cinnamic acids and their methyl esters with the DPPH(*) radical in alcoholic solutions[J].J Org Chem,2004,69(7):2309-2314.
[13] Subramaniam S R,Ellis E M.Esculetin-induced protection of human hepatoma HepG2cells against hydrogen peroxide is associated with the Nrf2-dependent induction of the NAD(P)H:Quinone oxidoreductase 1 gene[J].Toxicolo Appl Pharm,2011,250(2):130-136.
FreeRadicalScavengingCapabilityofCatecholCoumarinsandMechanism
LU Junxia1,3,LIKeke2,WANGPing3,CUIPan3,CHENLirong1,GONGXiaojie2*
(1.CollegeofEnvironmentalandChemicalEngineering,DalianUniversity,Dalian116622,China;2.CollegeofMedical,DalianUniversity,Dalian116622,China;3.LaboratoryofPharmaceuticalResourceDiscovery,DalianInstituteofChemicalPhysics,ChineseAcademyofSciences,Dalian116023,China)
Objective:To evaluate free radical scavenging capacity of catechol coumarin,and further explore the mechanism of the reaction between catechol coumarins and free radical.Methods:DPPH,ABTS·+scavenging activity of a series of coumarins including substituent group at position 4,8 and monomethylation products were assayed,then the curve of logc-scvenging activity was drawn.Finally,the free radical scavenging mechanism of catechol compounds was explored according to the literature.Results:All of compounds investigated possessed excellent antioxidant activity,and the ability to get rid of ABTS·+was stronger than that of DPPH.The ability of getting rid of DPPH was reduced by introducing nitrogen-containning groups,which acting as hydrogen bond acceptors for formation of intramolecular hydrogen bonds,while no significant changes in ABTS·+were found.However,the antioxidant activity decreased significantly,even to inactivation,for monomethylation of catechol coumarins.Conclusion:The mechanism complies with Hydrogen Atom Transfer (HAT) for scavenging DPPH,while sequential proton loss electron transfer may be more appropriate for ABTS·+.
Catechol coumarins;free radical;mechanism
2016-04-06)
国家自然科学基金(81172949);辽宁省优秀人才支持计划(LR2013058);辽宁省自然科学基金计划(2015020657);辽宁省科技厅科学技术计划(2014204007);大连市科技局科技计划(2014E12SF071)
*
弓晓杰,教授,硕士生导师,研究方向:中药新药开发;E-mail:gxjclr@163.com
10.13313/j.issn.1673-4890.2016.5.007
——以高中化学“氢键”的教学为例

