加味小柴胡汤抗幽门螺杆菌的有效物质部位群研究
胡丽娟,刘蔚,吴欢欢,李力,周爱军,刘焱文*
(1.湖北中医药大学,湖北 武汉 430065;2.武汉市中医医院,湖北 武汉 430050;3.东莞市中医院,广东 东莞 523000)
加味小柴胡汤抗幽门螺杆菌的有效物质部位群研究
胡丽娟1,刘蔚1,吴欢欢1,李力2,周爱军3,刘焱文1*
(1.湖北中医药大学,湖北 武汉 430065;2.武汉市中医医院,湖北 武汉 430050;3.东莞市中医院,广东 东莞 523000)
目的:对加味小柴胡汤抗幽门螺杆菌(Helicobacter pylori,H.pylori)的有效物质部位群进行筛选研究,以期阐述其药效物质基础,为该经典方剂治疗胃溃疡的临床疗效提供现代药理学依据。方法:在中医药理论指导下,将加味小柴胡汤复方视为整体,采用系统溶剂法提取分离为挥发油、生物碱类、酚酸类、皂苷类、多糖类等化学物质部位;采用琼脂扩散法和液体稀释法,考察该方剂及其各化学物质部位对H.pylori 的抑菌圈直径和最低抑菌浓度(minimal inhibitory concentration,MIC)。结果:全方水煎液组抑菌圈直径(6.90±0.63)mm,MIC为0.125 g生药·mL-1;挥发油物质部位组(7.46±0.47)mm,MIC为0.500 g生药·mL-1;生物碱物质部位组(7.28±0.21)mm,MIC为0.130 g生药·mL-1;酚酸类物质部位组(7.46±0.10)mm,MIC为0.506 g生药·mL-1;皂苷类物质部位组(7.29±0.10)mm,MIC为0.246 g生药·mL-1;总多糖物质部位组没有产生抑菌圈。结论:确定了加味小柴胡汤方中挥发油、生物碱类、酚酸类和皂苷类等物质部位为抗H.pylori的有效物质部位群。
加味小柴胡汤;幽门螺杆菌;有效物质部位群;抑菌圈;MIC
幽门螺杆菌(H.pylori)是胃溃疡和慢性胃炎疾患的病原体,也是导致胃癌和淋巴癌的重要病因。人类是H.pylori唯一天然宿主,因而胃溃疡和慢性胃炎为常见病、多发病。我国是H.pylori感染高发地区,感染人群约占56.22%,其中西藏地区高达84.62%[1],严重危害我国人民健康。因此,寻找抗H.pylori的药物是医药科学工作者的重要研究课题。
加味小柴胡汤以张仲景所著《伤寒论》中小柴胡汤为基本方,加味干姜、黄连、白术、茯苓组成。东莞市中医院周爱军主任医师长期临床运用加味小柴胡汤治疗胃溃疡和慢性胃炎,疗效显著。本实验在临床疗效基础上,将加味小柴胡汤复方视为整体,采用系统溶剂法将其提取分离为挥发油、生物碱类、酚酸类、皂苷类、多糖类等部位;以抑菌圈直径和最低抑菌浓度作为考察指标,对各物质部位进行抗H.pylori筛选研究,确定了该方剂的有效物质部位群。因此,本实验为加味小柴胡汤用于治疗胃溃疡和慢性胃炎的临床疗效提供了科学实验依据。
1 仪器与材料
1.1 仪器
数显电热培养箱303A-3型(上海浦东荣丰科学仪器有限公司);SW-CJ-1FD洁净工作台(苏州安泰空气技术有限公司);立式灭菌器LMQ.C型(宁波甬安医疗器械制造有限公司);超纯水机QYYS-20A型(重庆前沿水处理设备有限公司);光学显微镜BX41型(奥林巴斯);-80 ℃立式超低温保存箱DW-86L288型(Haier)等。
1.2 材料
微需氧产气袋(三菱瓦斯化学株式会社);哥伦比亚培养基、哥伦比亚血琼脂基础、2.5 L圆底立式厌氧培养袋、HB四连式牛津杯(青岛海博生物技术有限公司);无菌脱纤维绵羊血(平睿生物科技有限公司)。
1.3 质控菌
幽门螺杆菌标准菌种ATCC43504(上海北诺生物科技有限公司)。
1.4 供试药物的制备
加味小柴胡汤全方水煎液的制备:按处方比例称取一定量各味中药,水煎煮提取,浓缩,干燥,研磨成药粉。称取药粉适量,用双蒸水溶解,定容至10 mL,配制成相当于2 g生药·mL-1的药液,备用。
挥发油物质部位药液的制备:取处方量中药,采用水蒸气蒸馏法提取挥发油。取挥发油适量,加100 μL聚山梨酯-80,继加入双蒸水定容至10 mL,配制成相当于4 g生药·mL-1的药液,备用。
总多糖物质部位药液的制备:取加味小柴胡汤除黄连外组方的水煎液的浓缩液,少量多次加入95%乙醇,搅拌,使药液中乙醇浓度达70%,静置过夜,减压抽滤,将醇沉物干燥,得总多糖物质部位。取总多糖干浸膏粉适量,用双蒸水定容至10 mL,配制成相当于4 g生药·mL-1的药液,备用。
生物碱物质部位药液的制备:取上述抽滤后滤液适量,挥至无醇味,用1 mol·L-1NaOH溶液调pH至10~11,用等体积的三氯甲烷萃取8次,合并三氯甲烷萃取液,减压回收三氯甲烷,得三氯甲烷物质部位;另按处方比例称取黄连,用甲醇-盐酸(100∶1)混合溶液超声处理3次,每次30 min,合并黄连提取液,减压回收溶剂,得黄连提取物;按处方比例称取三氯甲烷萃取物和黄连提取物适量,混合,得生物碱物质部位。取生物碱物质部位干浸膏粉适量,加100 μL聚山梨酯-80,继加入双蒸水定容至10 mL,配制成相当于4 g生药·mL-1的药液,备用。
酚酸类物质部位药液的制备:将上述三氯甲烷萃取后的水相用1mol·L-1HCL溶液调pH至3~4,用等体积乙酸乙酯萃取8次,合并乙酸乙酯萃取液,减压回收乙酸乙酯,得酚酸物质部位。取酚酸物质部位干浸膏粉适量,加100 μL聚山梨酯-80,继加入双蒸水定容至10 mL,配制成相当于4 g生药·mL-1的药液,备用。
皂苷类物质部位药液的制备:将上述乙酸乙酯萃取后的水相用1 mol·L-1NaOH溶液调pH至中性,用等体积水饱和正丁醇萃取8次,合并正丁醇层,减压回收正丁醇,得皂苷物质部位。取皂苷物质部位干浸膏粉适量,用双蒸水溶解定容至10 mL,配制成相当于4 g生药·mL-1的药液,备用。
1.5 阳性对照药物的制备
称取克拉霉素胶囊(江苏亚邦爱普森药业,批号:20140302)内容物0.25 g,用双蒸水溶解并定容至15 mL,备用。
2 方法[2-4]
2.1 选择性培养基的配制
2.1.1 哥伦比亚液体培养基 称取本品29.0 g,加热溶解于1000 mL双蒸水中,121 ℃高压灭菌15 min,备用。
2.1.2 哥伦比亚血琼脂固体培养基 称取本品39.0 g,加热溶解于1000 mL双蒸水中,121 ℃高压灭菌15 min,冷至50 ℃左右时,加入5%无菌脱纤维绵羊血,混匀,趁热倾入无菌平皿。
2.2 菌种的复苏与培养
将H.pylori标准菌株从-80 ℃冰箱取出,室温放冷;取标准菌种100 μL置固体培养基中,用L型玻璃棒平铺,再将培养皿装入培养袋中,放入微需氧产气袋,迅速密封后置于恒温培养箱中,37 ℃培养72 h。
2.3 菌液的制备及其浓度确定
刮除固体培养基上的菌苔,将其转移至50 mL无菌的液体培养基中,作为原菌液,37 ℃培养24 h,用0.9%氯化钠溶液将菌液稀释成10倍、100倍、103倍、104倍、105倍的菌悬液,摇匀,分别取稀释的菌悬液各10 μL置固体培养皿中,用接种针划“丰”字,再将培养皿装入培养袋中,放入微需氧产气袋,迅速密封后置于恒温培养箱中,37 ℃培养72 h;每个浓度平行试验2次。采用菌落计数的方法,确定稀释后的菌液的浓度,再选取合适的菌液浓度进行体外抗菌试验。
2.4 琼脂扩散法测定抑菌环直径
取直径90 mm、高度为16 mm的培养皿,倾注约15 mL热融的哥伦比亚血琼脂培养基,待冷凝后,作底层;另取适量热融的血琼脂培养基,冷至50 ℃左右,加入适量菌悬液(约1 mL/皿,浓度为1×105CFU·mL-1),摇匀后倾入培养皿中,约6 mL/皿,作为菌层;冷凝后,用无菌镊夹取HB四连式牛津杯置于培养皿上,每孔加各物质部位药液100 μL,每个物质部位重复3次;最后将培养皿装入培养袋中,放入微需氧产气袋,迅速密封后置于恒温培养箱中,37 ℃培养72 h;观察并测量各部位药液的抑菌圈大小。
2.5 液体稀释法测定最低抑菌浓度(MIC)
取各试验组药液,用液体培养基稀释至1∶4、1∶8、1∶16、1∶32、1∶64、1∶128等浓度,其中全方水煎液组从1∶1、1∶2开始稀释;取各组稀释后的药液各1 mL,置于2 mL试管中,分别加入50 μL菌悬液(浓度为1×107CFU·mL-1),每稀释级重复2次。阳性对照管:1 mL液体培养基中加入50 μL菌悬液,使浑浊或有菌层;阴性对照管:2 mL液体培养基,应澄清。最后将试管装入培养袋中,放入微需氧产气袋,迅速密封后置于恒温培养箱中,37 ℃培养72 h;观察药液的浑浊情况,药液浑浊说明有菌生长,药液澄清且摇匀后仍澄清说明无菌生长,无菌生长的供试药液最低浓度为该供试药液的MIC。
3 结果
3.1 H.pylori 的菌落形态
光学显微镜观察菌落形态特征,呈“海鸥”状或者弯曲的“S”,见图1~2。
图1 幽门螺杆菌培养菌落形态

图2 幽门螺杆菌镜检图
3.2 抑菌圈试验测定结果
全方水煎液组、挥发油物质部位组、生物碱物质部位组、酚酸类物质部位组、皂苷类物质部位组都显示出明显抑菌效果,与阳性药物克拉霉素比较无显著差异;而总多糖物质部位组没有产生抑菌圈,显示无抗幽门螺杆菌活性。提示加味小柴胡汤抗幽门螺杆菌的有效物质部位群为挥发油类、生物碱类、酚酸类和皂苷类,结果见表1、图3。

组别药物浓度/g生药·mL-1抑菌圈直径/mm阳性对照组 0 0167g·mL-17 60±0 13全方水煎液组 2 006 90±0 63挥发油物质部位组4 007 46±0 47生物碱物质部位组4 157 28±0 21酚酸物质部位组 4 057 46±0 10皂苷物质部位组 3 947 29±0 10多糖物质部位组 4 00—

注:1.全方水煎液组;2.挥发油组;3.生物碱组;4.酚酸组;5.皂苷组;6.多糖组;7.阳性对照组。图3 加味小柴胡汤及其各物质部位抑菌效果图
3.3 MIC测定结果
采用倍比稀释法对加味小柴胡汤及各物质部位进行最低抑菌浓度的测定,测定结果见表2。结果显示,全方水煎液组的MIC为0.125 g生药·mL-1,生物碱物质部位的MIC为0.130 g生药·mL-1,皂苷物质部位的MIC为0.246 g生药·mL-1,挥发油部位的MIC为0.500 g生药·mL-1,酚酸部位的MIC为0.506 g生药·mL-1。
4 讨论
目前临床治疗H.pylori感染疾患主要采用三联治疗方案,虽然取得了较好的治疗效果,但随着抗菌药的耐药性、不良反应及复发率高等问题的出现,其对H.pylori感染疾患的效果已受到了明显影响。因此,近年来很多学者开始关注中医药治疗H.pylori感染疾患,体现了中医药治疗胃溃疡和慢性胃炎疾患过程中有效物质系统配伍协同作用的优势。据文献报道,黄连、黄芩、茯苓、党参、甘草等中药具有抗H.pylori的药效作用,小柴胡汤、半夏泻心汤、四君子汤、黄连解毒汤等中药复方治疗H.pylori感染疾患具有较好的疗效[5]。中医临床实践证实,H.pylori感染所致胃溃疡和慢性胃炎以湿热型病例居多,其次为肝胃不和型[6]。加味小柴胡汤以柴胡为君药引领和解表里、疏肝升阳之功效,配伍黄连、黄芩发挥清热解毒功能,半夏、生姜、白术、茯苓的功效为燥湿化痰、解表散寒、补脾补气,人参、大枣则加强补脾益气,甘草调和方中诸药。因此,加味小柴胡汤临床用于治疗胃溃疡和慢性胃炎疾患符合中医辨证的普遍规律。
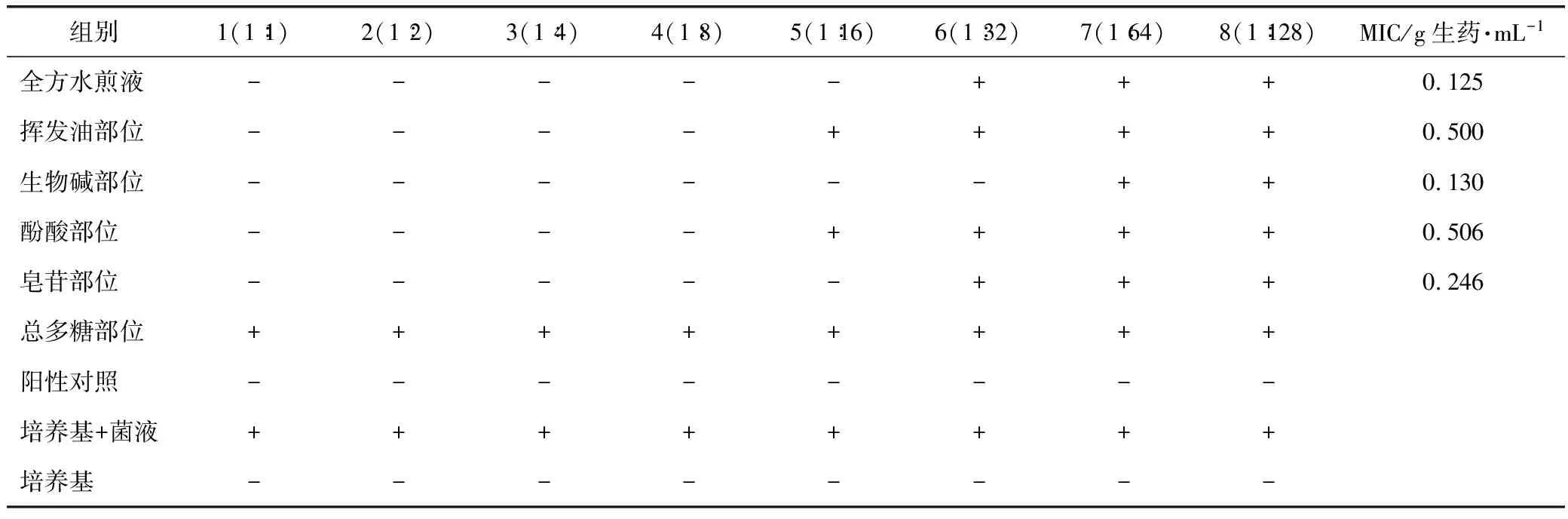
表2 加味小柴胡汤及其各物质部位的MIC实验结果
注:+表示“浑浊”;-表示“澄清”。
本实验在综合分析加味小柴胡汤方中各药化学成分的基础上,将该经典方视为整体,根据各类化学成分理化性质的特点,采用系统溶剂法将其提取分离为不同化学物质部位。制备供试品溶液过程中,发现全方、皂苷和多糖部位的水溶性较好,但其他物质部位水溶性较差,故考虑对水溶性较差的物质部位,在供试品溶液制备过程中加入1%聚山梨酯-80助溶。通过查阅相关文献发现,70%以上浓度的聚山梨酯-80具有一定抑菌作用[7]。本实验的供试品药液制备过程中仅加入1%聚山梨酯-80助溶,因此推测对实验结果影响甚微。由于培养H.pylori的固体培养基呈鲜红色,进行抑菌圈直径测量时有背景干扰,故在测量抑菌圈直径时,将培养皿放在菌落计数器的白光板上,打开白光灯,在白光板上用游标卡尺测量抑菌圈直径。在较强白光照射下,背景干扰降低,可观察到抑菌圈,抑菌圈直径大小也可准确测量。
通过抗H.pylori的筛选研究,确定了挥发油、生物碱、酚酸类、皂苷类等为有效部位群物质系统。实验结果表明,加味小柴胡汤及其有效物质部位群与目前临床用于治疗胃溃疡和慢性胃炎疾患的纯阳正气胶囊、清胃冲剂、双黄连口服液等中成药比较[8-9],其抗H.pylori的作用类似;与阳性药物比较,亦显示良好抑菌效果,这对于阐释该经典方剂的物质基础具有重要意义。加味小柴胡汤全方提取物与其有效物质部位比较,前者抗H.pylori的效果优于多数有效物质部位,从而体现了中药复方的配伍协同作用。因此,本实验研究为加味小柴胡汤治疗胃溃疡和慢性胃炎的临床疗效提供了科学实验依据,其有效物质的作用机理和配伍协同作用有待进一步深入研究。
[1] 张万岱,胡伏莲,萧树东,等.中国自然人群幽门螺杆菌感染的流行病学调查[J].现代消化及介入诊疗,2010,15(5):265-270.
[2] 喻钢,田万红,王斌,等.体外抗幽门螺旋杆菌抑菌方法的研究[J].药物分析杂志,2014,34(10):1897-1901.
[3] 陈智龙,吕永慧,王玎,等.清热化湿舒胃方及其寒热配伍对幽门螺旋杆菌的体外抑菌实验[J].世界华人消化杂志,2015,23(6):949-953.
[4] 许艺飞,江伟雯,邝兆进,等.胃疡宁丸体内外抗幽门螺杆菌的实验研究[J].中药新药与临床药理,2014,25(5):572-576.
[5] 甘英辉,严欢,程正,等.中药治疗幽门螺杆菌感染的研究进展[J].湖南中医杂志,2014,30(2):141-143.
[6] 王清晖,黄雅慧.中医药治疗消化性溃疡的方法选择[J].陕西中医,1998,19(3):118-119.
[7] 胡君茹,姜华,李喜香.三种非水溶性供试品溶剂对抑菌试验效果的影响[J].西部中药,2013,26(11):30-31.
[8] 冯青,刘伟,苏楠,等.纯阳正气胶囊抑制幽门螺杆菌作用研究[J].医药导报,2014,33(3):322-324.
[9] 蒋振明,徐国缨,张存钧,等.中药复方对幽门螺杆菌抑菌作用的体外实验[J].中国中西医结合消化杂志,2001,9(2):101-102.
StudyonAnti-HelicobacterpyloriEffectiveFractionsofModifiedXiaoChaihuDecoction
HU Lijuan1,LIUWei1,WUHuanhuan1,LILi2,ZHOUAijun3,LIUYanwen1*
(1.HubeiUniversityofChineseMedicine,Wuhan430065,China;2.WuhanHospitalofTraditionalChineseMedicine,Wuhan430050,China;3.DongguanHospitalofTraditionalChineseMedicine,Dongguan523000,China)
Objective:To investigate the anti-helicobacter pylori effect of the Modified Xiao Chaihu Decoction and their isolated componentsinvitro.Methods:The means of systematic solvent extraction was used to separate volatile oils,alkaloids,phenolic acids,saponins and polysaccharides from the decoction.The inhibition zones of the decoction and their isolated components were surveyed through agar diffusion method,and the minimal inhibitory concentrations(MICs)were also determined by using fluid dilution method.Results:The bacterial inhibition diameter and MIC of the decoction were(6.90±0.63)mm and 0.125 g·mL-1of the crude drug,the bacterial inhibition diameter and MIC of the volatile oils were(7.46±0.47)mm and 0.500 g·mL-1of the crude drug,the bacterial inhibition diameter and MIC of the alkaloids were(7.28±0.21)mm and 0.130 g·mL-1of the crude drug,the bacterial inhibition diameter and MIC of the phenolic acids were(7.46±0.10)mm and 0.506 g·mL-1of the crude drug,the bacterial inhibition diameter and MIC of the saponins were(7.29±0.10)mm and 0.246 g·mL-1of the crude drug,the bacterial inhibition diameters of the polysaccharides was zero.Conclusion:The volatile oils,alkaloids,phenolic acids and saponins of the Modified Xiao Chaihu Decoction are anti-helicobacter pylor active fractions.
Modified Xiao Chaihu Decoction;Helicobacter pylori;effective fractions;bacterial inhibition diameter;MIC
2015-06-03)
*
刘焱文,教授,博士生导师,研究方向:中药及其制剂的物质基础;Tel:(027)88920834,E-mail: ywliu2008@163.com
10.13313/j.issn.1673-4890.2016.3.011

