不同条件对蛇足石杉组培苗生长及石杉碱甲积累的影响
张小红,李晓君,杨雪飞,罗建平
(合肥工业大学 生物与食品工程学院,安徽 合肥 230009)
·中药农业·
不同条件对蛇足石杉组培苗生长及石杉碱甲积累的影响
张小红,李晓君,杨雪飞,罗建平*
(合肥工业大学 生物与食品工程学院,安徽 合肥 230009)
目的:考察不同条件对蛇足石杉组培苗生长和石杉碱甲积累的影响。方法:通过添加不同浓度的组合激素、无机氮源、前体物、诱导子,考察其对蛇足石杉干重增长率和石杉碱甲含量的影响。结果:不同条件对蛇足石杉组培苗生长和石杉碱甲积累的影响不同,适当的组合激素和无机氮源利于蛇足石杉组培苗的生长,前体物和适当的诱导子利于石杉碱甲的积累。其中0.50 mg·L-16-BA+0.05 mg·L-1IBA的激素组合对蛇足石杉组培苗的生长促进效果最显著,其干重增长率在培养12周时约是对照组的1.32倍,而0.5 mmol·L-1的赖氨酸对石杉碱甲积累的调控效果最好,与对照相比,在培养12周时,石杉碱甲含量提高了71.46%。结论:本研究初步实现了对蛇足石杉组培苗生长和石杉碱甲积累的调控,为通过千层塔的组织快繁缓解石杉碱甲的资源短缺提供了理论基础。
蛇足石杉;激素;无机氮源;前体物;诱导子;石杉碱甲
蛇足石杉Huperziaserrata(Thumb)Trev属石杉科、石杉属,又名千层塔,是我国传统名贵珍稀中草药[1],其有效成分石杉碱甲因其低毒、高效、选择性强等优点已被国际列为第二代乙酰胆碱酯酶抑制剂之一[2-4]。以石杉碱甲为主要成分的药物哈伯因与双益平在临床上已被用于治疗老年痴呆、重症肌无力、精神分裂等疾病[5-6]。随着老龄化社会的到来,市场对于石杉碱甲的需求量逐年倍增。因石杉碱甲全合成困难,其衍生物及类似物的活性均不如天然石杉碱甲且价格高昂,导致现阶段石杉碱甲的来源主要依赖野生蛇足石杉等极少种类的石杉科植物。而野生蛇足石杉生境特殊,生长缓慢,石杉碱甲含量低(仅为万分之一)[2]等限制性因素加剧了石杉碱甲的供需矛盾。本文试图通过添加外源激素、无机氮源、前体物、诱导子等方式,对蛇足石杉无菌组培苗进行培养,以期获得一种能够有效促进蛇足石杉生长、提高石杉碱甲含量的培养条件,为石杉碱甲的生产提供新途径。
1 材料
1.1 材料供试
材料蛇足石杉Huperziaserrata(Thumb)Trev组培苗由合肥工业大学生物与食品工程学院中草药与功能食品研究所提供,其诱导方法同前文[7]。蛇足石杉源植株由中国科学技术大学顾月华教授鉴定。
1.2 试剂
石杉碱甲标准品(≥98%,HPLC,成都瑞芬斯生物科技有限公司);石斛寡糖素(实验室制备);大量元素、微量元素、有机元素、激素及其它化学药品和试剂均为进口或国产分析纯以上。
1.3 仪器
超净工作台(苏州净化设备有限公司 SW-CJ-1FD);高效液相色谱仪(美国Agilent公司 1260);高压灭菌锅(日本三洋公司 MLS-3750);电子天平(梅特勒-托利有限公司)。
2 方法
2.1
培养基与培养条件实验使用的基本培养基为含2%蔗糖的1/4MS培养基(pH 5.8);培养基的灭菌条件是121 ℃、15 min;所有培养物均在25±2 ℃、12 h·d-1光照(50 μmol·m-2·s-1)下培养12周。
2.2
外源添加物实验分别考察外源激素、无机氮源、前体物和诱导子对蛇足石杉组培苗生长和石杉碱甲积累的影响。
外源激素包括:不同浓度的6-BA(0、0.5、1.0 mg·L-1)和NAA(0、0.05、0.10、0.20 mg·L-1)的组合;以及不同浓度的6-BA(0、0.10、0.25、0.50、1.00 mg·L-1)和IBA(0、0.05、0.10、0.20 mg·L-1)的组合。
无机氮源处理分别为不同总氮浓度(10、15、20 mmol·L-1)下不同比例的NH4+和NO3-组合(只有NO3-、1∶1、1∶2、1∶3、1∶4、1∶5、2∶1)。外源激素和氮源均在培养基配置时加入,并进行灭菌。
前体物处理时采用浓度分别为0、0.1、0.5和2.0 mmoL·L-1的赖氨酸(Lys),采用过滤灭菌加入已灭菌的培养基中。
诱导子处理包括非生物诱导子硝普钠(SNP)(0、10、50、200 μmol·L-1)和生物诱导子石斛寡糖素(0、2、10、40 mg·L-1)。诱导子的添加方式同Lys处理。
2.3 测定方法
蛇足石杉试管苗干重和石杉碱甲含量测定的取样量及取样方法均为每个处理接种5瓶,每瓶5株,重复实验3次。
蛇足石杉干重增长率的测定:分别称量蛇足石杉接种前的干重和培养后的干重,按如下公式计算干重增长率。
干重增长率(%)=(培养后干重-接种前干重)/ 接种前干重×100%
石杉碱甲含量采用HPLC测定方法,具体条件参照周小雷等方法[8]。色谱柱:PurospherRC18色谱柱(4.6×250 mm,i.d.,5 μm)(Merck);流动相:甲醇-水(85∶15);流速:0.3 mL·min-1;检测波长:308 nm,柱温:25 ℃;进样量20 μL。
2.4 数据处理
采用Microsoft Excel 2003、Origin 7.0 软件对数据进行处理和绘图,采用SPSS 17.0 统计分析软件对数据进行差异显著性检验(Duncan法,显著水平为P<0.05),不同字母表示两者之间具有显著性差异。
3 结果与分析
3.1 石杉碱甲HPLC谱图
与石杉碱甲标准品(图1A)相比较,蛇足石杉组培苗甲醇提取物(图1B)在HPLC图谱中出现和石杉碱甲标准品保留时间相同的峰,说明蛇足石杉组培苗具有合成石杉碱甲的能力。

图1 石杉碱甲标准品(A)和蛇足石杉组培苗甲醇提取物(B)HPLC色谱图
3.2 外源激素对蛇足石杉组培苗生长及石杉碱甲积累的影响
在实验浓度范围内,只有0.5 mg·L-16-BA+0.05 mg ·L-1NAA组合对蛇足石杉组培苗的生长产生了促进作用,约是对照组的1.16倍,其他组合均呈现不同程度的抑制作用(图2A);与对照相比,1.0 mg·L-16-BA+0.05 mg·L-1NAA组合可显著促进石杉碱甲的积累,其含量约是对照组的1.38倍,而其它组合均抑制蛇足石杉中石杉碱甲的积累(图2B)。

图2 不同浓度的6-BA与NAA组合对蛇足石杉干重增长率(A)及石杉碱甲含量(B)的影响
不同浓度的6-BA与IBA组合对蛇足石杉的生长和石杉碱甲含量呈现了不同的作用(图3)。与对照组相比,除1.00 mg·L-16-BA+0.05 mg·L-1IBA 外,0.10 mg·L-16-BA+0.05 mg·L-1IBA、0.25 mg·L-16-BA+0.10 mg·L-1IBA、0.50 mg·L-16-BA+0.05 mg·L-1IBA 3组激素组合均显著的促进蛇足石杉组培苗增长,其蛇足石杉干重增长率分别为对照组的1.14、1.30、1.32倍,而其余各组均对蛇足石杉的增长产生了抑制作用(图3A);与对照组相比,只有0.25 mg·L-16-BA+0.10 mg·L-1IBA、0.50 mg·L-16-BA+0.10 mg·L-1IBA、1.00 mg·L-16-BA+0.20 mg·L-1IBA 3组激素组合的石杉碱甲含量低于对照组,其余9组激素组合均显著高于对照组,且石杉碱甲含量分别提高到对照组的1.22、1.30、1.54、1.44、1.12、1.24、1.50、1.43、1.56倍(图3B)。
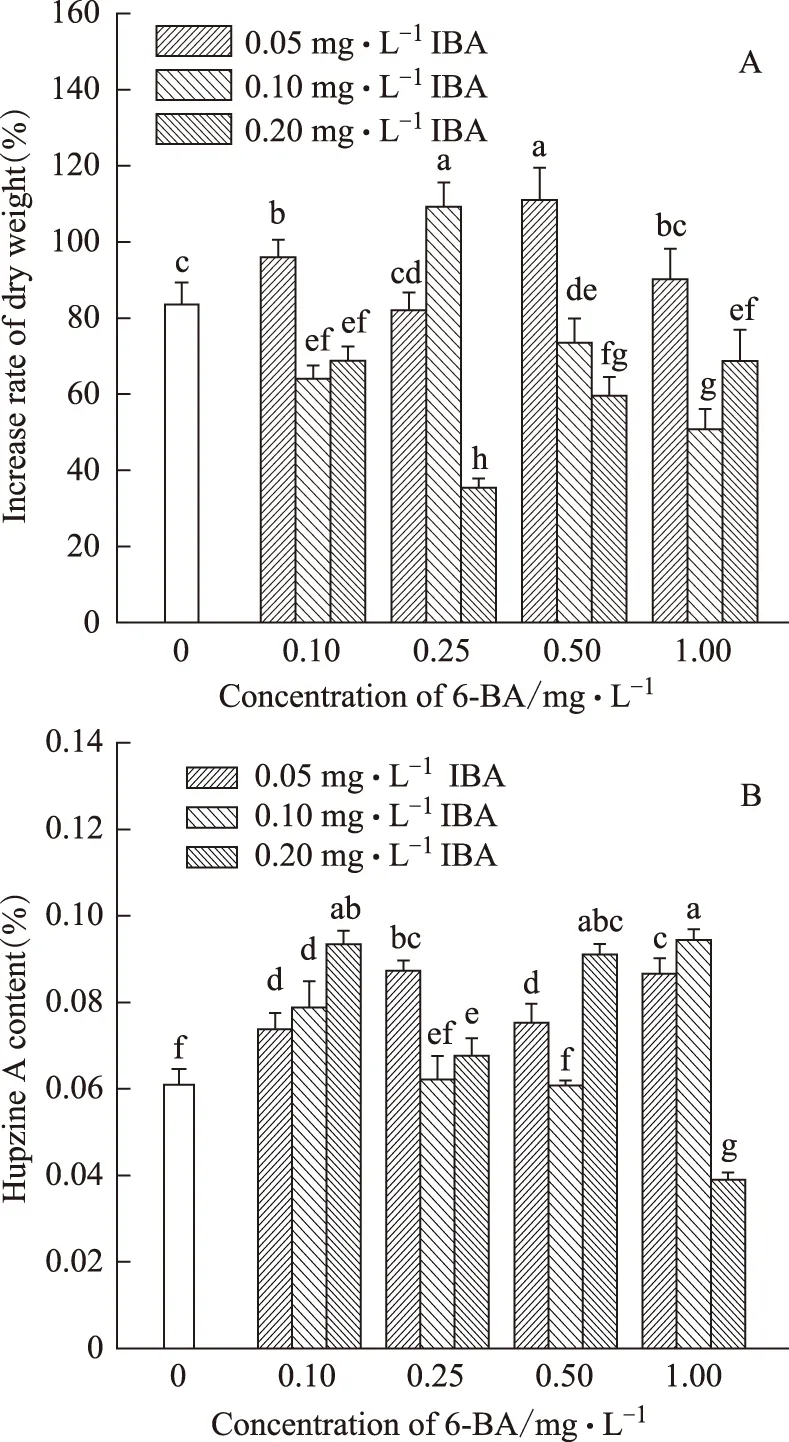
图3 不同浓度的6-BA与IBA组合对蛇足石杉干重增长率(A)及石杉碱甲含量(B)的影响
3.3 无机氮源对蛇足石杉组培苗生长及石杉碱甲积累的影响
在本实验浓度范围内,不同比例的氮源对蛇足石杉生长和石杉碱甲积累的作用表现不同(图4)。与对照(NH4+∶NO3-=1∶2)相比,10 mmol·L-1的总氮浓度抑制蛇足石杉生长或对其无影响,15 mmol·L-1的总氮浓度基本促进蛇足石杉生长,20 mmol·L-1的总氮浓度对蛇足石杉生长的影响结果差异化。(图4A);不同比例的NH4+∶NO3-对石杉碱甲的积累作用均呈现低浓度促进,高浓度抑制的“钟罩型”剂量依赖关系,其最适比例为1∶5,与对照相比,在时10、15、20 mmol·L-1的总氮浓度时,石杉碱甲含量分别为对照的1.61、1.47、1.56倍(图4B)。
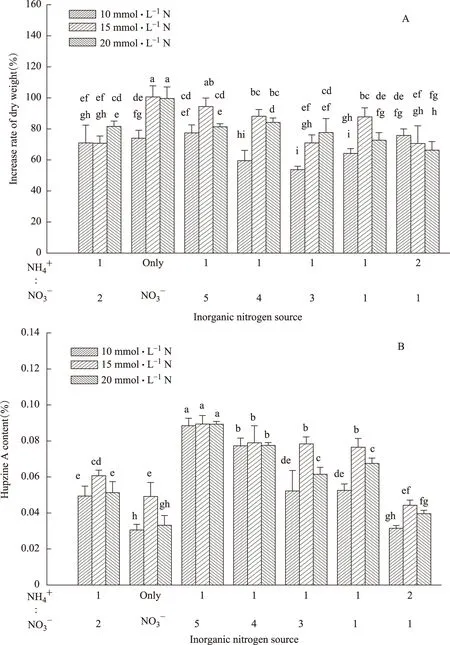
图4 无机氮源对蛇足石杉干重增长率(A)及石杉碱甲含量(B)的影响
3.4 前体物对蛇足石杉组培苗生长及石杉碱甲积累的影响
在本实验浓度范围内,赖氨酸(Lys)对蛇足石杉生长呈现低浓度促进,高浓度抑制的剂量关系,在最适浓度0.1 mmol·L-1时,蛇足石杉的干重增长率约是对照组的1.18倍。而在本实验浓度范围内,赖氨酸对石杉碱甲的积累产生了的促进作用,在最适浓度0.5 mmol·L-1时其石杉碱甲含量约是对照组的1.7倍(图5)。
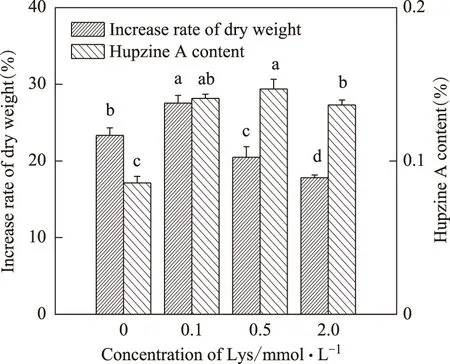
图5 赖氨酸对蛇足石杉干重增长率及石杉碱甲含量的影响
3.5 诱导子对蛇足石杉组培苗生长及石杉碱甲积累的影响
在本实验浓度范围内,一氧化氮对蛇足石杉的生长和石杉碱甲的积累均呈现低浓度促进,高浓度抑制的剂量关系。在最适浓度10 μmol·L-1时,蛇足石杉干重的增长率和石杉碱甲含量对分别为照组的1.21、1.40倍(图6)。

图6 一氧化氮对蛇足石杉干重增长率及石杉碱甲含量的影响
在实验浓度范围内,寡糖素有利于促进蛇足石杉生长和石杉碱甲积累,且随着寡糖素浓度的提高,促进效果越明显。当寡糖素的浓度为40 mg·L-1时,蛇足石杉的干重增长率和石杉碱甲含量分别是对照组的1.3倍和1.5倍(图7)。
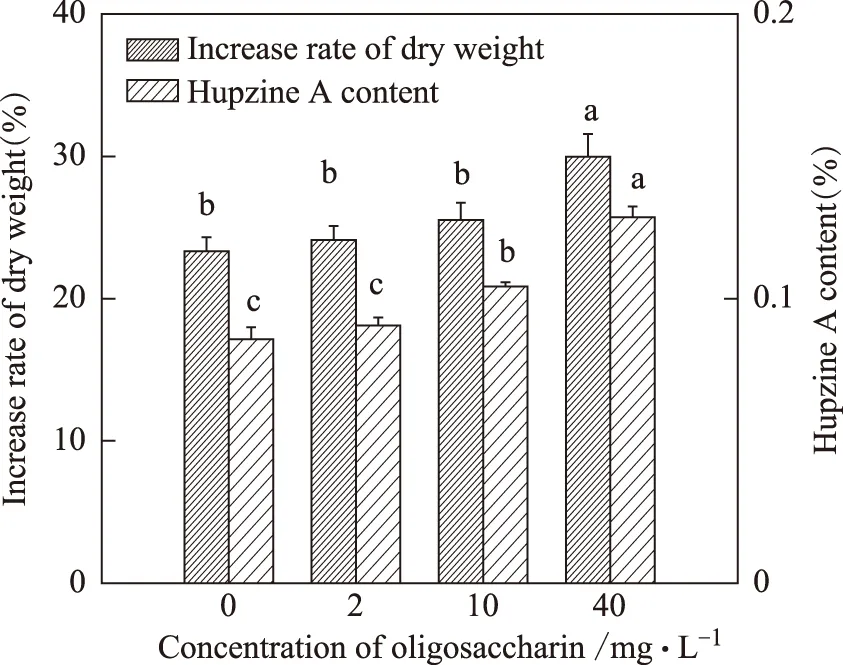
图7 寡糖素对蛇足石杉干重增长率(A)及石杉碱甲含量(B)的影响
4 讨论
植物内源激素是植物体内天然存在的有机化合物,其含量低但却对植物的生长发育起重要的调节作用,而外源激素是相对于内源激素而言的,其通过内源激素调节植物的生命活动[9]。本文通过添加外源激素6-BA与NAA和IBA进行组合,研究其对蛇足石杉组培苗生长和石杉碱甲积累的影响,发现6-BA与IBA组合较6-BA与NAA组合适合蛇足石杉组培苗的生长,而0.50 mg·L-16-BA+0.05 mg·L-1IBA为最适浓度。Waegel等研究发现激素NAA与6-BA组合对亮叶石杉Huperzialucidulum组培苗的生长具有促进作用但促进效果与对照组相比并不显著[10]。
在植物的组织培养过程中,氮作为无机营养成分必不可少,且通常以硝态氮和铵态氮相互配合的形式存在。在多种植物的培养过程中发现,无机氮源的总量和NH4+/NO3-的比例均会对植物的生长产生不同程度的影响[11-12]。本研究发现15 mmol·L-1的无机氮源利于蛇足石杉的生长,NH4+:NO3-为1∶5利于石杉碱甲的积累,可能是硝态氮在硝酸还原酶和亚硝酸还原酶的作用下还原成NH4+和pH影响植物对硝态氮和铵态氮的吸收等原因导致了蛇足石杉对硝态氮的偏向性[13]。
在植物组织培养中添加前体物质是一种常用的通过增加底物供应或者作为催化代谢途径中某关键酶来提高生物产量和目的次生代谢产物的方法[16]。本研究发现L-赖氨酸在实验浓度范围内对蛇足石杉中石杉碱甲的积累具有促进作用,其中0.5 mmol·L-1的赖氨酸为最适浓度,其石杉碱甲含量在培养12周时较对照组提高了71.46%,这也验证了蛇足石杉可通过L-赖氨酸脱羧酶催化L-赖氨酸脱羧形成1,5-戊二胺进入石杉碱甲代谢途径[14-15]。
诱导子从细胞培养的角度看,是指能够促进细胞产生目的代谢产物的因子,而从植物病理学角度看是植物抗病过程产生诱发植物产生抗毒素和引起植物过敏反应的因子,根据其来源不同可分为非生物诱导子与生物诱导子[16]。一氧化氮是一种水溶性兼脂溶性可扩散的小分子物质,其影响着植物的呼吸,种子萌发,根叶生长等一系列生物生长发育过程,其作为有效的非生物诱导子被广泛的应用到植物次生代谢产物的研究中[17]。本研究以硝普钠(SNP)作为一氧化氮(NO)的供体,考察其对蛇足石杉生物量和石杉碱甲调控的影响,结果表明,10 μmol·L-1的SNP有利于蛇足石杉生物量的积累,并促进了石杉碱甲含量的提高,其可能是触发蛇足石杉的防卫反应、调节了氮、碳代谢或者是激发了石杉碱甲次生代谢相关酶活性[18]。寡糖素是一种具有生物活性的寡糖,作为一种新型的生物诱导子被广泛用来调控植物的生长发育和次生代谢产物积累。本研究发现在实验浓度范围内石斛寡糖素对蛇足石杉生物量和石杉碱甲的积累均有不同程度的促进作用,其中40 mg·L-1的浓度效果最显著,这与诸多研究结果相符。甘烦远等人的研究表明人参寡糖素可显著提高云南红豆杉细胞的增长率和代谢物次生紫杉醇的含量,也能提高红花细胞的生长率及次生代谢物α-生育酚的含量[19-20]。一般认为寡糖素通过与细胞上的受体结合,从而导致细胞的生理变化,而对于其诱导次生代谢产物的形成的机理尚不清楚,有待进一步研究。
[1] 梁昊,潘利华,罗建平.石杉碱甲资源可持续利用研究进展[J].安徽农业科学,2010,38(23):12467-12468.
[2] Ma X Q,Gang D R.In vitro production of huperzine A,a promising drug candidate for Alzheimer's disease[J].Phytochemistry,2008,69(10):2022-2028.
[3] Wang B,Wang H,Zhao H W,et al.Efficacy and safety of natural acetylcholinesterase inhibitor huperzine A in the treatment of Alzheimer’s disease:an updated meta-analysis[J].J Neural Transm,2009,116(4):457-465.
[4] Ha G T,Wong R K,Zhang Y.Huperzine a as potential treatment of Alzheimer’s disease:an assessment on chemistry,pharmacology,and clinical studies[J].Chem Biodivers,2011,8(7):1189-1204
[5] 雷万学.哈伯因片剂的稳定性试验[J].临床医学,2002,22(5):57-58.
[6] 江红霞,李亚玲,叶建飞,等.双益平对精神分裂症患者认知功能影响的对照研究[J].山东精神医学杂志,2006,19(4):269-270.
[7] 杨雪飞,罗建平,王瑛.蛇足石杉茎尖灭菌方法与组织培养的研究[J].安徽农业科学,2008,36(12):4947-4949.
[8] 周小雷,袁经权,王硕,等.HPLC 法测定不同季节千层塔中石杉碱甲和石杉碱乙含量[J].中华中医药杂志,2013,28(2):504-506.
[9] 李代丽,康向阳.植物愈伤组织培养中内外源激素效应的研究现状与展望[J].生物技术通讯,2007,18(3):546-548.
[10] Dwyer T,Waegel A S.Effect of growth regulators onHuperzialucidulumexplants in vitro.Acta Hort,2004,631,181-185.
[11] Yan Q Y,Duan Z Q,Li J H,et al.Cucumber growth and nitrogen uptake as affected by solution temperature and NO3-:NH4+ratios during the seedling[J].Kor J Hort Sci Techno,2013,31(4):393-399.
[12] Zhang F C,Kang S Z,Li F S,et al.Growth and major mutrient concentrations in brassica campestris supplied with differentNH4+/NO3-ratios[J].J Integr Plant Biol,2007,49(4):455-462.
[13] 张树清,魏小平.蔬菜作物对硝铵态氮吸收能力比较研究[J].兰州大学学报(自然科学版),2002,38(4):77-84.
[14] Luo H M,Li Y,Sun C,et al.Comparison of 454-ESTs fromHuperziaserrataandPhlegmariuruscarinatus reveals putative genes involved in lycopodium alkaloid biosynthesis and developmental regulation.[J].BMC plant biology,2010,10(1):209.
[15] Ma X Q,Gang D R.The Lycopodium alkaloids[J].Nat Prod Rep,2004,21(6):752-772.
[16] 谷荣辉,洪利亚,龙春林.植物细胞培养生产次生代谢物的途径[J].植物生理学通讯,2013,(9):869-881.
[17] 张秀玮,董元杰,邱现奎,等.外源NO对不同作物种子萌发、幼苗生长及抗氧化酶活性的影响[J].植物营养与肥料学报,2012,18(2):397-404.
[18] 郑春芳,姜东,戴廷波,等.外源一氧化氮供体硝普钠浸种对盐胁迫下小麦幼苗碳氮代谢及抗氧化系统的影响[J].生态学报,2010,30(5):1174-1183.
[19] 甘烦远,彭丽萍,郑光植.云南红豆杉细胞培养中紫杉醇的代谢调控[J].云南植物研究,1996,18(4):451-453.
[20] 甘烦远,郑光植,王世林等.诱导子人参寡糖对红花培养细胞的生理效应[J].Acta Botancia Sinica,1992,34(3):208-213.
EffectsofDifferentConditionsontheGrowthofMicropropagatedHuperziaserrataPlantletsandtheAccumulationofHuperzineA
ZHANGXiaohong,LIXiaojun,YANGXuefei,LUOJianping*
(SchoolofBiotechnologyandFoodEngineering,HefeiUniversityofTechnology,Hefei230009,China)
Objective:The present study aims at investigating the effects of different conditions on the growth of micropropagatedHuperziaserrataplantlets and the accumulation of huperzine A.Methods:The basal mediums were supplemented with different concentrations of hormones,inorganic nitrogen sources,precursor Lys and elicitors.The increase in dry weight of micropropagatedH.serrataplantlets and the content of huperzine A were determined.Results:The micropropagated plantlets had different responses to the different factors not only in growth rate but also in huperzine A accumulation.Among these factors,the combination of 0.50 mg·L-16-BA+0.05 mg·L-1IBA was the optimum condition for the growth of micropropagatedH.serrataplantlets,which was 1.32-fold of the control after 12 weeks.For the accumulation of huperzine A,Lys at 0.5 mmol·L-1was the most effective factor.Under this condition,huperzine A content in micropropagated plantlets was 0.72-fold higher than that of the control at 12 weeks.Conclusion:This study realized the regulation of the growth and huperzine A accumulation of micropropagatedH.serrataplantlets,which would provide a theoretical basis for exploitation ofH.serratausing plant microprogation technique.
Huperziaserrata;hormone;inorganic nitrogen sources;precursor;elicitor;huperzine A
10.13313/j.issn.1673-4890.2016.4.018
2015-06-03)
*
罗建平,教授,研究方向:中草药与功能食品;E-mail:jianpingluo@hfut.edu.cn

