茶叶联苯菊酯原位降解菌株的微生物学特性研究
贺望兴 胡桂萍 石旭平 曹挥华 朱运华 张国彪 欧阳雪灵 游艳红 胡瑶根
(江西省蚕桑茶叶研究所 330202)
茶叶联苯菊酯原位降解菌株的微生物学特性研究
贺望兴胡桂萍*石旭平曹挥华朱运华张国彪欧阳雪灵游艳红胡瑶根
(江西省蚕桑茶叶研究所330202)
对前期富集驯化筛选得到的茶园联苯菊酯降解微生物LB-1进行最佳培养基、生长条件以及对环境的适应性等微生物学特性分析。结果表明:菌株LB-1在牛肉膏蛋白胨加糖培养基、发酵温度30℃、pH值为7、装液量30mL的培养条件下生长最快。菌株LB-1在发酵培养基中呈S型生长,在高于2 %的氯化钠浓度下大量死亡,表明LB-1对高盐环境不具备良好的适应性。
茶;联苯菊酯降解菌;Klebsiella sp.;微生物特性
茶叶是我国一种重要的经济作物,2012年我国茶叶产量居世界第一,出口量居世界第二。随着生活水平的提高,人们对茶叶食品安全问题越来越重视[1]。调查显示农药残留量超标已成为当前我国茶叶出口和内销最严重的质量安全问题之一。联苯菊酯是一种人工合成的菊酯类超高效杀虫、杀螨剂,在我国是代替有机氯和其他剧毒性杀虫剂的主要农药类型之一,其使用量仅次于有机磷,占世界杀虫剂市场的 20%,占我国杀虫剂施用面积的 1/3 以上[2~3]。但由于联苯菊酯具有化学性质稳定,农作物利用率低,在环境中不易分解等特点,导致土壤环境和作物上联苯菊酯残留严重,严重危害到人类的健康和生态环境安全[4]。最新研究表明,联苯菊酯还有蓄毒性,人和动物长期接触会引起一些慢性疾病[5~6],且具有致癌、致畸、致突变的危险[7~8];
自然环境中残留的农药主要是通过生物和非生物2种途径来实现农药的降解和转化[9],而传统的物理、化学农药降解方法,往往对仪器和试剂的要求高,成本高,且降解过程中易产生有毒物质,造成二次污染。微生物降解农残因具有安全、绿色、高效和无二次污染等优点,被认为是处理农药残留的一种新型有效的方法[10]。目前国内外研究学者已筛选到大量菊酯类农药降解菌株,这些菌株归属于二十多个种属[11]。研究发现微生物对农药的降解方式主要有酶促和非酶促两种,且以酶促方式为主要形式。国外已有报道环境中的联苯菊酯可以被微生物通过微生物自身酶系统以及分泌的代谢物作用而被分解[12~13],国内学者发现联苯菊酯是被降解微生物作为有机碳源而降解,且联苯菊酯浓度越高,微生物生长越好[14]。究其原因是微生物通过酶对农药分子的特殊毒性基团进行代谢,使其失去毒性,并在代谢过程中将农药分子当作自身需要的碳源物质,从中获得生长所需的能量[15]。因此土壤微生物在联苯菊酯的降解过程中发挥着重要作用[16~18]。
针对近年来我国茶产业中菊酯类农药超标事件频发,茶叶质量安全现状堪忧的问题,笔者开展了茶叶联苯菊酯的农药残留降解研究。实验前期通过富集驯化筛选得到一株适合茶园联苯菊酯降解的微生物LB-1,克雷伯氏菌Klebsiella sp.,本实验主要对其进行生物学分析及菌剂开发技术前期工艺研制,以期为进一步提高茶叶绿色清洁化生产技术水平,实现茶叶菊酯类农药残留零超标提供理论和技术参考。
1 材料与方法
1.1培养基
牛肉膏蛋白胨培养基(g/L)(NA):牛肉膏3,蛋白胨10,NaCl 5,琼脂15~20,pH 7.4~7.6。
牛肉膏蛋白胨加糖培养基(g/L)(NA+S):牛肉膏3,蛋白胨10,葡萄糖 5,琼脂15~20,pH 7.4~7.6。
富集培养基(g/L)(EM):蛋白胨5,酵母提取物5,磷酸氢二钾1,葡萄糖1,pH 7.0~7.2。
基础无机盐培养基(g/L)(MSM):磷酸氢二钠1.5,磷酸二氢钾1.5,硝酸四氢氮1,硫酸镁0.2,氯化钙0.01,硫酸镁0.001,酵母提取物0.05,pH 7.0~7.2。
PDA培养基(g/L)(PDA):马铃薯 200,葡萄糖 20,琼脂 20,pH自然。
1.2实验方法
1.2.1液体发酵最适培养基优化
将已活化好的菌株LB-1分别以体积分数1%的接种量转接到装液量100mL的牛肉膏培养基、牛肉膏加糖培养基、富集培养基、基础无机盐培养基、PDA培养基中,在30℃、150r/min条件下振荡培养。在其他条件保持不变的情况下培养1d,进行单因素试验。各单因素设计以不接种为对照,每个处理设3个重复,测定不同发酵培养基条件下菌株LB-1在ODnm600波长下的光密度值,确定菌株LB-1最佳液体发酵培养基。
1.2.2生长条件优化
将已活化好的菌株LB-1以体积分数1%的接种量转接到发酵培养基中,在30℃、150r/min条件下振荡培养。最佳液体发酵工艺条件试验:分别通过改变发酵基本条件中温度(15℃,25℃,30℃,35℃,45℃)、pH(2.0,4.0,6.0,7.0,8.0)、装液量(20mL,30mL,50mL,80mL,100mL),在其他条件保持不变的情况下培养1d,进行单因素试验。各单因素设计以不接种为对照,每个处理设3个重复,测定不同发酵参数条件下菌株LB-1在ODnm600波长下的光密度值,确定菌株LB-1最佳生长条件。
1.2.3菌株LB-1生长曲线分析
用接种环取一环经过平板活化的菌株LB-1至发酵液体培养基中,在30℃、150r/min的条件下每隔2h取一次菌液,菌液在ODnm600波长下测定其光密度值,绘制菌株LB-1的生长曲线。
1.2.4菌株 LB-1对不同环境的适应性
将已活化好的菌株LB-1分别以体积分数1%的接种量转接到含不同NaCl浓度(1%,2%,4%,6%,8%)的发酵培养基中,在30℃、150r/min条件下振荡培养。在其他条件保持不变的情况下培养1d,进行单因素试验。各单因素设计以不接种为对照,每个处理设3个重复,测定不同NaCl浓度的发酵培养基条件下菌株LB-1在ODnm600波长下的光密度值,确定菌株LB-1对不同环境的适应性。
2 结果与分析
2.1液体发酵最适培养基优化
菌株LB-1液体发酵培养基优化结果如图1所示,菌株LB-1在NA+S培养基中生长最快,OD值为0.545;其次为NM培养基,OD值为0.507;然后是NA培养基,OD值为0.408;接着是PDA培养基,OD值为0.337;而在MSM培养基中生长最慢。这表明菌株LB-1偏好有机碳源和氮源,对无机碳氮利用性差。这可能与有机碳、氮源可以给微生物提供碳、氮源的同时还可以提供丰富的生长因子有关。
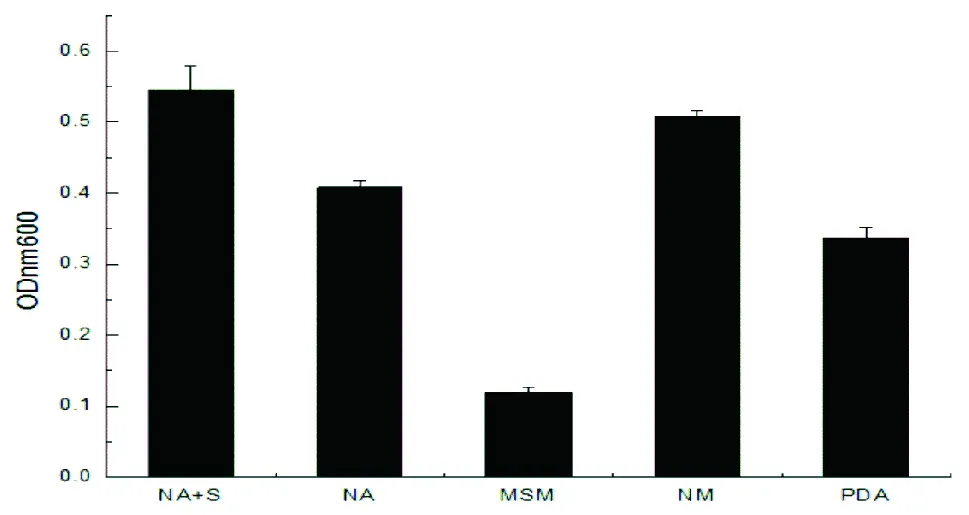
图1 液体发酵最适培养基优化
2.2生长条件优化
2.2.1发酵装液量优化
菌株LB-1发酵装液量优化结果如图2所示,在装液量达到30mL时,菌株LB-1生长最快,OD值为0.583;随着装液量的增加菌株LB-1的生长反而受到抑制,结果表明过多的装液量会影响菌株LB-1的生长量,这可能是因为装液量太多发酵液中溶氧量不足,菌生长过程中得不到充足的氧气。综合考虑可以确定菌株LB-1发酵最适装液量为30mL。
2.2.2发酵液pH优化
pH值与生物的生命活动以及新陈代谢密切相关,过高或过低的pH值都不利于微生物的代谢及生长速率,甚至可导致微生物死亡。菌株LB-1发酵液pH优化结果如图 3所示,LB-1在偏碱性条件下生长较好,其最适生长pH为7,OD值为0.445。当pH值低于6时其生长明显受到抑制,菌株 LB-1对碱性条件适应性强的特点使之可适用于碱性土壤的修复,具有较大的应用范围。
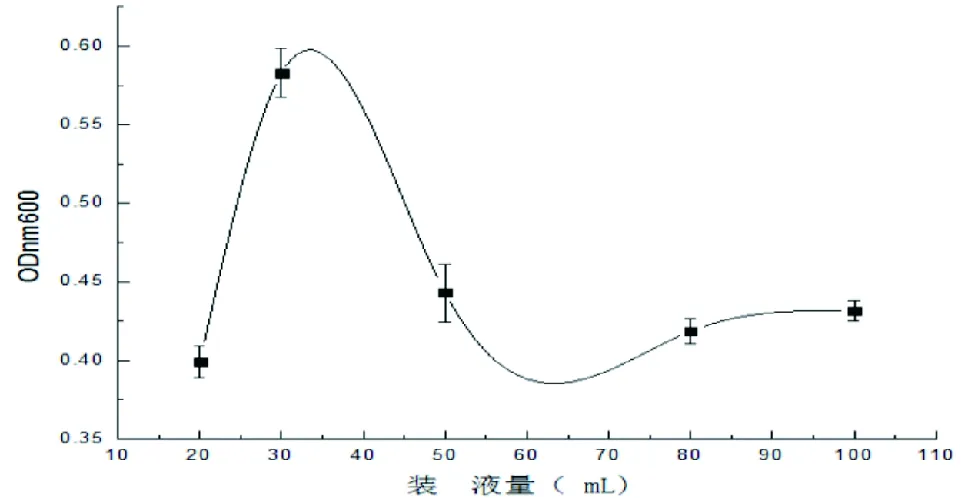
图2 装液量优化
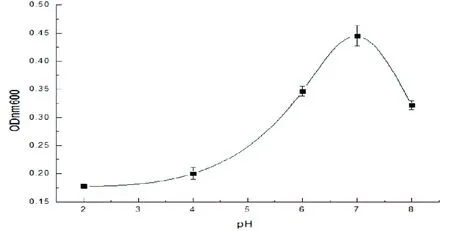
图3 发酵液pH优化
2.2.3发酵温度优化
温度主要通过影响菌生长、产物形成和合成方向等方面来影响发酵过程。发酵温度是发酵生产中重要的影响因素,所以必须采用最适宜的温度来进行发酵。菌株LB-1发酵液温度优化结果如图4所示:LB-1在低温和高温环境中生长都不好,尤其在低温环境下菌株LB-1生长几乎停滞,随着温度的提高菌株LB-1生长开始复苏,在 30 ℃的发酵温度下LB-1生长最快,OD值为0.345,但发酵温度再提高菌株LB-1开始衰亡,实验结果可以确定其最适发酵温度是30 ℃。
2.3菌株LB-1生长曲线分析
菌株LB-1生长曲线分析结果如图5所示,菌株LB-1在发酵培养初期(0~2h)细菌由于主要在适应培养环境以及为对数生长期的快速繁殖合成必要的前体物质而生长缓慢,在2~16 h培养时间内菌株处于对数生长期,该期间菌株LB-1快速繁殖,菌浓度越来越高;培养16 h之后菌株进入稳定生长期,菌株生长量与死亡量相平衡,菌浓度变化不大;在培养20 h后由于培养液营养物质消耗殆尽以及有害次生代谢产物的积累导致菌株生长量低于死亡量,细菌进入衰亡期。
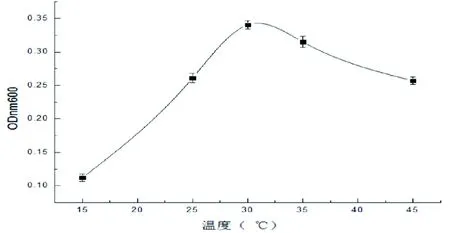
图4 发酵温度优化
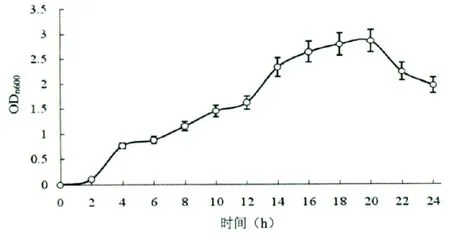
图5 菌株LB-1生长曲线
2.4菌株LB-1对不同环境的适应性
菌株LB-1对不同环境的适应性结果如图6所示,菌株LB-1在2 %的NaCl浓度下表现出最好的适应性,OD值为0.418。随着NaCl浓度的上升,LB-1的适应性越来越差,尤其当NaCl浓度高于6 %时,菌株LB-1的生长量最低,最低时OD值为0.07。研究结果显示,菌株LB-1对高盐环境不具备良好的适应性,这可能是因为高盐环境下菌株LB-1高度失水,导致了LB-1的死亡。
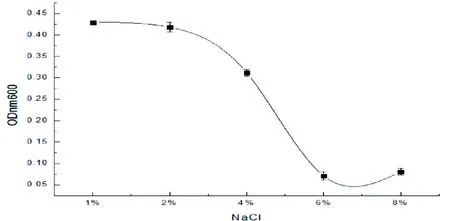
图6 菌株 LB-1对不同环境的适应性
3 结论与讨论
实验研究了降解联苯菊酯菌株LB-1的最适生长培养基、生长条件、生长曲线以及对不同环境的适应性,以期为今后的大规模发酵生产应用提供理论参数。研究发现,菌株LB-1以牛肉膏蛋白胨加糖培养基,在发酵温度30℃、pH值为7、装液量30 mL的培养条件下生长最快;菌株LB-1在发酵培养基中呈S型生长,在发酵2~16h内处于对数生长期,之后进入稳定生长期,在培养20h后菌株进入衰亡期;菌株LB-1在高于2 %的氯化钠浓度下大量死亡,表明LB-1对高盐环境不具备良好的适应性。
最适发酵培养基优化结果与李清云等[20]报道的菊酯降解菌GF31最适碳源为葡萄糖、最适有机氮源为牛肉膏、且在有机氮源的生长情况普遍比无机氮源好的结果相一致。生长条件优化实验结果与高亚楠等[19]、李清云等[20]报道的高效菊酯降解菌的最适发酵温度27℃、pH值为7、装液量40mL基本相符。这表明菊酯类降解菌具有某种对环境条件的相似性。针对实验室环境条件与室外将降解菌喷洒在茶叶上降解农残有很大区别,降解菌LB-1如何在室外茶园中发挥相同功效,将是接下来深入研究的方向。
[1]戴平望.超高效液相色谱-串联质谱法测定茶叶中5种农药残留量[J].理化检测,2014 (4):508~511.
[2]胡志强,许良忠,任雪景,等.拟除虫菊酯类杀虫剂的研究进展[J].青岛化工学院学报,2002,23(1):48~51.
[3]薛振祥.我国拟除虫菊酯30年的回眸和展望[C].中国拟除虫菊酯发展30年学术研讨会论文集.北京:化学工业出版社,2003:1~15.
[4]Laskowski DA.Physical and chemical properties of pyrethroids[J] .Reviews of Environmental Contamination and Toxicoligy . New YorkSpringer,2002,(174):49~170.
[5]A1-Makkawy HK,Magdy DM.Persistence and accumulation of some organic insecticides in Nile water and fish[J].Resources Conservation and Recycling,1999,27(1):105~115.
[6]Kolaczinski JH, Curtis CF. Chronic illness as a result of low-level exposure to synthetic pyrethroid insecticides: A review of the debate[J]. Food and Chemical Toxicology,2004,42 (5):697~706.
[7]Nishi K, Huang HZ, Kamita SG, et al. Characterization of pyrethroid hydrolysis by the human liver carboxylesterases hCE-1 and hCE-2[J]. Archives of Biochemistryand Biophysics,2006,445(1): 115~123.
[8]薛南冬,王洪波,徐晓自.水环境中农药类内分泌干扰物的研究进展[J].科学通报,2005,50(22):2441~2449.
[9]乔雄梧.农药在土壤中的环境行为[J].农药科学与管理,1999(A05):12~16.
[10]王兆守,李顺鹏.拟除虫菊酯类农药微生物降解研究进展[J].土壤,2005,37(6):577~580.
[11]王保战.菊酯类农药的微生物降解研究[A].第十二届全国环境微生物学术研讨会, 武汉,2009.
[12]Singh BK.Organophosphorus-degrading bacteria: ecology and industrial applications[J].Nature Reviews Microbiology,2009(7):156~163.
[13]Lee S, Gan JY, Kabashima JN, et al. Microbial transformation of pyrethroid insecticides in aqueous and sediment phases[J].Environmental Toxicology and Chemistry,2004(23):1~6.
[14]罗天雄.联苯菊酯降解微生物生长环境的优化作用研究[J].安徽农学通报, 2009,15(21):35,153.
[15]汪华.高效氯氰菊酯降解菌的分离鉴定及特性研究[D].浙江:浙江工业大学,2009:1~59.
[16]Zhang WJ, Rui WY , Tu C, et a1. Responses of soil microbial community structure and diversity to agricultural deintensification [J].Pedosphere, 2005,15(4):440~447.
[17]Sogorb MA, Vilanova E.Enzymes involved in the detoxification of organophosphoms, carbamate and pyrethroid insecticides through hydrolysis [J]. Toxicology letters,2002,128(1): 215~228.
[18]Yu YL,Chen YX,Luo YM,et al. Rapid degradation of butachlor in wheat rbizosphere soil[J].Chemosphere, 2003(50):771~774.
[19]高亚楠,朱杰,李芳,等. 高效氯氰菊酯降解菌群的结构分析及其降解特性研究[J].环境污染与防治,2015,37(6).69~73.
[20]李青云,徐小芳, 刘幽燕, 等. 氯氰菊酯高效降解菌GF31的生长特性及其对污染土壤的修复能力[J].环境工程学报, 2011,5(6):1425~1430.
公益性项目(No.201303094);江西省科技支撑计划(20151BBA13042);公益性行业(农业)科研专项(201303094-08)。

