Cu2O/TNTs电极的制备及其光电催化还原CO2合成甲醇研究
曹华珍,宁伟,姜志鹏,郑国渠*
(浙江工业大学材料科学与工程学院,浙江 杭州 310014)
【研究报告】
Cu2O/TNTs电极的制备及其光电催化还原CO2合成甲醇研究
曹华珍,宁伟,姜志鹏,郑国渠*
(浙江工业大学材料科学与工程学院,浙江 杭州 310014)
以钛阳极氧化制备的TiO2纳米管(TNTs)阵列为载体,采用脉冲电沉积法将Cu2O沉积到TNTs的管壁上,制备了Cu2O/TNTs电极。采用扫描电镜(SEM)、透射电镜(TEM)以及X射线光电子能谱(XPS)对电极的形貌以及沉积物价态进行了表征。通过循环伏安、光电流-时间曲线测试,研究了沉积电位以及沉积电量对电极光电催化性能的影响。结果表明:脉冲电沉积的沉积物为Cu2O纳米颗粒。制备的Cu2O/TNTs电极光电活性及稳定性明显优于Cu2O/Ti电极。电位-0.5 V(相对于饱和甘汞电极)下脉冲沉积60 mC制备的电极对CO2还原具有较高的光电催化活性。在装有100 mL 0.1 mol/L NaHCO3溶液的自制密闭反应器中利用Cu2O/TNTs电极光电催化还原CO2,合成的产物主要为甲醇,还原5 h后甲醇含量达到6.05 mg/L。
二氧化钛;阳极氧化;纳米管阵列;氧化亚铜;脉冲电沉积;二氧化碳;还原;光电催化
First-author's address: College of Materials Science and Engineering, Zhejiang University of Technology, Hangzhou 310014, China
随着工业经济的发展、人口的剧增,全球能源日益紧张,利用太阳能光电催化还原CO2转化为能量更高的甲醇或者甲烷等有机物,不仅可以缓解大气中不断增加的 CO2所造成的温室效应,而且为日益枯竭的碳能源寻找了新的合成途径。因而,CO2还原制备醇类等物质的研究成为相关领域的研究热点[1-3]。
催化剂的活性、稳定性以及产物选择性是评价催化剂性能的关键。Cu2O作为一种典型的p型半导体,其禁带宽度约为2.1 eV[4],可以吸收波长小于590 nm的太阳光。另外,其导带电势达到-1.1 eV(相对于标准氢电极SHE),比CO2/CH3OH还原电位-0.38 V更负,具备强的还原能力。然而,Cu2O在水溶液中较差的稳定性在很大程度上制约了其应用,这主要是由于Cu2O自身还原电位要比水的还原电位更正[5-6],因此Cu2O常与其他半导体复合以拓宽其应用范围。Ghadimkhani等人[7]通过氧化-电沉积工艺在铜基体上制备了CuO/Cu2O纳米棒阵列,用于光电催化还原CO2制备甲醇,在模拟太阳光(AM1.5,70 mW/cm2)以及-0.2 V(相对于SHE)的电位下表现出高的催化性能,法拉第效率接近95%。Huang等人[8]制备了Cu2O/CuO/TiO2纳米线电极,其中TiO2通过浸渍法沉积于电极表面,TiO2薄膜层的存在大大提升了电极的光电活性及稳定性。
TiO2纳米管(TNTs)具有独特的纳米阵列结构以及优异的性能,常常被用作催化剂的载体,在光解水制氢[9-10]、光降解[11-12]、传感器[13-14]、染料敏化电池[15-16]等众多领域都有着广泛的应用。将Cu2O负载到TNTs上制备复合电极,一方面TNTs的纳米结构使其具有高的比表面积,另一方面Cu2O和TNTs组合构成的P-N结结构有利于光生电对的分离,使得电极可能表现出更优异的光电催化性能。因此,本文以阳极氧化制备的 TNTs为基体,采用脉冲电沉积技术将Cu2O纳米颗粒负载到TNTs的管壁上,制备Cu2O/TNTs复合电极,系统研究了沉积电位以及沉积电量对电极催化活性的影响,并用于光电催化还原CO2合成甲醇。
1 实验
1.1 电极制备
1.1.1TNTs电极的制备
工业纯钛板经机械抛光、除油以及化学抛光处理[17]后,以环氧树脂胶密封,裸露面积为1 cm × 1 cm。钛的阳极氧化在20 °C的1%(质量分数)HF水溶液中进行,以石墨电极为阴极,采用JWY3010型直流稳压电源控制氧化电压20 V,氧化时间20 min。阳极氧化制备的TNTs在450 °C的空气气氛中热处理2 h。
1.1.2Cu2O/TNTs电极的制备
采用脉冲电沉积将Cu2O负载到TNTs上,沉积过程在三电极电解槽中进行,以热处理TNTs为工作电极,Pt为对电极,饱和甘汞电极(SCE)为参比电极。沉积液组成为0.3 mol/L CuSO4、240 mL/L乳酸和4 mol/L NaOH,沉积温度为50 °C。电沉积在CHI660C型电化学工作站上进行,采用控电位脉冲沉积模式,脉冲周期为0.2 s,导通时间0.1 s,关断时间0.1 s。实验制备了不同沉积电位(-0.3、-0.4、-0.5和-0.6 V)、不同沉积电量(30、60、90和120 mC)的试样。作为对比,以钛板为工作电极,采用相同的脉冲模式沉积Cu2O,制备了Cu2O/Ti电极。
1.2表征与测试
1.2.1物理表征
利用Kratos AXIS Ultra DLD型 X射线光电子能谱(XPS)分析沉积物的价态;采用Zeiss Supra55型扫描电子显微镜(SEM)观察电极的表面及截面形貌;通过Tecnai G2 F30 S-Twin型高分辨透射电子显微镜(HRTEM)观察电极的微观结构,并根据电子衍射图样、晶面间距分析沉积物的物相。
1.2.2循环伏安曲线测试
循环伏安曲线测试在CHI660电化学工作站上进行,采用与1.1.2相同的三电极体系,以制备的Cu2O/TNTs电极为工作电极。测试介质为0.1 mol/L NaHCO3溶液,测试温度为室温,测试电位范围为-0.8 ~ 0.4 V,扫描速率为10 mV/s。
1.2.3光电性能测试
在自制的密闭反应器中测定光电流-时间曲线以研究电极的光电催化性能。电解液为 100 mL的 0.1 mol/L NaHCO3溶液,测试前往容器内通入CO2或者N2气体20 min,控制内部气压1.5 kPa。测试偏压-0.3 V(相对于SCE),采用CEL-TCX250型氙灯模拟可见光(用滤光片滤去420 nm以下的光,光强200 mW/cm2),通过金属挡光板实现光照与无光照的交替施加。
1.2.4光电催化还原CO2合成甲醇
合成反应在1.2.3所述装置中进行,持续通入CO2气体并维持内部气压1.5 kPa。以Pt片电极为对电极,SCE作为参比电极,Cu2O/TNTs电极为工作电极,施加偏压-0.3 V,在可见光照条件下反应 5 h。利用 Agilent 7890-7000B型气相色谱-质谱联用仪(GC-MS)对产物的成分及含量进行分析,选用HP-INNOWAX型毛细管柱(60 m × 0.25 mm × 0.25 μm),进样口温度250 °C,吹扫捕集进样5 mL,高纯氦气作为载气,载气流速1.0 mL/min,扫描范围29 ~ 650 m/z。
2 结果与讨论
2.1电沉积Cu2O
图1为TNTs电极在铜电解液中的线性扫描伏安曲线。从图中明显看到,Cu2+还原的起始电位为-0.3 V,随着扫描电位负移,还原电流逐渐增大,在-0.48 V左右出现明显的电流峰,该电流峰对应于Cu2+/Cu2O还原反应[18]。在-0.75 V之后,随扫描电位负移,电流迅速增大,为典型的析氢反应特征。从伏安曲线中可以得知Cu2O的沉积电位范围应在-0.3 ~ -0.75 V之间。
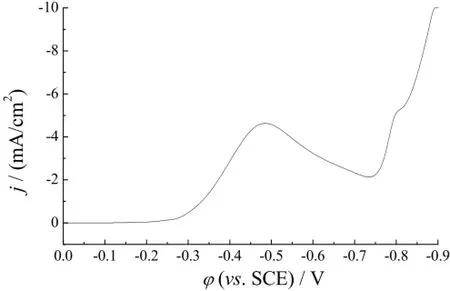
图1 TNTs在铜电解液中的线性扫描伏安曲线Figure 1 Linear sweep voltammogram of TNTs electrode in copper electrolyte
图2为电极的XPS谱图。从图2a可知,在932.5 eV和952.4 eV处出现的特征峰分别对应于Cu 2p3/2以及Cu 2p1/2,由于Cu+与Cu的Cu 2p3/2结合能峰都会出现在(932.6 ± 0.1) eV,通过Cu 2p很难区别Cu+和Cu[19]。图2b为Cu LMM俄歇谱图,俄歇动能峰能量为916.6 eV,对应于Cu2O中的一价铜[20]。由此可见,电沉积产物为Cu2O,即所制备的电极为Cu2O/TNTs电极。
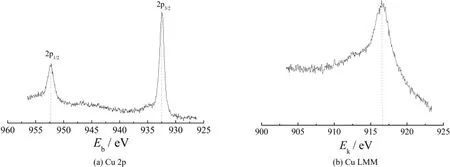
图2 Cu2O/TNTs电极的Cu 2p谱图以及Cu LMM谱图Figure 2 Cu 2p and Cu LMM spectra of Cu2O/TNTs electrode
2.2Cu2O/TNTs电极的表面形貌
图3为-0.5 V脉冲电位下不同沉积电量所制备的Cu2O/TNTs电极的SEM照片。从图中清晰看到,阳极氧化法制备的TiO2纳米管排列规则、分布均匀,管内径约为80 nm。脉冲沉积初期,如沉积电量仅为30 mC时,TNTs的表面几乎无沉积物;随着沉积电量增加(60 mC),TNTs的表面出现少量纳米颗粒,从此时的截面形貌(见图3e)可知,纳米颗粒沿着纳米管的内壁和外壁生长;当沉积电量达到90 mC时,沉积物基本填满TNTs的孔隙,纳米颗粒开始在表面堆积,但仍可以看到纳米管的存在。SEM照片表明,采用脉冲沉积模式可以防止沉积速率过快、颗粒过大并堆积在纳米管表面而堵塞纳米管的现象,有效实现Cu2O纳米颗粒在TiO2纳米管阵列孔隙内的沉积,只有当沉积电量过大时,沉积物才开始在表面堆积。
图4为Cu2O/TNTs电极的透射电镜图。从图中看到规则排列的纳米孔洞结构,沉积物均匀地分布在孔隙内,即在纳米管内部以及纳米管之间的缝隙内均有沉积物,与SEM结果一致。图4c为选区电子衍射图,可以看到3个明显的同心衍射环,分别对应于Cu2O的(111)、(220)和(311)晶面。图4d为对应的高分辨透射电镜照片,可以看到清晰的晶格条纹,晶面间距0.246 nm对应Cu2O的(111)晶面,晶面间距0.352 nm对应TiO2的(101)晶面。上述结果进一步证实,在TNTs基体上脉冲沉积的产物为Cu2O。

图3 -0.5 V脉冲电位下沉积不同电量制备的Cu2O/TNTs电极的SEM照片Figure 3 SEM images of Cu2O/TNTs electrodes prepared with different deposition charges at a potential of -0.5 V

图4 Cu2O/TNTs电极的透射电镜照片、选区电子衍射图及高分辨透射电镜图Figure 4 TEM, selected area electron diffraction and HRTEM images of Cu2O/TNTs electrode
2.3Cu2O/TNTs电极的光电催化活性
测试Cu2O/TNTs电极的光电催化活性之前,首先研究它在0.1 mol/L NaHCO3溶液中的循环伏安行为,以确定适宜的外加电位范围。图5为脉冲电位-0.5 V下沉积60 mC所制Cu2O/TNTs电极在0.1 mol/L NaHCO3溶液中的循环伏安曲线。在阴极扫描方向-0.54 V处出现一个明显的还原峰,对应于Cu2O还原为单质Cu,其反应如式(1)所示[6]。-0.74 V后电流迅速增大,此时开始发生析氢反应。循环伏安曲线表明所制备的Cu2O/TNTs电极在较负的电位下,Cu2O很容易被还原而导致电极失活,因此外加偏压不宜过大。实验选定偏压-0.3 V(相对于SCE),一方面保证电极催化活性物质的稳定性,另一方面在光、电协同作用下电极可以发挥出优异的催化还原活性。
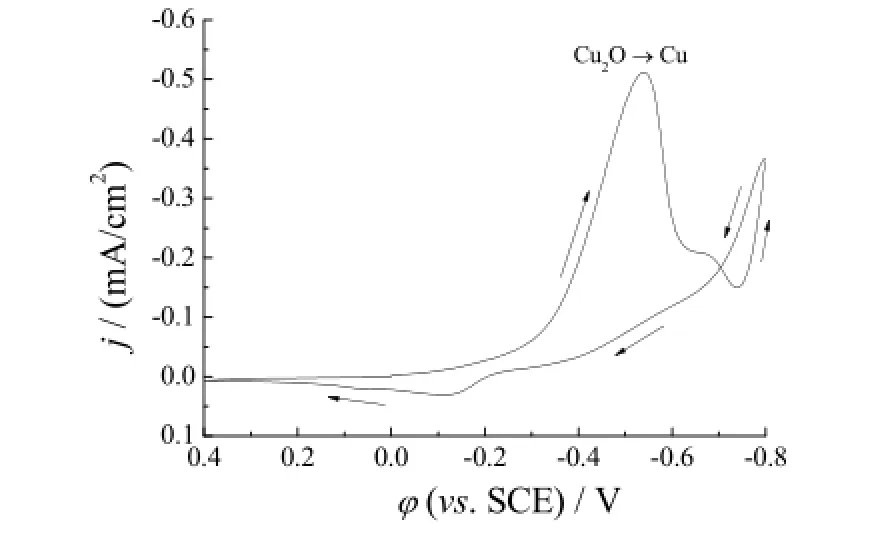
图5 -0.5 V脉冲电位下沉积60 mC制备的Cu2O/TNTs电极在0.1 mol/L NaHCO3溶液中的循环伏安曲线Figure 5 Cyclic voltammogram of Cu2O/TNTs electrode prepared at -0.5 V with 60 mC charge in 0.1 mol/L NaHCO3electrolyte

图6是不同脉冲电位下沉积60 mC所制备的Cu2O/TNTs电极在0.1 mol/L NaHCO3溶液中的光电流-时间曲线,图中的N2和CO2分别代表测试时通入的气体。在N2气氛下,响应电流主要由于水的还原引起;在CO2气氛下,响应电流则由水的还原和CO2还原共同作用。Cu2O/TNTs电极在CO2气氛中的响应电流明显强于N2气氛中的响应电流,且可见光照条件下的电流大大高于不加光条件下的电流,表明电极具有优异的光电催化还原CO2活性。根据图6,不同脉冲电位下所制Cu2O/TNTs电极的光电催化活性不同,其中脉冲电位-0.5 V时制备的电极响应电流较大,对CO2还原表现出相对较高的光电催化活性。
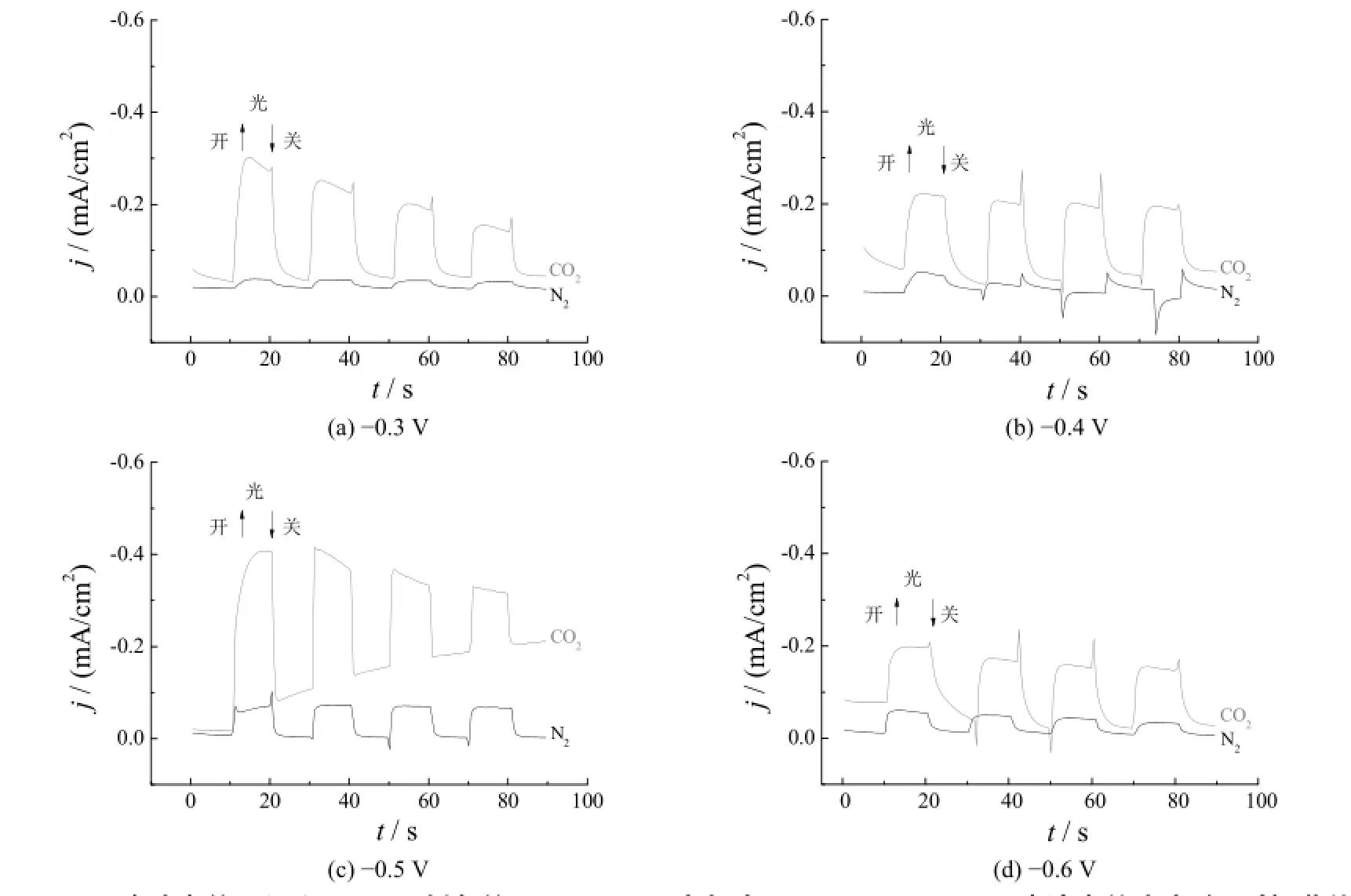
图6 不同脉冲电位下沉积60 mC制备的Cu2O/TNTs电极在0.1 mol/L NaHCO3溶液中的光电流-时间曲线Figure 6 Photocurrent vs. time curves of Cu2O/TNTs electrodes prepared at different potentials with 60 mC deposition charge measured in 0.1 mol/L NaHCO3 electrolyte
图7为脉冲电位-0.5 V下沉积不同电量所制备的Cu2O/TNTs电极在0.1 mol/L NaHCO3溶液中的光电流-时间曲线。脉冲沉积电量直接决定沉积物的负载量,结合光电流-时间曲线分析对比不同Cu2O负载量对光电催化活性的影响。在可见光光照下,TNTs电极几乎没有光电流响应,而负载Cu2O纳米颗粒的TNTs电极的光电流响应显著增强。沉积电量为60 mC时所制电极的光电催化活性相对较高,CO2还原电流达到0.41 mA/cm2。结合SEM照片可知,沉积电量为60 mC时Cu2O纳米颗粒主要填充于纳米阵列的孔隙内,活性比表面积大;而沉积电量达到90 mC以上时,Cu2O颗粒将纳米管覆盖并形成致密层,活性比表面积减小,因而电极活性下降。
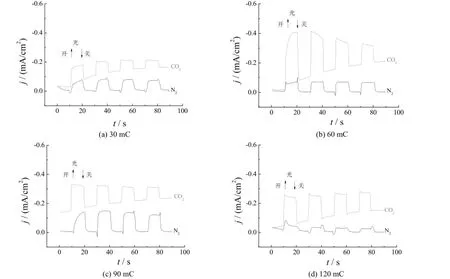
图7 -0.5 V脉冲电位下沉积不同电量制备的Cu2O/TNTs电极在0.1 mol/L NaHCO3溶液中的光电流-时间曲线Figure 7 Photocurrent vs. time curves of Cu2O/TNTs electrodes prepared with different deposition charges at a deposition potential of -0.5 V measured in 0.1 mol/L NaHCO3electrolyte
图8为-0.5 V脉冲电位下沉积60 mC所制备的Cu2O/Ti电极及Cu2O/TNTs电极在0.1 mol/L NaHCO3溶液中的光电流-时间曲线。Cu2O/Ti电极及Cu2O/TNTs电极在初始阶段的光电流均较高,分别为0.38 mA/cm2和0.41 mA/cm2;140 s后两者的光电流分别降至0.04 mA/cm2和0.21 mA/cm2;200 s后,Cu2O/Ti电极的催化活性几乎消失。对比Cu2O/Ti电极及Cu2O/TNTs电极的光电流-时间曲线可知,Cu2O/TNTs电极具有更加稳定、高效的催化活性。随反应时间延长,光电流下降主要是由电极光腐蚀失效或活性物质脱落所致。本实验制备的Cu2O/TNTs复合电极中,Cu2O呈纳米颗粒状负载在纳米阵列的孔隙内。由于纳米管的支撑在很大程度上避免了活性物质的脱落,因而Cu2O/TNTs复合电极的稳定性优于纯钛基体上制备的Cu2O颗粒电极。另一方面,采用TNTs作为基体可有效促进空穴-电子对的提前分离,从而显著提升电极的光电催化还原活性。
2.4光电催化还原CO2合成甲醇
甲醇合成反应在自制的密闭容器中进行,介质为0.1 mol/L NaHCO3溶液,体积100 mL,在可见光照及-0.3 V偏压下反应5 h。气相色谱-质谱测试结果表明产物主要为甲醇。电解液中的甲醇含量随时间的变化如图9所示,合成的甲醇量与反应时间呈准线性关系,即所制备的Cu2O/TNTs电极在该条件下催化还原CO2合成甲醇具有良好的稳定性。
3 结论
(1) 以阳极氧化法制备的TNTs电极为基体,采用脉冲电沉积模式,成功将Cu2O纳米颗粒负载到纳米阵列的孔隙内,制备了Cu2O/TNTs复合电极。
(2) 脉冲沉积电位、沉积电量是影响电极形貌及性能的关键因素。在-0.5 V脉冲电位下沉积60 mC制备的Cu2O/TNTs电极具有较优的光电催化还原CO2活性。
(3) 在 TNTs基体上制备的 Cu2O纳米颗粒复合电极与纯钛基体上制备的 Cu2O颗粒电极相比,稳定性和光电催化活性显著提高。
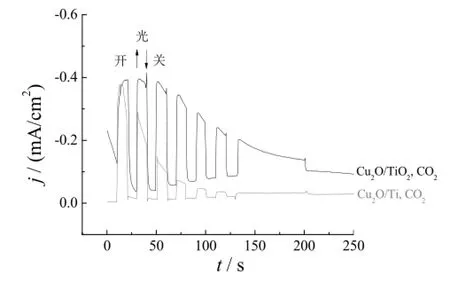
图8 -0.5 V脉冲电位下沉积60 mC所制备的Cu2O/Ti电极和Cu2O/TNTs电极在0.1 mol/L NaHCO3溶液中的光电流-时间曲线Figure 8 Photocurrent vs. time curves of Cu2O/Ti and Cu2O/TNTs electrodes prepared at -0.5 V with 60 mC deposition charge measured in 0.1 mol/L NaHCO3electrolyte

图9 Cu2O/TNTs电极还原CO2合成甲醇的产量随时间的变化Figure 9 Variation of the yield of methanol synthesized by CO2reduction with time at Cu2O/TNTs electrode
(4) 在0.1 mol/L NaHCO3电解液中采用Cu2O/TNTs电极光电催化还原CO2,合成的产物主要为甲醇,还原5 h后甲醇含量达到6.05 mg/L。
[1] OLAH G A, PRAKASH G K S, GOEPPERT A. Anthropogenic chemical carbon cycle for a sustainable future [J]. Journal of the American Chemical Society,2011, 133 (33): 12881-12898.
[2] WANG J J, JING Y H, OUYANG T, et al. Photocatalytic reduction of CO2to energy products using Cu-TiO2/ZSM-5 and Co-TiO2/ZSM-5 under low energy irradiation [J]. Catalysis Communications, 2015, 59: 69-72.
[3] YUAN L, XU Y J. Photocatalytic conversion of CO2into value-added and renewable fuels [J]. Applied Surface Science, 2015, 342: 154-167.
[4] TSUI L K, WU L L, SWAMI N, et al. Photoelectrochemical performance of electrodeposited Cu2O on TiO2nanotubes [J]. ECS Electrochemistry Letters, 2012,1 (2): D15-D19.
[5] ENGEL C J, POLSON T A, SPADO J R, et al. Photoelectrochemistry of porous p-Cu2O films [J]. Journal of the Electrochemical Society, 2007, 155 (3): F37-F42.
[6] ZHAO L, DONG W, ZHENG F G, et al. Interrupted growth and photoelectrochemistry of Cu2O and Cu particles on TiO2[J]. Electrochimica Acta, 2012, 80: 354-361.
[7] GHADIMKHANI G, DE TACCONI N R, CHANMANEE W, et al. Efficient solar photoelectrosynthesis of methanol from carbon dioxide using hybrid CuO-Cu2O semiconductor nanorod arrays [J]. Chemical Communications, 2013, 49 (13): 1297-1299.
[8] HUANG Q, KANG F, LIU H, et al. Highly aligned Cu2O/CuO/TiO2core/shell nanowire arrays as photocathodes for water photoelectrolysis [J]. Journal of Materials Chemistry A, 2013, 1 (7): 2418-2425.
[9] ZHANG J L, ZHANG X W, LEI L C. Modification of TiO2nanotubes arrays by CdS and their photoelectrocatalytic hydrogen generation properties [J]. Chinese Science Bulletin, 2008, 53 (12): 1929-1932.
[10] YANG X Y, XIAO T C, EDWARDS P P. The use of products from CO2photoreduction for improvement of hydrogen evolution in water splitting [J]. International Journal of Hydrogen Energy, 2011. 36 (11): 6546-6552.
[11] XIAO Q, OUYANG L L. Photocatalytic photodegradation of xanthate over C, N, S-tridoped TiO2nanotubes under visible light irradiation [J]. Journal of Physics and Chemistry of Solids, 2011, 72 (1): 39-44.
[12] CAO G J, CUI B, WANG W Q, et al. Fabrication and photodegradation properties of TiO2nanotubes on porous Ti by anodization [J]. Transactions of Nonferrous Metals Society of China, 2014, 24 (8): 2581-2587.
[13] PERILLO P M, RODRÍGUEZ D F. A room temperature chloroform sensor using TiO2nanotubes [J]. Sensors and Actuators B: Chemical, 2014, 193: 263-266.
[14] TELEKI A, BJELOBRK N, PRATSINIS S E. Flame-made Nb- and Cu-doped TiO2sensors for CO and ethanol [J]. Sensors and Actuators B: Chemical, 2008,130 (1): 449-457.
[15] GHICOV A, ALBU S P, HAHN R, et al. TiO2nanotubes in dye-sensitized solar cells: critical factors for the conversion efficiency [J]. Chemistry - An Asian Journal, 2009, 4 (4): 520-525.
[16] ROY P, KIM D H, LEE K Y, et al. TiO2nanotubes and their application in dye-sensitized solar cells [J]. Nanoscale, 2010, 2 (1): 45-59.
[17] 叶乔, 曹华珍, 逯东辉, 等. Ti3+掺杂的TiO2纳米管阵列制备及其电化学阻抗谱研究[J]. 电镀与涂饰, 2014, 33 (11): 453-456.
[18] SOMASUNDARAM S, CHENTHAMARAKSHAN C R N, DE TACCONI N R, et al. Photocatalytic production of hydrogen from electrodeposited p-Cu2O film and sacrificial electron donors [J]. International Journal of Hydrogen Energy, 2007, 32 (18): 4661-4669.
[19] GHODSELAHI T, VESAGHI M A, SHAFIEKHANI A, et al. XPS study of the Cu@Cu2O core-shell nanoparticles [J]. Applied Surface Science, 2008, 255 (5):2730-2734.
[20] YANO T, EBIZUKA M, SHIBATA S, et al. Anomalous chemical shifts of Cu 2p and Cu LMM Auger spectra of silicate glasses [J]. Journal of Electron Spectroscopy and Related Phenomena, 2003, 131/132: 133-144.
[ 编辑:温靖邦 ]
Preparation of Cu2O/TNTs electrode and its photoelectrocatalytic performance for the reduction of CO2to methanol
CAO Hua-zhen, NING Wei, JIANG Zhi-peng, ZHENG Guo-qu*
TiO2nanotubes (TNTs) arrays obtained by anodization of titanium were used as a matrix to prepare a Cu2O/TNTs electrode via pulse electrodeposition of Cu2O on the walls of TNTs. The morphology of the electrode and the valence of deposit on it were characterized by scanning electron microscopy (SEM), transmission electron microscopy (TEM) and X-ray photoelectron spectroscopy (XPS). The effects of deposition potential and charge on photoelectrocatalytic properties of the as-prepared electrode were studied by cyclic voltammetry and photocurrent-time curve measurement. It was shown that the deposits are Cu2O nanoparticles. The photoelectroactivity and stability of Cu2O/TNTs electrode are better than that of a Cu2O/Ti electrode. The Cu2O/TNTs electrode prepared at a deposition potential of -0.5 V (vs. saturated calomel electrode) with a deposition charge of 60 mC presents high photoelectroactivity for CO2reduction. The photoelectrosynthesis performed in a homemade airtight reactor with 100 mL of 0.1 mol/L NaHCO3solution using the Cu2O/TNTs electrode proved that the main reduction product is methanol with a yield reaching 6.05 mg/L after reduction reaction for 5 hours.
titania; anodization; nanotube array; copper(I) oxide; pulse electrodeposition; carbon dioxide; reduction;photoelectrocatalysis
TG174.451; TQ153
A
1004 - 227X (2016) 09 - 0437 - 07
2016-01-22
2016-03-30
曹华珍(1975-),女,江西景德镇人,博士,副教授,从事金属材料及表面处理研究。
郑国渠,教授,(E-mail) zhenggq@zjut.edu.cn。

