纳美芬联合单唾液酸四己糖神经节苷脂钠用于脑肿瘤手术患者的临床观察Δ
王善军,刘小刚,张 伟,周 帅(.潍坊市益都中心医院神经外科,山东潍坊 6500;.滨州医学院人体解剖与组织胚胎学研究所,山东滨州 56603)
纳美芬联合单唾液酸四己糖神经节苷脂钠用于脑肿瘤手术患者的临床观察Δ
王善军1*,刘小刚1,张伟1,周帅2(1.潍坊市益都中心医院神经外科,山东潍坊262500;2.滨州医学院人体解剖与组织胚胎学研究所,山东滨州256603)
目的:探讨纳美芬联合单唾液酸四己糖神经节苷脂钠用于脑肿瘤手术患者的临床疗效及安全性。方法:64例脑肿瘤手术患者按计算机随机化程序分为观察组和对照组,各32例。对照组患者采用脑细胞保护、降低颅内压、抗感染、扩血管等常规治疗方法;观察组患者在对照组治疗基础上,于术后第1天开始持续静脉泵注纳美芬0.7 μg/(kg·h)与单唾液酸四己糖神经节苷脂钠100 mg/d,连续使用7 d。观察两组患者治疗前与治疗后3、7 d血浆皮质醇、促肾上腺皮质激素(ACTH),血清白细胞介素(IL)6、肿瘤坏死因子(TNF)α和巴氏指数(BI)的变化,并观察神经功能改善情况和不良反应发生情况;随访90 d,使用卡氏(KPS)评分评估患者的生活自理能力。结果:治疗后,两组患者血浆皮质醇、ACTH含量及血清TNF-α、IL-6水平均较治疗前显著下降,差异有统计学意义(P<0.05);观察组患者在治疗后3、7 d的皮质醇、ACTH、TNF-α水平,以及治疗后7 d的IL-6水平均较对照组降低得更为明显,差异均有统计学意义(P<0.05)。治疗后,两组患者的BI评分均较治疗前显著提高,且观察组较对照组提高得更为明显,差异均有统计学意义(P<0.05)。治疗后7 d,观察组患者的神经功能改善率为50.00%,明显高于对照组(18.75%),差异有统计学意义(P<0.05)。观察期间,两组患者均未见明显不良反应发生。术后随访90 d,观察组患者KPS评分不低于70分者占比为71.88%,明显高于对照组(46.87%),差异有统计学意义(P<0.05)。结论:纳美芬联合单唾液酸四己糖神经节苷脂钠能促进脑肿瘤患者恢复,降低患者皮质醇、ACTH、IL-6和TNF-α水平,并能改善患者预后。
纳美芬;单唾液酸四己糖神经节苷脂钠;脑肿瘤手术;神经功能
脑肿瘤手术为有创治疗,这种创伤刺激会在术后引起患者强烈的应激反应和炎症反应,从而加重颅脑中枢神经的损伤程度[1]。因此,降低术后应激反应和保护中枢神经系统对改善患者预后、提高其康复水平具有重要意义。纳美芬和单唾液酸四己糖神经节苷脂钠是临床治疗中枢神经损伤的常用药,本研究主要探讨了两药联用对脑肿瘤手术患者的临床疗效及对白细胞介素(IL)6和肿瘤坏死因子(TNF)α的影响。
1 资料与方法
1.1纳入与排除标准
纳入标准:(1)经CT、磁共振(MRI)辅助检查及临床诊断为脑占位性病变,并经术后病理诊断证实为脑肿瘤的患者;(2)患者或其家属知情同意并签署知情同意书。
排除标准:(1)对纳美芬或单唾液酸四己糖神经节苷脂钠存在使用禁忌者;(2)术前长期服用阿片类药物者;(3)有既往开颅手术史者;(4)合并其他严重脏器功能障碍者。
1.2研究对象
本研究方案经潍坊市益都中心医院(以下简称“我院”)医学伦理委员会审核批准后,选取我院神经外科2011年2月-2015年3月收治的择期行脑肿瘤手术的患者64例为研究对象,包括良性肿瘤患者48例、恶性肿瘤患者11例、转移癌患者5例;男性35例,女性29例;年龄19~69岁,平均年龄(43.06± 14.65)岁;平均体质量(63.43±12.05)kg。根据计算机随机化程序,将入选患者随机分为观察组和对照组,各32例。两组患者的性别、年龄、体质量、肿瘤类型等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。
表1 两组患者一般资料比较(±s)Tab 1 Comparison of general information between 2 groups (±s)

表1 两组患者一般资料比较(±s)Tab 1 Comparison of general information between 2 groups (±s)
肿瘤类型(良性/恶性/转移性),例24/6/2 24/5/3组别对照组观察组n 32 32性别(男/女),例18/14 17/15年龄,岁45.03±16.54 41.54±13.35体质量,kg 61.67±11.09 65.08±15.68
1.3治疗方法
两组患者均行常规治疗,包括脑细胞保护、降低颅内压、抗感染、扩血管等,并给予保障患者呼吸循环功能、维持酸碱平衡和对症治疗。观察组患者在常规治疗基础上,于术后第1天开始持续静脉泵注盐酸纳美芬注射液(灵宝市豫西药业有限责任公司,批准文号:国药准字H20080805,规格:1 ml∶0.1 mg)0.7 μg/(kg·h)和注射用单唾液酸四己糖神经节苷脂钠(哈尔滨医大药业股份有限公司,批准文号:国药准字H20060422,规格:20 mg)100 mg/d,连续使用7 d。
1.4检测指标
于术后第1天药物治疗前及术后第3、7天清晨分别采集患者空腹静脉血4~6 ml,经肝素抗凝处理后,以离心半径5 cm、转速4 000 r/min离心10 min,分离出血浆和血清,置于-80℃低温保存。采用电化学发光法对分离出的血浆标本中皮质醇和促肾上腺皮质激素(ACTH)水平进行测定,试剂盒购自美国DPC公司;采用酶联免疫吸附法对分离出的血清标本中IL-6 和TNF-α水平进行测定,试剂盒购自上海活乐生物科技有限公司。所有测量过程均严格按照试剂盒说明书要求操作。
1.5观察指标
(1)于术后第1天药物治疗前及术后第3、7天,采用巴氏指数(BI)评估患者的神经功能改善情况,治疗后BI评分不低于治疗前或不少于60分认定为神经功能改善,计算神经功能改善率。(2)随访90 d,使用卡氏(KPS)评分评估患者的生活自理能力,KPS评分不低于70分认定为生活自理能力较好,并计算患者比例。(3)观察用药过程中的不良反应发生情况。
1.6统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以±s表示,组内及组间比较采用t检验;计数资料以率表示,组间比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1两组患者治疗前后血浆皮质醇和ACTH变化
治疗前,两组患者血浆皮质醇和ACTH含量比较,差异均无统计学意义(P>0.05)。治疗后3、7 d,两组患者皮质醇和ACTH含量均显著下降,且观察组患者较对照组下降得更为明显,差异均有统计学意义(P<0.05)。两组患者治疗前后血浆皮质醇和ACTH变化见表2。
2.2两组患者治疗前后IL-6和TNF-α变化
表2 两组患者治疗前后血浆皮质醇和ACTH变化(±s)Tab 2 Changes of serum cortisol andACTH between 2groups before and after treatmen(t±s)
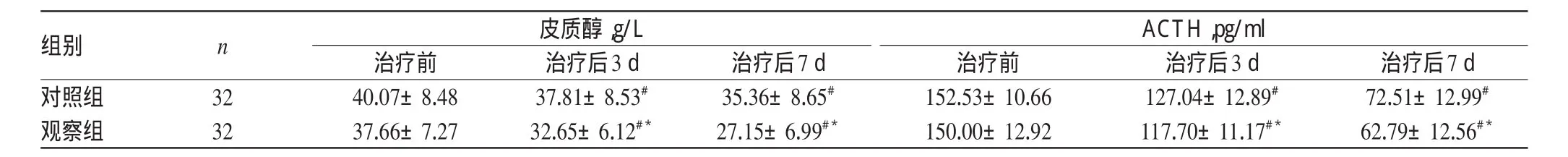
表2 两组患者治疗前后血浆皮质醇和ACTH变化(±s)Tab 2 Changes of serum cortisol andACTH between 2groups before and after treatmen(t±s)
注:与治疗前比较,#P<0.05;与对照组治疗后比较,*P<0.05Note:vs.before treatment,#P<0.05;vs.control group after treatment,*P<0.05
组别对照组观察组n 皮质醇,g/L ACTH,pg/ml 32 32治疗前40.07±8.48 37.66±7.27治疗后3 d 37.81±8.53#32.65±6.12#*治疗后7 d 35.36±8.65#27.15±6.99#*治疗前152.53±10.66 150.00±12.92治疗后3 d 127.04±12.89#117.70±11.17#*治疗后7 d 72.51±12.99#62.79±12.56#*
治疗前,两组患者血清IL-6和TNF-α水平比较,差异均无统计学意义(P>0.05)。治疗后3、7 d,两组患者IL-6和TNF-α水平均显著下降,且观察组患者的IL-6(治疗后7 d)和TNF-α(治疗后3、7 d)水平较对照组下降得更为明显,差异均有统计学意义(P<0.05)。两组患者治疗前后IL-6和TNF-α变化见表3。
2.3两组患者治疗前后BI评分变化
表3 两组患者治疗前后IL-6和TNF-α变化(±s,ng/L)Tab 3 Changes of IL-6 and TNF-α between 2groups before and after treatmen(t±s,ng/L)

表3 两组患者治疗前后IL-6和TNF-α变化(±s,ng/L)Tab 3 Changes of IL-6 and TNF-α between 2groups before and after treatmen(t±s,ng/L)
注:与治疗前比较,#P<0.05;与对照组治疗后比较,*P<0.05Note:vs.before treatment,#P<0.05;vs.control group after treatment,*P<0.05
组别对照组观察组n IL-6 TNF-α 32 32治疗前136.66±5.62 136.63±5.75治疗后3 d 121.62±12.57#116.53±12.86#治疗后7 d 107.38±17.24#96.09±20.54#*治疗前165.83±7.93 163.94±6.64治疗后3 d 151.87±14.16#142.24±12.73#*治疗后7 d 133.13±15.76#119.2±17.31#*
治疗前,两组患者BI评分比较,差异无统计学意义(P>0.05)。治疗后,两组患者BI评分均有较大提高,且观察组患者较对照组提高得更为明显,差异均有统计学意义(P< 0.05)。治疗后第7天,观察组患者的神经功能改善率为50.00%,明显大于对照组(18.75%),差异有统计学意义(χ2= 12.65,P<0.01)。两组患者治疗前后BI评分变化及神经功能改善率见表4。
表4 两组患者治疗前后BI评分变化及神经功能改善率(±s)Tab 4 BI score changes and improvement rate of neurological function between 2 groups before and after treatmen(t±s)
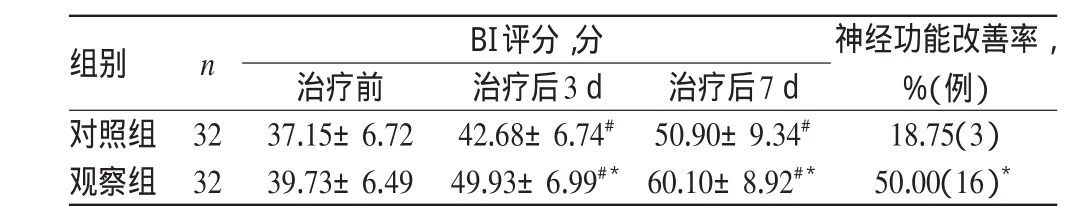
表4 两组患者治疗前后BI评分变化及神经功能改善率(±s)Tab 4 BI score changes and improvement rate of neurological function between 2 groups before and after treatmen(t±s)
注:与治疗前比较,#P<0.05;与对照组治疗后比较,*P<0.05Note:vs.before treatment,#P<0.05;vs.control group after treatment,*P<0.05
神经功能改善率,%(例)18.75(3)50.00(16)*组别对照组观察组n BI评分,分32 32治疗前37.15±6.72 39.73±6.49治疗后3 d 42.68±6.74#49.93±6.99#*治疗后7 d 50.90±9.34#60.10±8.92#*
2.4不良反应
观察期间,两组患者均未见明显不良反应发生。
2.5两组患者KPS评分比较
术后随访90 d,观察组中KPS评分不低于70分者占71.88%(23/32),对照组占46.87%(15/32),组间比较差异有统计学意义(χ2=4.15,P=0.04)。
3 讨论
脑肿瘤手术作为一种创伤刺激,会刺激机体产生应激反应,从而释放大量兴奋性神经递质、炎症因子和含氧化合物等,造成中枢神经系统的继发性损伤[2]。皮质醇、促肾上腺皮质激素联合评价可以较好地显示下丘脑-垂体-肾上腺皮质轴的功能状态[3]。另有研究显示,IL-6、TNF-α等因子也参与了脑肿瘤手术患者颅脑损伤后的继发性病理过程,可以作为炎性反应的标志物[4-6]。
纳美芬是一种纯度较高的阿片类受体拮抗药,对兴奋性神经递质具有强拮抗作用;此外,纳美芬还可以稳定细胞生物膜,对减少损伤性细胞因子、修复受损神经元细胞、逆转神经功能障碍以及改善微循环等均有作用[7-9]。单唾液酸四己糖神经节苷脂钠是一种中枢神经损伤治疗药,可以通过受损的血脑屏障进入中枢神经系统内,从而具有抗氧化和修复神经元两大作用,能有效降低脑水肿和脑出血的发生率[10]。
本研究结果显示,治疗后观察组患者的皮质醇、ACTH含量和IL-6、TNF-α水平均显著下降,其原因可能为:单唾液酸四己糖神经节苷脂钠可以进入中枢神经元细胞内保护细胞膜的稳定性,降低IL-6、TNF-α等炎性因子水平,拮抗氧自由基和兴奋性神经递质的毒副作用;纳美芬可以减少阿片类受体信号传导,降低神经系统兴奋性,减少应激性激素皮质醇、ACTH的分泌。观察组患者的BI评分和神经功能改善率均明显高于对照组,其原因可能与纳美芬和单唾液酸四己糖神经节苷脂钠的修复作用有关,其可以修复缺损细胞膜、减少氧化反应、加强神经元自我修复能力。观察组患者的KPS评分明显高于对照组,其原因可能为联合用药能减轻患者创伤性应激反应,使由应激产生的不良反应减少,从而减轻了对机体颅脑的损伤程度,提高了患者的生活自理能力。
综上所述,纳美芬联合单唾液酸四己糖神经节苷脂钠用于脑肿瘤手术患者具有良好疗效,其机制可能与降低应激性激素皮质醇、ACTH的含量以及炎性因子IL-6、TNF-α的水平,从而抑制创伤后应激反应和炎性反应程度密切相关。但是,由于本研究样本量较小、研究时间较短,在用药剂量安全性和远期预后效果方面尚需要进一步证实。
[1]邓民强,田仁副,潘柯,等.纳美芬对脑肿瘤术后患者血浆皮质醇、促肾上腺皮质激素及葡萄糖水平的影响[J].重庆医学,2013,42(2):160.
[2]Masson EA,Sibille E,Martine L,et al.Apprehending ganglioside diversity:a comprehensive methodological approach[J].J Lipid Res,2015,56(9):1 821.
[3]Zhang JZ,Jing L,Ma Y,et al.Monosialotetrahexosy-1 ganglioside attenuates diabetes-enhanced brain damage after transient forebrain ischemia and suppresses phosphorylation of ERK1/2 in the rat brain[J].Brain Res,2010,1 344 (1):200.
[4]Piao H,Kuan CT,Chandramohan V,et al.Affinity-matured recombinant immunotoxin targeting gangliosides 3′-isoLM1 and 3′,6′-isoLD1 on malignant gliomas[J].MAbs,2013,5(5):748.
[5] 张林峰,郑小玲.纳美芬联合神经节苷脂GM1治疗急性卒中的有效性及安全性观察[J].现代诊断与治疗,2015,26(1):70.
[6]焦园园,刘红,张艳华.9家肿瘤专科医院激素类抗肿瘤药应用情况及处方合理性分析[J].中国药房,2014,25 (26):2 410.
[7]Zhang YP,Huang QL,Zhao CM,et al.GM1 improves neurofascin155 association with lipid rafts and prevents rat brain myelin injury after hypoxia-ischemia[J].Braz J Med Biol Res,2011,44(6):553.
[8]Seyfried TN,Mukherjee P.Ganglioside GM3 is antiangiogenic in malignant brain cancer[J].J Oncol,2013,405 (23):7 321.
[9]马笑宇.神经节苷脂钠联用纳美芬对急性重型颅脑损伤患者氧化应激状态的影响[J].抗感染药学,2011,8(4):296.
[10]Kobayashi Y,da Silva R,Kumanogoh H,et al.Ganglioside contained in the neuronal tissue-enriched acidic protein of 22 kDa(NAP-22)fraction prepared from the detergent-resistant membrane microdomain of rat brain inhibits the phosphatase activity of calcineurin[J].J Neurosci Res,2015,93(9):1 462.
(编辑:胡晓霖)
Clinical Observation of Nalmefene Combined with Monosialotetrahexosylganglioside Sodium in the Treatment of Patients in Brain Tumor Operation
WANG Shanjun1,LIU Xiaogang1,ZHANG Wei1,ZHOU Shuai2(1.Dept.of Neurosurgery,Yidu Central Hospital of Weifang,Shangdong Weifang 262500,China;2.The Institution of Human Anatomy and Embryology,Binzhou Medical University,Shandong Binzhou 256603,China)
OBJECTIVE:To explore the clinical efficacy and safety of nalmefene combined with monosialotetrahexosylganglioside sodium in the treatment of patients in brain tumor operation.METHODS:64 patients in brain tumor operation were randomly divided into observation group and control group,32 cases in each group.Control group received brain cell protection,reducing intracranial pressure,anti-infective,vasodilator and other conventional treatment;observation group additionally received 0.7 μg/(kg· h)nalmefene combined with 100 mg/d monosialotetrahexosylganglioside sodium from the first day of operation,for continuous 7 d.The plasma cortisol,adrenocorticotropic hormone(ACTH)before and 3,7 d after treatment,changes of serum IL-6,TNF-α and Barthel index(BI)in 2 groups were observed,improvement of neurological function and ADR were observed;Karnofsky (KPS)score was determined after 90 d follow-up used to assess the patient’s ability to take care of themselves.RESULTS:After treatment,plasma cortisol and ACTH content,serum TNF-α and IL-6 levels in 2 groups significantly decreased than before,the difference was statistically significant(P<0.05);cortisol,ACTH and TNF-α levels 3,7 d after treatment,IL-6 level 7 d after treatment in observation group decreased more significantly than control group,the differences were statistically significant(P<0.05).After treatment,BI score in 2 groups significantly increased,and observation group increased more significantly than control group,the differences were statistically significant(P<0.05).7 d after treatment,improvement rate of neurological function was 50.00%,which was significantly higher than that of the control group(18.75%),the difference was statistically significant(P<0.05).There was no significant ADR occurred of 2 groups in the study.Following-up for 90 d,the KPS score in observation group with not less than 70 points accounted for 71.88%,which was significantly higher than the control group(46.87%),the difference was statistically significant(P<0.05).CONCLUSIONS:Nalmefene combined with monosialotetrahexosylganglioside sodium can promote the recovery of patients in brain tumor operation,reduce cortisol,ACTH,IL-6 and TNF-α levels and improve prognosis of patients.
Nalmefene;Monosialotetrahexosylganglioside sodium;Brain tumor operation;Neurological function
R749.1+4文献标志码A
1001-0408(2016)23-3221-03
10.6039/j.issn.1001-0408.2016.23.18
山东省自然科学基金资助项目(No.2014ZRB14674)
*住院医师,硕士。研究方向:神经外科学。电话:0536-3275657。E-mail:yanruiyun81@126.com
2015-09-17
2015-11-11)

