基于T-RFLP技术的不同水位梯度植物根际细菌群落多样性特征分析
张琼琼, 黄兴如, 郭逍宇
首都师范大学资源环境与旅游学院, 北京 100048
基于T-RFLP技术的不同水位梯度植物根际细菌群落多样性特征分析
张琼琼, 黄兴如, 郭逍宇*
首都师范大学资源环境与旅游学院, 北京100048
为了解水位梯度控制下不同湿地植物根际细菌群落多样性,以北京市奥林匹克公园植物氧化塘人工湿地为例,采用末端限制性片段长度多态性(T-RFLP)技术结合ANOVA分析,比较了水位梯度控制下三棱草、芦苇、香蒲、睡莲4种植物根际细菌群落的多样性。研究结果显示:随着水位梯度加深,根际细菌群落多样性呈现减少趋势,HhaⅠ、MspⅠ、RsaⅠ 3种不同酶切所得结果一致,且综合3种酶切的PAT比对中RFs组合数量随水位梯度加深也呈相应变化趋势。进一步分析发现,随水位梯度加深植物根际可培养细菌RFs数量变化较显著。不同水位梯度下各植物根际细菌群落中差异显著的菌群为Beta变形杆菌纲,水位梯度加深可能导致不同生态型植物根际泌氧能力降低,进而影响植物根际好氧细菌生存,从而出现三棱草根际属水平菌群丰富度最高,其次为芦苇、香蒲,最少为睡莲。各植物根际细菌群落的优势属多数为变形杆菌门,是脱氮除磷的功能性菌门,其中产碱杆菌属和黄杆菌属为四种植物根际细菌的共同优势属,在碳氮循环中起重要作用。
水位梯度;湿地植物;细菌多样性;T-RFLP
湿地是自然环境中自净能力最强的生态系统之一[1],可利用基质-植物-微生物复合生态系统的物理、化学、生物三重协同作用,通过过滤、沉淀、吸附、离子交换、植物吸收和微生物分解等多种途径实现对污水的高效净化[2]。湿地植物在污水净化过程中扮演着重要角色。植物可以直接吸收利用水体中的氮磷等富营养化元素,进而通过植物收割使其从湿地去除。但通过植物吸收同化的去除量仅是一少部分,Oostrom等认为仅有13%的氮是通过基质的过滤和植物吸收作用被去除[3]。栖息于湿地植物根际的多种微生物是水体中污染物主要降解者,原因是根际是植物、微生物和基质共同作用最直接、最强烈的区域[4],且植物根分泌物、通气条件及凋落物的分解过程会影响植物根际微生物群落结构特性进而影响系统的净化效能[5-6]。细菌在根环境中对各种根分泌物利用率和敏感性远远超过真菌、放线菌及藻类等,在根际微生物活动中较活跃且占主导地位,并能与根际联合生存、定殖及保持在根部[7]。
水位是影响湿地生态过程的关键因素[8]。水位梯度变化是影响湿地植物空间异质分布的主导因子[9],湿地水位梯度变异影响植物氧气的供给,从而于湿地近岸带依次形成湿生植物、挺水植物、浮叶植物等生态型的植物分布格局。基于水位梯度变异的氧气供给调节导致不同类型的湿地植物生物地化循环中好氧和厌氧过程的相互影响。高水位促进反硝化[10]、甲烷生成[11]等厌氧过程的速率,同时降低硝化作用等好氧过程的速率[12]。
基于末端限制性片段长度多态性技术(Terminal restriction fragment length polymorphism analysis, T-RFLP)可以定性和定量的进行微生物群落结构分析及不同群落结构间的比较[13],它是建立在16S rDNA基础上,其数据输出形式在测序过程中直接数字化完成对大量信息的快速分析,前期限制性内切酶选择是影响分析结果的关键因素[14],选择内切酶应考虑其消化后产生单峰具有特异性及可测定范围内末端片段长度(T-RFs)的数量[15]。在样品群落多样性超过100种时,使用单酶切可能只识别50%的群落,适宜选择2—4种限制性内切酶进行多重酶切,可检测50%—70%的群落丰富度表达[16]。研究表明,分析细菌16S rDNA多态性时,MspⅠ最易得到可分辨的单一片段,HhaⅠ和RsaⅠ可产生数量最多的T-RFs[17]。HhaⅠ、MspⅠ、RsaⅠ 三种四碱基限制性内切酶的酶切位点分别为GCG′C、C′CGG、GT′AC,综合包括了AT和GC位点,且酶切位点特异性高,可提高16S rDNA片段中的酶切频率、丰富酶切片段[18-19]。由于双酶切不一定比单酶切产生更多T-RFs,甚至可能少于单酶切,因此综合3种酶切在各自反应体系中进行分别酶切,提高操作分类单元的精确有效性[20]。
近年来,已有学者尝试借用统计学方法在海量数据中挖掘数据的内在规律方面的优势对T-RFLP分析中酶切片段进行分析。储昭瑞等采用T-RFLP技术,选取合适的HhaⅠ和RsaⅠ限制性内切酶,使得不同厌氧氨氧化细菌对应不同T-RFs,进而完成对厌氧氨氧化细菌群落组成的快速分析[21]。黄艺等借助加权平均回归方法根据滇池流域38个样品产生的110个T-RFs片段对各环境因子的生态适宜性将其划分为对环境干扰的敏感片段、中间片段和耐受片段,进而成功地对滇池流域浮游生物的完整性进行评价[22]。Ding T等采用Average Proportion per Existence (APE)和部分主成分分析(pCCA)的方法对不同物种、不同季节、不同环境条件下植物叶内生细菌群落所产生的T-RFs片段进行差异性分析,表明物种变异是影响T-RFs片段变异的主要因素,其次是生长季节和生长环境[23]。
本文利用T-RFLP技术结合HhaⅠ、MspⅠ、RsaⅠ综合酶切结果的多样性指数、片段类型、片段丰度和基于MiCA的PAT比对分析比较不同水位梯度下湿地近岸带优势植物即湿生植物三棱草(CarexphacotaSpr.)、挺水植物芦苇(Phragmitescommunis)和香蒲(Typhaorientalis)、浮叶植物睡莲(Nymphaeatetragona)的根际细菌群落结构多样性差异,并尝试借助方差分析检验基于水位梯度变异的不同植物根际细菌群落属特征差异,探讨同一水域不同水位梯度条件下植物根际细菌群落间变异关系及细菌群落与宿主植物根际微环境间响应关系。研究结果预期在多元统计分析与T-RFLP相结合的微生物生态学问题分析中进行有益尝试,并预期揭示基于水位梯度湿地植物根际细菌群落多样性变异特征,对构建高效的湿地净化系统及改善和维护生态平衡提供科学参考。
1 研究区概况
奥林匹克公园南园湿地位于奥林匹克公园内,地处北京市区北部。该区属暖温带半干旱半湿润大陆性季风气候。多年平均气温11—12 ℃,极端最高气温41.6 ℃,极端最低气温-21.2 ℃;多年平均水面蒸发量在1200 mm左右;多年平均降雨量约600 mm,年内分配不均,多集中在汛期6—9月,约占全年的85%。奥林匹克公园以清河、北小河再生水处理厂的出水为补水水源,并循环利用,且补水入湖前流经南园湿地以改善水质。作为奥林匹克南园湿地的子系统之一,植物氧化塘水位梯度约1—2 m之间,兼具好氧塘和厌氧塘的优点,塘内各个部分均分布有大量水生植物,主要包括三棱草、芦苇、香蒲、睡莲等,集中分布于湿地近岸带0—10 m处,并形成较为明显的近岸带植被分布格局。植被覆盖度较高,可达70%—90%。通过植物的净化作用出水水质可以达到地表Ⅲ类水水质标准(GB3838—2002)。
2 材料与方法
2.1样品采集及DNA提取
2012年6月14日分别从奥林匹克公园南园湿地植物氧化塘基于塘中心到近岸带设置东、南、西、北四条样带,并在样带上依据不同水位梯度下优势物种采集湿生植物三棱草(0—1cm水深)、挺水植物芦苇(约10cm水深)和香蒲(约15cm水深)、浮叶植物睡莲(约100cm水深)根际土壤样品,新鲜表面附着基质的各植物根际样品装入消菌的三角瓶密封,立即带回实验室处理分析。将三棱草、芦苇、香蒲、睡莲各根际新鲜泥土通过真空抽滤泵过滤去除水分,滤膜上即留有植物根际微生物样品,随后将根际样品冷冻储藏于-20 ℃备用。采用土壤样品提取试剂盒(天根生化科技北京有限公司)提取根际样品总DNA,操作步骤按照使用说明书进行。提取总DNA经0.8%(m/v)琼脂糖凝胶电泳检测鉴定,提取的DNA放置于-20 ℃条件下保存、备用。
2.216S rDNA的PCR扩增
本实验的细菌引物选用正向引物5′端带荧光物质FAM标记的27f(6-FAM-5′-AGAGTTTGATCC TGGCTCAG-3′)和反向引物1492r(5′-GGTTACCTTGTTACG ACTT -3′)对根际样品进行16S rDNA基因进行扩增。PCR反应体系成分(50 μL)包含25 μL 2×Taq PCR Master Mix,2 μL正反向引物,4 μL根际土壤总DNA,17 μL ddH2O。PCR反应条件:95 ℃预变性5 min;30个循环的常规PCR(95 ℃变性50 s,55 ℃退火50 s,72 ℃引物延伸1 min);72 ℃延伸7 min;4 ℃保存。荧光PCR产物采用1.0%的琼脂糖凝胶检测。
2.3末端限制性片段长度多态性(T-RFLP)分析
采用限制性内切酶HhaⅠ、MspⅠ、RsaⅠ分别对PCR产物进行酶切,酶切体系成分(20 μL)包含:1 μL内切酶,2 μL 10×buffer,10 μL PCR产物,7 μL ddH2O。将体系混匀后,置于恒温培养箱37 ℃反应4 h。然后,在65 ℃条件下水浴15 min使限制性内切酶失活,终止消化反应。之后将消化产物经ABI测序仪扫描检测,得到T-RFLP图谱。
2.4数据处理与统计分析
依据T-RFLP图谱文件(选择末端限制性片段(Terminal restriction fragments T-RFs)在50—660 bp范围内且荧光强度超过100 U的峰[24])运用Peak Scanner Software V1.0软件进行分析,将其分析结果输入T-REX程序(http://trex.biohpc.org/)进行处理,输出T-RFs类型及相对丰度的组成矩阵,将每个T-RF所占的百分比作为权重输入Primer 5.0软件进行等级多元聚类分析及非度量多维标度分析(non-metric multidimensional scaling,MDS)。基因多样性指数分析即利用Margale 指数(S)评价物种丰富度,均匀度指数(J′)计算均匀度,Shannon-weaver指数(H′)评价细菌群落综合多样性。
基于HhaⅠ、MspⅠ、RsaⅠ三种限制性内切酶消化的T-RFs类型及相对丰度组成矩阵,依据MiCA3(http://mica.ibest.uidaho.edu/)数据库,利用Phylogenetic Assignment Tool(PAT)程序(https://secure.limnology.wisc.edu/trflp/newuser.jsp)比对分析细菌菌群系统发育关系。依据比对结果构建基于属水平的0、1数据矩阵(将特定样品中出现的属定义为1,未出现的属定义为0),从而构建了样品数×RFs数(16×4646)的矩阵和样品数×属数的16×199的原始0、1数据矩阵。在数据矩阵的基础上,方差分析采用SPSS 16.0中的ANOVA方法(所有统计学显著水平指数P<0.05)。
2.5水质检测

3 结果与分析
3.1基于水位梯度的植物根际细菌群落分类和排序
基于HhaⅠ、MspⅠ、RsaⅠ三种酶切的T-RFLP图谱分类排序结果见图1和图2。聚类分析能反应样品间微生物群落结构的相似度。从图1可以看出,基于相似性系数为50%—55%对3种酶切结果分群并类,各酶切结果均表现为湿生植物三棱草根际细菌群落、挺水植物芦苇根际细菌群落、挺水植物香蒲根际细菌群落和浮叶植物睡莲根际细菌群落四大类。其次,随不同生态型植物立地水位梯度加深,其根际细菌群落相似性降低。不同酶切具有相同的结论,表明基于T-RFLP的酶切分型效果具有稳定性。

图1 基于T-RFLP图谱的植物样品根际细菌群落结构的聚类分析Fig.1 Cluster analysis of plant samples rhizosphere bacterial community structure based on T-RFLP patterns
基于3种酶切的MDS排序图的压力系数均在正常范围内,即配合度适宜。从图可以看出随着水位梯度的变化各生态型植物根际群落细菌结构具有独立的分布范围。其次,不同生态型植物根际细菌群落分布格局及其范围表现出差异性,具体表现为三棱草因其适应干湿交替的水环境波动幅度较大的立地条件而具较宽生态幅度,在排序图上具较广分布格局和范围;芦苇和香蒲在挺水界面范围内分布较为集中,在排序图上具较为相似的分布格局和范围;睡莲因其对水位深度要求较为严格使其在排序图上表现为较窄的生态幅度和分布格局。基于排序的分析结果与分类结果具一致性。

图2 植物根际细菌群落结构的MDS分析Fig.2 MDS analysis of plant rhizosphere bacteria community structure
3.2基于水位梯度的植物根际细菌群落多样性分析
3.2.1基于单一酶切的多样性分析
依据上述聚类结果,计算不同聚类菌群中T-RFs的平均丰度。在此基础上定义T-RF片段丰度值>4%的类型为优势菌群,片段丰度值<1%的类型为偶见菌群,其余为非优势菌群[25]。采用多样性指数、片段数和片段丰度3种指标描述基于水位梯度的植物根际细菌群落多样性变异(表1),并对其分析结果进行差异显著性检验。从表中多样性指数变化趋势可以看出,随水位梯度加深各植物根际细菌群落物种丰富度指数、均匀度指数、多样性指均呈递减趋势。结合不同菌群片段数和片段丰度和可知睡莲根际细菌群落不仅具有最丰富优势菌群片段数和最高优势菌群丰度和,而且具有最低的偶见菌群片段数和最低偶见菌群丰度和,二者综合作用使得睡莲根际细菌群落具最低均匀度指数。三棱草根际细菌群落因其具最低优势菌群片段数和较高偶见菌群片段数使其具最高群落均匀度指数。不同酶切类型相比较,MspⅠ较其它两种酶切类型对基于水位梯度的多样性变化更为敏感;不同多样性表征参数相比较,多样性指数较片段数及片段丰度和对基于水位梯度的多样性变化更为敏感;不同多样性指数相比较,对基于水位梯度多样性变化的敏感程度依次为物种丰富度指数、均匀度指数和综合多样性指数的减小趋势。

表1 HhaⅠ、MspⅠ、RsaⅠ三种单一酶切的植物根际细菌群落多样性分析
平均值±标准差;不同字母表示处理间差异显著性(P<0.05)
3.2.2基于多酶切综合比对的多样性分析
为进一步检验分析基于水位梯度的植物根际细菌群落多样性的变异规律,以样品数×RFs数(16×4646)数据矩阵为原始数据得到各植物根际可培养细菌与非培养细菌的酶切组合RFs结果(表2)。从表中RFs组合数在不同RFs组成类型和水位梯度控制下的不同植物类型条件下具显著差异,其中基于3种酶切的PAT比对RFs组合数量随水位梯度变异呈显著的变化趋势,即近岸带的湿生植物根际细菌RFs丰富度最高,由挺水植物向浮叶植物过度过程中植物根际细菌RFs丰富度呈减少趋势。依据可培养和非培养对3种酶切的PAT比对RFs组合进行菌种划分,采用ANOVA分析可以看出基于水位梯度变化的植物根际细菌群落多样性变化主要是由植物根际可培养细菌RFs片段数的差异引起(P<0.05);其次基于T-RFLP分析中可培养RFs片段数占到总细菌RFs片段数量4%—10%,符合可培养细菌种类低于细菌总量1%—10%的研究结果,进一步证明了基于T-RFLP方法本试验结果的可靠性。基于多酶切综合多样性分析结果可客观的反应基于水位梯度变异的湿地植物根际细菌群落结构变化规律。
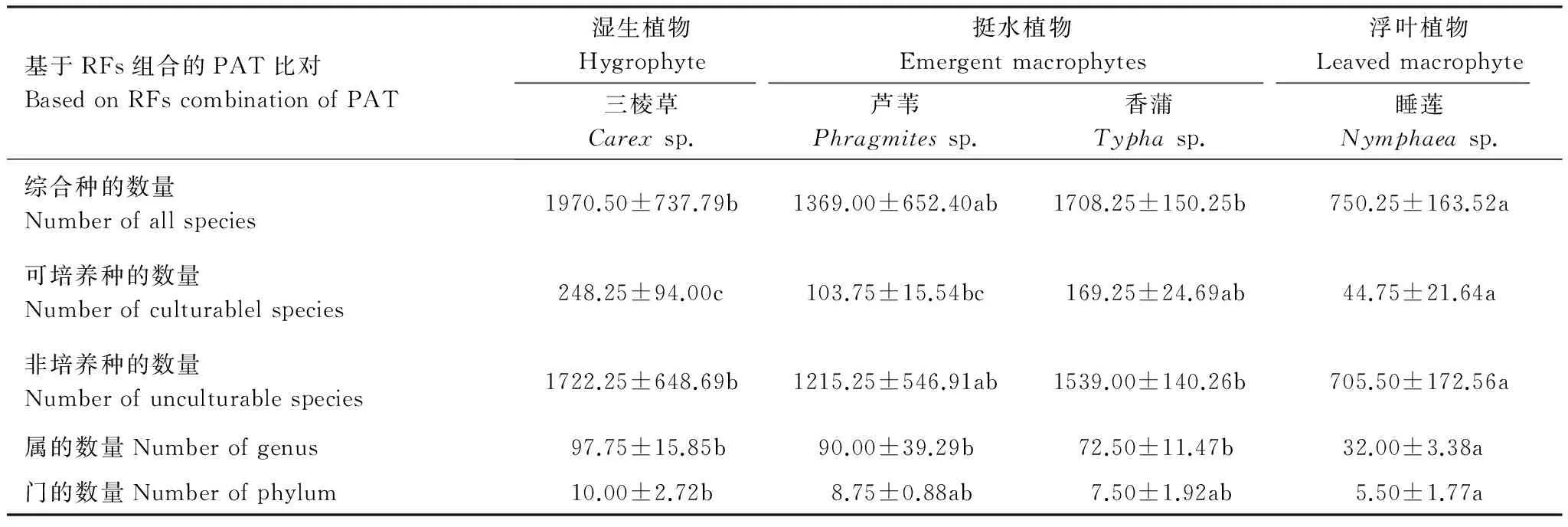
表2 基于水位梯度植物根际细菌RFs组合数量
3.3基于水位梯度变异的植物根际细菌群落组成特征分析
3.3.1基于水位梯度变异的湿地植物根际菌群差异分析
(1)基于门水平的植物根际菌群差异分析
为进一步分析基于门水平的不同水位梯度下的植物根际细菌群落多样性变异特征,以样品数×属数(16×199)矩阵和样品数×RFs数(16×4646)数据矩阵为原始数据,采用ANOVA分析对基于属数的门水平的细菌丰富度进行差异检验。属的结果表明Beta、Alpha、Gamma变形杆菌纲(β、α、γ-Proteobacteria)在不同水位梯度条件下由岸边向塘中心呈递减趋势(P<0.01),其余门类不具有统计学意义的变异特征。RFs数的结果表明Beta变形杆菌纲(β-Proteobacteria)在不同水位梯度条件下由岸边向塘中心呈现相应减少趋势(P<0.01),其余门类不具有统计学意义的变异特征。基于RFs数的门水平的细菌丰富度的差异检验与属数的分析结果具有部分相似的变化趋势,但后者分辨率低于前者。β-Proteobacteria细菌丰富度较其余门类差异性极显著,包括多种好氧或兼性细菌。

图3 不同水位梯度下基于属数(a)和RFs数(b)的门水平的植物根际细菌群落多样性条形图Fig.3 Diversity of plant rhizosphere bacterial communities in different water level gradients based on the genus numbers (a) and RFs numbers (b) ▲▲和●●分别为图a和图b中不同水位梯度下基于门水平的同一菌群在不同植物根际细菌群落结构中的极显著差异(0.01)分布
(2) 基于属水平的植物根际菌群差异分析
基于RFs片段数的属水平的菌群丰富度进行差异检验,结果表明不同水位梯度条件下Beta变形菌纲(β-Proteobacteria)中具有显著差异的属为产碱杆菌属(Alcaligenes)(P<0.01)、伯克氏菌属(Burkholderia)(P<0.01)、无色杆菌属(Achromobacter)(P<0.01)、戴尔福特菌属(Delftia)(P=0.043)、紫色杆菌属(Janthinobacterium)(P<0.01)、草螺菌属(Herbaspirllum)(P=0.027)、罗尔斯通氏菌属(Ralstonia)(P<0.01)、Pelomonas(P=0.019),且显著差异的属数随水位梯度增加呈减少趋势,其余门类中不具显著差异属。

图4 不同水位梯度下植物根际细菌群落中Beta变形杆菌纲的菌属多样性条形图Fig.4 Bar graph showing β-Proteobacteria species diversity of plant rhizosphere bacteria community based on water level gradient▲▲和▲分别为不同水位梯度下基于属水平的同一菌群在不同植物根际细菌群落结构中的极显著差异(0.01)分布和显著差异(0.05)分布
3.3.2基于优势属的植物根际细菌菌群组成特征分析
依据HhaⅠ、MspⅠ、RsaⅠ三种酶切优势片段,以T-RF片段丰度>4%的类型为优势菌群,筛选出不同水位梯度下的植物根际细菌菌群中优势菌属(表3)。从表中看出,不同水位梯度下各植物根际细菌优势属呈现数量差异,其中近岸带湿生植物三棱草根际细菌优势属数量少为3种,低于深水位其余植物根际细菌优势属数量,芦苇根际细菌优势属数量最多,同时各植物根际细菌优势属呈现类型差异,产碱杆菌属和黄杆菌属(Flavobacterium)为4种植物根际细菌群落的共有优势属,伯克氏菌属为除睡莲之外3种植物根际细菌菌群的优势属,而节杆菌属(Arthrobacter)为除3棱草之外3种植物根际细菌菌群的优势属。由于环境因素或植物根系差异导致了芦苇和睡莲根际细菌菌群中红长命菌属(Rubrivivax)和 二氧化碳嗜纤维菌属(Capnocytophaga)等特有属的出现。

表3 不同水位梯度下植物根际细菌群落可能优势属
+优势属;-未出现
3.4基于水位梯度的植物根际细菌群落与水质状况的响应关系


表4 研究区主要水质指标及水环境质量标准
4 讨论
4.1水位梯度控制下植物根际细菌群落多样性差异分析
本试验采用T-RFLP技术结合单一酶切及综合酶切结果分析不同水位深度的4种典型植物的根际细菌群落多样性差异,基于ANOVA方法检测表明基于水位梯度变化各植物根际细菌群落间多样性差异均具有统计学意义,试验结果显示,基于单一酶切不同植物间根际细菌群落的物种丰富度指数、均匀度指数及综合多样性指数均存在一定差异;综合3种酶切可见湿生植物三棱草根际细菌群落中菌种数量、属数量及门数量最多,其次为挺水植物芦苇和香蒲,睡莲所占数量最少。导致此差异结果的主要因素与水位深度、植物种类、根系泌氧及根际分泌物等生态因子有关[28]。
4.1.1水位深度对植物根际细菌群落多样性差异影响
水位深度决定了植物生长分布格局[29],而不同植物类型的根际微生物多样性会有所不同,本试验中三棱草、芦苇、香蒲和睡莲根际细菌群落多样性指数、T-RFs数量及相对丰度均存在一定差异。封晔等通过T-RFLP方法对神木县六道沟流域8种植物根际细菌群落多样性的研究结果表明,8种植物根际细菌数量和大小均表现出一定差异[30]。赵庆节等采用PCR-DGGE方法对不同植物人工湿地土壤微生物特性研究同样指出芦苇与香蒲根际土壤微生物多样性存在差异,且芦苇高于香蒲[31]。同时水位条件直接影响水中基质氧的可利用率、气体扩散率[32],进而影响植物根系的生长及微生物活性。随水位深度增加,基质中含氧量减少,降低了水体及基质中有机污染物降解效率[33],导致有机负荷的相对增加带来微生物多样性的减少[34],本文4种植物中三棱草根际细菌群落多样性最丰富,可能由于三棱草地处干湿交替的水分环境,人工基质疏松,含氧量充足,有助于提高植物根际氧气利用率,促进基质中硝化作用与反硝化作用的偶联,加速营养物质分解,减少基质中有机负荷,增加细菌生长繁殖速率,促使其根际细菌多样性增加。冯胜等认为细菌群落多样性与水体营养水平呈负相关性[35]。同理可解释随水位深度增加,芦苇、香蒲、睡莲根际细菌多样性在属水平上呈减少趋势。武钰坤等对人工湿地芦苇和香蒲根际微生物群落多样性的研究结果表明,芦苇根际微生物具有最多的常见物种及最大的物种均匀性[36]。可见,水位深度变化会通过影响植物类型及饱和基质的含氧量来改变微生物活性[32],间接影响湿地植物间根际环境细菌群落多样性。
4.1.2水位梯度控制下植物根际微环境对其根际细菌群落多样性差异影响
根际微生物群落结构多样性受宿主植物的影响,可能是由于不同植物类型形成独特的根际微环境,如植物根际泌氧、分泌物等对细菌具有趋化、富集作用[37],会导致不同植物间根际细菌群落种类及数量的变化,使微生物多样性与宿主植物呈现专一性[30]。本文中基于水位梯度植物根际细菌RFs组合数量,湿生植物三棱草综合种的数量最多,其次为挺水植物芦苇和香蒲,睡莲最少。原因是湿地植物具有根系生物量大及通气组织发达等特点,增加植物根在饱和基质中的输氧能力。植物根际泌氧在根际还原态介质中形成氧化态的区域环境[38],促使根际形成好氧微生物生存的微氧环境[39]。根际泌氧能力与植物根系生物量及通气组织呈正相关关系[40-41],且根际泌氧速率因不同植物种类存在差异,导致植物根际土壤性质发生明显变化[6,42],从而形成根际微生物群落多样性差异。研究表明,5月份和8月份芦苇根系生物量增幅均高于香蒲[43],且芦苇的泌氧能力高于香蒲[44],同时根茎型湿地植物根系生物量显著高于须根型湿地植物[45],由此进一步说明,三棱草、芦苇(根茎型)根际细菌群落属数量及门数量均高于香蒲、睡莲(须根型)。
基于属水平的植物根际细菌群落间存在一定差异,显著差异属主要包括产碱杆菌属、伯克氏菌属、无色杆菌属、戴尔福特菌属、紫色杆菌属、草螺菌属、罗尔斯通氏菌属和Pelomonas,其中产碱杆菌属为专性好氧,紫色杆菌属为兼性好氧,伯克氏菌属、罗尔斯通菌属为好氧,其它均为微好氧[46],这些属的分布程度均随水位梯度加深呈递减趋势,且均与植物根泌氧能力呈正相性。不同水位梯度下植物根际细菌群落可能优势属产碱杆菌属、黄杆菌属、伯克氏菌属及节杆菌属均以好氧菌为主,符合人工湿地优势属的分布特征[47]。
植物根际分泌的有机、无机化合物是刺激根际微生物繁殖的重要能源和养分源[5],其中脂肪族和芳香族的碳氢化合物、氨基酸及糖类物质的改变会直接影响根际分泌物的种类和数量,间接影响不同植物根际间微生物的种类及数量[48],且细菌较真菌、放线菌等对植物根际分泌物具更高的敏感性及利用率[7]。植物根际分泌物对根际微生物的作用是松散的、非特异性的,主要是促进革兰氏阴性无芽胞杆菌在根际的聚积[49],本文中各植物根际优势属产碱杆菌属和黄杆菌属均为革兰氏阴性无芽胞杆菌[50],且随水位梯度加深呈丰富度减少趋势。产碱杆菌属可利用不同有机酸和氨基酸作为碳源,伯克氏菌属可氧化分解单糖、双糖、多糖,并可利用作为唯一碳源。唐利等利用连续收集装置对芦苇和香蒲根际分泌物比较分析结果表明,香蒲根际微生物数量多于芦苇[51]。不同水位梯度植物根际优势属出现共性及细菌群落相似性特征,这可能与该4种植物间根际微环境的相似性,促使其根际细菌群落结构呈现相似性。
4.2湿地植物根际细菌群落组成特征与水环境质量的关系

5 结论
本研究采用T-RFLP技术分析水位梯度控制下湿地植物根际细菌群落多样性特征,并结合ANOVA解释了植物间根际细菌群落多样性差异,通过实验结果统计分析得出:(1)文中选取HhaⅠ、MspⅠ、RsaⅠ三种不同酶切产生结果一致,均为随水位梯度加深各植物生态幅逐渐变窄,根际细菌群落多样性逐渐减少,且基于3种酶切的PAT比对RFs组合数量随水位梯度变化呈相应变化趋势,其差异结果主要是由植物根际可培养细菌RFs片段数的变异引起。(2)不同水位梯度控制下各生态型植物根际的Beta变形杆菌纲中属水平的菌群丰富度随水位梯度增加而减少,且差异性显著,产碱杆菌属、伯克氏菌属、无色杆菌属、戴尔福特菌属、紫色杆菌属、草螺菌属、罗尔斯通氏菌属和Pelomonas均为好氧菌,其丰富度可能与各植物根系泌氧能力密切相关。湿生植物泌氧能力最强的三棱草根际属水平的菌群丰富度最高,其次为芦苇、香蒲,最少为睡莲。(3)水位梯度控制下四种植物根际细菌群落的多数优势属属于变形杆菌门,是脱氮除磷的功能性菌门,其中产碱杆菌属和黄杆菌属为四种植物根际细菌共同优势属,在碳氮循环中起重要作用,有助于人工湿地水体净化。
[1]Mausbach Maurice J, Parker W Bblake. Background and history of the concept of hydric soils // Richardson J L, Vepraskas M J, eds. Wetland Soils: Genesis, Hydrology, Landscapes, and Classification. New York: Lewis Publishers, 2001: 19-33.
[2]曹优明, 戴涛. 菖蒲人工湿地对煤矿废水中镉的处理研究. 工业水处理, 2012, 32(7): 43-45.
[3]van Oostrom A J. Nitrogen removal in constructed wetlands treating nitrified meat processing effluent. Water Science and Technology, 1995, 32(3): 137-147.
[4]李海燕, 王金成, 梁健. 辽东栎与油松根际土壤微生物群落结构比较研究. 土壤通报, 2010, 41(6): 1360-1364.
[5]李稹, 黄娟, 姜磊, 徐文杰, 王其东, 陈曦. 人工湿地植物根系分泌物与根际微环境相关性的研究进展. 安全与环境学报, 2012, 12(5): 41-45.
[6]Colmer T D. Long-distance transport of gases in plants: a perspective on internal aeration and radial oxygen loss from roots. Plant, Cell & Environment, 2003, 26(1): 17-36.
[7]李潞滨, 刘敏, 杨淑贞, 刘亮, 缪崑, 杨凯, 韩继刚. 毛竹根际可培养微生物种群多样性分析. 微生物学报, 2008, 48(6): 772-779.
[8]Jessica L M Gutknecht, Robert M Goodman, Teri C Balser. Linking soil process and microbial ecology in freshwater wetland ecosystems. Plant and Soil, 2006, 289(1/2): 17-34.
[9]王海洋, 陈家宽, 周进. 水位梯度对湿地植物生长、繁殖和生物量分配的影响. 植物生态学报, 1999, 23(3): 269-274.
[10]M Scott Smith, James M Tiedje. Phases of denitrification following oxygen depletion in soil. Soil Biology and Biochemistry, 1979, 11(3): 261-267.
[11]Coles Janice R P, Yavitt Joseph B. Linking belowground carbon allocation to anaerobic CH4and CO2production in a forested peatland, New York State. Geomicrobiology Journal, 2004, 21(7): 445-455.
[12]Qiu S, McComb A J. Drying-induced stimulation of ammonium release and nitrification in reflooded lake sediment. Marine and freshwater Research, 1996, 47(3): 531-536.
[13]Tillmann Lueders, Michael W Friedrich. Evaluation of PCR amplification bias by terminal restriction fragment length polymorphism analysis of small-subunit rRNA andmcrAgenes by using defined template mixtures of methanogenic pure cultures and soil DNA extracts. Applied and Environmental Microbiology, 2003, 69(1): 320-326.
[14]Terence L Marsh. Terminal restriction fragment length polymorphism (T-RFLP): an emerging method for characterizing diversity among homologous populations of amplification products. Current Opinion in Microbiology, 1999, 2(3): 323-327.
[15]李献梅, 王小芬, 崔宗均. 末端限制性片段长度多态性技术(T-RFLP)在微生物群体分析上的应用与技术优化. 中国农业大学学报, 2009, 14(4): 1-9.
[16]吕雪莲, 刘维达. T-RFLP在医学微生态研究中的应用. 中国微生态学杂志, 2009, 21(3): 282-284.
[17]滕齐辉, 曹慧, 崔中利, 王英, 孙波, 郝红涛, 李顺鹏. 太湖地区典型菜地土壤微生物16S rDNA的PCR-RFLP分析. 生物多样性, 2006, 14(4): 345-351.
[18]Gesche Braker, Héctor L Ayala-del-Ríoé, Allan H Devol, Andreas Fesefeldt, James M Tiedje. Community Structure of Denitrifiers,Bacteria, andArchaeaalongRedox Gradients in Pacific Northwest Marine Sediments by Terminal Restriction Fragment Length Polymorphism Analysis of Amplified Nitrite Reductase (nirS) and 16S rRNA Genes. Applied Environmental Microbiology, 2001, 67(4): 1893-1901.
[19]段永红, 王铭, 孙毅, 杨武德. 高粱甲基化连锁群A、B的构建及甲基化位点、甲基化模式的分析. 中国农业科学, 2012, 45(18): 3699-3708
[20]Dunbar J, Ticknor L O, Kuske C R. Phylogenetic Specificity and Reproducibility and New Method for Analysis of Terminal Restriction Fragment Profiles of 16S rRNA Genes from Bacterial Communities. Applied Environmental Microbiology, 2001, 67(1): 190-197.
[21]储昭瑞, 李相昆, 孟令威, 张杰. T-RFLP技术在厌氧氨氧化菌群结构分析中的应用. 哈尔滨工业大学学报, 2013, 45(2): 26-30.
[22]黄艺, 舒中亚. 基于滇池流域浮游细菌生物完整性指数的河流生态系统健康评价——以滇池流域为例. 环境科学, 2013, 34(8): 3010-3018.
[23]Ding T, Michael W Palmer, Ulrich Melcher. Community terminal restriction fragment length polymorphisms reveal insights into the diversity and dynamics of leaf endophytic bacteria. BMC microbiology, 2013, 13(1): 1471-2180.
[24]Osborn A Mark, Moore Edward R B, Timmis Kenneth N. An evaluation of terminal-restriction fragment length polymorphism (T-RFLP) analysis for the study of microbial community structure and dynamics. Environmental Microbiology, 2000, 2(1): 39-50.
[25]Zhang R, Thiyagarajan Vengatesen, Qian P T. Evaluation of terminal-restriction fragment length polymorphism analysis in contrasting marine environments. FEMS Microbiology Ecology, 2008, 65(1): 169-178.
[26]吕明姬, 汪杰, 范铮, 黄艺. 滇池浮游细菌群落组成的空间分布特征及其与环境因子的关系. 环境科学学报, 2011, 31(2): 299-306.
[27]李智. 富氮污染水体微生物激活剂的研究与应用[D]. 武汉: 华中农业大学, 2013.
[28]George A Kowalchuk, Douwe S Buma, Wietse de Boer, Peter G L Klinkhamer, Johannes A.van Veen. Effects of above-ground plant species composition and diversity on the diversity of soil-borne microorganisms. Antonie van Leeuwenhoek, 2002, 81(1/4): 509-520.
[29]魏华, 成水平, 吴振斌. 水文特征对水生植物的影响. 现代农业科技, 2010, (7): 13-16.
[30]封晔, 唐明, 陈辉, 丛伟. 黄土高原六道沟流域8种植物根际细菌与AMF群落多样性研究. 环境科学, 2012, 33(1): 314-322.
[31]赵庆节. 种植不同植物的人工湿地土壤微生物群落研究. 上海交通大学学报(农业科学版), 2011, 29(3): 47-52.
[32]方忠梅. 水位对小叶章湿地 CO2、CH4排放及土壤微生物活性的影响. 生态环境学报, 2013, 22(3): 465-468.
[33]程香菊, 陈永灿, 袁丽蓉, 赵文谦. 水体大气复氧能力研究综述. 科技导报, 2008, 26(17): 89-91.
[34]于凤庆. 不同有机负荷条件下活性污泥微生物群落结构的演替分析[D]. 天津: 天津大学, 2012.
[35]冯胜, 秦伯强, 高光. 细菌群落结构对水体富营养化的响应. 环境科学学报, 2007, 27(11): 1823-1829.
[36]武钰坤, 刘永军, 司英明, 熊家晴, 王晓昌. 人工湿地不同植物根际微生物群落多样性比较研究. 生态科学, 2012, 31(3): 318-323
[37]Heinrich D, Hess D. Chemotactic attraction ofAzospirillumlipoferumby wheat roots and characterization of some attractants. Canadian Journal of Microbiology, 1985, 31(1): 26-31.
[38]邓泓, 叶志鸿, 黄铭洪. 湿地植物根系泌氧的特征. 华东师范大学学报: 自然科学版, 2007, (6): 69-76.
[39]Gilbert Bettina, Fenzel Peter. Rice roots and CH4oxidation: the activity of bacteria, their distribution and the microenvironment. Soil Biology and Biochemistry, 1998, 30(14): 1903-1916.
[40]Norio Tanaka, Kentaro Yutani, Thidar Aye, K B S N Jinadasa. Effect of broken dead culms ofPhragmitesaustralison radial oxygen loss in relation to radiation and temperature. Hydrobiologia, 2007, 583(1): 165-172.
[41]刘志宽, 牛快快, 马青兰, 白晓华, 苏刘选. 8种湿地植物根部泌氧速率的研究. 贵州农业科学, 2010, 38(4): 47-50.
[42]Visser E J W, Colmer T D, Blom C W P M, Voesenek L A C J. Changes in growth, porosity, and radial oxygen loss from adventitious roots of selected mono-and dicotyledonous wetland species with contrasting types of aerenchyma. Plant Cell & Environment, 2000, volume 23(11):1237-1245(9).
[43]赵建刚, 杨琼, 陈章和, 黄正光. 几种湿地植物根系生物量研究. 中国环境科学, 2003, 23(3): 290-294.
[44]吴海明, 张建, 李伟江, 张波. 人工湿地植物泌氧与污染物降解耗氧关系研究. 环境工程学报, 2010, 4(9): 1973-1977.
[45]陈文音, 陈章和, 何其凡, 汪晓燕, 王才荣, 陈达丰, 赖增隆. 两种不同根系类型湿地植物的根系生长. 生态学报, 2007, 27(2): 450-458.
[46]东秀珠, 蔡妙英. 常见细菌系统鉴定手册. 北京: 科学出版社, 2001: 1-419.
[47]李科得, 胡正嘉. 芦苇床系统净化污水的机理. 中国环境科学, 1995, 15(2): 140-144.
[48]Liao M, Xie X M. Effects of combination of plant and microorganism on degradation of simazine in soil. Journal of Environmental Sciences, 2008, 20(2): 195-198
[49]申建波, 张福锁. 根分泌物的生态效应. 中国农业科技导报, 1999, 1(4): 21-27.
[50]娄丹. 不常见的革兰氏阴性无芽胞杆菌的鉴定. 微生物学免疫学译刊, 1980, (4): 56-58.
[51]唐利, 杨奇, 邱江平, 李旭东. 芦苇、香蒲根际分泌物及其根际效应比较分析. 哈尔滨商业大学学报(自然科学版), 2010, 26(4): 425-429.
[52]Bernard R Glick, Damir M Karaturovíc, Peter C Newell. A novel procedure for rapid isolation of plant growth promoting pseudomonads. Canadian Journal of Microbiology, 1995, 41(6): 533-536.
[53]汪仲琼, 王为东, 祝贵兵, 尹澄清. 人工和天然湿地芦苇根际土壤细菌群落结构多样性的比较. 生态学报, 2011, 31(16): 4489-4498.
[54]Wießner A, Kappelmeyer U, Kuschk P, Kästner M. Influence of the redox condition dynamics on the removal efficiency of a laboratory-scale constructed wetland. Water Research, 2005, 39(1): 248-256.
[55]张淑香, 高子勤. 连作障碍与根际微生态研究Ⅱ.根系分泌物与酚酸物质. 应用生态学报, 2000, 11(1): 152-156.
[56]江月, 周建刚, 邹煜平, 刘德立. 一种有固氮能力的节杆菌菌株的分离和初步鉴定. 华中师范大学学报(自然科学版), 2004, 38(2): 210-214.
[57]Krakat Niclas, Schmidt Stefan, Scherer Paul. Potential impact of process parameters upon the bacterial diversity in the mesophilic anaerobic digestion of beet silage. Bioresource Technology, 2011, 102(10): 5692-5701.
[58]魏成, 刘平. 人工湿地污水净化效率与根际微生物群落多样性的相关性研究. 农业环境科学学报, 2008, 27(6): 2401-2406.
[59]Antonio Gelsomino, Anneke Keijzer-Wolters C, Giovanni Cacco, Jan Dirk van Elsas. Assessment of bacterial community structure in soil by polymerase chain reaction and denaturing gradient gel electrophoresis. Journal of Microbiological Methods, 1999, 38(1/2): 1-15.
[60]张力, 金卫红, 高锋. 空心莲子草和三棱草对海岛高含盐河道水质净化效果的研究. 浙江海洋学院学报(自然科学版), 2012, 31(4): 325-328.
[61]刘霄, 唐婷芳子, 黄岁樑, 刘学功. 4 种湿地植物的生长特性和污水净化效果研究. 云南农业大学学报, 2013, 28(3): 392-399.
[62]卢晓明, 赵丰, 陈建军, 张勇, 黄民生. 睡莲与梭鱼草的生理特性及脱氮除磷比较. 武汉理工大学学报, 2009, 31(23): 44-47.
Analysis of the characteristics of rhizosphere bacterial diversity from plants with different water level gradients based on T-RFLP
ZHANG Qiongqiong, HUANG Xingru, GUO Xiaoyu*
CollegeofResourcesEnvironmentandTourism,CapitalNormalUniversity,Beijing100048,China
To elucidate rhizosphere bacterial diversity from plants with different water level gradients, we examined bacterial diversity in Beijing Olympic Park plant oxidation pond, an artificial wetland. The rhizosphere bacterial diversities forCarexphacotaspr.,Phragmitescommunis,Typhaorientalis, andNymphaeatetragonagrown in plants with different water levels were compared based on terminal restriction fragment length polymorphism (T-RFLP) analysis combined with analysis of variance (ANOVA). Our results showed that rhizosphere bacterial diversity decreased with increasing water levels. Different restriction enzymes, i.e.,HhaI,MspI, andRsaI, yielded the same digestion results. By combing results from digestion with these three restriction enzymes, RF combination numbers from PAT alignment also decreased with increasing water levels, consistent with the results of single restriction enzyme digestion. Further analysis showed that RF numbers in cultured rhizosphere bacteria changed significantly with the increase in water level; in contrast, the RF numbers of uncultured bacteria did not change significantly. Under different water gradients,β-Proteobacteriaexhibited the most significant variations among the four plants, possibly because the increase in water level may have reduced the abilities of the different plants to secrete oxygen, thereby affecting the survival of plant rhizosphere aerobic bacteria. The triangular had the highest number of rhizosphere bacterial genera, followed by reeds, cattails, and finally water lilies. The abundances of the aerobic bacteriaAlcaligenessp.,Burkholderiasp.,Achromobactersp.,Delftiasp.,Janthinobacteriumsp.,Herbaspirllumsp.,Ralstoniasp., andPelomonassp. were probably related to the capacity of plant roots to secrete oxygen. Moreover, the oxygen-secreting capacity of rhizospheres and root exudates varied because wetland plants with different water level gradients exhibited different growth conditions and metabolic activities, affecting rhizosphere bacteria growth and reproduction. The most dominant organisms in the rhizosphere bacterial communities of these four plants wereProteobacteria, which function in the removal of nitrogen and phosphorus. The common dominant genera among these rhizosphere bacteria wereAlcaligenesandFlavobacterium, which play important roles in carbon and nitrogen cycles and contribute to wetland water purification.
water level gradient; wetland plant; bacterial diversity; T-RFLP
国家自然科学基金项目(40901281);北京市教育委员会科技计划面上项目(KM201310028012)
2014-12-18;
2015-06-15
Corresponding author.E-mail: xiaoyucnu@126.com
10.5846/stxb201412182516
张琼琼, 黄兴如, 郭逍宇.基于T-RFLP技术的不同水位梯度植物根际细菌群落多样性特征分析.生态学报,2016,36(14):4518-4530.
Zhang Q Q, Huang X R, Guo X Y.Analysis of the characteristics of rhizosphere bacterial diversity from plants with different water level gradients based on T-RFLP.Acta Ecologica Sinica,2016,36(14):4518-4530.

