陕西省部分地区猪伪狂犬病病毒分离鉴定及其gE基因遗传变异分析
方 琳,朱 辉,李 烨,张思远,彭 特,叶贺佳
(广州市华南农大生物药品有限公司,广东广州 511300)
陕西省部分地区猪伪狂犬病病毒分离鉴定及其gE基因遗传变异分析
方琳,朱辉,李烨,张思远,彭特,叶贺佳
(广州市华南农大生物药品有限公司,广东广州 511300)
为了解2015年陕西省猪伪狂犬病(PR)流行情况和病毒遗传变异特点,采集不同地区28份疑似PR发病猪场的病料进行PCR检测,采用鸡胚绒毛尿囊膜接种和BHK-21细胞培养分离PRV,应用生物信息学方法分析主要毒力基因gE遗传变异特征。结果显示,从28份PRV疑似病料中检测出7份PRV阳性样品,分离出7株PRV地方株。陕西分离毒株与目前国内的流行毒株同源性较高,且在同一进化分支内,与欧美分离株同源性较低,亲缘关系相对较远。其中4个分离毒株具有变异株的典型分子特征,即773 bp~775 bp CGA的特征性插入,另3个分离毒株则与经典参考毒株Ea株和GDSH株位于1个相对独立的分支;SX01株和SX03株抗原表位发生改变,SX03株O-GalNAc糖基化位点缺失,SX04株在1个抗原表位增加了1个潜在的O-GalNAc糖基化位点。表明陕西省PRV gE基因在分子水平上发生了变异,核酸演化上发生了相对独立的进化,氨基酸序列的突变对其抗原表位和糖基化位点产生了影响。
猪伪狂犬病病毒;gE基因;遗传变异;生物信息学
猪伪狂犬病(Porcine pseudorabies,PR) 是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的传染病,临床症状以新生仔猪腹泻及神经症状,妊娠母猪流产、死胎等繁殖障碍,成年猪隐性感染,长期带毒排毒为特征[1]。PRV可感染多种家畜、家禽和野生动物。猪是该病的自然宿主和主要传染源,各年龄段均可感染,15日龄以内仔猪病死率可达100%,断奶仔猪发病率40%、病死率20%左右,成年育肥猪感染后可引起生长停滞和增重缓慢等症状[2-3],给我国养猪业造成了巨大的经济损失。
弱毒疫苗或gE基因缺失疫苗免疫接种是控制猪伪狂犬病的重要措施[4-5]。但自2011年以来,在我国多个使用PRV基因缺失疫苗免疫的规模化猪场暴发了疑似猪伪狂犬病的流行,发病率和病死率明显上升。现有研究指出,在不同省份分离出的PRV变异株[6-12],与以前的流行株相比,新流行株免疫保护性抗原的抗原性可能已发生变异,从而导致现有疫苗不足以提供完全保护[13-15]。据此,本研究对2015年间陕西铜川、兴平、渭南、榆林、韩城、安康等地疑似PRV感染发病猪场采集的28份临床疑似病料进行了PCR检测和病毒分离,比较了其主要毒力基因gE的遗传变异特点,探讨陕西省部分地区PRV的分子流行病学及遗传进化情况,以期为该病的防控提供参考。
1 材料与方法
1.1材料
1.1.1病料28份临床疑似病料来源于2015年从陕西铜川、兴平、渭南、榆林、韩城、安康等地疑似PRV感染发病猪场中采集的脑和肺部病变组织,置-20 ℃保存备用。
1.1.2细胞BHK-21细胞由广州市华南农大生物药品有限公司病毒学实验室保存。
1.1.3主要试剂DNA提取试剂盒、LaTaqDNA聚合酶、pMD19-T载体、DNA Marker DL 2 000,TaKaRa公司产品;胶回收试剂盒,Tiangen公司产品;细胞培养基MEM、新生牛血清、胰酶均,Gibco公司产品。
1.2方法1.2.1引物的设计与合成根据GenBank上发表的PRV gE基因序列,利用引物设计软件 Premier5.0设计1对引物,鉴定引物P1和P2用于扩增gE基因,目的片段长度为990 bp,引物由Invitrogen公司合成。
P1:5′-CTTCCACTCGCAGCTCTTCT-3′
P2:5′-GTCACTTCCGGTTTCTCCGG-3′
1.2.2病料样品的PCR检测将病料解冻,研磨制成匀浆液,冻融3次后离心,取上清液,参照核酸提取试剂盒说明书方法提取DNA。以提取的DNA为模板进行PCR扩增,25 μL PCR扩增反应体系为:DNA 模板2 μL,2× GC buffer Ⅰ12.5 μL,dNTP Mixture (2.5 mmol/L) 4 μL,上游引物0.5 μL,下游引物0.5 μL,LATaqDNA polymerase (5 U/μL) 0.5 μL,用ddH2O补至25 μL。反应程序为:95 ℃ 5 min;94 ℃ 1 min,60 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR产物用10 g/L琼脂糖凝胶电泳检测。
1.2.3病毒的分离与培养
1.2.3.1鸡胚绒毛尿囊膜接种将PCR鉴定为阳性的病料上清液,加入双抗,4 ℃作用12 h,经0.22 μm滤器过滤除菌后分别接种到9日龄~11日龄SPF鸡胚绒毛尿囊膜上,弃24 h内死亡鸡胚,每日观察鸡胚死亡情况,72 h仍未死亡的鸡胚收集置4 ℃冰箱过夜,观察绒毛尿囊膜病变,并将收集的绒毛尿囊膜经研磨制成匀浆液,冻融3次,离心,取上清液经0.22 μm滤器过滤除菌后,置-20 ℃冻存备用。
1.2.3.2BHK-21细胞接种和传代取1.2.3.1中的无菌上清液接种BHK-21单层细胞进行培养,37 ℃吸附1 h后弃上清,加入适量维持液继续培养,逐日观察细胞病变(CPE)。待CPE达70%以上时收获病毒,并在BHK-21细胞上连续培养传至第5代。培养过程中同时设立不接毒的细胞培养物作为阴性对照。
1.2.4PRV gE基因的扩增与测序采用gE基因特异性引物,以提取的病毒分离株细胞培养物的DNA为模板,对gE基因进行PCR扩增(方法同1.2.2),并将扩增产物克隆到pMD19-T载体中进行序列测定。
1.2.5PRV gE基因序列分析将测定的序列在NCBI中进行Blast比对,确定其为PRV gE 基因序列后,利用生物学分析软件DNA Star和Mega6.0,将分离株及GenBank中登录的17个经典毒株和2012年-2015年全国不同省份分离的21个PRV变异株的gE基因核苷酸和氨基酸序列进行比对,分析分离毒株的序列特征并构建系统进化树。
1.2.6氨基酸序列分析 将测定的核酸序列进行多序列比对后,转化为氨基酸序列。使用Predicted Antigenic Peptides程序预测抗原表位,YinOYang和NetOGlyc程序预测糖基化位点。
2 结果
2.1病料的PCR检测结果
gE糖蛋白是PRV的主要毒力因子之一,并作为标志基因用来区分疫苗免疫和野毒感染[16-17]。为鉴定在陕西各地采集的临床疑似PRV感染病料是否存在野毒感染情况,本研究将28份病料分别研磨制成匀浆液,提取DNA,以提取的DNA为模板,采用PRV特异性gE检测引物进行PCR扩增。结果28份病料中有7份扩增出了约990 bp大小的条带,与预期扩增片段大小相符,说明临床采集的28份病料中有7份病料为PRV阳性。将扩增的7份阳性检测样品一起进行琼脂糖凝胶电泳,结果如图1所示。
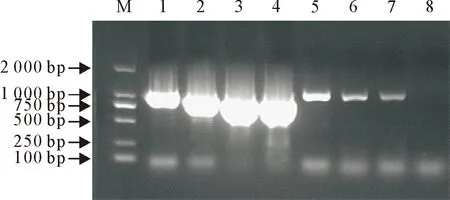
M.DNA标准DL 2 000; 1~7.病料中PRV的PCR扩增产物;8.阴性对照
M.DNA Marker DL 2 000; 1-7.PCR products of PRV from samples; 8.Negative control
图1病料中PRV的PCR扩增结果
Fig.1PCR amplification of PRV from tissue samples
2.2病毒的分离与鉴定
2.2.1鸡胚绒毛尿囊膜接种结果将PCR鉴定为阳性的7份病料上清液过滤除菌后接种SPF鸡胚,于接种后72 h肉眼可见绒毛尿囊膜增厚,表面出现较大隆起的灰白色痘疱样病变,对照组鸡胚绒毛尿囊膜未见异常(图2)。
2.2.2BHK-21细胞CPEPRV具有广泛的细胞嗜性,可在PK-15、IBRS-2、BHK-21、Hela、SK6、MDCK、牛肾原代细胞及鸡胚成纤维细胞等细胞中增殖,病毒毒力不同可导致细胞病变稍有差异,但均具有合胞体这一典型的细胞病变。本研究将2.2.1的病料上清液接种BHK-21细胞,有2株PRV在第1代观察到典型CPE,其他5株在第3代观察到典型CPE。PRV连续培养传至第5代,与对照未接种细胞相比,BHK-21细胞在接种后的24 h~48 h变圆、收缩、细胞间界限消失、融合、形成合胞体(图3),而对照细胞界限明显,呈均匀致密的单层。随着在相应细胞中传代次数的增多,典型CPE出现时间从第1代的60 h~72 h左右缩短至24 h~48 h。
2.3PRV gE基因的扩增与测序
采用gE基因特异性引物,以提取的病毒分离株细胞培养物的DNA为模板,对gE基因进行PCR扩增。琼脂糖凝胶电泳结果显示,7个分离毒株均扩增出了约990 bp的条带(图4),与预期扩增片段大小相符。将回收的PCR产物纯化后连接于pMD19-T载体中,送Invitrogen公司进行测序。测序结果显示,有4个分离毒扩增片段的大小为990 bp,共编码330个氨基酸,分别命名为SX01、SX03、SX05、SX-SQ。另外3个分离毒扩增片段的大小为987 bp,共编码329个氨基酸,分别命名为SX02、SX04、SX-XP。将测定的序列在NCBI中进行BLAST比对,确定其为PRV gE基因,说明从病料中分离出了PRV野毒株。
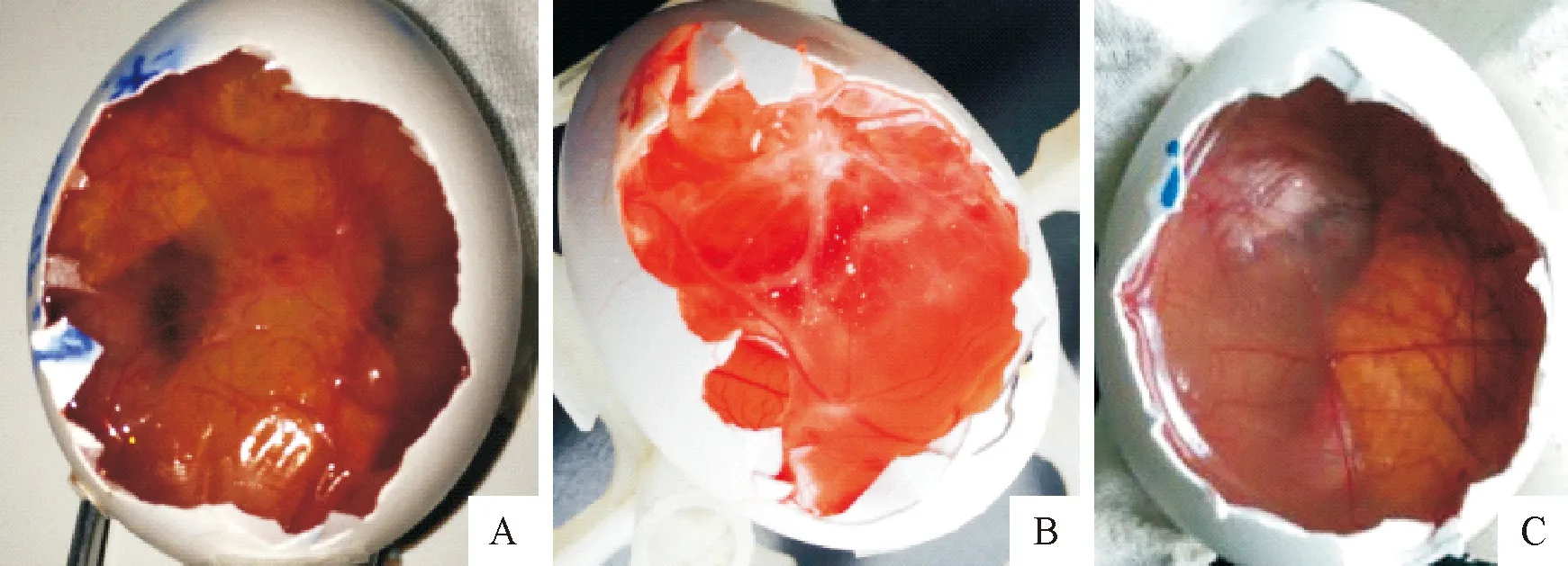
A,B.接种后72 h痘疱样病变;C.对照(72 h)
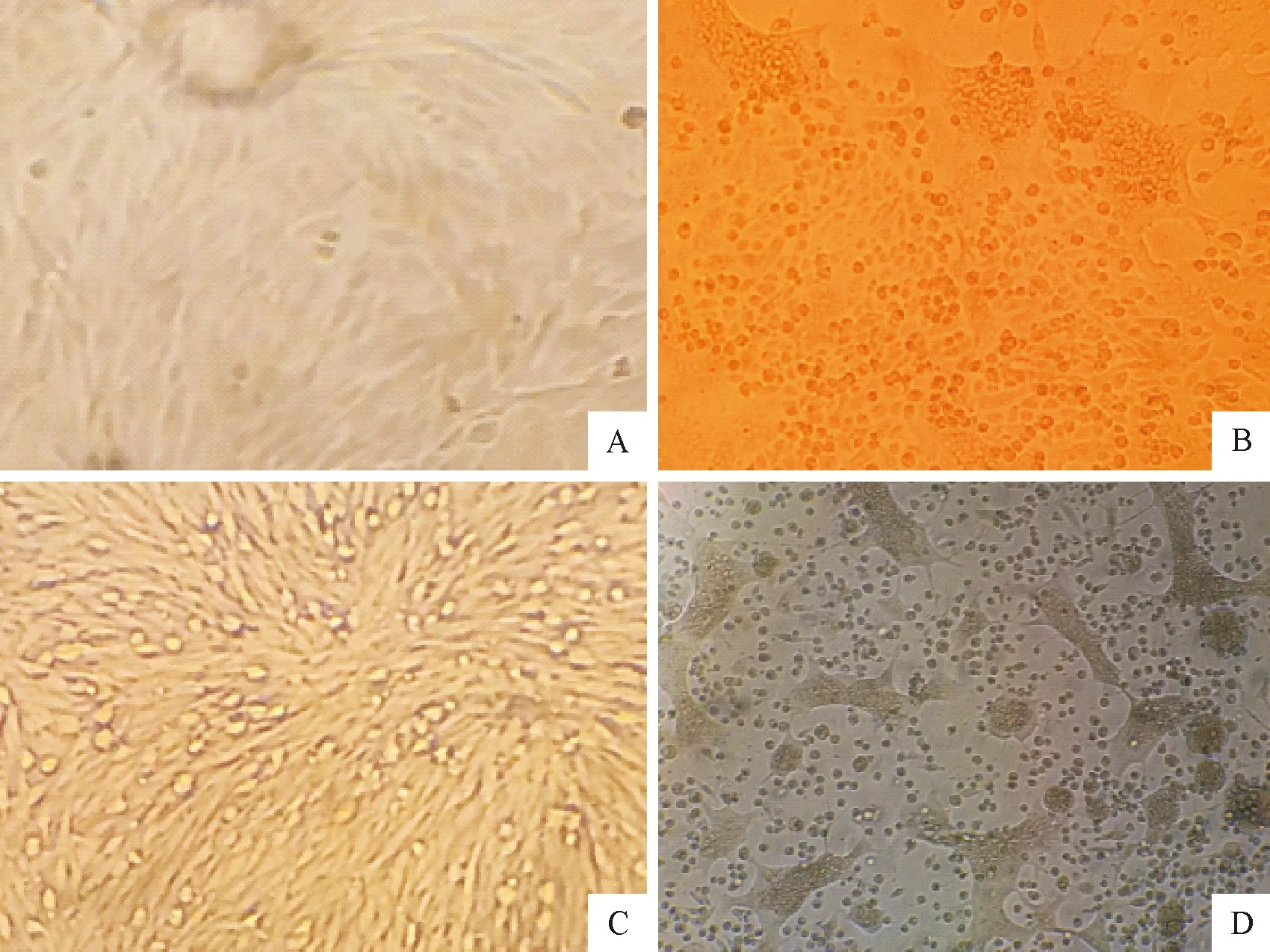
A.对照(24 h);B.接毒后24 h细胞病变;C.对照(48 h);D.接种后48 h左右细胞病变
A.BHK-21 cells in control group(24 h);B.CPE of BHK-21 cells(24 h);C.BHK-21 cells in control group(48 h);D.CPE of BHK-21 cells(48 h)
图3PRV陕西株感染BHK-21细胞产生的病变情况(100×)
Fig.3Cytopathogenic effects of BHK-21 cells infected with PRV Shaanxi strains(100×)
2.4PRV gE基因及推导的氨基酸序列分析
将7个陕西分离毒株与GenBank登录的38株PRV参考毒株的gE基因核苷酸及推导的氨基酸序列的相似性进行比较。结果显示,陕西各分离毒株之间的核苷酸和氨基酸序列的同源性分别为98.7%~99.8%和97.3%~100%;与2012年以来国内不同省份陆续分离的GD01(2015)、JS(2015)、TJ(2014)等21株PRV变异株的核苷酸和氨基酸序列的同源性分别为98.3%~99.8%和96.4%~99.7%;而与Ea、Min-A、Kaplan、Becker等经典参考株的核苷酸和氨基酸序列同源性分别为97.4%~100%和95.1%~100%。其中,分离毒SX02和SX-XP与参考毒株Ea和GDSH gE基因的氨基酸同源性高达100%。gE基因及推导的氨基酸序列比对结果说明,7个陕西分离毒株彼此间同源性较高,与2012年以来国内不同省份分离的PRV变异株同源性相对较高,而与Becker、CL-15、Kaplan、Rice等经典参考毒株的同源性相对较低。
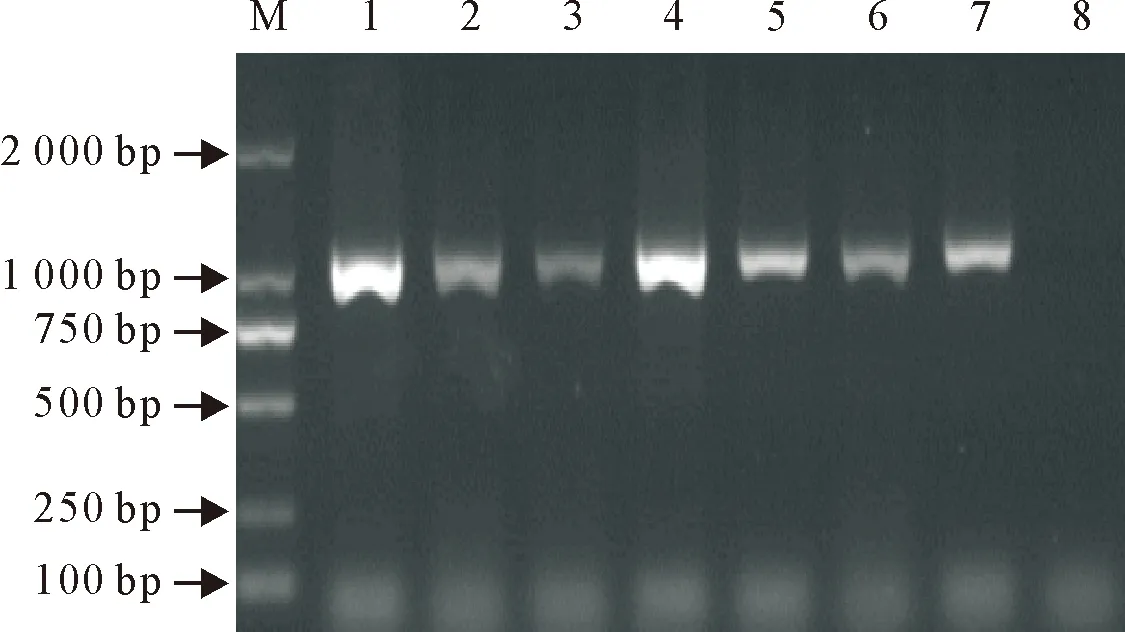
M.DNA标准DL 2 000; 1~7.PRVgE基因扩增产物;8.阴性对照
M.DNA Marker DL 2 000; 1-7.PCR products of PRV gE gene; 8.Negative control
图4PRV gE基因扩增结果
Fig.4PCR amplification of PRV gE gene
与经典参考毒株相比,SX01、SX03、SX05、SX-SQ 4株分离毒的gE基因核苷酸序列中存在3个连续碱基的插入,即773 bp~775 bp CGA的插入,导致编码的氨基酸序列上第258位增加1个Asp(D)残基。2012年以后国内不同省份陆续分离的21株PRV变异株在这个位点上均存在3个连续碱基的插入,从而导致gE蛋白相应位点上1个Asp(D)的插入。该插入特征为PRV变异毒株的重要标志,是判断PRV是否为变异毒株的重要指标[10]。而SX02、SX04、SX-XP 3个分离毒在773 bp~775bp并没有CGA的插入,与Ea、Korea、GDSH、P-Prv等经典毒株相同。同时,7株PRV陕西分离毒均在233、235、265、270、283、287位发生了氨基酸置换(G233R、R235H、A265I、S270A、283A、A287P),与2012年以来国内不同省份分离的PRV变异株的氨基酸序列突变位点相同。核苷酸在第63位均发生突变(C→T),但该突变位点并没有引起相应位点氨基酸的变化。
值得注意的是,SX01、SX03、SX05、SX-SQ 4株分离毒第210位氨基酸为I,与大部分2015年的PRV流行毒株相同;而SX02、SX04、SX-XP 3个分离毒第210位氨基酸为V,与经典毒株(包括欧美分离株和亚洲分离株)和2014年前分离的PRV流行毒株相同。SX01、SX03、SX-SQ 3株分离毒在个别位点上发生了氨基酸突变。
2.5PRV gE基因遗传演化分析
将7个陕西分离毒株与GenBank登录的其他38株参考毒株的gE基因核苷酸序列做进化树分析(图5),结果显示,45株PRV毒株共分为2个大群,分别包括75V19、CL-15、Kaplan等的欧美分离株和包括Ea、Fa、P-Prv及近年国内分离的亚洲分离株。进一步分析发现,7个陕西分离毒株和2012年以来国内不同省份分离的PRV变异株形成了一个相对独立的分支,与欧美分离株关系相对较远。SX01、SX03、SX05、SX-SQ 4株分离毒与近3年国内不同省份分离的14株PRV变异株位于一个相对独立的分支中,亲缘关系相对较近,属于近年来流行的PRV变异毒株。而SX02、SX04、SX-XP 3个分离毒与经典参考毒株Ea株和GDSH株位于位于另一个相对独立的分支中,亲缘关系相对较近,由共同的祖先进化而来。此外,7株陕西分离株与国外分离株Korea株和P-Prv株的亲缘关系相对较近,位于同一大分支中。
2.6gE蛋白特性比较分析
2.6.1B细胞抗原表位预测使用依据蛋白质亲水性参数为基础的Predicted antigenic peptides程序,预测7株PRV的gE基因编码肽段均存在11个潜在的B细胞抗原表位,整体抗原性良好。但与Ea株相比,SX01株在24-66位处抗原表位发生改变,这与氨基酸第62位C→R有关;SX03株和在24-66位和163-176位两处抗原表位发生改变,这与氨基酸第64位F→S,第165位P→A有关。表明氨基酸序列的突变改变了陕西2株PRV分离毒的囊膜糖蛋白gE结构,从而对其抗原表位产生了影响,但是抗原表位的改变是否会影响gE基因的免疫原性和功能,进而影响PRV的毒力,还需进一步研究。此外,SX01株氨基酸在34位点发生置换(P→S),SX-SQ氨基酸在223位点发生置换(S→A),均位于潜在的抗原表位内,这些氨基酸位点的变化是否会对其相应位置的抗原性产生影响,从而影响PRV毒力,亦有待进一步研究。
2.6.2潜在糖基化位点预测使用糖基化位点预测软件,对陕西分离株的gE基因编码肽段的N糖基化位点和O-GalNAc糖基化位点进行预测。预测结果显示,7株陕西分离毒gE基因编码肽段存在2个潜在的N糖基化位点,分别位于20位和105位氨基酸处,与Ea株的N糖基化位点基本一致。SX01、SX02、SX05、SX-SQ和SX-XP 5株分离毒均存在1个潜在的O-GalNAc糖基化位点,位于第66位氨基酸处,与Ea株的O-GalNAc糖基化位点基本一致。而SX03株第66位氨基酸O-GalNAc糖基化位点缺失,SX04株在172位氨基酸处增加了1个潜在的O-GalNAc糖基化位点,该位点位于一个可能的抗原表位内,这2个糖基化位点的消失和增加是否与病毒的生物学特性变化有关,还需进一步研究验证。
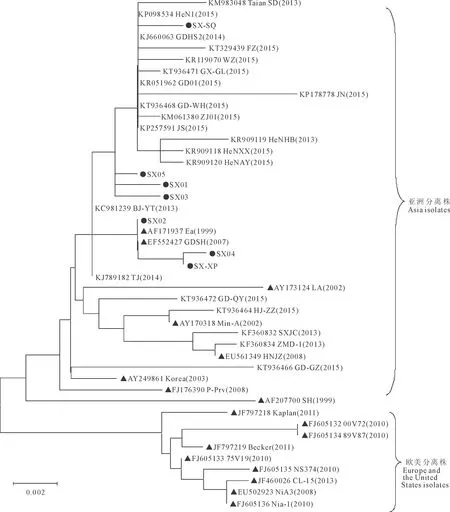
●为陕西分离毒株;▲为经典参考毒株;未标记的为2012-2015年全国各地分离的变异株。
3 讨论
近年来,在我国许多使用猪伪狂犬基因缺失疫苗免疫的规模化猪场,暴发了猪伪狂犬病,具有持续感染,终生带毒等发病特点和流行形势,给养猪业带来巨大的损失。已有报道指出,新发的猪伪狂犬病病原在原猪伪狂犬病毒的基础上发生了重组变异,形成了新的超强毒株[18],与以前的PRV流行毒株相比,新流行毒株在基因和蛋白水平上发生了变异,进而导致现有疫苗保护率降低,疫病难以防控。因此,对PRV进行分离鉴定和遗传进化分析,以此监测PRV毒株的变异情况,从分子水平揭示PR在猪场重新流行的原因,为PR的防控提供理论依据,具有重要的现实意义。
本研究对2015年陕西省多地疑似暴发PR的猪场采集的病料进行检测,同时采用先接种鸡胚绒毛尿囊膜再接种BHK-21细胞的病毒分离方法对阳性病料进行病毒分离。该方法是利用疱疹病毒可在绒毛尿囊膜上产生典型痘疱样病变的特性,对病料中PRV进行纯化,可以简化病毒分离步骤,快速分离PRV,避免混合感染的病料直接接种细胞造成分离病毒不纯等缺点。
广州市华南农大生物药品有限公司病毒学实验室共分离出了7个PRV分离毒株,均能在细胞上稳定传代,可产生细胞融合等典型病变。将7个PRV分离毒株与GenBank中登录的17个经典毒株和近3年国内分离的21个流行变异株的gE基因序列进行比对,发现7株陕西分离毒与流行变异株的相似性较高,在进化树上处于1个相对独立的分支中,与经典株亲缘关系相对较远;其中4个分离毒株与2012年以来国内流行的变异株之间存在相同的分子特征,即773 bp~775 bp CGA特征性插入,该位点的插入是区分变异毒株的典型特征[8-14],表明SX01、SX03、SX05、SX-SQ 4个分离毒株为PRV变异株;而另3个分离毒株没有CGA特征性插入,且与经典参考毒株Ea株和GDSH株处于1个的分支上。说明陕西不同地区PRV分离毒的gE基因在分子水平上发生了一定的变异,核酸演化上发生了相对独立的进化。
7个分离毒株分别来自陕西铜川、兴平、渭南、榆林、韩城、安康等不同地区的猪场,反映了陕西不同地方PRV的流行变化情况。通过遗传进化分析,说明陕西2015年流行的毒株存在多元化的特征,既存在变异毒株,也存在与经典毒株同源关系较近的毒株。本研究从分子水平研究了陕西省部分地区PRV的分子流行病学和遗传变异规律,为预防和控制PRV的发生和流行提供理论依据。
[1]殷震,刘景华.动物病毒学[M].2 版.北京:科学出版社,1997.[2]Pomeranz L E,Reynolds A E,Hengartner C J.Molecular biology of pseudorabies virus:impact on neurovirology and veterinary medicine[J].Microbiol Mol Biol Rev,2005,69(3):462-500.
[3]Klupp B G,Lomniczi B,Visser N,et al.Mutations affecting the UL21 gene contribute to avirulence of pseudorabies virus vaccine strain Bartha[J].Virology,1995,212(2):466-473.
[4]Mettenleiter T C.PRV:the virus and molecular pathogenesis[J].Vet Res,2000,31:99-115.
[5]孔德江,何晓玲,易栋,等.规模化猪场猪伪狂犬病的筛查与防控[J].中国兽医学报,2009,10(5):75-77.
[6]童武,张青占,郑浩,等.免疫后发病仔猪中伪狂犬病毒的分离和鉴定[J].中国动物传染病学报,2013,21(3):1-7.
[7]吴云飞,朱玲,徐志文,等.伪狂犬病病毒四川株的分离鉴定及增殖特性[J].中国兽医科学,2013,43(6):557-564.
[8]赵鸿远,彭金美,安同庆,等.猪伪狂犬病病毒变异株的分离鉴定及其gE基因的分子特征[J].中国预防兽医学报,2014,36(7):506-509.
[9]郝飞,汤德元,李春燕,等.伪狂犬病病毒 Guizhou-DY 株的分离鉴定及致病性研究[J].畜牧兽医学报,2013,44(11):1851-1856.
[10]范克伟,戴爱玲,李晓华,等.猪源伪狂犬病病毒福建龙岩分离株的鉴定及其TK和gE基因的分子特征[J].中国兽医科学,2015,45(10):1021-1030.
[11]朱前磊,方先珍,程果,等.猪伪狂犬病毒YZ 株gE全基因的克隆与序列分析[J].安徽农学通报,2015,21(7):127-129.[12]高晓云,顾阳,潘鑫龙,等.猪伪狂犬病病毒河南分离株gE全基因的克隆与序列分析[J].华北农学报,2015,30(1):137-141.
[13]Yu X,Zhou Z,Hu D,et al.Pathogenic pseudorabies virus,China,2012[J].Emerg Infect Dis,2014,20(1):102-104.
[14]彭金美,安同庆,赵鸿远,等.猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J].中国预防兽医学报,2013,35(1):1-4.
[15]An T,Peng J,Tian Z,et al.Pseudorabies virus variantin Bartha-K61-vaccinated pigs,China,2012[J].Emerg Infect Dis,2013,19(11):1749-1755.
[16]Tirabassi R S,Enquist L W.Role of envelope protein gE endocytosis in the pseudorabies virus life cycle[J].J Virol,1998,72(6) :4571-4579.
[17]吴德铭,黄毓茂,罗满林,等.伪狂犬病毒粤A株 gE基因真核表达质粒的构建[J].华南农业大学学报:自然科学版,2003,24(3):69-72.
[18]姜平.伪狂犬病毒基因重组导致毒力返强[J].兽医导刊,2015(10):50-51.
Isolation and Identification of Porcine Pseudorabies in Some Areas of Shaanxi Province and Analysis of Genetic Variation of gE Gene
FANG Lin,ZHU Hui,LI Ye,ZHANG Si-yuan,PENG Te,YE He-jia
(Guanzhou South China Biological Medicine CO.,LTD.,Guangzhou,Guangdong,511300)
In order to investigate the prevalence and genetic variation of PRV in Shaanxi Province in 2015,28 diseased tissues of swine were collected and detected by PCR,and the PRV was isolated by inoculating chick embryo chorioallantoic membrane and BHK-21 cell.Meanwhile the main virulence gene gE was amplified and its genetic variation characteristics were analyzed by bioinformatics methods.The results showed that the isolated 7 PRV Shaanxi strains had higher homology and closer relationships with Chinese epidemic strains than foreign reference strains.Among them,4 strains had characteristic insert of CGA in 773 bp-775 bp,which was the important marker for the PRV variant,and the other 3 strains had closer relationships with classical strains GDSH and Ea.The epitopes of strains SX01 and SX03 were changed,O-GalNAc glycosylation site of strain SX03 was deleted,a potential O-GalNAc glycosylation site was added in a epitope of strain SX04.The research indicated that PRV gE gene of Shaanxi had mutated in molecular level,and the mutant amino acids had an impact on its epitope and glycosylation sites.This study provided a theoretical basis for PRV monitoring and control.
Porcine pseudorabies virus; gE gene; genetic variation; bioinformatics analysis
2015-12-27
广州市产学研协同创新重大专项(201508020088)
方琳(1982-),女,安徽合肥人,硕士,主要从事动物传染病学和生物制品研究。
S852.659.1;S858.28
A
1007-5038(2016)08-0024-07

