三黄鸡STING基因的克隆与序列分析
曹艳杰,何怡宁,李和鸣,谢智文,戴锦龙,磨美兰
(广西大学动物科学技术学院,广西南宁 530005)
三黄鸡STING基因的克隆与序列分析
曹艳杰,何怡宁,李和鸣,谢智文,戴锦龙,磨美兰*
(广西大学动物科学技术学院,广西南宁 530005)
为探究鸡干扰素基因刺激蛋白(STING)的结构及功能,采用RT-PCR方法从三黄鸡外周血淋巴细胞中扩增出全长STING基因编码区序列并进行克隆测序。序列分析显示,该基因编码区全长1 140 bp,编码379个氨基酸。核苷酸序列比较发现,三黄鸡STING基因与原鸡和火鸡的同源性较高,分别为100%和92.3%,与其他物种STING基因的亲缘关系依次为其他禽类>哺乳动物>鱼类。预测STING的分子质量为42.63 ku,理论等电点为6.67,有较好的亲水性与抗原性。蛋白质二级结构中折叠占7.4%,无规则卷曲占51.2%,螺旋占41.4%。该蛋白由胞内区、跨膜区和胞外区组成,跨膜结构域仅有1个且位于N端,无信号肽。本研究首次成功克隆了三黄鸡STING基因,并对其进行了生物信息学分析,可以为全面解析鸡STING的分子结构及功能提供参考。
STING基因;三黄鸡;克隆;序列分析
干扰素基因刺激蛋白(stimulator of interferon genes,STING)也被称为MITA、ERIS或MPYS,是天然免疫Ⅰ型干扰素(IFN-α和IFN-β)生成通路中的一个衔接蛋白。STING在细菌、病毒等病原微生物引起的天然免疫反应中发挥着重要的调控作用[1]。
STING是RNA病毒和DNA病毒诱导Ⅰ型干扰素表达和抗病毒天然免疫中的重要接头蛋白,多种DNA和RNA病毒入侵能激活以STING为中心蛋白的相关通路[2]。病毒感染后,STING与MAVS相互作用招募TBK1,自身寡聚化形成MAVS-STING-TBK1-IRF3复合物,促进TBK1对IRF3的
磷酸化激活,从而介导Ⅰ型干扰素的表达[1,3]。利用STING基因敲除小鼠研究发现,STING基因缺失小鼠对细菌DNA、病毒DNA、哺乳动物DNA及各种DNA病毒,如单纯疱疹病毒1(HSV-1)等感染的应答显著降低,Ⅰ型干扰素的产生受到显著抑制[4]。STING也可以激活NF-κB介导的转录途径,诱导Ⅰ型干扰素的产生。STING不是DNA受体,不能结合DNA,但对DNA病毒受体研究发现,目前被鉴定的多个DNA受体IFI16、DDX41、cGAS、DNA-PK和环状GMP-AMP合成酶等都以STING依赖方式参与Ⅰ型干扰素通路的活化[5]。STING是细菌来源的环二核苷酸(CDNs)的直接受体,免疫第二信使cGAS蛋白(即CDNs合成酶)的发现,加深了我们对STING介导的DNA免疫应答的认识[6]。Sun W等[1]研究推断STING通过二聚化激活天然免疫反应,二聚化是其自身激活及下游信号传递必需的。Jin 等[7]发现STING还与MHC-II类分子似相关,并介导死亡信号的转导。
近几年来,人和猪等哺乳动物STING基因研究取得了重大进展[9-10]。相比于哺乳动物,禽类STING基因研究的发展较为缓慢滞后。本试验对三黄鸡STING基因进行克隆、生物信息学分析及蛋白质结构的预测,旨在为进一步揭示禽类相关传染病的发生、传播机制及天然免疫的调节机理奠定基础。
1 材料与方法
1.1材料
DH5α,康为世纪科技(北京)有限公司产品;pMD20-T、PrimeSTAR GXL DNA Polymerase和逆转录试剂盒,TaKaRa公司产品;DNA Marker DL 2000 、DNA Marker DL 1 000、总RNA抽提试剂盒、质粒抽提试剂盒和DNA纯化回收试剂盒,天根生化科技(北京)有限公司产品;淋巴细胞分离液,索莱宝科技有限公司产品;其他试剂均为分析纯。三黄鸡购自广西富凤农牧有限公司。
1.2方法
1.2.1鸡外周血淋巴细胞的分离采集三黄鸡新鲜抗凝血5 mL,使用外周血淋巴细胞分离液分离外周血淋巴细胞。
1.2.2总RNA提取参照总RNA抽提试剂盒说明提取三黄鸡外周血淋巴细胞总RNA,置-20 ℃保存备用。1.2.3引物设计与合成参照NCBI上的原鸡跨膜蛋白173即STING mRNA基因序列(NM-001305152.1),利用primer 6.0和Oligo 7设计扩增三黄鸡STING基因全长序列的1对引物。上游引物P1:5′-TAGGAATTCATGCCCCAGGACCCGTCAA- CCAGGAG(EcoRⅠ)-3′;下游引物P2:5′- TAAAG- CTTTCAGGGGCAGTCACTGCG(HindⅢ)-3′。引物由广州华大基因有限公司合成。1.2.4STING基因的RT-PCR扩增将抽提的外周血淋巴细胞总RNA反转录成cDNA,然后进行PCR扩增。为了提高扩增特异性,使用降落PCR进行扩增。循环参数为:98℃ 5 min;98 ℃ 10 s,63℃ 15 s,68℃ 20 s,5个循环;98℃ 10 s,59℃ 15 s,68℃ 20 s,5个循环;98℃ 10 s,57℃ 15 s,68℃ 20 s,5个循环;98℃ 10 s,55℃ 15 s,68℃ 20 s,20个循环。PCR产物经10 g/L琼脂糖凝胶电泳进行鉴定。
1.2.5克隆与鉴定对PCR产物进行回收纯化并与pMD20-T载体连接,转化DH5α感受态细胞。通过蓝白斑筛选挑取单个白色菌落,增菌培养后提取质粒进行单、双酶切鉴定。选取3个阳性样品送广州华大基因有限公司测序。
1.2.6STING基因序列分析及结构预测应用DNA Star软件和Expasy在线软件(hitp://web.expasy.org/protpa)对STING基因进行序列相似性分析和对其编码产物的亲水性、疏水性、柔韧性和抗原性进行预测;利用MEGA 5.0软件分析其遗传演化关系。同时分别应用蛋白质结构预测服务器PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)、TMHMM Server 2.0 (http://www.cbs.dtu.dk/services/TM-HMM/)和SignalP 4.1 Server软件(http://www.cbs.dtu.Dk/servces/SignalP/)对其二级结构、跨膜区和信号肽进行分析。
2 结果
2.1三黄鸡STING基因RT-PCR扩增结果
以三黄鸡外周血淋巴细胞总RNA逆转录得到的cDNA为模板进行PCR扩增。结果显示,扩增得到1条大小约为1 140 bp的特异性条带,与预期结果符合(图1)。
2.2三黄鸡STING基因的克隆鉴定
将RT-PCR扩增产物回收、连接、转化后,挑取白色菌落,培养提取重组质粒进行酶切鉴定。结果显示,重组质粒经EcoRⅠ单酶切和EcoRⅠ+HindⅢ双酶切后均得到与预计大小相符的片段(图2)。将筛选得到的阳性克隆命名为pT-STING。
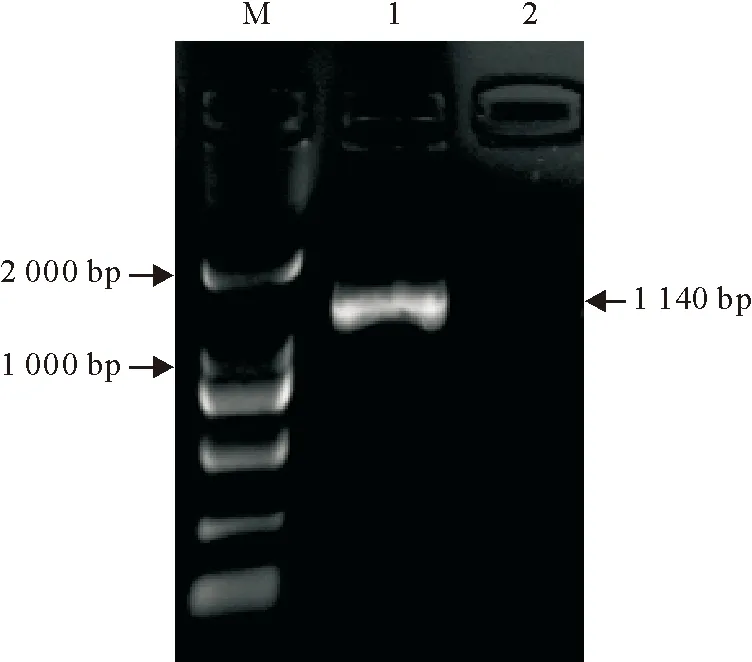
M.DNA标准DL 2 000;1.鸡STING基因的RT-PCR产物;2.阴性对照
M.DNA Marker DL 2 000; 1.RT-PCR product of STING gene from Sanhuang chicken ; 2.Negative control
图1三黄鸡STING基因的RT-PCR扩增
Fig.1RT-PCR amplification of STING gene from Sanhuang chicken

M.DNA标准DL 1 000;1.pT-STING的EcoR Ⅰ +HindⅢ双酶切;2.pT-STING的EcoRⅠ单酶切
M.DNA Marker DL 1 000; 1 Products from pT-STING digested byEcoRⅠ andHindⅢ; 2.Products from pT-STING digested byEcoRⅠ
图2重组质粒pT-STING的酶切鉴定
Fig.2Restriction enzymatic digestion analysis of recombinant plasmid pT-STING
2.3三黄鸡STING基因序列测定及分析
将酶切鉴定正确的重组质粒进行测序,将获得的测序结果与GenBank中登录的STING相关序列进行Blast比较,与引物源原鸡STING基因(NM001305152.1)核苷酸同源性最高(100%),确定其为三黄鸡STING基因编码区序列。该基因含1个完整的开放阅读框(ORF),共编码379个氨基酸。
2.4三黄鸡STING基因序列的同源性和遗传演化关系分析
将克隆的三黄鸡STING基因与GenBank中公布的14个其他物种的STING基因序列进行核苷酸同源性比较。结果显示,三黄鸡STING基因与原鸡的同源性最高,达100%;火鸡的次之,为92.3%;与斑马鱼和鲤鱼的同源性最低,分别为46.1%和44.6%;与白领姬鹟、沙鸡属、绿头鸭等禽类动物的同源性为74.6%~78.7%;与人、小家鼠、野猪等哺乳动物的同源性为51.9%~56.0%。
进一步对三黄鸡和以上14个物种的STING基因序列进行系统遗传进化分析。结果表明,三黄鸡与原鸡、火鸡、白领姬鹟、沙鸡属、绿头鸭等禽类的形成1个分支,其中与原鸡亲缘关系最近;小家鼠、牛、野猪等哺乳动物的形成1个分支,与三黄鸡的遗传距离较近;斑马鱼和鲤鱼形成1个与三黄鸡的遗传距离较远的分支(图3)。
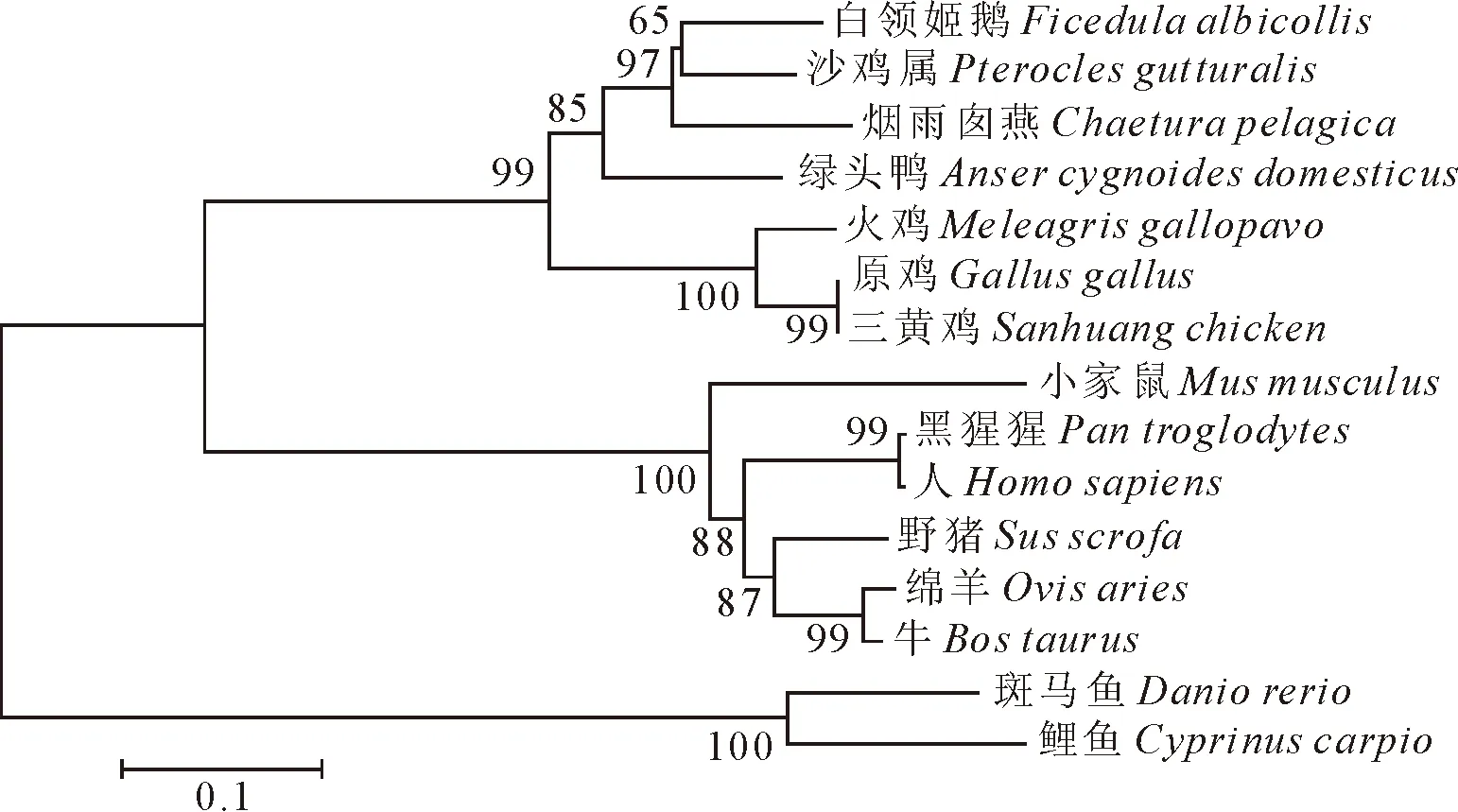
图3 三黄鸡和其他物种的STING基因核苷酸的进化关系树
2.5三黄鸡STING基因编码产物基本理化性质分析
通过DNA Star软件和Expasy在线软件对扩增得到的三黄鸡STING基因编码产物进行理化性质分析。结果该基因编码379个氨基酸,对应蛋白的分子式为C1897H3032N530O541S22,原子个数为6 022,分子质量为42.63 ku,推导的理论等电点为6.67。氨基酸组成中,碱性氨基酸残基为40个,酸性氨基酸残基为42个,疏水性氨基酸残基143个,极性氨基酸残基94个。蛋白不稳定系数为69.26,提示该蛋白可能为不稳定蛋白。脂溶性指数为105.01,总平均亲水性值(GRAVY)为-0.041,表现出较好的亲水性。
2.6三黄鸡STING基因编码产物的亲水性、疏水性、柔韧性及抗原性预测
应用DNA Star软件子程序Prostean对三黄鸡STING基因编码产物的亲、疏水性,柔韧性及抗原性进行预测。结果显示,三黄鸡STING基因编码产物亲水性残基所占比例大于疏水性残基,因此推测其编码蛋白整体表现为亲水性,但在28-50位之间有较高疏水性,可能为跨膜区域;柔韧性区域在N端分布较稀疏,中间段与C端分布相对均匀。抗原表位区域较大,中段与C端相对较为密集,N端次之;与柔韧性区域出现较多重叠区,这些区域易于变性,便于抗原、抗体自由结合,可能是抗原位点的结合区(图4)。
2.7三黄鸡STING二级结构、跨膜区及信号肽预测
将推测的三黄鸡STING氨基酸序列输入到蛋白质结构预测服务器PSIPRED中,对其进行二级结构预测。结果显示,STING蛋白肽链中折叠占7.4%,无规则卷曲占51.2%,螺旋占41.4%。无规则卷曲和螺旋交替出现,折叠主要穿插于无规则卷曲之间(图5)。应用TMHMM Serverv.2.0分析其跨膜区,该蛋白由胞内区(1-27 aa)、跨膜区(28-50 aa)和胞外区(51-379 aa)3部分组成,且仅有1个跨膜结构域(图6)。用SignalP 4.1 Server软件预测其信号肽,结果显示,该蛋白无信号肽(图7)。
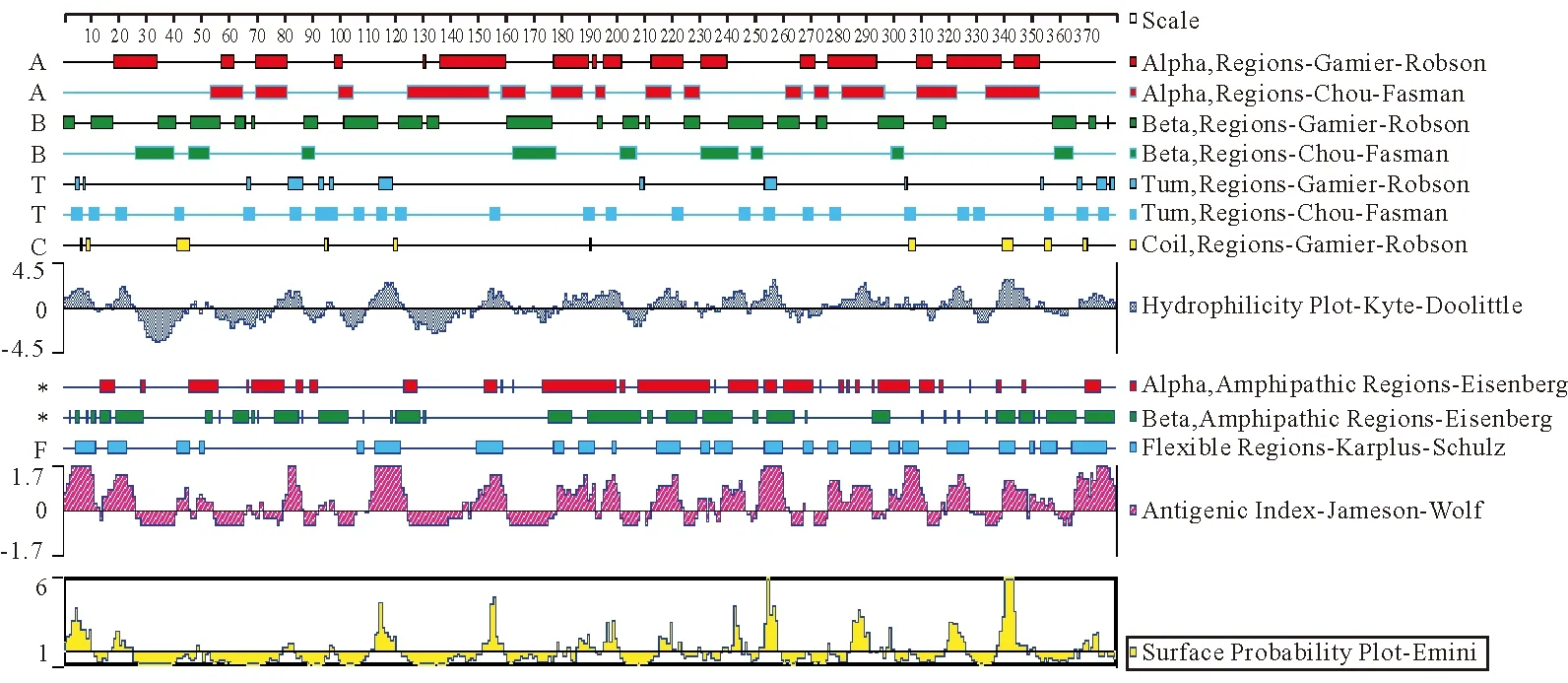
图4 三黄鸡STING基因编码产物的亲水性、疏水性、柔韧性及抗原性预测

图5 三黄鸡STING基因编码氨基酸序列二级结构预测图
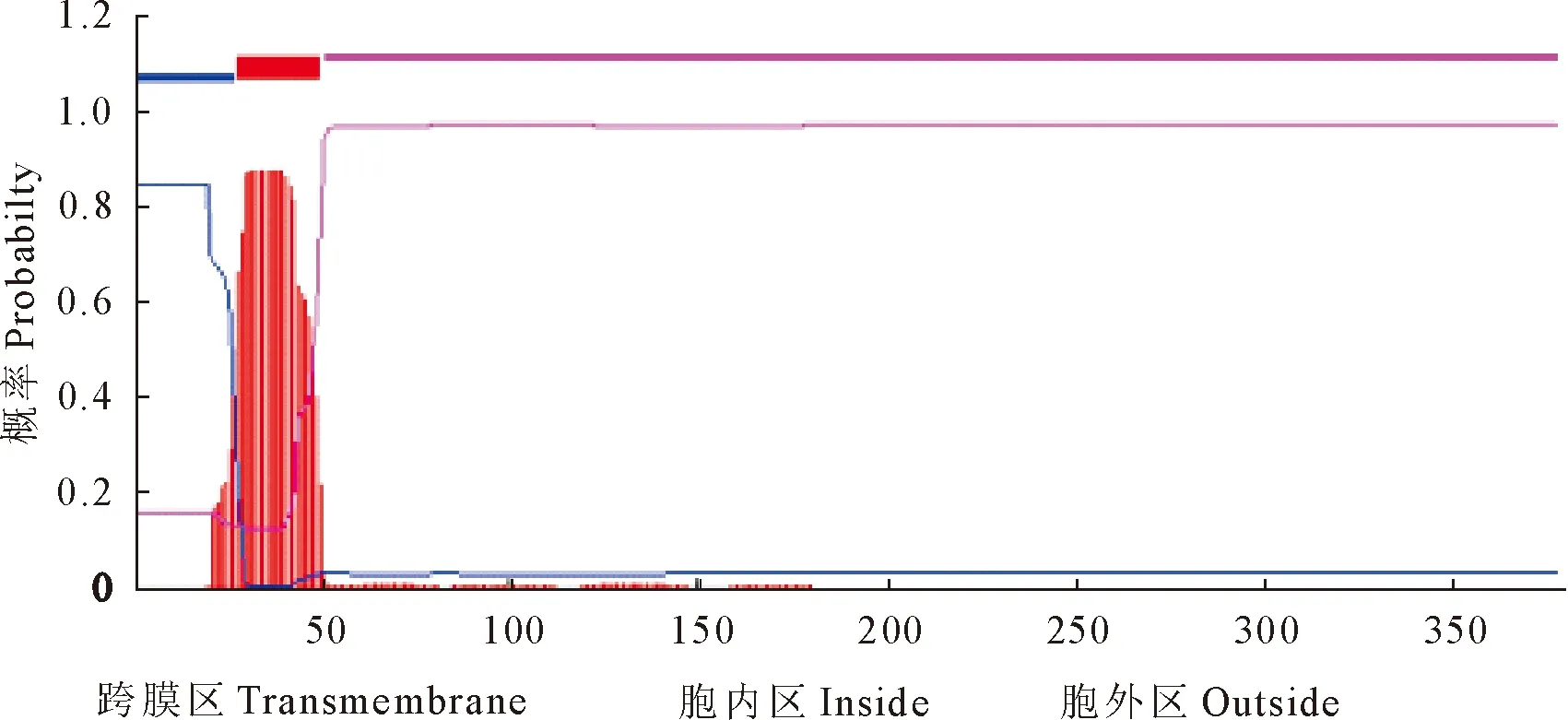
图6 三黄鸡STING跨膜区预测
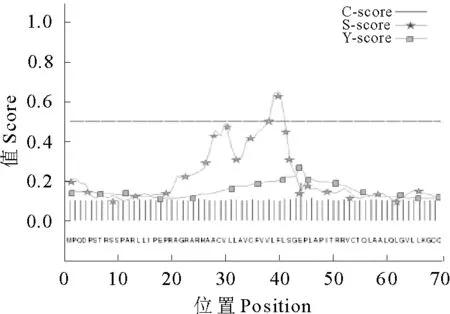
图7 三黄鸡STING信号肽位置预测
3 讨论
天然免疫是宿主抵御病原体感染的第一道防线,在特异性免疫应答的启动、类型和强度方面发挥重要的作用。STING是天然免疫Ⅰ型干扰素生成通路中的一个重要衔接蛋白,因此对其结构和功能的了解非常必要。
本研究首次克隆了三黄鸡STING基因。核苷酸序列相似性分析显示,三黄鸡STING基因与原鸡亲缘关系最近,与火鸡、绿头鸭、白领姬鹟、沙鸡属的亲缘关系次之,并同属于禽类分支上;与野猪、牛、绵羊、人、黑猩猩、小家鼠亲缘关系渐远;与斑马鱼和鲤鱼亲缘关系最远。利用生物信息学相关软件对其进行序列分析及蛋白结构预测,结果显示,三黄鸡STING整体表现为亲水性,有一个跨膜结构域,大部分蛋白在膜外,因此推测其为一次跨膜蛋白。三黄鸡STING为跨膜蛋白,这一点与目前已知的关于人、猪等哺乳动物的相一致。而关于跨膜次数,则与哺乳动物不同。相关研究表明,人和猪等哺乳动物STING的N端有4个或5个跨膜结构域[9-10],而三黄鸡STING仅有一个跨膜结构域。另外,三黄鸡STING无信号肽,表明该蛋白不是分泌蛋白。但是,已预测的哺乳动物的STING为分泌蛋白,N端有信号肽[10]。由此推测,三黄鸡STING与哺乳类STING在结构和功能上可能存在一定的种属差异性。
信号肽不仅决定一个蛋白质是否为分泌蛋白,而且和蛋白质或其新生肽链在细胞内的定位有关。目前,关于STING的定位仍然存在一定争议,Zhong B等[10]发现STING定位于线粒体外膜,并与同样定位于线粒体的膜蛋白MAVS相互作用,因此,他们认为STING可能起到连接MAVS信号复合物与TBKI-IRF3调控路径的作用。而Ishikawa H等[11]认为STING主要存在于内质网,并且通过胞内位置的变化发挥作用。谢立兰[9]研究发现猪源STING同时分布于内质网和线粒体,但主要定位于内质网。Cheng Y等[12]利用激光共聚焦技术在DF-1细胞中进行STING亚细胞定位,发现鸡STING主要定位于内质网,也有部分定位于线粒体。由此可知,在禽类和哺乳类动物上,已出现STING同时存在于内质网和线粒体的相关报道。但在其他动物上还未见此类报道。因此,对STING的定位仍有待更加深入地研究。
本研究首次克隆了三黄鸡STING基因并利用生物信息学技术对该基因序列进行了分析和蛋白结构预测,初步了解了该基因编码蛋白的理化性质、亲水性、抗原性、二级结构、跨膜区及信号肽等信息,为进一步研究家禽STING的结构功能和揭示病毒入侵宿主的致病机制奠定基础。
[1]Sun W,Li Y,Chen L,et al.ERIS,an endoplasmic reticulum IFN stimulator,activates innate immune signaling through dimerization [J].Proc Natl Acad Sci,2009,106(21):8653-8658.
[2]谢欣,王孝伟,刘俊义.免疫途径抗 HIV 信号通路:cGAS-STING 研究进展[J].国际药学研究杂志,2014,41(5):528-532.
[3]Ishikawa H,Ma Z,Barber G N.STING regulates intracellular DNA-mediated,type Ⅰ interferon-dependent innate immunity [J].Nature,2009,461(7265):788-792.
[4]李颖.细胞抗病毒天然免疫信号转导的调控机制[D].湖北武汉:武汉大学,2011.
[5]Sun L,Wu J,Du F,et al.Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway [J].Science,2013,339(6121):786-791.
[6]尚桂军.铜绿假单胞菌T6SS效应蛋白Tse3和人天然免疫蛋白STING结构和功能研究[D].山东泰安:山东大学,2014.
[7]Jin L,Waterman P M,Jonscher K R,et al.MPYS,a novel membrane tetraspanner,is associated with major histocompatibility complex class II and mediates transduction of apoptotic signals[J].Mol Cell Biol,2008,28(16):5014-5026.
[8]陈慧慧.天然免疫中重要的接头分子的研究进展[J].科学通报,2013,58(21):2021-2034.
[9]谢立兰.伪狂犬病毒和猪传染性胃肠炎病毒诱导β干扰素产生的分子机制研究[D].湖北武汉:华中农业大学,2011.
[10]Zhong B,Yang Y,Li S,et al.The adaptor protein MITA links virus-sensing receptors to IRF3 transcription factor activation [J].Immunity,2008,29(4):538-550.
[11]Ishikawa H,Barber G N.STING an endoplasmic reticulum adaptor that facilitates innate immune signaling [J].Nature,2008,455(7213):674-678.
[12]Cheng Y,Sun Y,Wang H,et al.Chicken STING mediates activation of the IFN gene independently of the RIG-I gene[J].J Immunol,2015,195(8):3922-3936.
Cloning and Sequence Analysis of STING Gene in Sanhuang Chicken
CAO Yan-jie,HE Yi-ning,LI He-ming,XIE Zhi-wen,DAI Jin-long,MO Mei-lan
(College of Animal Science and Technology,Guangxi University,Nanning,Guangxi,530005,China)
To know the structure and function of STING gene in chicken,the coding region of STING gene was amplified from peripheral blood mononuclear cells of Sanhuang chicken by RT-PCR and cloned,then sequenced.Sequence analysis showed that the coding region of STING gene was 1 140 bp in length and encoded a protein of 379 amino acids.Similarity analysis of nucleotide sequence showed that Sanhuang chicken shared high nucleotide similarity withGallusgallusand turkey in STING gene (100% and 92.3%,respectively).The descending nucleotide similarity orders among Sanhuang chicken and other species were other avian types>mammals>fish.The predicted molecular weight and isoelectric point of STING were about 42.63 ku and 6.67,respectively.And the predicted STING protein had high hydrophilicity and antigenicity.The protein structure study indicated that beta-turn,random coil and alpha-helix were 7.4%,51.2% and 41.4%,respectively.The protein was composed of intracellular domain,transmembrane domain and extracellular domain and just had a transmembrane domain in its N terminal.The protein contained no signal peptide.The STING gene of Sanhuang chicken was cloned successfully for the first time in our study and the bioinformatics analysis was conducted,which provided references for the analysis of molecular structure and function of STING in chickens.
STING gene; Sanhuang chicken; cloning; sequence analysis
2015-12-30
国家自然科学基金项目(31360611);广西自然科学基金项目(2014GXNSFDA118011,2013GXNSFCA019010)
曹艳杰(1991-),女,河南开封人,硕士研究生,主要从事禽病学研究。*通讯作者
S852.23
A
1007-5038(2016)08-0030-06

