一起猪水肿病病原分离鉴定及药敏试验
梁 乔,赵凤菊,于学武,李井春,赵晓彤*
(1.辽宁省动物疫病预防控制中心,辽宁沈阳 110164;2.辽宁省动物医学研究院, 辽宁沈阳 110164)
一起猪水肿病病原分离鉴定及药敏试验
梁乔1,2,赵凤菊1,2,于学武1,2,李井春1,2,赵晓彤1,2*
(1.辽宁省动物疫病预防控制中心,辽宁沈阳 110164;2.辽宁省动物医学研究院, 辽宁沈阳 110164)
为查明猪群的发病原因,对发病猪进行了临床剖检及实验室检测,通过分子病原学检测,排除了猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV-2)和猪伪狂犬病病毒(PRV)4种病原感染,并对病料进行了细菌分离鉴定与药敏试验。结果发现,所分离到的菌株培养特性及生化反应特性与大肠埃希菌基本一致,经进一步鉴定菌体抗原血清型均为O65和O68;药敏试验结果表明,分离株存在多重耐药现象,其对喹诺酮类、大环内酯类、青霉素类、氨曲南类药物均呈不同程度耐药,而其对氨基糖苷类、磺胺类药物均较敏感,进一步试验验证分离株均能产生超广谱β-内酰胺酶(ESBLs)。
猪水肿病;大肠埃希菌;分离鉴定;耐药性;超广谱β-内酰胺酶
猪水肿病是由某些特定血清型大肠埃希菌引起的肠道毒血症,以头部、面部等处水肿,四肢麻痹,共济失调等为主要特征。1938年,Shanks首先报道了在爱尔兰发现猪水肿病,随后世界各地陆续有发生该病的相关报道;1956年,我国于北京地区首次发现该病,该病发病急、病死率高,急性病例死亡率几乎为100%,亚急性病例死亡率为60%~80%,极高的病死率严重制约着养猪业的发展。引起猪水肿病的病原血清型较多,各血清型之间的交叉保护性不强,菌苗的免疫效果并不明显,因此在临床上抗菌药治疗为该病的主要治疗方法[1]。然而,抗生素的普遍使用和滥用极易使细菌产生耐药性[2]。我国多个地区如四川[3]、河北[4-5]、浙江[6]等地对动物源大肠埃希菌耐药情况进行过报道,发现大肠埃希菌耐药性日益严重;欧美[7-8]等国家相关报道也证实大肠埃希菌耐药率在逐渐上升,耐药性的产生直接影响疾病的治疗与控制。
沈阳新民某农户饲养的100日龄的猪突然发病,呈群体发病趋势。主要表现为皮肤表面点状出血,食欲减退,精神沉郁,口吐白沫,体温升高,初期病猪四肢无力,行走不稳,发出呻吟声或嘶哑声,肌肉震颤,眼睑、脸部和头部发生水肿。剖检发现淋巴结水肿出血,胸腔积液,肺充血、出血、水肿,肺间质增宽,心水肿、充血,脾出血,有坏死点,肾出血,肾乳头坏死并形成包膜,回盲瓣出血、肿胀、坏死,肠淋巴结充血。该批猪疫苗免疫情况如下:10日龄接种过伪狂犬病活疫苗,生产厂家为大北农南京天邦生物科技有限公司;1月龄接种过猪瘟细胞苗,生产厂家为辽宁益康生物股份有限公司。
从病猪的临床诊断、病理剖检方面初步诊断为猪水肿病。为了进一步确诊该病进行了细菌病原分离鉴定,并对分离到的病原菌进行了耐药性监测。同时为排除是否有其他疾病感染,进行了猪瘟病毒(Classical swine fever virus,CSFV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome viruse,PRRSV)、猪圆环病毒2型(Porcine cicrovirus type 2,PCV-2)、猪伪狂犬病病毒(Porcine pseudorabies virus,PRV)的检测,旨在有效控制猪群疾病发生,降低经济损失,为科学防治该病提供可靠依据。
1 材料与方法
1.1材料
1.1.1病料采集采集具有明显临床症状患病猪的心、肝、脾、肺等组织脏器共5份。
1.1.2培养基和试剂营养琼脂培养基(批号:20130805)、麦康凯培养基(批号:20130701)、营养肉汤培养基(批号:20110406),北京奥博星生物技术有限公司产品;药敏纸片(批号:140506)、水解酪蛋白琼脂培养基(MH)(批号:140509)、微量生化鉴定管、超广谱β-内酰胺酶(extended spectrum beta-Lactamases,ESBLs)(批号:141028)检测试剂盒双纸片试条,杭州市天和微生物试剂有限公司产品;大肠埃希菌标准菌体抗原(O抗原)血清购自中国兽医药品监察所;Trizol和DNAzol核酸提取试剂盒,Invitrogen公司产品;CSFV(批号:20140901)、PRRSV(批号:20150601)、PCV-2(批号:20150301)和PRV(批号:20141201)检测试剂盒,北京生科尚仪科技有限公司产品;其他为实验室常规试剂。
1.2方法
1.2.14种病毒病原的检测
1.2.1.1病料的处理将病料用石英砂研磨后加入5 mL生理盐水,4 ℃、3 000 r/min离心5 min后取上清液备用。
1.2.1.2病毒核酸的提取病毒核酸的提取方法按照Trizol和DNAzol核酸提取试剂盒试剂说明书进行操作。
1.2.1.3CSFV、PRRSV病原检测采用荧光RT-PCR方法,反应体系为25 μL,RT-PCR反应液15 μL,RNA模板10 μL,Taq酶0.25 μL,1/4颗RT-PCR酶颗粒。反应条件为:42 ℃ 30 min;92℃ 3 min,92℃ 10 min,45℃ 30 min,72℃ 60 min,92℃ 10 min,60℃ 30 min(收集荧光)。
1.2.1.4PCV-2和PRV病原检测采用荧光PCR方法,反应体系为25 μL,PCR反应液23 μL,DNA模板2 μL,Taq酶0.25 μL。反应条件为:94 ℃ 3 min;94 ℃ 5,60 ℃ 30s(收集荧光),40个循环。
1.2.2细菌分离与纯培养无菌操作取病猪心血、淋巴结、肝、脾等组织分别接种于普通营养琼脂培养基和麦康凯平板培养基上,37 ℃培养24 h后观察细菌生长情况和菌落特征,在麦康凯培养基上挑取粉红色、中等大小、光滑的菌落进行涂片、革兰染色和镜检;在普通营养琼脂平板挑取白色、中等大小菌落进行涂片、染色、革兰染色镜检。革兰染色、形态、大小及菌落培养特性等均符合文献[9]中大肠埃希菌菌株的特征描述,初步确定为大肠埃希菌,并用普通营养琼脂培养基纯化,以便完成细菌生化试验鉴定和细菌药物敏感性试验。
1.2.3细菌生化试验采用微量生化反应管法,用接种针挑取待检菌接种于微量生化鉴定管中,按厂家肠埃希菌科细菌微量生化鉴定管要求进行生化鉴定。
1.2.4血清型鉴定采用凝集试验方法进行菌体抗原的鉴定。按照中国兽药监察所提供的产品使用说明书进行操作。细菌分离株先采用平板凝集试验确定可能的O抗原血清型,再通过试管凝集试验确定其O抗原血清型。定型标准为测试血清的试管凝集价达到原血清效价1/2以上,阴性对照为无菌生理盐水。
1.2.5药敏试验
1.2.5.1采用常规药敏纸片法病原菌纯培养18 h~24 h后,挑取纯培养菌落置于无菌生理盐水中,制成相当于0.5麦氏单位的菌悬液,用灭菌棉签蘸取适量均匀涂抹到MH琼脂培养基表面,反复几次,每次将平板旋转60 ℃,最后沿平皿周边绕两圈,贴好纸片后在35 ℃恒温培养箱中培养16 h~18 h后测量药敏试纸在平板中产生的抑菌环直径,检测结果根据NCCLS标准进行判定,按敏感(S)、中介(I)、耐药(R)形成报告。
1.2.5.2超广谱β-内酰胺酶(extended spectrum beta-lactamases,ESBLs)筛选和确证试验采用纸片扩散法,筛选试验选用头孢曲松(30 μg)和头孢噻肟(30 μg)2种药敏纸片。确证试验用ESBLs检测试剂盒双纸片试条进行。若头孢曲松抑菌环直径≤25 mm、头孢噻肟抑菌环直径≤27 mm,则提示试验菌株可能产生ESBLs,需进一步作表型确证试验来加以确定;若确证试验时含棒酸纸片的抑菌环直径大于不加棒酸纸片的抑菌环5 mm以上,则判定产生ESBLs 。
2 结果
2.14种病毒病原的检测结果
对CSFV、PRRSV和PCV-2、PRV分别进行荧光RT-PCR和荧光PCR扩增后,结果均为阴性。
2.2细菌学分离与培养结果
通过18 h~24 h培养后,5份样本中有3份在普通营养琼脂培养基上形成灰白色、圆形、半透明、表面稍隆起、光滑湿润、边缘整齐的菌落;在麦康凯培养基上形成粉红色、圆形隆起、光滑湿润、边缘整齐的菌落;将以上培养物进行常规涂片、革兰染色后镜检,在显微镜下见到革兰阴性中等大小、两端钝圆的直杆菌,根据培养特征与镜检结果初步判定分离到的3株菌株为大肠埃希菌。
2.3细菌的生化鉴定结果
将疑似大肠埃希菌的菌株进行生化试验,该菌能发酵葡萄糖、乳糖、麦芽糖、蔗糖、甘露醇5种糖类,产酸产气,吲哚、甲基红试验均为阳性,VP试验、枸橼酸盐试验、H2S试验均为阴性。通过生化试验最终判定为大肠埃希菌。
2.4血清型鉴定结果
通过血清平板凝集试验、试管凝集试验,最终鉴定出两种大肠埃希菌O血清型,分别为O65和O68。
2.5药敏试验结果
2.5.1药敏纸片法检测结果通过药敏试验发现3株大肠埃希菌的药敏结果一致。由表1可知,菌株对恩诺沙星、氟苯尼考、萘啶酸、克拉霉素、氯霉素、甲氧苄啶、磷霉素、阿莫西林、氨苄青霉素、青霉素G、羧苄青霉素、苯唑青霉素、氧哌嗪青霉素、先锋V、先锋Ⅵ、头孢曲松、头孢噻肟、洁霉素耐药;对氟哌酸、链霉素、妥布霉素、卡那霉素、丁胺卡那霉素、庆大霉素、美满霉素、磺胺异恶唑、复方新诺明较敏感。
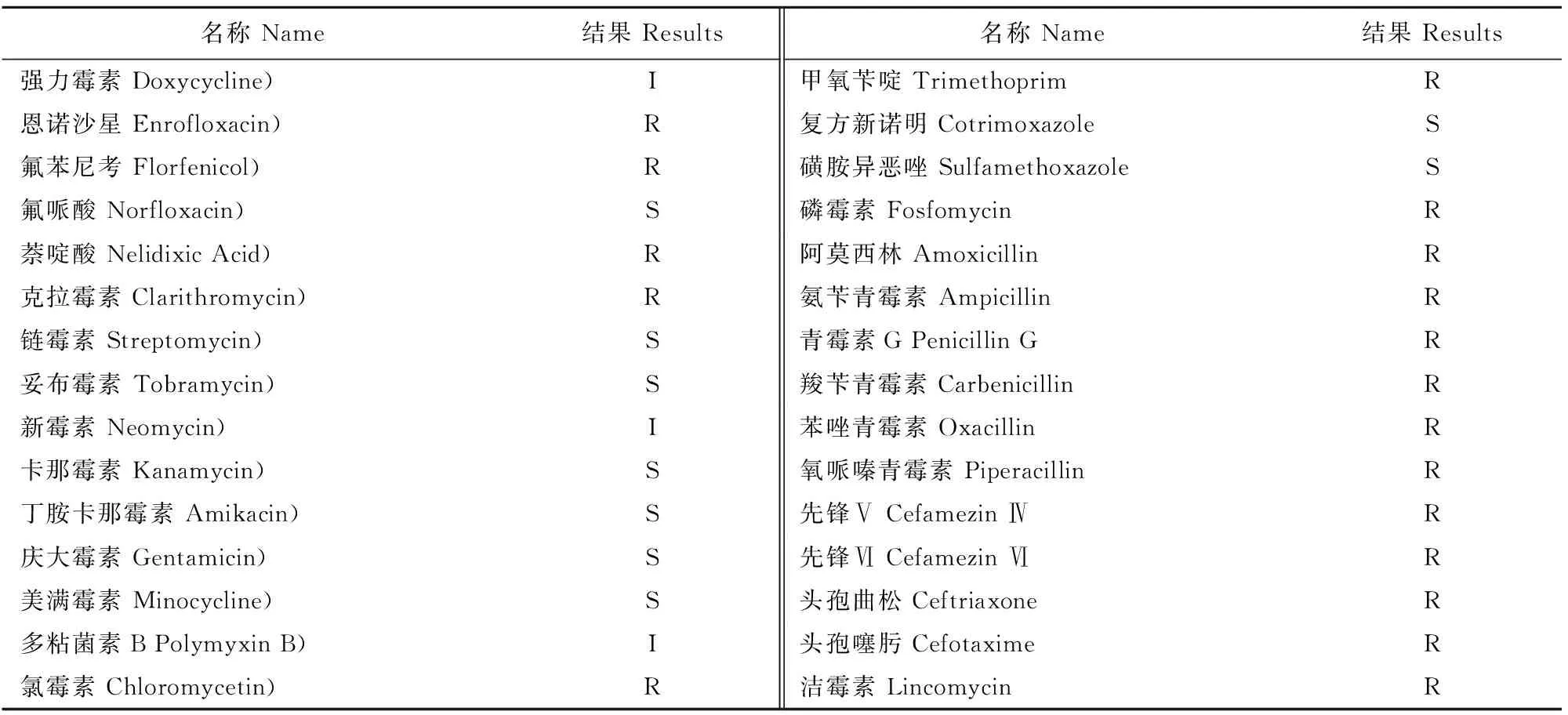
表1 分离菌株药敏试验结果
注:敏感(S)、中介(I)、耐药(R)。
Note :Susceptible(S),intermediate(I),resistant(R).
2.5.2ESBLs筛选和确证试验结果3株大肠埃希菌在ESBLs筛选试验中头孢曲松、头孢噻肟的抑菌环直径分别均为20 mm和23 mm。在ESBLs确证试验中含棒酸的头孢噻肟纸片抑菌环直径与不含棒酸的抑菌环直径之差均大于5 mm,判定为本次分离到菌株均可产生ESBLs。
3 讨论
猪水肿病的发生,受诸多因素影响,例如季节气候影响、饲养管理不当、环境卫生管理不到位等等。发病初期常呈现无任何症状就突然死亡现象,所以要早发现、早治疗,在做好饲养管理、环境卫生管理的同时做好疫苗预防。由于致猪水肿病的大肠埃希菌血清型较多,猪场单纯地使用一种菌苗并不能充分达到预防目的。因此,有针对性地对自家猪场的致病性大肠埃希菌的种类进行病原分离和鉴定或到专业的鉴定机构去鉴定,选择有效的疫苗或自制疫苗才能更好的对该病进行科学有效地防控[10]。
根据国内各地区猪源致病性大肠埃希菌血清型的相关报道,不同地区、同一地区不同猪场流行的血清型都存在较大差别,本试验得出的优势血清型与国内其他地区的报道不同,不难看出血清型的分布存在地域差。同时本猪群分离株为交叉凝集血清型,增加了本猪群大肠杆菌病的防控难度。猪大肠埃希菌的血清型繁多,而各血清型之间交叉保护率较低,同一猪场又可能同时存在多种血清型,因此了解清楚该猪场或该区域的优势血清型对于疾病的区域性防治具有重要意义。
本猪群分离到的大肠埃希菌对喹诺酮、大环内酯类、青霉素类、氨曲南类耐药,对氨基糖苷类、磺胺类较敏感。因此,建议在治疗时选择卡那霉素、庆大霉素、链霉素等敏感性较高的药物,同时采取了改善饲养环境,加强饲养管理等措施。通过对发病猪连续3天的综合治疗,症状明显好转。因此,在生产实践中有必要定期进行耐药性监测,在选择敏感药物进行治疗的同时还要改善饲养环境,并通过添加微量元素、维生素等增加机体的免疫力,适当采取对症治疗措施。
1980年产超广谱β-内酰胺酶菌株在世界范围开始蔓延[11],大肠埃希菌之所以对大多数抗菌药物产生耐药性,其根本原因就在于其所产生的超广谱β-内酰胺酶(ESBLs)[12]。超广谱β-内酰胺酶(ESBLs)能够造成耐药基因在细菌间扩散,从而改变细菌的耐药性,产生ESBLs菌株的耐药谱广,通常表现多重耐药,是临床常见的大肠埃希菌和肺炎克雷伯菌主要耐药机制[13]。刘雅妮等[14]、刘保光等[15]等报道,与非产ESBLs大肠埃希菌相比,产ESBLs大肠埃希菌无论是对β-内酰胺类抗菌药还是对非β-内酰胺类抗菌药耐药率均高于非产ESBLs大肠埃希菌。本试验中共选出30种抗菌药,其中对18种抗菌药都产生耐药性,耐药率为60.0%,更是印证了这一说法。为了能尽快控制大肠埃希菌感染特别是耐药性大肠埃希菌感染,各地在定期检测产ESBLs情况的同时要减少使用或是交替使用抗生素,延缓耐药菌株的产生。
[1]李求知,杭柏林,王青,胡建和.致仔猪水肿病大肠杆菌的分离鉴定及耐药性分析[J].河南科技学院学报,2011,39(2):61-65.
[2]易本驰,陈敏,何敏,等.信阳地区规模化猪场大肠杆菌耐药性监测[J].中国兽医杂志,2010,46(2):25-26.
[3]刘书亮,陶勇,王红宁,等.规模化猪场致病性大肠杆菌血清型鉴定[J].西南农业学报,2000(13):74-77.
[4]顾小龙,刘红彬.张家口地区仔猪黄痢病原菌血清型检测及药敏试验[J].河南农业科学,2012,41(10):142-144.
[5]马增军,芮萍,逯春香,等.猪源肠外致病性大肠杆菌的分离与鉴定[J].中国人兽共患病学报,2015,31(2):130-134.
[6]麻延峰,王宏艳,严晗光,等.金华地区仔猪致病性大肠杆菌的血清型鉴定及药敏试验[J].浙江农业学报,2014,26(6):1437-1441.
[8]Alrowais H,McElheny C L,Spychala C N,et al.Fosfomycin resistance inE.coli,pennsylvania,USA[J].Emerging Infectious Diseases,2015 ,21(11):2045-2047.
[9]陆承平.兽医微生物学[M].北京:中国农业出版社,2007:99-107.
[10]徐建生,成大荣,黄维嘉,等.选择优良菌株用于仔猪水肿病疫苗的改进[J].中国预防兽医学报,2002,24(4):297-300.
[11]Pilmis B,Delory T,Groh M,et al.Extended-spectrum beta-lactamase-producing Enterobacteriaceae (ESBL-PE) infections:are carbapenem alternatives achievable in daily practice [J].Int J Infect Dis,2015,39:62-67.
[12]王兴林,文德学,李莹.大肠埃希菌产超广谱β-内酰胺酶的基因型研究及耐药性分析[J].中国卫生检验杂志,2014,24(24):3619-3621.
[13]Tseng S P,Wang S F,Kuo C Y,et al.Characterization of fosfomycin resistant extended-spectrum β-lactamase-producingEscherichiacoliisolates from human and pig in Taiwan[J].PLoS One,2015,10(8):1-14.
[14]刘雅妮,商军,郭士博.猪源分离大肠埃希菌产生ESBLs的基因型及耐药性分析[J].中国兽药杂志,2011,45(9):19-22.
[15]刘保光,肖尚修,吴华,等.鸭大肠杆菌超广谱β-内酰胺酶的检测及药物敏感性分析[J].中国畜牧兽医,2010,37(9):188-190.
Isolation,Identification and Drug Sensitive Test of Pathogen from Swine Edema Disease
LIANG Qiao1,2,ZHAO Feng-ju1,2,YU Xue-wu1,2,LI Jing-chun1,2,ZHAO Xiao-tong1,2
(1.Liaoning Center for Animal Disease Control and Prevention,Liaoning, Shenyang, 110164, China;2.AnimalMedicineResearchInstituteofLiaoningProvince,Liaoning,Shenyang,110164,China)
In order to find out the causes of swine herd,the clinical autopsy and laboratory testing were performed.The other pathogenic infections such as CSFV,PRRSV,PCV-2 and PRV were excluded by real-time PCR method.Then pathogen isolation,identification and drug sensitivity tests were performed.The results indicated that the training characteristics and biochemical characteristics of isolated bacteria identified withE.coli.Cell antigen of the isolated bacteria were O65 and O68.The drug sensitivity tests showed that the isolated strains were multi drug resistant.And they were resistant to quinolone,macrocyclic lactones,penicillins,aztreonam class. But they were sensitive to aminoglycosides,sulfonamides,and they could produce extended spectrum beta-lactamases(ESBLs).
Swine edema disease;Escherichiacoli; isolation and identification; antibiotics resistant; extended spectrum beta-lactamases
2016-01-05
辽宁省自然科学基金项目(201402573);辽宁省农业攻关项目(2015202013)
梁乔(1991-),女,辽宁庄河人,助理兽医师,主要从事动物疫病的检测和防控工作。*通讯作者
S858.28;S852.612
B
1007-5038(2016)08-0120-04

