猪传染性胃肠炎病毒陕西分离株S蛋白抗原位点的真核表达
宋林林,王晓红,姜 博,赵 毅,王 祥,穆 杨*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2. 陕西省动物疫病预防控制中心,陕西西安710016;3. 北京市顺义区张镇兽医卫生防检站,北京 101307)
猪传染性胃肠炎病毒陕西分离株S蛋白抗原位点的真核表达
宋林林1,王晓红1,姜博1,赵毅2,王祥3,穆杨1*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2. 陕西省动物疫病预防控制中心,陕西西安710016;3. 北京市顺义区张镇兽医卫生防检站,北京 101307)
猪传染性胃肠炎(TGE)是严重危害全世界养猪业健康发展的一种高度传染性病毒病,其病原猪传染性胃肠炎病毒(TGEV)的S蛋白携带有主要的B淋巴细胞识别的抗原决定簇,是诱导机体产生保护性中和抗体的主要抗原。本研究以提取的TGEV 陕西分离株感染的ST细胞的RNA为模板,采用RT-PCR方法扩增编码S蛋白上包含C、B、D、A 4个抗原位点的基因片段,将目的片段连接到真核表达载体pcDNA3.1/V5-HisB上,构建重组表达载体,转染293T细胞后,通过Western blot检测目的基因的表达。结果成功克隆到编码S蛋白C、B、D、A 4个抗原位点的基因片段,以TGEV阳性猪血清和抗His标签单抗的Western blot结果均显示,目的基因在293T细胞中获得表达。本研究为TEG核酸疫苗的研制奠定了基础。
猪传染性胃肠炎病毒;S基因;抗原位点;真核表达
猪传染性胃肠炎(Transmissible gastroenteritis,TGE)是由猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)引起的一种急性、高度接触性肠道传染病,不同年龄和品种的猪均易感,尤其哺乳仔猪最易感[1]。主要表现为呕吐、腹泻、脱水症状[2-3],严重危害着全世界养猪业的健康发展。TGEV属于冠状病毒科冠状病毒属,是引起肠道疾病的主要原因[4],病毒耐低pH环境,可在易感动物小肠绒毛上皮细胞中复制,造成细胞变性、绒毛缩短等从而导致吸收障碍和腹泻。新生仔猪感染TGEV后20 h内患胃肠炎,在1 d~4 d死亡,1周龄仔猪感染后病死率可达100%[5]。TGEV可通过消化道和呼吸道与受感染个体或与带病猪粪便、乳汁、呕吐物、呼吸及鼻腔分泌物直接接触发生,猪只因摄取被病毒污染的物质发病[6-7]。近年来,TGE在国内流行形势严峻,已成为严重危害养猪业的重要疫病之一[8-9]。
TGEV基因组为不分段的单股正链RNA,其5′端有帽子结构,3′端有poly(A)尾,基因组与核蛋白结合,具有感染性。整个基因组全长约28.5 kb,结构为5′-ORF1a-ORF1b-S(ORF2)-ORF3a-ORF3b-sM(ORF4)-M(ORF5)-N(ORF6)-ORF7-3′[10-11],其中ORF2编码的S糖蛋白形成典型的花瓣状囊膜突起,突出于病毒粒子表面,它携带主要的B淋巴细胞抗原决定簇,是唯一能诱导机体产生中和抗体和提供免疫保护作用的结构蛋白[12],而且含有宿主细胞氨肽酶受体的识别位点,决定着宿主细胞亲嗜性、TGEV的致病性和血凝作用,还具有细胞膜融合作用,可以使病毒核蛋白进入细胞浆,是目前TGE基因工程疫苗的研究靶点[13-14]。TGEV S基因全长约4.3 kb,其氨基端约1/2的区域含有4个抗原位点(从N-端到C-端依次为C,B,D和A)[15],其诱导机体产生的免疫保护作用几乎相当于全长S蛋白诱导产生的保护作用[16-17]。目前没有防治该病的特效药物,疫苗接种是预防该病的有效措施,然而传统疫苗接种后并不能达到期望的效果。现已证实,针对TGE的免疫属于获自母猪乳汁的被动免疫,长期以来,疫苗研究的目标在于使乳汁中起主要免疫作用的IgA抗体能不断分泌,但效果总不能令人满意[18]。本研究拟构建表达TGEV S蛋白 C、B、D、A抗原位点的真核质粒,为构建TGE核酸疫苗和利用细胞因子诱导核酸疫苗刺激机体产生的抗体向分泌型IgA进行类别转换的研究奠定基础。
1 材料与方法
1.1材料
1.1.1细胞与病毒ST细胞、293T细胞、猪传染性胃肠炎病毒(TGEV)陕西分离株,由西北农林科技大学兽医免疫生物学实验室保存;感受态细胞DH5α,北京全式金生物技术有限公司产品。
1.1.2主要试剂质粒提取试剂盒、胶纯化试剂盒,北京全式金生物技术公司产品;RNAiso Plus、PrimeSTAR®HS DNA polymerase、TaqTMVersion 2.0 plus dye、DNA Marker,TaKaRa公司产品;T4 DNA Ligase、BamHⅠ、EcoRⅠ,NEB公司产品;pcDNA3.1/V5-HisB、转染试剂LipofectamineTM3000、Agarose(Molecular Biology Grade),Invitrogen 公司产品;DMEM培养基、胎牛血清(FBS)、胰酶(trypsin)、Opti-MEM®Ⅰ(1×)、氨苄青霉素钠盐(Amp),Gibco公司产品;PageRuler Prestained Protein ladder,Thermo Scientific公司产品;NP-40裂解液,碧云天生物技术公司产品;Anti-His mouse mAb ,Tianjin Sungene公司产品;猪 TGEV阳性血清,TSZ Biosciences公司产品;GAPDH Rabbit mAb,CST公司产品;HRP-conjugated Affinipure Goat Anti-Mouse IgG、HRP-conjugated Affinipure Goat Anti-swine IgG,Jackson ImmunoResearch公司产品。
1.2方法
1.2.1引物的设计和合成根据TGEV陕西分离株[19]S基因序列,利用Primer Premier 5.0设计1对扩增包括编码S蛋白C、B、D、A 4个抗原位点序列的引物。上游引物F-eTGEV-S序列为5′-CGCGGATCCATGAAAAAACTATTTGTGGTTTTG-3′,下游引物R-eTGEV-S 序列为5′-CCGGAATTCTAAAACGTCCGTGCAGTTTCG-3′,在上、下游引物中分别引入BamHⅠ和EcoRⅠ酶切位点(下划线),扩增产物大小预期为1 800 bp。引物由上海英潍捷基贸易有限公司合成。
1.2.2病毒增殖、总RNA提取与cDNA合成将保存的种毒接种于培养至80%左右融合度的ST细胞,收获出现明显细胞病变的接毒48 h的细胞。反复冻融3次离心收获上清液,应用Mini BEST Viral RNA/DNA Extraction Kit按试剂盒说明提取上清液中病毒总RNA,按PrimeScriptTMRT Reagent Kit试剂盒说明书操作,以提取的总RNA为模板进行cDNA合成,反应体系:5×PrimeScriptTMRT Reagent Kit 2.0 μL,Prime Script RT Enzyme Mix Ⅰ 0.5 μL,Oligo dT Primer (50 μmol/L) 0.5 μL,Random 6 mers (100 μmol/L) 2.0 μL,Total RNA 1 000 ng,RNase Free ddH2O补足至10 μL。反应条件:37 ℃ 15 min;85 ℃ 5 s、4 ℃保存。合成的cDNA直接用于PCR扩增或置-20 ℃保存备用。
1.2.3目的片段的扩增及鉴定按50 μL体系进行目的片段扩增,反应体系:cDNA 1 μL,上游、下游引物各1 μL,d NTP 4 μL,PrimeSTAR®HS DNA polymerase 0.5 μL,5×PrimeSTAR®buffer 10 μL,灭菌双蒸水补足至50 μL。反应条件采用两步法:98 ℃ 5 min;98 ℃ 10 s、68 ℃ 2 min,30个循环;然后72 ℃ 7 min,反应结束后产物于4 ℃保存。取5 μL PCR产物用10 g/L琼脂糖凝胶电泳检测,紫外凝胶成像系统观察结果。
1.2.4重组质粒的构建与鉴定参考DNA胶回收试剂盒说明书回收目的片段并进行BamHⅠ、EcoRⅠ双酶切,回收酶切产物与用相同酶酶切的pcDNA3.1/V5-HisB载体16 ℃过夜连接。将连接产物转化 DH5α感受态细胞,涂板培养后挑取单菌落摇菌并进行菌液PCR鉴定,阳性菌液提取质粒进行双酶切鉴定。随机选取菌液PCR和双酶切鉴定均为阳性的质粒3份送生工生物工程(上海)股份有限公司测序,将测序正确的质粒命名为pcDNA3.1/V5-His-TGEV-S。
1.2.5细胞转染在转染前1 d,用含100 mL/L FBS不含抗生素的DMEM培养液将生长状态良好的293T细胞按5×105个/孔铺于6孔细胞板,培养至细胞密度达70%~80%融合度时(约24 h)按LipofectamineTM3000说明进行重组质粒转染,同时设置空载体对照,转染后6 h~8 h将培养液更换为含100 mL/L FBS的DMEM培养液继续培养。
1.2.6目的蛋白表达鉴定转染后2 d~4 d收集转染的细胞,连同收集的正常293T细胞用NP40裂解液充分裂解。准备样品进行100 g/L分离胶 SDS-PAGE,电泳结束后将蛋白转印至PVDF膜,用50 g/L脱脂奶粉室温封闭2 h,PBS′T洗膜后参照蛋白Marker裁剪膜后转入相应的anti His-Tag mouse mAb(Tianjin Sungene,0.5 μg/mL)或猪 TGEV阳性血清(TSZ Biosciences,1∶500)或GAPDH Rabbit mAb(CST,1∶1 000)中4℃孵育过夜,次日洗膜后将膜放入HRP-标记的相应二抗中(80 ng/mL),室温孵育1 h,洗膜后用ECL底物发光液浸泡2 min,ChemiDocTMMP Imaging Systerm显色并拍照记录结果。
2 结果
2.1病毒增殖
将TGEV接种于80%左右融合度的ST细胞,与正常ST细胞(图1A)相比,24 h即出现肉眼可见的细胞病变,部分细胞开始聚集成小的细胞团,细胞间界限清晰度下降(图1B),到48 h细胞病变已经很明显,部分细胞已经形成比较大的细胞团,个别细胞肿大圆缩脱落,有些细胞细胞融合成为多核细胞(图1C)。

A.正常ST细胞;B.感染24 h;C.感染48 h
2.2目的基因 PCR扩增结果
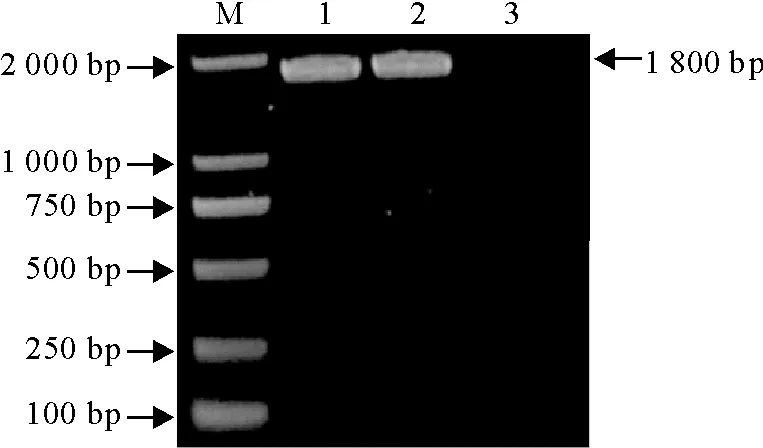
PCR产物经10 g/L琼脂糖凝胶电泳检测,在约1 800 bp处有一条特异条带,与预期结果一致(图2)。M.DNA标准DL 2 000;1~2.目的基因PCR产物;3.阴性对照
M.DNA Marker DL 2 000;1-2.PCR products of target gene;3.Negative control
图2TGEV S基因片段PCR扩增结果
Fig.2PCR amplification result of S gene fragment of TGEV
2.3重组质粒鉴定
挑取单菌落摇菌进行菌液PCR鉴定,阳性菌液提取质粒进行BamHⅠ和EcoRⅠ双酶切,结果切出约5 500 bp的载体条带和1 800 bp的目的条带,与预期结果一致(图3)。
2.4融合蛋白表达产物Western blot鉴定结果
收集转染的细胞,以anti His-Tag mAb(图4A)或猪TGEV阳性血清(图4B)为一抗,HRP-标记的相应抗体为二抗,进行Western blot试验,结果转染重组质粒的细胞样品在69 ku处均有免疫印迹条带,正常293T细胞样品和转染空载体的细胞样品均无相应条带(图4A和图4B),说明293T细胞表达的目的蛋白能与TGEV阳性血清和anti His-Tag mAb发生反应,表明获得的TGEV S蛋白具有良好的反应原性。

M.DNA标准DL 8 000;1~4.重组质粒pcDNA3.1/V5-His-TGEV-S 双酶切
M.DNA Marker DL 8 000;1-4.Recombinant plasmid pcDNA3.1/V5-His-TGEV-S digested byBamHⅠ andEcoRⅠ
图3重组质粒pcDNA3.1/V5-His-TGEV-S双酶切鉴定结果
Fig.3Identification of pcDNA3.1/V5-His-TGEV-S by double enzyme digestion
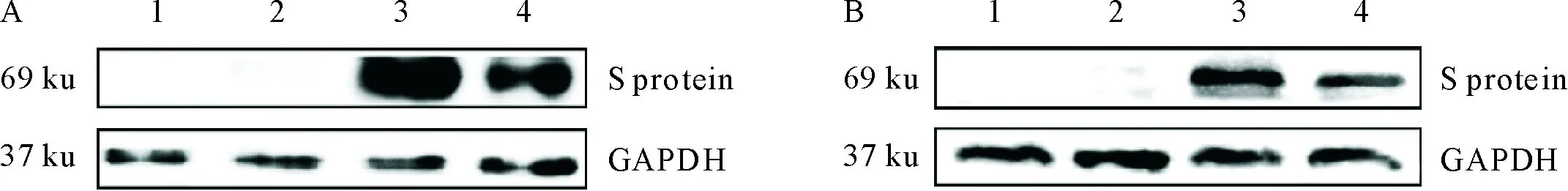
A.抗His标签单克隆抗体;B.猪TGEV阳性血清
3 讨论
猪传染性胃肠炎是由猪传染性胃肠炎病毒引起的一种急性、高度接触性消化道传染病。该病发病急,传播快,各年龄段猪均可感染,仔猪病死率高,可达100%,日龄较大猪或成年猪虽然发病但几乎没有死亡,却可以引起猪只掉膘、降低饲料报酬、增加药费和人力等开支,造成的损失非常严重[20]。该病目前仍无安全有效的防控方法和治疗的理想药物。现已证实,TGEV的免疫属于获自母猪乳汁的被动免疫,长期以来,疫苗研究的目标在于使起主要免疫作用的IgA抗体能不断分泌,但效果总不满意[18]。本研究利用PCR技术扩增出S基因氨基端长为1.8 kb的片段,其中包含C、B、D、A 4个主要抗原位点,然后将其克隆到pcDNA3.1/V5-HisB真核表达载体上,为S基因核酸疫苗的构建鉴定基础。
pcDNA3.1/V5-HisB是Invitrogen 公司开发的高拷贝哺乳细胞表达载体,羧基端带有V5和His标签,由CMV启动子启动融合蛋白高效表达,携带的标签蛋白使得用抗V5或抗His标签蛋白单抗很容易检测目的蛋白的表达。TGEV ORF2 编码的S蛋白携带主要的B 淋巴细胞抗原决定簇,是唯一能诱导机体产生中和抗体和提供免疫保护作用的结构蛋白,也是TGE基因工程疫苗的研究靶点。S蛋白具有良好的免疫原性,能诱导机体产生特异性IgG和黏膜分泌型IgA[21]。S蛋白含有C、B、D、A 4个主要抗原位点,这些位点位于占S蛋白一半的543 aa的氨基端内。张莉等[22]用毕赤酵母真核表达系统表达猪传染性胃肠炎河北分离株S蛋白氨基端含有C、B、D、A 抗原位点的片段,Western blot检测显示获得了分子质量为82 ku左右的目的蛋白,用纯化的蛋白免疫接种小鼠,ELISA检测显示表达的蛋白具有免疫活性。本研究采用pcDNA3.1/V5-HisB载体构建TGE S基因核酸疫苗,转染293T细胞采用抗His标签单抗和猪TGEV阳性血清为一抗的Western blot均检测到目的蛋白的表达,表明构建的核酸疫苗可以启动目的蛋白的表达。
TGE主要通过肠道感染猪只,猪小肠是TGEV的重要靶器官,肠道局部黏膜免疫对阻止TGEV的侵入具有极其重要的作用。肠道分泌型IgA在抗TGEV感染中发挥主要作用[23]。张小会等[24]研究了TGEV S基因疫苗SL7207(PVAXD-TS)口服免疫仔猪后诱导产生的免疫规律,发现仔猪口服免疫后第4周即可检测到抗TGEV的特异性IgG和粪黏液IgA抗体,中和试验显示疫苗诱导的血清IgG具有中和活性,证实以减毒沙门菌为载体的TGEV S基因疫苗口服免疫仔猪有较好的免疫原性。抗体类别转换是指抗体可变区不变,即结合抗原的特异性相同,但其重链类型(恒定区)发生改变。每个B细胞开始时一般均表达IgM,但随后可通过抗体类别转换表达和产生不同类型的抗体,如IgG、IgA、IgE和抗体类别转换主要由Ig恒定区基因重组或其重链mRNA的不同拼接所导致。抗体的类别转换是在抗原诱导下发生的,而Th细胞分泌的多种细胞因子则直接调节抗体转换的类别。局部微环境和细胞因子可影响和调节免疫球蛋白类型的转换。白细胞介素5(IL-5)是白细胞介素家族的重要细胞因子之一,研究发现IL-5可以促进IgA的产生。本课题组前期已经获得了编码猪IL-5的基因序列,并构建了相应的真核表达载体[25],TGEV S基因真核表达载体的构建为后续将其与猪IL-5联合使用,以刺激免疫猪使其产生的抗体向SIgA转换,从而提高疫苗刺激母猪肠道SIgA的应答能力,加强对仔猪免疫保护作用的研究鉴定了基础。
目前,虽然关于S基因的各种新型疫苗的研究层出不穷,但基本都处于实验室研究阶段,还没有能真正用于临床的。临床上防控该病仍然从接种灭活疫苗和弱毒疫苗、杜绝引入病原、加强管理、对症治疗等几个方面进行。如何在现有基础上提高所用疫苗的免疫作用,获得更好的保护效果,是摆在所有研究者面前的一道难题。相信随着分子生物学、分子免疫学等学科与技术的发展,在TGE的防控上会取得更大的突破。
[1]Yuan X,Lin H,Fan H.Efficacy and immunogenicity of recombinant swinepox virus expressing the A epitope of the TGEV S protein [J].Vaccine,2015,33(32):3900-3906.
[2]Li P,Ren X.Reverse transcription loop-mediated isothermal amplification for rapid detection of transmissible gastroenteritis virus [J].Curr Microbiol,2011,62(3):1074-1080.
[3]Yu T F,Shao S L,Xu X J,et al.Express transmissible gastroenteritis virus spike gene B and C antigen sites in multiple expression systems [M]//ZHU E,SAMBATH S.Information Technology and Agricultural Engineering.Berlin,Heidelberg;Springer Berlin Heidelberg.2012:49-56.
[4]Suo S,Wang X,Zarlenga D,et al.Phage display for identifying peptides that bind the spike protein of transmissible gastroenteritis virus and possess diagnostic potential [J].Virus Genes,2015,51(1):51-56.
[5]Abid N B,Chupin S A,Bjadovskaya O P,et al.Molecular study of porcine transmissible gastroenteritis virus after serial animal passages revealed point mutations in S protein [J].Virus Genes,2011,42(2):212-219.
[6]Schwegmann-Wessels C,Herrler G.Sialic acids as receptor determinants for coronaviruses [J].Glycoconj J,2006,23(1-2):51-58.
[7]任晓峰,佟玲,孙雪娇,等.猪传染性胃肠炎病毒(TGEV)种毒特性研究 [J].东北农业大学学报,2013,44(6):1-7.
[8]杨小泉.猪流行性腹泻和传染性胃肠炎综合防控措施探索 [D].湖南长沙:湖南农业大学,2013.
[9]谢立兰,方六荣,方华为,等.免疫学和分子生物学技术在猪传染性胃肠炎诊断中的应用进展 [J].中国兽药杂志,2016,50(2):56-62.
[10]邢瑞.猪传染性胃肠炎病毒全基因组扩增及S蛋白表达 [D].内蒙古呼和浩特:内蒙古农业大学,2011.
[11]Penzes Z,Gonzalez J M,Calvo E,et al.Complete genome sequence of transmissible gastroenteritis coronavirus PUR46-MAD clone and evolution of the purdue virus cluster [J].Virus Genes,2001,23(1):105-118.
[12]Jimenez G,Correa I,Melgosa M P,et al.Critical epitopes in transmissible gastroenteritis virus neutralization [J].J Virol,1986,60(1):131-139.
[13]Gelhaus S,Thaa B,Eschke K,et al.Palmitoylation of the Alphacoronavirus TGEV spike protein S is essential for incorporation into virus-like particles but dispensable for S-M interaction [J].Virology,2014,464-465:397-405.
[14]穆杨.猪传染性胃肠炎疫苗研究进展 [J].动物医学进展,2011,32(2):91-96.
[15]Weiwei H,Qinghua Y,Liqi Z,et al.Complete genomic sequence of the coronavirus transmissible gastroenteritis virus SHXB isolated in China [J].Arch Virol,2014,159(9):2295-2302.
[16]Meng F,Zhao Z,Li G,et al.Bacterial expression of antigenic sites A and D in the spike protein of transmissible gastroenteritis virus and evaluation of their inhibitory effects on viral infection [J].Virus Genes,2011,43(3):335-341.
[17]Reguera J,Ordono D,Santiago C,et al.Antigenic modules in the N-terminal S1 region of the transmissible gastroenteritis virus spike protein [J].J Gen Virol,2011,92(Pt 5):1117-1126.
[18]Peng S Y,Lü N,Zhang Y,et al.Immune response induced by spike protein from transmissible gastroenteritis coronavirus expressed in mouse mammary cells [J].Virus Res,2007,128(1-2):52-57.
[19]穆杨,丛日华,梁宁.传染性胃肠炎病毒陕西分离株S基因主要抗原位点基因的克隆与序列分析 [J].西北农业学报,2011,20(7):17-21.
[20]殷震,刘景华.动物病毒学[M].2版 北京:科学出版社,1998.
[21]Tuboly T,Nagy E.Construction and characterization of recombinant porcine adenovirus serotype 5 expressing the transmissible gastroenteritis virus spike gene [J].J Gen Virol,2001,82(Pt 1):183-190.
[22]张莉,康雪燕,章振华,等.毕赤酵母表达的猪传染性胃肠炎病毒纤突糖蛋白及其免疫原性分析 [J].华北农学报,2015,30(6):84-90.
[23]Shirato K,Maejima M,Matsuyama S,et al.Mutation in the cytoplasmic retrieval signal of porcine epidemic diarrhea virus spike (S) protein is responsible for enhanced fusion activity [J].Virus Res,2011,161(2):188-193.
[24]张小会,张丹,梁恩涛,等.减毒沙门氏菌投递的TGEVS基因疫苗口服免疫猪的动态规律 [J].中国人兽共患病学报,2016,32(1):33-38.
[25]穆杨,刘园园,李亮亮,等.关中黑猪IL-5 cDNA的克隆表达与多克隆抗体制备 [J].细胞与分子免疫学杂志,2013,29(9):953-957.
Eukaryotic Expression of S Protein Antigenic Sites of Transmissible Gastroenteritis Virus Shaanxi Isolate
SONG Lin-lin1,WANG Xiao-hong1,JIANG Bo1,ZHAO Yi2,WANG Xiang3,MU Yang1
(1.College of Veterinary Medicine,Northwest A&F University,Yangling,Shaanxi, 712100,China;2.ShaanxiCentreforAnimalDiseaseControlandPrevention,Xi'an,Shaanxi,710016,China;3.VeterinaryHealthInspectionStationofZhangzhen,Shunyi,Beijing, 101307,China)
Transmissible gastroenteritis (TGE) is a highly contagious viral disease seriously damaging the healthy development of swine industry worldwide.S protein of transmissible gastroenteritis virus(TGEV),carrying major antigenic determinant of B lymphocytes,is the main antigen which can induce neutralizing antibodies.In this study,gene fragment encoding C,B,D,A antigenic site of S protein was amplified using the RNA template extracted from ST cells infected with TGEV Shaanxi isolate.Recombinant expression plasmid was constructed by inserting target fragment into the eukaryotic expression vector pcDNA3.1/V5-HisB.293T cells were transfected with the recombinant vector and the expression of target gene was detected by Western blot.The results showed gene fragment encoding C,B,D,A antigenic sites of S protein was successfully amplified.The results of Western blot using TGEV positive pig serum and anti-His monoclonal antibody indicated that the target gene was expressed in 293T cells.This study laid the foundation for the development of TGE DNA vaccine.
Transmissible gastroenteritis virus;spike gene;antigen site;eukaryotic expression
2016-03-15
陕西省农业攻关项目(2014K01-22-01)
宋林林(1989-),女,山东聊城人,硕士研究生,主要从事重大动物疫病发病机制研究。*通讯作者
S852.659.3;Q786
A
1007-5038(2016)08-0006-05

