大肠埃希菌PCR检测方法的建立及应用
赵凤菊,顾贵波,李井春,王 竹
(辽宁省动物疫病预防控制中心,辽宁沈阳 110164)
大肠埃希菌PCR检测方法的建立及应用
赵凤菊,顾贵波,李井春,王竹
(辽宁省动物疫病预防控制中心,辽宁沈阳 110164)
本研究建立了一种快速诊断动物大肠杆菌病的PCR检测方法,与传统的细菌分离培养、生化鉴定方法相比较有效缩短了检测时间,提高了检测效率,同时为大肠杆菌病的快速诊断和流行病学调查提供了有效的技术手段。通过对大肠埃希菌ECs1048基因序列分析,利用Premier5.0软件设计并合成了1对特异性引物,建立了检测大肠埃希菌ECs1048基因的PCR检测方法。通过反复试验确定本方法的最佳退火温度为56℃。灵敏性试验和特异性试验表明本方法能够检测出的最低菌悬液浓度为1.5×102CFU/mL,并具有较高的特异性。稳定性与重复性试验表明本方法具有良好的稳定性。利用本方法对临床样品的检测结果与生化试验鉴定结果的符合率为100%。本研究建立的检测方法灵敏性高、特异性强、稳定性好,可应用于动物大肠杆菌病的诊断。
大肠埃希菌;聚合酶链反应;建立
大肠埃希菌(Escherichiacoli)广泛存在于自然界中,其中致病性大肠埃希菌是能引起人和动物共同感染的重要人兽共患病病原[1]。在不发达和中等发达国家大肠埃希菌是引起新生儿败血症的主要原因之一,每年因新生儿败血症死亡的儿童达100万以上[2]。5岁以下儿童中,30%~40%急性腹泻病例是由致泻大肠埃希菌引起的[3]。近5年来,每年每10个死亡的孩子中就有一个是腹泻病导致的。随着大型集约化养殖业的发展,病原性大肠埃希菌对畜牧业造成的损失已日益明显[4]。由于大肠埃希菌抗原性复杂,血清型较多,且各血清型间几乎没有交叉保护作用,从而给本病的免疫预防造成很大困难[5-6]。因此,快速诊断成为有效控制大肠杆菌病的关键。
大肠埃希菌一般先根据其培养特性、生物学特性进行初步鉴定,然后根据生化试验进行最终的确诊。但传统的细菌分离、生化试验等鉴定方法存在操作过程繁琐、耗时长等缺点[10]。因此,建立快速、特异的检测方法对大肠杆菌病的诊断具有重要意义。随着分子生物学技术的发展,PCR技术被广泛应用于各种细菌病的病原鉴定。本研究根据大肠埃希菌的保守基因ECs1048序列设计引物,建立了大肠埃希菌PCR检测方法。不仅为大肠杆菌病的快速诊断提供了技术支持,同时也为本病的有效防控提供科学依据。
1 材料与方法
1.1材料
1.1.1样品致病性大肠埃希菌临床分离株、金黄色葡萄球菌、沙门菌、奇异变形杆菌、猪链球菌、巴氏杆菌由辽宁省动物疫病预防控制中心保存;大肠埃希菌ATCC25922购自杭州市天和微生物试剂有限公司;羊梭菌病多联干粉灭活疫苗购自哈药集团生物疫苗有限公司(201204);临床病料采自辽宁地区。
1.1.2主要试剂DNAzol提取试剂、ExTaqDNA聚合酶、10×ExTaqbuffer、2.5 mmol/L dNTPs、DNA Marker DL 2 000、溴化乙锭,宝生物工程(大连)有限公司产品;营养琼脂培养基、麦康凯培养基,北京奥博星生物技术有限公司产品,生产批号分别为20130608、20130708;细菌肠杆菌科微量生化反应管,杭州天和微生物试剂公司产品。
1.1.3引物根据GenBank上登录的大肠埃希菌ECs1048(EU902952.1)基因序列,利用Primer Premier5.0软件设计并合成了1对特异性引物。引物由上海生工生物工程技术服务有限公司合成。引物序列为:F:5′-GCCTCGCCTGGAGAATGA-3′,R:5′-CCTGAGACTGCGGTGGAA-3′。扩增目的片段大小为272 bp。
1.2方法
1.2.1细菌的培养及DNA模板的制备将大肠埃希菌划线接种于麦康凯培养基于37℃培养18 h~24 h后,挑选典型菌落,用1 mL无菌生理盐水制备成一定浓度的菌悬液。吸取200 μL菌悬液至1.5 mL Eppendorf管中,加入800 μL DNAzol提取试剂,混匀后4℃、12 000 r/min离心10 min。吸取900 μL上清,置于另一1.5 mL Eppendorf管中,加入500 μL无水乙醇,混匀后4℃、12 000 r/min离心5 min。吸弃上清,用无菌水配制的750 mL/L乙醇洗涤2次,干燥后用40 μL无菌水溶解沉淀,置-20℃保存备用。
1.2.2反应体系及反应条件优化采用25 μL反应体系,通过对PCR反应体系及反应条件的优化,确定PCR反应体系为:10×PCR buffer 2.5 μL,2.5 mmol/L dNTPs 2 μL,上、下游引物(20 μmol/L)各1 μL,ExTaq酶0.125 μL,灭菌水16.375 μL,模板 2 μL。
反应条件为:94℃ 5 min;94℃ 45 s,56℃ 45 s,72℃ 50 s,35个循环;72℃ 10 min。扩增产物经10 g/L琼脂糖凝胶(含0.5 μg/mL溴化乙锭)电泳,然后用凝胶成像系统分析。
1.2.3特异性试验提取大肠埃希菌、金黄色葡萄球菌、沙门菌、奇异变形杆菌、猪链球菌、巴氏杆菌、羊梭菌病多联干粉灭活疫苗菌的核酸,并设立无模板阴性对照。按优化的PCR反应条件,分别以各菌种基因组DNA为模板进行PCR扩增,检测该方法的特异性。
1.2.4敏感性试验将纯培养物制成1.5×108CFU/mL~101CFU/mL菌悬液,然后分别提取基因组DNA进行PCR扩增,检测该方法的敏感性。
1.2.5重复性与稳定性试验利用优化后的反应体系和反应条件,分3次提取大肠埃希菌标准阳性菌株的基因组DNA,并平行进行3次PCR扩增,检测方法的稳定性。
1.2.6临床病料检测
1.2.6.1细菌分离鉴定无菌采集18份临床疑似病料,同时接种营养琼脂培养基、麦康凯培养基于37℃培养18 h~24 h。并于麦康凯培养基上挑取典型菌落进行纯培养,然后按厂家肠杆菌科细菌微量生化鉴定管要求进行生化鉴定。1.2.6.2临床样品的PCR检测对18份临床疑似病料样品提取基因组DNA,用本试验建立的PCR方法进行检测并与细菌分离鉴定结果进行比较分析。
2 结果
2.1目的基因的扩增结果
分别提取大肠埃希菌标准菌株及临床分离株的DNA,进行PCR扩增反应。结果显示,可扩增出272 bp的目的基因条带,证明该方法可扩增出hypothetical protein(ECs1048)基因(图1)。
2.2特异性试验结果
以优化的PCR反应条件检测该方法对大肠埃希菌、金黄色葡萄球菌、沙门菌、奇异变形杆菌、猪链球菌、巴氏杆菌、梭菌的特异性。结果显示,仅以大肠埃希菌的DNA为模板能扩增出特异性目的条带。表明该方法具有较高的特异性,与其他病原无交叉反应(图2)。
M.DNA标准DL 2 000;1.大肠埃希菌ATCC25922;2.大肠埃希菌分离株;N.阴性对照
M.DNA Marker DL 2 000;1.E.coliATCC25922;2.E.coliisolate;N.Negative control
图1目的基因的PCR扩增
Fig.1PCR amplification of target gene
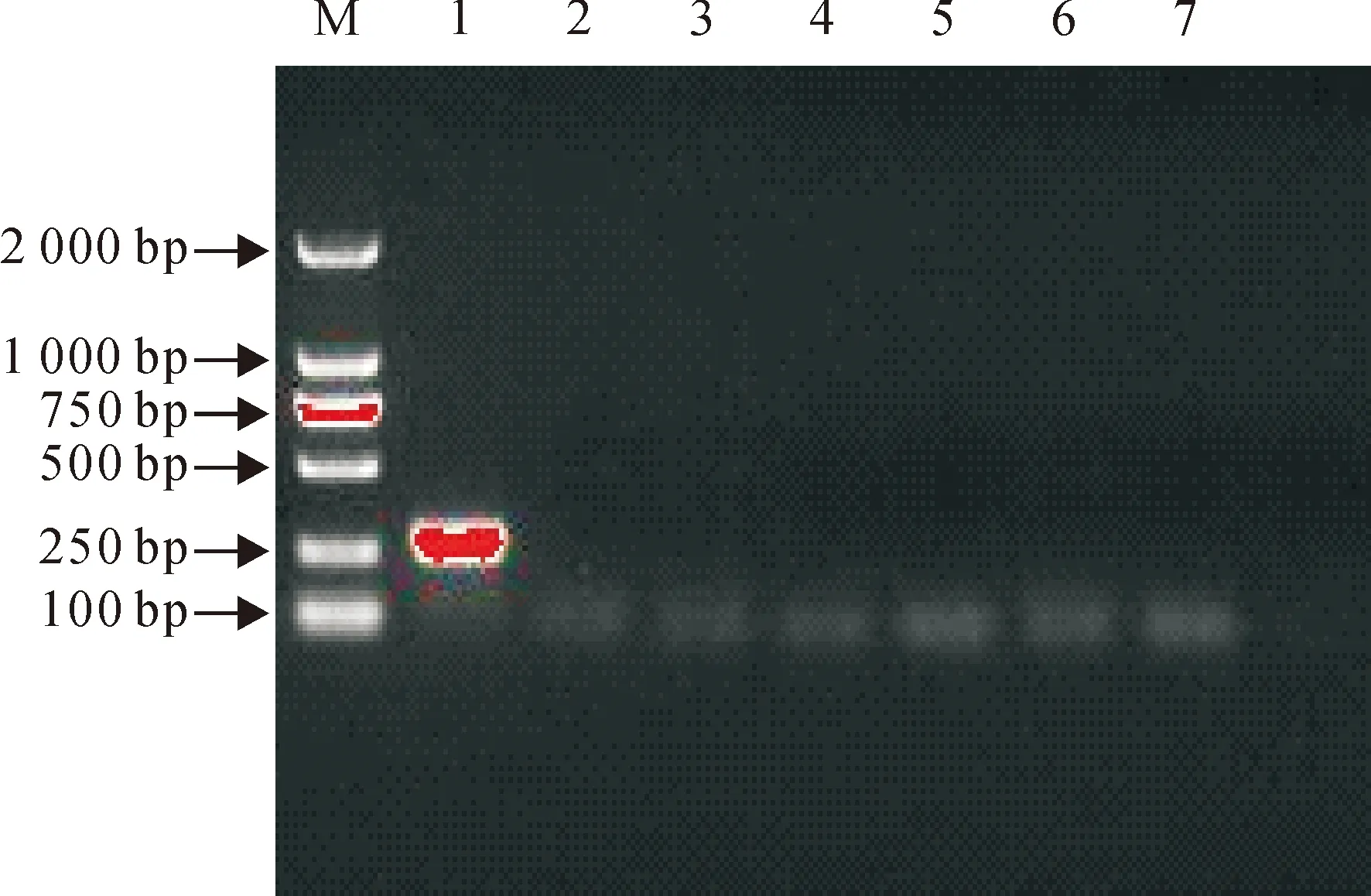
M.DNA标准DL 2 000;1.大肠埃希菌;2.金黄色葡萄球菌;3.沙门菌;4.奇异变形杆菌;5.猪链球菌 ;6.巴氏杆菌;7.羊梭菌病多联干粉灭活疫苗
M.DNA Marker DL 2 000;1.E.coli;2.S.aureus;3.Salmonella;4.Proteusmirabilis;5.Streptococcussuis;6.Pasteurella;7.Clostridiumperfringens
图2PCR特异性试验
Fig.2The specificity test of PCR
2.3敏感性试验结果
提取浓度为1.5×108~101CFU/mL的大肠埃希菌菌悬液的DNA为模板进行PCR扩增,电泳结果显示,能扩增出目的条带的最低菌悬液浓度为1.5×102CFU/mL(图3)。
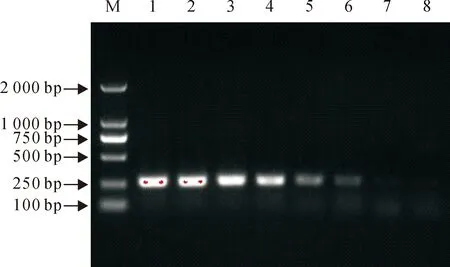
M.DNA Marker DL 2 000;1.1.5×108CFU/mL;2.1.5×107CFU/mL;3.1.5×106CFU/mL;4.1.5×105CFU/mL;5.1.5×104CFU/mL;6.1.5×103CFU/mL;7.1.5×102CFU/mL;8.1.5×101CFU/mL
图3PCR敏感性试验
Fig.3The sensitivity test of PCR
2.4重复性与稳定性试验结果
通过试验表明该方法具有良好的重复性与稳定性(图4)。
2.5临床病料的检测结果
2.5.1细菌分离鉴定结果通过细菌分离培养与革兰染色镜检,18份样品中14份样品分离菌的培养特征与镜检结果与大肠埃希菌相符。将这14份样品的培养物进行生化鉴定,结果生化特性基本与大肠埃希菌相符。
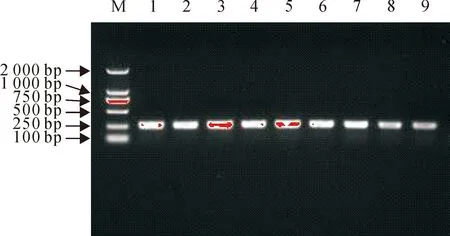
M.DNA标准DL 2 000;1~3.第1次提取的DNA;4~6.第2次提取的DNA;7~9.第3次提取的DNA
M.DNA Marker DL 2 000;1-3.DNA extracted first time;4-6.DNA extracted second time;7-9.DNA extracted third time
图4PCR方法重复性与稳定性试验
Fig.4The reproducibility and stability tests of PCR
2.5.2临床样品的PCR检测应用建立的方法对18份临床疑似病料进行检测,14份为大肠埃希菌阳性,4份为大肠埃希菌阴性。将检测结果与细菌分离培养鉴定结果相比较,结果显示,该PCR方法鉴定结果与病原分离培养鉴定结果符合率为100%。证明建立的方法可以准确地检测出病料中的大肠埃希菌,可以很好的应用于临床样品的检测(图5)。

M.DNA标准DL 2 000;1~18.临床样品;N.阴性对照:P.阳性对照
3 讨论
大肠埃希菌是人和各种动物肠道内的正常菌群,一般情况下不具有致病力,其中一些特殊血清型的大肠埃希菌对人和动物有致病性,能够引起人和动物的腹泻、败血症、心内膜炎、肺炎、泌尿道感染、幼畜或幼儿脑炎、腹膜炎等[11-12]。传统的细菌分离鉴定虽然能够满足临床的部分需要,但仍存在需时较长的缺点。随着分子生物学技术的发展,PCR技术已经成功应用于多种细菌病的病原鉴定。PCR技术的应用不仅提高了检测的准确性,还加快了检测速度,为动物疫病防控争取到宝贵时间,降低了动物疫病给畜牧业可能造成的经济损失,同时也为有效控制动物疫病的传播提供了新的技术支持。
本试验建立的大肠埃希菌PCR检测方法能够扩增出与预期大小一致的目的基因条带,且对其他6种细菌均无扩增反应,表明该PCR检测方法具有较高的特异性。通过敏感性试验发现在菌悬液浓度为1.5×102CFU/mL时也能扩增出清晰的目的条带,表明其具备较好的敏感性。对该PCR检测方法的重复性评价说明建立的方法具有较高的精确度和良好的稳定性。大肠埃希菌PCR检测方法建立后,利用该方法与传统的细菌分离鉴定方法同时对临床患病猪的样品进行检测,符合率达100%,说明建立的方法不仅可应用于纯培养物的检测,也可成功应用于临床样品的检测。
准确的疫病诊断是采取有效控制疫病蔓延的关键,而检测方法的灵敏性与特异性又是准确诊断的必要条件。近几年,猪群特别是规模化猪场频繁发生腹泻性疾病,给养猪业造成了巨大的经济损失。然而导致猪只腹泻的原因多而复杂,虽然采取了相应的防治措施,但防治效果并不明显。大肠埃希菌是引起腹泻的一个重要原因,但因为一些因素导致易被人们忽视。全面分析发病原因,采取合理的治疗措施,对疫病有效防控尤为重要。本试验建立的检测方法不仅为大肠杆菌病的诊断提供了有效的技术支持,也为本病的有效防控提供了理论依据。
[1]马增军,芮萍,逯春香.猪源肠外致病性大肠杆菌的分析与鉴定[J].中国人兽共患病学报,2015,31(2):130-134.
[2]Cools P,Jespers V,Hardy L,et al.A multi-country cross-sectional study of vaginal carriage of group B streptococci (GBS) andEscherichiacoliin resource-poor settings:prevalences and risk factors[J].PLoS One,2016,11(1):e0148052.doi: 10.1371/journal.pone.0148052.
[3]Odetoyin B W,Hofmann J,Aboderin A O,et al.DiarrhoeagenicEscherichiacoliin mother-child pairs in Ile-Ife,South Western Nigeria[J].BMC Infect Dis,2016,16(1):28. doi: 10.1186/s12879-016-1365-x.
[4]Liu L,Johnson H L,Cousens S,et al.Global,regional,and national causes of child mortality:an updated systematic analysis for 2010 with time trends since [J].Lancet,2012,379:2151-2161.
[5]陈浦言.兽医传染病学[M].北京:中国农业出版社,2012.
[6]高荣琨,王丽芳,李锐,等.太原地区鸡源性大肠杆菌的分离鉴定及耐药性分析[J].中国预防兽医学报,2013,35(8):631-634.
[7]Hu P,Janga S C,Babu M,et al.Global functional atlas ofEscherichiacoliencompassing previously uncharacterized proteins[J].PLoS Biol,2009,7(4):e96. doi: 10.1371/journal.pbio.1000096.
[8]Neuhaus K,Landstorfer R,Fellner L,et al.Translatomics combined with transcriptomics and proteomics reveals novel functional,recently evolved orphan genes inEscherichiacoliO157:H7 (EHEC) [J].BMC Genomics,2016,17:133. doi: 10.1186/s12864-016-2456-1.
[9]Tautz D,Domazet-Loso T.The evolutionary origin of orphan genes[J].Nat Rev Genet,2011,12(10):692-702.
[10]黄埔和平,杨霞,赵军,等.鸭源鸡杆菌双重PCR检测方法的初步建立[J].中国预防兽医学报,2013,35(8):640-643.
[11]姜晓冰.大肠杆菌质粒介导喹诺酮耐药机制研究[D].广东广州:华南理工大学,2013.
[12]郭雪丽,王红宝,李红丽,等.山西省致病性猪大肠杆菌分离及生物特性研究[J].养猪,2015(2):97-99.
Establishment and Preliminary Application of PCR for DetectingEscherichiacoli
ZHAO Feng-ju,GU Gui-bo,LI Jing-chun,WANG Zhu
(Prevention and Control Center of Liaoning Province Animal Epidemic Disease,Shenyang,Liaoning,110164,China)
This study established a rapid diagnostic PCR method for colibacillosis in animals.Compared with traditional bacterial culture,biochemical identification method,the PCR can effectively reduce the test time,improve the detection efficiency.Also it provided the effective technical means for rapid diagnosis and epidemiological investigation of the disease.Based on ECs1048 gene sequence fromEscherichiacoli,a pair of specific primers were designed and synthesized by premier 5.0 software,and the PCR detection method for ECs1048 gene was established.The optimum annealing temperature of the method was 56℃ by repeated experiments.Sensitivity and specificity tests showed that the method can detect the minimum suspension concentration 1.5×102CFU/mL,and has a high specificity.Stability and repeatability tests showed that the method has good stability.At the same time,the method was applied to detect the clinical samples,and the coincidence rate of the test results and the biochemical test results was 100%.Thus,The detection method established in this study has high sensitivity,strong specificity and good stability.It can be used in the laboratory diagnosis of colibacillosis in animals.
Escherichiacoli;polymerase chain reaction;establishment
2016-03-05
辽宁省自然科学基金项目(201402573);辽宁省农业攻关及产业化项目(2015202013)
赵凤菊(1978-),女,河北廊坊人,高级兽医师,硕士,主要从事动物人畜共患病的防控与研究。
S852.615.2
A
1007-5038(2016)08-0011-04

