复元醒脑汤对糖尿病脑梗死大鼠脑组织SDF-1、CXCR4、VEGF基因及蛋白表达作用的研究*
沈俊逸 方邦江凌 丽 陈振翼 王晓翠(上海中医药大学附属龙华医院,上海 200032)
·研究报告·
复元醒脑汤对糖尿病脑梗死大鼠脑组织SDF-1、CXCR4、VEGF基因及蛋白表达作用的研究*
沈俊逸 方邦江△凌 丽 陈振翼 王晓翠
(上海中医药大学附属龙华医院,上海 200032)
目的 观察复元醒脑汤对糖尿病脑梗死大鼠脑组织SDF-1、CXCR4、VEGF基因及蛋白表达的干预作用。方法 120只健康雄性SD大鼠随机分为正常对照组、假手术组、模型组、治疗组各30只。造模完成后,治疗组予以复元醒脑汤,假手术组、模型组予以0.9%氯化钠注射液,灌胃7 d。测定比较各组实验大鼠脑组织SDF-1、CXCR4、VEGF的mRNA及蛋白表达水平。结果 各组脑组织SDF-1、CXCR4、VEGF三种基因及蛋白表达具有类似趋势,由高到低依次为正常对照组、治疗组、模型组及假手术组。正常对照组高于假手术组;治疗组高于模型组(均P<0.01)。结论 复元醒脑汤可上调SDF-1、CXCR4及VEGF的mRNA及蛋白表达水平,改善受损血管内皮功能及修复功能而促进局部血管再生和侧支循环建立。
糖尿病脑梗死 复元醒脑汤 SDF-1 CXCR4 VEGF
【Abstract】Objective:To carry out the effect of Fuyuan Xingnao Decoction on the gene expression and protein secretion of SDF-1、CXCR4 and VEGF in diabetic cerebral infarction rats.Methods:Randomly all the enrolled healthy male SD rats were divided into 4 groups as Group C(control),Group AD(treated with placebo after acute cerebral infarction combined with diabetes mellitus),Group DM(diabetes mellitus without acute cerebral infarction)and Group AT (treated with Fuyuan Xingnao Decoction after acute cerebral infarction combined with diabetes mellitus).After 7 day,the gene expression and protein secretion of SDF-1、CXCR4 and VEGF were measured in each samples.Results:Descendingly among all the groups the gene expression and protein secretion order of SDF-1,CXCR4 and VEGF were Group C,Group AT,Group AD and Group DM.Those of Group C were significantly overtopped than those of Group DM (P<0.01).Those of Group AT were significantly elevated in comparison with Group AD(P<0.01).Conclusion:Fuyuan Xingnao decoction can improve the gene expression and protein secretion of SDF-1、CXCR4 and VEGF in diabetic cerebral infarction rats,and then improve the vascular regeneration and the establishment of the collateral circulation.
【Key words】Fuyuan Xingnao Decoction;Diabetic cerebral infarction;SDF-1;CXCR4;VEGF
众多研究表明糖尿病患者脑梗死发病率、致残率及死亡率均较非糖尿病者高,机制尚不明确[1-7]。这给临床治疗及预防带来很大困难。本实验所用方药复元醒脑汤是方邦江教授临床常用的治疗糖尿病并发脑梗死基础方,经临床验证疗效显著。前期多项研究业已证实,复元醒脑汤能改善糖尿病脑梗死大鼠神经行为和缺血脑组织病理结构,降低脑系数、脑组织含水量、脑血管通透性而缓解脑水肿[8-10]。研究结果示,内源性内皮祖细胞(EPCs)具有修复缺血性脑损伤的能力[11],而基质细胞衍生因子-1(SDF-1)及其高度特异性受体CXCR4、血管内皮生长因子(VEGF)等外源性细胞因子能够促进内皮祖细胞的募集和动员[12],从而促进缺血脑组织恢复以及血管新生。目前关于单纯糖尿病血管病变或单纯脑梗死SDF-1/CXCR4的研究众多,而糖尿病并发脑梗死SDF-1/CXCR4变化的研究尚未见报道。本实验从糖尿病并发脑梗死的分子生物学机制入手进行了研究,并对中医中药治疗的作用机制进行了初步探讨,以期为临床治疗及预防提供理论依据。现报告如下。
1 材料与方法
1.1 动物 120只SPF级雄性SD大鼠,体质量(250± 25)g,由上海斯莱克实验动物有限责任公司提供,于上海中医药大学附属龙华医院科技楼实验动物中心饲养,动物合格证号SCXK(沪)2011-009。
1.2 药物 复元醒脑汤[人参10 g(单煎),三七10 g,石菖蒲12 g,水蛭10 g,益母草30 g,生南星15 g,制大黄9 g(后下)],由上海市龙华医院制剂室生产提供,生药质量浓度为388 g/L。
1.3 仪器及试剂 1)凝胶成像仪GelDoc XR+,台湾Amersham Pharmacia Biotech公司生产,荧光定量PCR仪、Applied Biosystems,北京Funglyn Biotech Incorporated生产;ABI 7900HT,大龙兴创实验仪器有限公司生产,BX51光学显微镜153714-709,日本Olympus生产;DP2-BSW摄像系统17267-617,日本Olympus生产;电泳仪164-5056,美国BIO-BAD公司生产;转膜仪 170-3939,美国 BIO-BAD公司生产;酶标仪51119000美国Thermo公司生产;化学发光成像系统Bioshine ChemiQ,上海鸥翔科学仪器有限公司生产。2)多聚甲醛、水合氯醛,上海国药集团化学试剂公司生产;STZ美国Sigma公司生产;PMSF,美国Amresco公司生产;RIPA裂解液,上海市碧云天生物技术有限公司生产;BCA蛋白分析试剂盒上海市碧云天生物技术有限公司生产;Actin抗体,美国CST公司生产;SDF-1抗体,美国CST公司生产;CXCR4抗体,美国CST公司生产;VEGF抗体,美国CST公司生产;HRP标记山羊抗兔IgG,美国Gibco公司生产;ECL化学发光试剂盒,美国Millipore公司生产;逆转录M-MLV1试剂盒(RT-PCR),美国Gibco公司生产;FastStart Universal SYBR Green,上海叶舟生物科技有限公司生产;TRI REAGENT RNA提取试剂盒,美国Molecular Research Center,Inc生产;引物合成引物,上海生工生物工程股份有限公司提供。
1.4 模型制备[13]将STZ试剂溶于pH为4.6的柠檬酸钠缓冲液中(现配现用),大鼠接受腹腔注射STZ试剂(50 mg/kg)[14],1周后成模(血糖>16.7 mmol/L),并连续高脂饮食饲养2周。实施自体血栓栓塞性大鼠脑梗塞模型手术[15-16],1)制作血栓:将模型组、治疗组两组糖尿病大鼠用10%水合氯醛溶液按30 mg/100 g剂量麻醉后[17],先暴露其股静脉,抽取静脉血0.5 mL加入预先加有75 U凝血酶的EP管中,立即混匀。然后用注射器吸取沉淀部分注入2根头皮针塑料管内,静置15 min再打进盛有生理盐水的培养皿中,洗掉凝血块表面的红细胞。在显微镜下选择富含纤维素(深色)的血栓剪切成1~2 mm的小段,再转入pH为7.4的PBS缓冲液中恒温(37℃)静置5 h使其凝缩,然后吸入EP50管中备用。2)制作脑梗死模型:将大鼠按前法麻醉后用眼科镊子钝性分离出左侧颈总、颈内、颈外动脉。结扎颈外动脉,用动脉夹夹闭颈总动脉和颈内动脉,用提前制备好的一毫升注射器针头(将头处折1个90°的平钩)在颈外动脉上挑刺出一个小口。将吸入血栓的EP50导管由颈外动脉插入颈内动脉,松开颈内动脉上的动脉夹。缓慢将血栓注入颈内动脉,用生理盐水冲管后拔出EP50导管,结扎颈外动脉近心端。松开颈总动脉夹,缝合肌肉和皮肤。3)假手术组不将导管插入颈外动脉,其余操作与手术组相同,手术过程中控制动物肛温在(37±0.5)℃。
1.5 分组及药物干预 在常规适应性喂养后按照正常对照组30只、糖尿病组90只进行随机分组的糖尿病组采用STZ腹腔注射法致糖尿病模型,造模成功后,连续高脂饮食饲养2周,再将糖尿病组按每组均等例数(每组30例)随机分为糖尿病脑梗死组(模型组)、糖尿病脑梗死假手术组(假手术组)、糖尿病脑梗死治疗组 (治疗组),完成造模后,治疗组每日按10.4 mL/(kg·d),每日2次,以复元醒脑汤灌胃(参照陈奇主编《中药药理实验方法学》依实验动物与人体表面积比计算),模型组、假手术组予以等量的生理盐水灌胃,连续7 d后处死取材。
1.6 标本采集与检测 1)脑组织SDF-1、CXCR4、VEGF mRNA表达水平检测:实验结束后,模型组、假手术组、治疗组分别给与10%水合氯醛深度麻醉后,快速断头取脑,剪开皮肤暴露头及颈段,从颈椎处剪断脊髓,剥离颈部肌肉,用止血钳剔除颅骨,去除硬脑膜,迅速将脑组织100 mg放在液氮中冷冻。反复研磨成粉末,加入1 mL的TRI REAGENT RNA,氯仿抽提,异丙醇沉淀,75%酒精漂洗。DEPC水溶解RNA,反转录RNA为cDNA,进行定量PCR反应。引物的序列分别为:VEGF Front primer CCTGGCTTTACTGCTGTACCT,reverse primer GCTGGTAGACGTCCATGAACT;SDF-1 Front primer GCTCTGCATCAGTGACGGTA,Reverse primer AGGGCACAGT TTGGAGTGTT;CXCR4 Front primerGCACATCATGGTGGGTCTCA,Reverseprimer CCCCACGTAATACGGTAGCC;β-Actin Front primer CAAGTTCAACGGCAC AGTCA,Reverse primer CACCCCATTTGATGTTAGCG。2)脑组织SDF-1、CXCR4、VEGF蛋白表达水平检测:称取模型组、假手术组、治疗组30 mg脑组织,加入取500 μL的裂解液RIPA充分裂解,用BCA试剂盒定量蛋白。SDS page电泳,转膜。孵育的一抗抗体SDF-1抗体,CXCR4抗体,VEGF抗体(1∶1000),4℃过夜 孵育二抗抗体(1∶5000),室温1 h振荡孵育,ECL法曝光显影。
2 结 果
2.1 各组脑组织SDF-1、CXCR4、VEGF的基因表达水平比较 见表1和图1。结果示SDF-1、CXCR4、VEGF 3种基因与Actin的相对表达量由高到低依次为正常对照组、治疗组、模型组及假手术组。其中正常对照组与假手术组比较各基因的表达量均具有统计学意义(P<0.01);治疗组3种基因表达水平均高于模型组(均P<0.01);模型组与假手术组比较差异无统计学意义(P>0.05)。
表1 各组脑组织SDF-1、CXCR4、VEGF的基因表达量比较(±s)

表1 各组脑组织SDF-1、CXCR4、VEGF的基因表达量比较(±s)
与模型组比较,**P<0.01;与正常对照组比较,△△P<0.01。下同。
?

图1 各实验组脑组织中SDF-1、CXCR4、VEGF的基因表达量
2.2 各组脑组织SDF-1、CXCR4、VEGF蛋白表达水平比较 见表2和图2,图3。造模结束后,每组各取5只大鼠进行SDF-1、CXCR4、VEGF蛋白表达量检测。图2为 SDF-1、CXCR4、VEGF 3种蛋白的 Western Blot图,进行灰度值扫描后得到了各蛋白与Actin的相对表达水平。由表2和图3可见SDF-1、CXCR4、VEGF 3种蛋白与Actin的相对表达水平由高到低依次为正常对照组、治疗组、模型组及假手术组。正常对照组与假手术组比较,差异有统计学意义 (均P<0.01);治疗组中各蛋白的表达量均高于模型组(均P<0.01);模型组中各蛋白表达量均高于假手术组(均P<0.01)。
表2 各组脑组织中SDF-1、CXCR4、VEGF的蛋白表达量比较(±s)
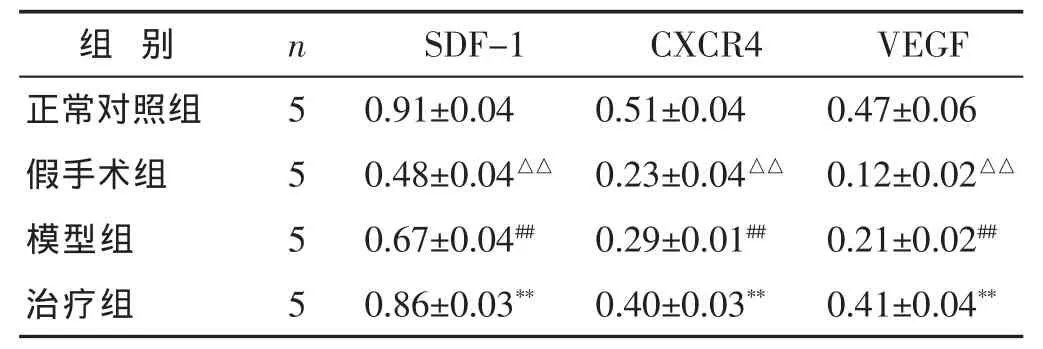
表2 各组脑组织中SDF-1、CXCR4、VEGF的蛋白表达量比较(±s)
与假手术组比较,##P<0.01。
?
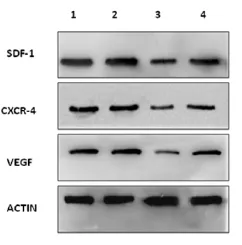
图2 各组脑组织中SDF-1、CXCR4、VEGF典型的蛋白表达量
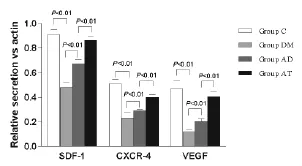
图3 各组脑组织中SDF-1、CXCR4、VEGF的蛋白表达量
3 讨 论
本研究发现复元醒脑汤治疗糖尿病脑梗死后大鼠的SDF-1、CXCR4和VEGF的基因表达与蛋白分泌均高于生理盐水治疗组。据报道EPCs具有修复缺血性脑损伤的能力[18],SDF-1/CXCR4在脑缺血损伤后EPCs的“归巢”中起着重要的调节作用[12],而损伤局部VEGF的表达也对EPCs的“归巢”起到相应的调节作用,从而增强缺血局部的神经和血管再生[19];我们因此推测复元醒脑汤治疗糖尿病脑梗死大鼠可能的分子机制在于直接提高或通过提高其调节因子SDF-1、CXCR4和VEGF的基因表达及蛋白分泌而间接提高了EPCs的细胞功能,从而增强缺血局部的神经和血管再生。
既往研究资料证实只有在病理状态下SDF-1、CXCR4和VEGF 3种基因与蛋白才会有所表达和分泌[20-21],这似乎与本实验中正常对照组上述因子高的结果相悖;经过大量查阅文献发现糖尿病机体的SDF-1、CXCR4及VEGF的基因表达及蛋白分泌是显著下调的[22],本实验也得出同样的结论。文献亦报告了脑梗死机体SDF-1、CXCR4及VEGF基因与蛋白的表达与分泌是上调的[23-24],因此推测在糖尿病脑脑梗死机体中,糖尿病对上述基因、蛋白的下调与脑梗死的上调联合作用的结果是糖尿病的下调占了优势,因此本实验得出正常对照组基因表达与蛋白分泌高于假手术组的结果。此外以上基因、蛋白改变是否与时间有关本实验未涉猎,可以通过进一步的实验来验证其确切变化趋势及相关机制。
近年来,人们越来越多地关注糖尿病合并脑梗死的研究,在这些研究中,复方治疗研究是最多的,这也表现了脑梗死疾病治疗的主要方向。经过大量的实验总结后,现在的大部分研究人员普遍认为糖尿病并发脑梗死中医基本致病机是“气阴两虚、瘀痰阻络”,“活血通络”为糖尿病脑梗死的基本原则。由于糖尿病合并脑梗死是一个非常严重的病症,该病致病机理以及治疗手段不同于其他的一些疾病,因此在治疗方案的运用中常是中西医结合,利用中成药复方治疗本病的同时配合西医降低血糖、改善体内细胞脱水等常规疗法。总之,中医治疗糖尿病脑梗死有丰富的经验和大量的实验支持。
本研究从SDF-1/CXCR4、VEGF生物学轴对内皮祖细胞的调控,促进血管修复与新生的角度,探讨复元醒脑汤促进糖尿病脑梗死缺血脑组织血管修复与新生的分子机制与有效作用靶点,是一个可行的全新思路与重要切入点。此外还从该角度对糖尿病脑梗死的作用机制进行了初步研究,为进一步深入明确糖尿病脑梗死确切机制奠定了理论基础,其研究结果将有助于进一步加深对糖尿病脑梗死等血管并发症病理机制的认识和防治水平的提高。
[1] 李印肖,张月霞.脑梗死患者糖化血红蛋白水平与颈动脉粥样硬化的相关性分析[J].临床荟萃,2008,23(8):1702-1703.
[2] 史洪润,杨玉庆,高昭水,等.高血糖对红细胞聚集与急性脑梗死关系的研究[J].中风与神经病杂志,1999,16(3):161.
[3] Slevin M,Krupinski J,Slowik A,et al.Serial measurement of vascular endothelil growth factor and transforming growth factor-β1 in serum of patients with acute ischemic stroke[J].Stroke,2000,31(8):1863-1870.
[4] WW.FORE.Noninscelin dependent diabetes mullitas.The prevention of complication[J].Med clin north Am,1995,79 (2):287-298.
[5] 余红岚,宋静芳,王功娣.急性脑梗死患者炎症因子与血脂、血尿酸水平的相关分析[J].贵州医药,2009,33(2):163-164.
[6] 张建岭.糖尿病患者与非糖尿病患者脑梗死的发病原因及预后比较[J].河北北方学院学报,2007,24(2):51-2.
[7] 郑关毅,林智颖,陈晓东,等.脑梗死患者辩证分型与自由基代谢的关系[J].福建中医药,2004,35(6):1-2.
[8] 方邦江,周爽,沈俊逸,等.复元醒脑汤对糖尿病脑梗死大鼠脑组织血流量及含水量影响的实验研究[J].老年医学与保健,2012,18(6):381-384.
[9] 赵平,沈俊逸,方邦江,等.复元醒脑汤对糖尿病脑梗死大鼠脑组织梗死体积的影响[J].上海中医药大学学报,2013,9(5):66-68.
[10]黄金阳,王宏,方邦江.复元醒脑汤对糖尿病脑梗死大鼠血-脑屏障干预作用的实验研究[J].江苏中医药,2013,48 (8):68-70.
[11]LL Chen,YF Liao,TS Zeng,et al.Number and function of circulating endothelial progenitor cell in diabetics with different vascular complications[J].Zhonghua Yi Xue Za Zhi,2009,89 (18):1234-1239.
[12]GC Schatteman,HD Hanlon,C Jiao,et al.Blood-derived angioblasts accelerate blood-flow restoration in diabeticmice[J].J Clin Invest,2000,106(4):571-578.
[13]LJ Harris,P Zhang,H Abdollahi,et al.Availability of adipose-derived stem cells in patients undergoing vascular surgical procedures[J].J Surg Res,2010,163(2):105-112.
[14]LJ Harris,P Zhang,H Abdollahi,et al.Availability of adipose-derived stem cells in patients undergoing vascular surgical procedures[J].J Surg Res,2010,163(2):105-112.
[15]EZ Longa,PR Weinstein,S Carlson,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(2):84-91.
[16]李浩,贾建平.大鼠大脑中动脉线栓法的改良与评价[J].中风与神经病杂志,2006,12(23):666-667.
[17]JM Capla,RH Grogan,MJ Callaghan,et al.Diabetes impairs endothelial progenitor cell-mediated blood vessel formation in response to hypoxia[J].Plast Reconstr Surq,2007,119(1):59-70.
[18]LL Chen,YF Liao,TS Zeng,et al.Number and function of circulating endothelial progenitor cell in diabetics with different vascular complications[J].2006,13(25):115-116.
[19]双卫兵,王志慧,王东文,等.2型糖尿病大鼠模型的制备及其验证[J].山西医科大学学报,2005,36(6):275-279.
[20]李浩,贾建平.大鼠大脑中动脉线栓法的改良与评价[J].中风与神经病杂志,2006,12(23):666-667.
[21]N Ferrara,WJ Henzel.Pituitary follicular cells secrete a novel heparin-binding growth factor specific for vascular endothelial cells[J].Biochem Biophys Res Commum,1989,161(2):851-858.
[22]黄波,刘学政,宠东渤.不同途径注射链脲佐菌素致大鼠糖尿病模型的研究[J].锦州医学院学报,2003,24(1):19-21.
[23]JB Bederson,LH Pitts,M Tsuji,et al.Rat middle cerebral artery occlusion:evalution of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-476.
[24]S Raffi,B Heissig,K Hottori.Efficient mobilization and recruitment of marrow-derived endothelial and hematopoietic stem cells by adenoviral vectors expressing angiogenic factors[J].Gene Ther,2002,9(10):631-641.
Experimental Study of Fuyuan Xingnao Decoction on the Gene Expression and Protein Secretion of SDF-1,CXCR4 and VEGF in Diabetic Cerebral Infarction Rats
SHEN Junyi,FANG Bangjiang,LING Li,et al.Longhua Hospital,Shanghai University of Traditional Chinese Medicine,Shanghai 200032,China
R285.5 文献标志码:A
1004-745X(2016)08-1457-04
10.3969/j.issn.1004-745X.2016.08.001
国家自然科学基金项目(81273725)
(电子邮箱:fangbji@163.com)
2016-06-24)

