头孢曲松、克拉霉素和甲硝唑联合疗法对未足月胎膜早破患者结局的临床分析
郑春燕,曹锦慧,罗树玲,白治英
头孢曲松、克拉霉素和甲硝唑联合疗法对未足月胎膜早破患者结局的临床分析
郑春燕,曹锦慧*,罗树玲,白治英
目的对比两种不同的抗菌治疗方案对于未足月胎膜早破(PPROM)患者抗菌治疗的有效性及其对新生儿结局的影响。方法回顾性分析212例PPROM患者的围生期结局,患者在妊娠期<34周分别给予2种抗菌方案治疗;通过羊水培养阳性和羊水中MMP-8浓度升高评估羊膜内感染/发炎。结果给予方案二治疗的患者中位抗菌至分娩的时间较方案一延长(29.9 d vs.8.8 d,P<0.01);方案二治疗组患者急性组织学绒毛羊膜炎和脐带炎的发生率(50.4%、14.2%)低于方案一治疗组(66.7%、42.4%),差异有统计学意义(P<0.01);方案二组新生儿的心室内出血、脐带炎和大脑性麻痹的发生率低于方案一组(P<0.05)。结论头孢曲松、克拉霉素和甲硝唑联合疗法对于PPROM患者可以延长潜伏期,降低急性组织学绒毛膜羊膜炎和脐带炎发生率,改善新生儿的临床结局,表明联合用药(头孢曲松、克拉霉素和甲硝唑)有助于改善PPROM围生期结局。
未足月胎膜早破;头孢曲松;克拉霉素;甲硝唑;羊膜内感染/发炎
0 引言
胎膜早破(Premature rupture of membranes,PROM)是围生期最常见的母体并发症,未足月胎膜早破(PPROM)诱发早产的发生率占所有妊娠的2%[1-2],近1/3的早产儿为未足月胎膜早破所致的早产[3]。目前PPROM已经成为临床研究和流行病学研究的热点[4-8],被称为“主要的产科综合征”,是习惯性早产的主要诱因。实验室细菌培养检测发现,30%早产PROM患者存在微生物入侵羊膜腔(Microbial invasion of the amniotic cavity,MIAC)现象。针对行羊膜穿刺术的PPROM患者的一系列研究也表明,随着时间的推移,MIAC患病率明显增加,当患者早产开始时,MIAC约占PPROM患者的75%[9-10]。因此,对于PPROM患者抗菌药物的管理旨在治疗或者阻止感染率的上升[1]。本研究旨在探讨两种不同的抗菌治疗方案对PPROM患者抗菌治疗的有效性及其对早产新生儿临床结局的影响,现报道如下。
1 材料与方法
1.1研究对象回顾性研究1998年3月至2012年7月在我院诊断并分娩的PPROM患者(妊娠期<34周),所有PPROM患者均常规采用羊膜穿刺术取样进行微生物检测和新生儿肺成熟度评估。研究对象纳入标准:①产前抗菌治疗时间≥24 h;②可获得围生期临床结果;③经腹羊膜穿刺术获得羊水可用于微生物检测。所有患者均签订知情同意书,本研究同时经医院道德伦理委员会审核通过。
根据上述的纳入标准共纳入212例PPROM患者。其中,99例患者接受方案一进行抗菌治疗,即采用氨苄青霉素和头孢菌素,其中包括15例曾应用红霉素或甲硝唑联合氨苄青霉素或头孢菌素的患者。静脉注射氨苄青霉素2~4 g/d,分4次给药;静脉注射头孢菌素1~2 g/d,分2~4次给药;口服红霉素0.75~2 g/d,分3~4次给药;静脉注射红霉素1.5 g/d,分3次给药。113例患者接受方案二治疗,即每24小时静脉注射1 g头孢曲松,每12小时口服500 mg克拉霉素,每8小时静脉注射500 mg甲硝唑。PPROM患者根据上述方案进行常规化管理。抗菌治疗持续至胎儿分娩后(甲硝唑的最长使用时间不超过4周)或无证据表明有羊水泄露。
方案一组产妇的平均年龄为(29.3±3.2)岁,初产妇42例(47.2%),剖宫产分娩37例(41.5%),分娩时孕周为(32.1±4.8)周,出生时婴儿体重为(1.93±1.24) kg;方案二组产妇的平均年龄为(30.1±2.9)岁,初产妇54例(47.8%),剖宫产分娩43例(38.1%),分娩时孕周为(31.9±5.4)周,出生时婴儿体重为(1.82±1.31) kg;两组上述一般资料比较差异无统计学意义(P>0.05),基本特征一致,具有可比性。
1.2胎膜破裂诊断、微生物检测及炎症诊断胎膜破裂的诊断:①突然见阴道内有较多液体流出,可见胎脂及胎粪,肛诊将胎先露部上推见阴道液量增多;②窥器检查见液体自宫颈口流出或阴道后穹窿有较多混有胎脂和胎粪的液体;③阴道液硝嗪试纸测试阳性(pH≥7.0);④阴道涂片检查:阴道液干燥片检查有羊齿状结晶出现为羊水,收集羊水分别用于需氧菌、厌氧菌以及生殖道支原体的培养,测定羊水中白细胞和中性粒细胞数量。
羊膜炎诊断:孕妇体温>37.8 ℃,除外呼吸道、泌尿系和其他局部感染;子宫触痛;宫腔异味;孕妇心率>100次/min;胎儿心率>160次/min,实验室检查羊水中基质金属蛋白酶-8 (MMP-8)浓度升高(>23 ng/mL)[11]。急性绒毛膜羊膜炎诊断:体温连续2次≥37.8 ℃;孕妇心率连续2次≥100次/min;持续胎心基线偏快(≥160次/min),排除脐带绕颈等因素;子宫压痛;阴道见脓性分泌物;白细胞计数>15×109/L,中性粒细胞比值>0.8;血沉>70 mm/h;根据病理学检查结果,当患者表现为急性炎症反应时,检测胎盘的胎盘外绒毛膜或者绒毛膜板等[12-13]。脐带炎的诊断:炎症细胞浸润脐血管和(或)蜕膜血管,可在脐带血管壁或者脐带沃顿胶中检测到中性粒细胞[13-14]。
1.3新生儿临床结局新生儿临床结局事件主要包括:呼吸窘迫综合征(RDS)、支气管肺发育不良(BPD)、先天性新生儿败血症、心室内出血(IVH)、脑室周围白质软化症(PVL)、坏死性小肠结肠炎(NEC)、新生儿综合患病率、大脑性麻痹(CP)和新生儿存活率等。
2 结果
2.1两组PPROM产妇的临床基本特征方案二组MMP-8浓度高于方案一组,且差异有统计学意义(P<0.01)。见表1。
2.2妊娠和新生儿结局由图1可见,方案二组的中位抗菌至分娩的时间间隔为29.5 d (95%CI:
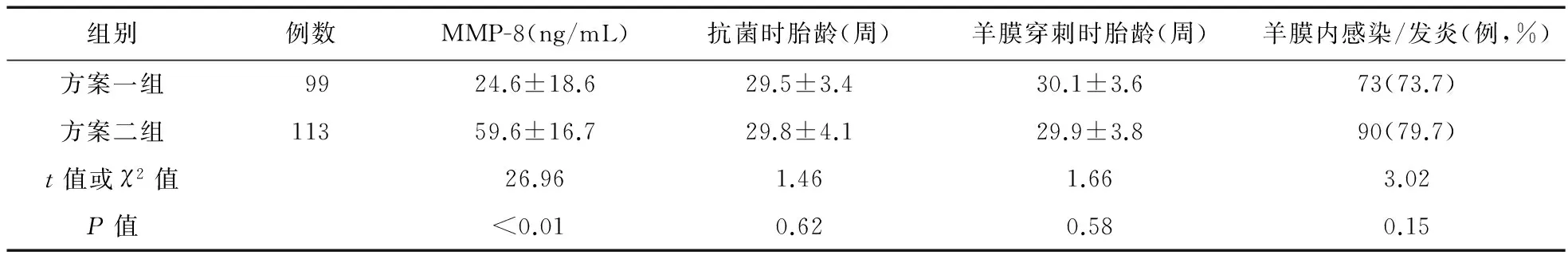
表1 两组患者的临床基本特征比较
5~62 d),方案一组为16.2 d (95%CI:4~59 d),两组比较差异有统计学意义(P<0.01)。由表2可见,方案二组在初始抗菌治疗后7 d内先兆性早产的患者比例低于方案一组(20.4% vs.43.4%,P<0.01);方案二组在32周内先兆性早产患者的比例略低于方案一组,但差异无统计学意义(55.8% vs.57.6%,P>0.05)。方案二组患者急性组织学绒毛膜羊膜炎和脐带炎的发生率均低于方案一组,差异有统计学意义(P<0.05)。由表3可见,方案二组新生儿IVH和CP的发生率低于方案一组(2.7% vs.19.2%,P<0.01;0 vs.6.1%,P<0.05)。

图1 两组患者抗菌至分娩时间间隔的生存分析
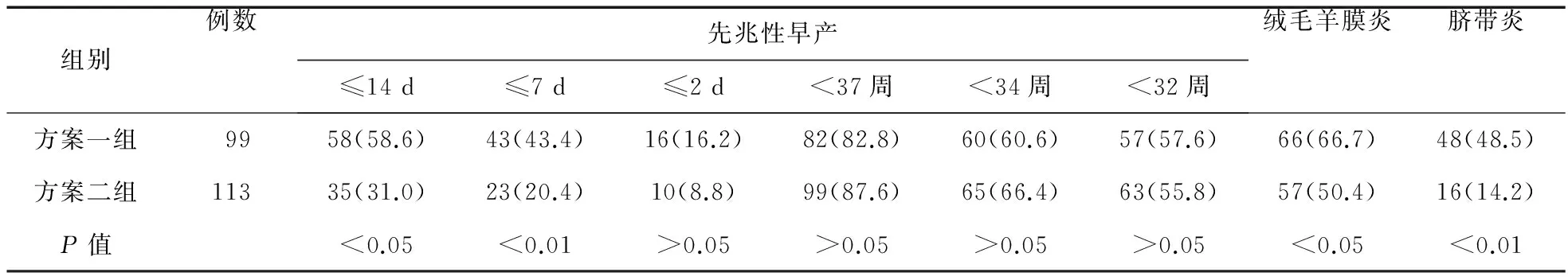
表2 两组妊娠结局比较(例,%)

表3 两组新生儿结局(例,%)
2.3羊膜内感染/发炎和抗菌方案不同的抗菌方案对无羊膜内感染/发炎患者妊娠期和新生儿临床结局的影响差异无统计学意义(P>0.05),见表4。
对于羊膜内感染/发炎的患者,初始抗菌治疗后14、7、2 d内,方案二组先兆性早产的发生率低于方案一组(P<0.05);方案二组新生儿脐带炎、IVH、CP的发生率及新生儿综合患病率低于方案一组,差异有统计学意义(P<0.05)。见表5。
对于羊膜内感染/发炎的患者,方案一组的中位抗菌至分娩的时间间隔为8.8 d (95%CI:2~19 d),方案二组为29.9 d (95%CI:3~61 d),方案二组中位时间较方案一组延长,差异有统计学意义(P<0.01)。见图2。
多因素回归分析表明,对于羊膜内感染/发炎的患者,方案二组的抗菌至分娩的时间间隔显著延长,差异有统计学意义(HR:0.44,95%CI:0.26~0.69,P<0.01)。
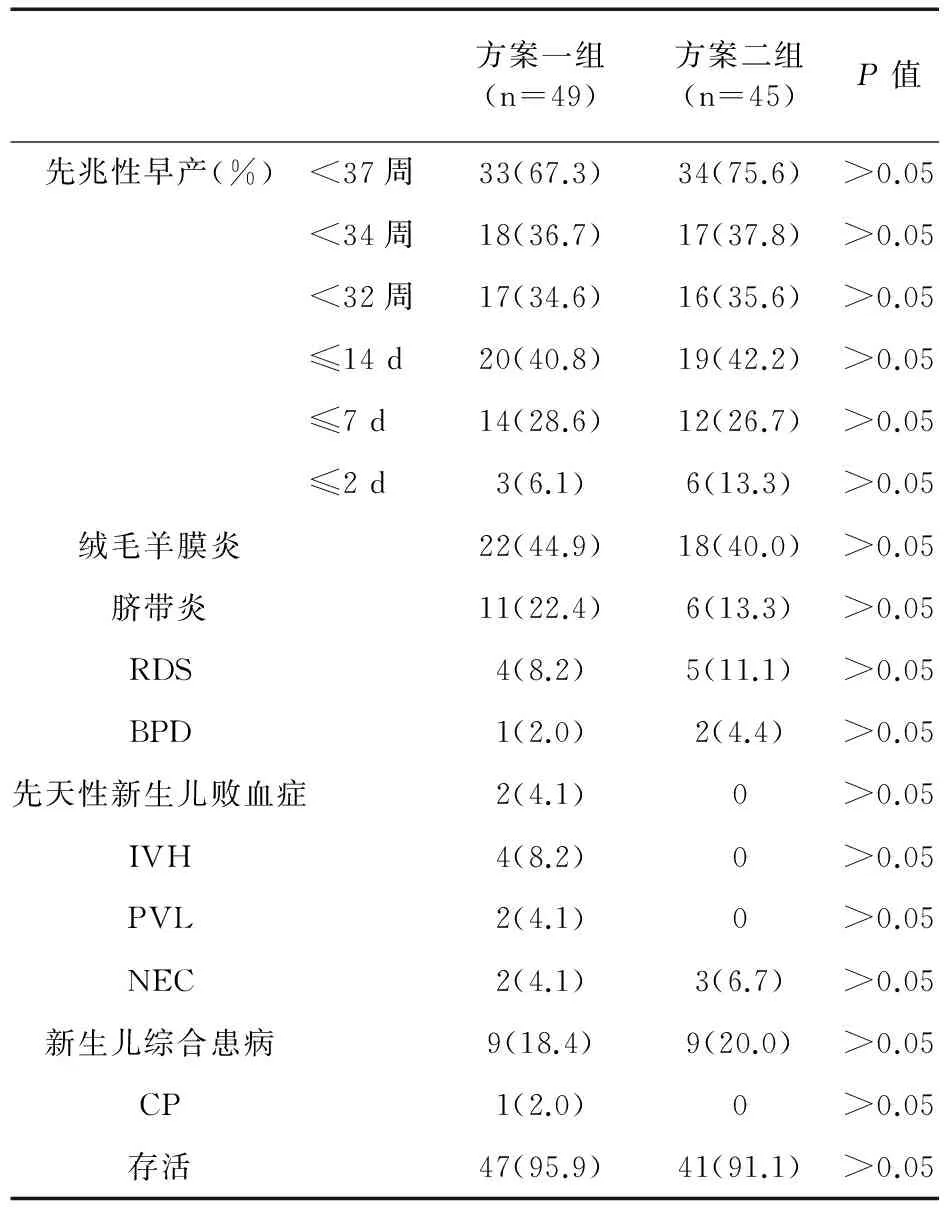
表4 两组无羊膜内感染/发炎患者的围生期结局(例,%)
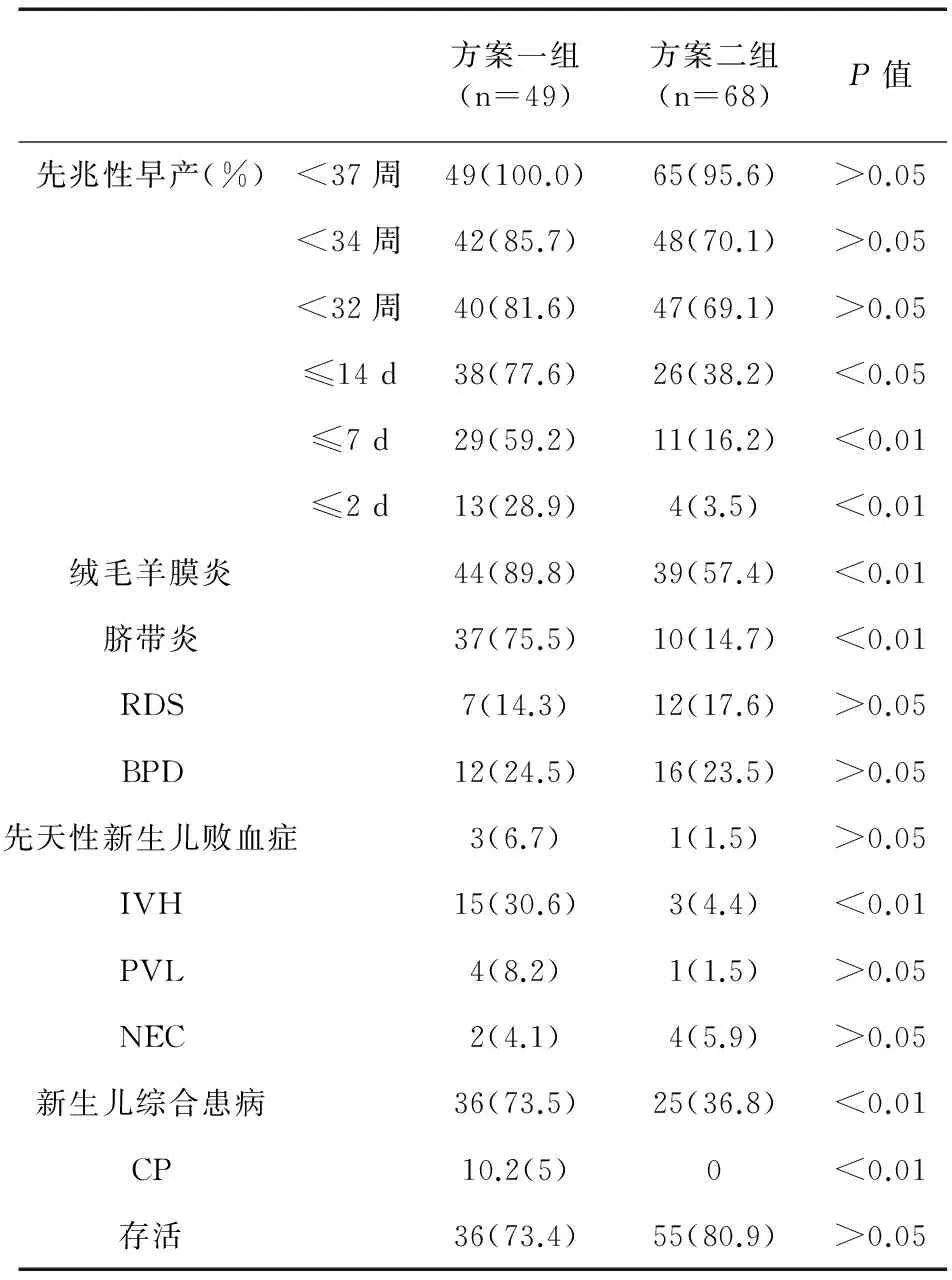
表5 两组羊膜内感染/发炎患者的围产期结局(例,%)
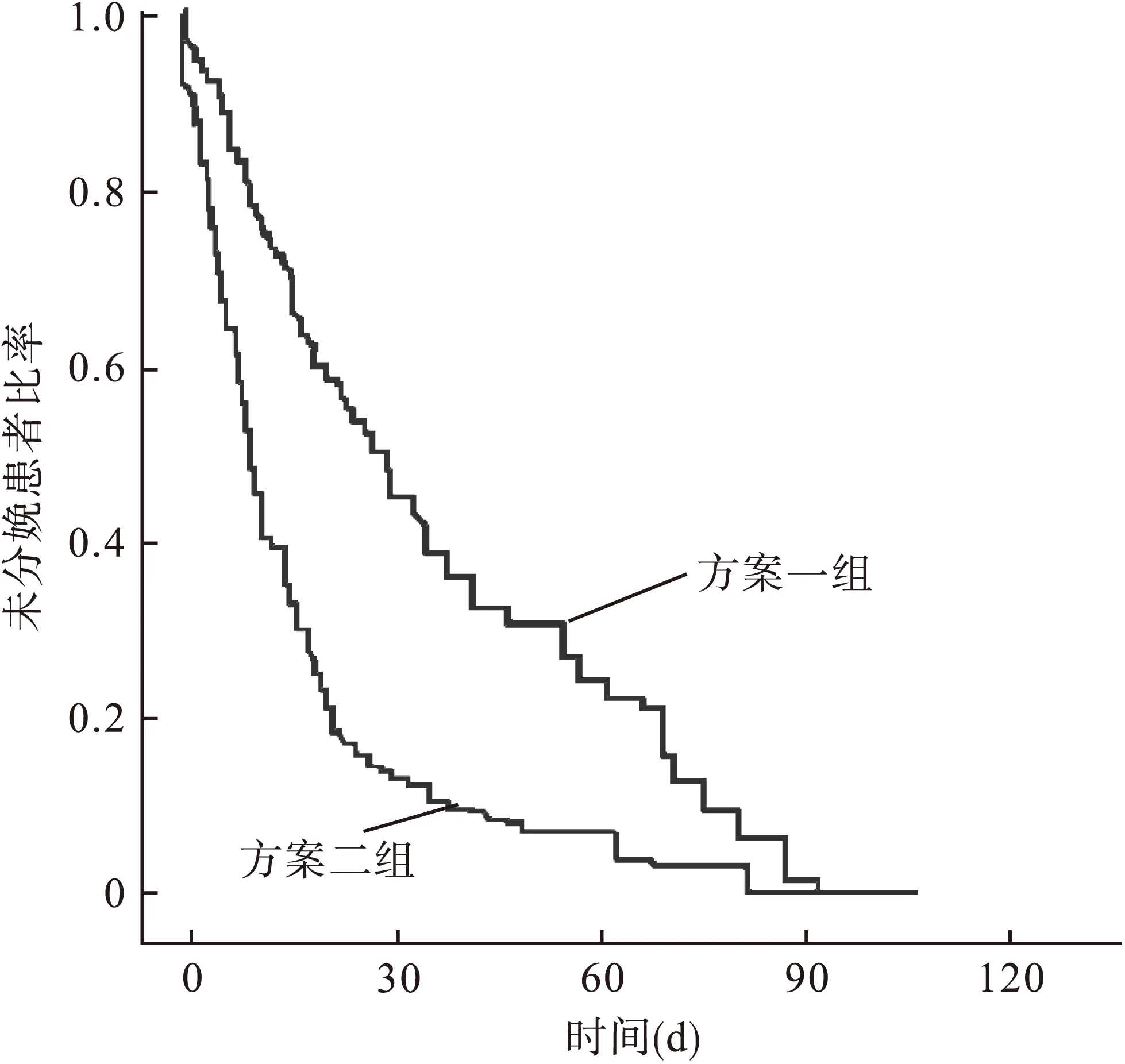
图2 两组羊膜内感染/发炎患者抗菌至分娩时间间隔的生存分析
3 讨论
在结合培养和分子微生物学技术检测的研究发现,约30%~50%的PPROM患者表现为MIAC引起感染,30%的患者表现为多种微生物感染,5%的患者为真菌感染[9-10,15],由于所涉及的微生物种类范围过广,使得大多数患者在短时间内难以鉴别具体的微生物种类,因此广谱抗菌治疗已应用于临床试验和实践治疗[16]。
已有报道显示,对于PPROM患者可以根除MIAC[17],但也有研究发现,在抗菌管理前后行羊膜穿刺术,抗菌药物并不能根除随后的羊膜内感染[18],这可能是由于经过胎盘途径会导致抗菌效果差(如红霉素),故抗菌治疗因未能全面抑制,致使微生物感染可以继续发展。最近研究表明,80%的生殖道支原体对红霉素治疗抵抗,主要是由于患者羊水中最常见的变种微小脲原体(Ureaplasmaparvum)导致[17]。因此需要寻找一种新的抗菌治疗方案,以有效抑制微生物的感染。
口服克拉霉素能有效抑制支原体感染,与红霉素、阿奇霉素相比,其更易于经胎盘途径。研究表明,口服克拉霉素的生物利用度也使其具有足够的抗菌活性。与红霉素相比,克拉霉素对Ureaplasma有更低的最小抑制浓度(MIC),因此其在抑制Ureaplasma方面具有更好的抗微生物能力[19];静脉注射甲硝唑可以有效抑制PPROM常见的厌氧菌[20],同时静脉注射甲硝唑也可有效降低口服过程对胃肠的不良影响;静脉注射的头孢曲松钠是第三代头孢菌素类抗菌药物,可以广泛地抑制需氧菌,如Streptococcussp、Haemophilussp和Hemophilussp等,而且头孢曲松钠易穿过胎盘,可以到达脐带血、羊水和胎盘中,在上述生物体液和组织中可达到充足的抗微生物作用的药物浓度。
羊膜内感染/发炎是影响不良妊娠和新生儿结局的最主要的风险因素[21],因此,抗菌药物治疗是管理PPROM患者羊膜内感染/发炎的重要手段。目前的研究表明,新型的抗菌方案(方案二组)可延长潜伏期,降低48 h、7 d和14 d内先兆性早产率,显著改善新生儿结局,并且减少急性组织学绒毛膜羊膜炎和脐带炎的发生率,但主要是针对在开始治疗时已经出现羊膜内感染/发炎的患者。有报道,阿莫西林联合红霉素并不能在短期内降低急性组织学绒毛膜羊膜炎的发生率[22];另外一项随机临床试验比较7 d内头孢唑林、头孢唑林联合红霉素和头孢唑林联合克拉霉素在抗菌方面的有效性,发现头孢唑林联合克拉霉素与严重脐带炎患者发生率的减少相关[23]。
本研究存在一定的局限性,首先,本文为回顾性研究,在监测临床药物干预水平上具有明显的不足之处;其次,在对照组的选择上容易存在偏倚现象,但不会影响潜伏期的持续性时间或急性组织学绒毛膜羊膜炎和脐带炎的发生率;最后,两种方案的比较难以确定头孢曲松、克拉霉素和甲硝唑中哪种药物对围生结局具有更好的作用,但目前研究结果显示,3种抗菌药物联合应用对于PPROM患者羊水中的大多数微生物(尤其是生殖道支原体)均具有抗菌活性,同时可以显著改善产前结局。
综上所述,本研究系统性地评估了新型抗菌方案(方案二)对PPROM患者的影响,表明方案二可延长PPROM妊娠持续时间,降低急性组织学绒毛膜羊膜炎、脐带炎及新生儿不良结局的发生率,为临床实践提供参考,值得在临床推广。
[1]Mercer B.Antibiotics in the management of PROM and preterm labor[J].Obstet Gynecol Clin North Am,2012,39:65-76.
[2]Winn H,Chervanak F,Romero R.Clinical maternal-fetal medicine online[M].2nd ed.London (UK):Informa Healthcare,2011:1-24.
[3]Goldenberg R,Culhane J,Iams J,et al.Epidemiology and causes of preterm birth[J].Lancet,2008,371:75-84.
[4]Ismail A,Lahiri S.Management of prelabour rupture of membranes(PROM) at term[J].J Perinat Med,2013,41:647-649.
[5]张慧丽,刘叶花,何玉甜,等.有无明显诱因致早产合并胎膜早破的临床对比分析[J].实用妇产科杂志,2013,29(2):129-132.
[6]Ramsauer B,Vidaeff A,Hosli I,et al.The diagnosis of rupture of fetal membranes (ROM):a meta-analysis[J].J Perinat Med,2013,41:233-240.
[7]Gelber S,Brent E,Varrey A,et al.Equivalence of erythromycin and azithromycin for treatment of PPROM[J].Am J Obstet Gynecol,2013,208:S291.
[8]Wong L,Holmgren C,Silver R,et al.Outcomes of expectantly managed pregnancies with multiple gestations and preterm premature rupture of membranes prior to 26 weeks[J].Am J Obstet Gynecol,2015,212:215 e1-9.
[9]Kacerovsky M,Musilova I,Khatibi A,et al.Intraamniotic inflammatory response to bacteria:analysis of multiple amniotic fluid proteins in women with preterm prelabor rupture of membranes[J].J Matern Fetal Neonatal Med,2012,25:2014-2019.
[10]Kacerovsky M,Andrys C,Hornychova H,et al.Amniotic fluid soluble Toll-like receptor 4 in pregnancies complicated by preterm prelabor rupture of the membranes[J].J Matern Fetal Neonatal Med,2012,25:1148-1155.
[11]Park C,Yoon B,Kim S,et al.The frequency and clinical significance of intra-amniotic inflammation defined as an elevated amniotic fluid matrix metalloproteinase-8 in patients with preterm labor and low amniotic fluid white blood cell counts[J].Obstet Gynecol Sci,2013,56:167-175.
[12]赵志英.绒毛膜羊膜炎诊断的研究进展[J].国际妇产科学杂志,2011,38(3):207-210.
[13]D′Alquen D,Kramer BW,Seidenspinner S,等.患绒毛膜羊膜炎和脐带炎的早产儿脐带内皮细胞的激活和胎儿的炎性反应[J].世界核心医学期刊文摘:儿科学分册,2005,(9):46-47.
[14]Ma B,Forney L,Ravel J.Vaginal microbiome:rethinking health and disease[J].Annu Rev Microbiol,2012,66:371-389.
[15]Agrawal V,Hirsch E.Intrauterine infection and preterm labor[J].Semin Fetal Neonatal Med,2012,17:12-19.
[16]Mercer B,Crouse D,Goldenberg R,et al.The antibiotic treatment of PPROM study:systemic maternal and fetal markers and perinatal outcomes[J].Am J Obstet Gynecol,2012,206:e141-e149.
[17]Smorgick N,Frenkel E,Zaidenstein R,et al.Antibiotic treatment of intra-amniotic infection with Ureaplasma urealyticum:a case report and literature review[J].Fetal Diagn Ther,2007,22:90-93.
[18]Gomez R,Romero R,Nien J,et al.Antibiotic administration to patients with preterm premature rupture of membranes does not eradicate intra-amniotic infection[J].J Matern Fetal Neonatal Med,2007,20:167-173.
[19]Duffy L,Crabb D,Searcey K,et al.Comparative potency of gemifloxacin,new quinolones,macrolides,tetracycline and clindamycin against Mycoplasma spp[J].J Antimicrob Chemother,2000,45:29-33.
[20]Brook I,Wexler H,Goldstein EJ.Antianaerobic antimicrobials:spectrum and susceptibility testing[J].Clin Microbiol Rev,2013,26:526-546.
[21]赵志英.绒毛膜羊膜炎诊断的研究进展[J].国际妇产科学杂志,2011,38(3):207-210.
[22]Hauth JC.The NICHD-MFMU antibiotic treatment of pPROM study:correlation with acute placental inflammation and perinatal mortality[J].Am J Obstet Gynecol,1997,176:S53.
[23]Kwak H,Shin M,Cha H,et al.The efficacy of cefazolin plus macrolide (erythromycin or clarithromycin) versus cefazolin alone in neonatal morbidity and placental inflammation for women with preterm premature rupture of membranes[J].Placenta,2013,34:346-352.
Clinical analysis of the effect of combination use of ceftriaxone,clarithromycin and metronidazole on the neonatal outcome of patients with PPROM
ZHENG Chun-yan,CAO Jin-hui*,LUO Shu-ling,BAI Zhi-ying
(Department of Obstetrics and Gynecology,the Yulin Xingyuan Hospital,Yulin 719000,China)
ObjectiveTo compare the efficacy of two anti-microbial regimens in the treatment of patients with preterm premature rupture of the membranes (PPROM),and observe their effects on neonatal outcomes.MethodsThe perinatal outcomes of patients with PPROM were analyzed retrospectively,and 212 patients with PPROM less than 34 weeks were given two anti-microbial regimens.Intra-amniotic infection/inflammation was assessed by positive amniotic fluid culture and elevation of amniotic fluid MMP-8 concentration.ResultsPatients in regimen Ⅱ group had a longer median antibiotic-to-delivery interval than regimen Ⅰ group (29.9 d vs.8.8 d,P<0.01),and lower rates of acute histologic chorioamnionitis and funisitis (50.4% vs.66.7%,P<0.01;14.2% vs.42.4%,P<0.01).The rates of neonatal intra-ventricular hemorrhage (IVH) and cerebral palsy (CP) in regimen Ⅱ group were lower than those of regimen Ⅰ group (P<0.05).ConclusionCombination use of ceftriaxone,clarithromycin and metronidazole can prolong the latency period,reduce the rate of acute histologic chorioamnionitis/funisitis,and improve neonatal outcomes of patients with PPROM.It suggests that the combination use of anti-microbial agents (ceftriaxone,clarithromycin and metronidazole) can improve the perinatal outcome in PPROM.
Preterm premature rupture of the membranes (PPROM);Ceftriaxone;Clarithromycin;Metronidazole;Intra-amniotic infection/inflammation
2016-01-08
榆林市星元医院妇产科,陕西 榆林 719000
10.14053/j.cnki.ppcr.201608019

