类芦根系抗氧化酶和植物螯合肽对Cd、Pb胁迫的应答
罗洁文,李莹,苏烁烁,黄晓敏,周垂帆*. 福建农林大学林学院,福建 福州 350002,2. 海峡两岸红壤区水土保持协同创新中心,福建 福州 350002
类芦根系抗氧化酶和植物螯合肽对Cd、Pb胁迫的应答
罗洁文1, 2,李莹1, 2,苏烁烁1, 2,黄晓敏1,周垂帆1, 2*
1. 福建农林大学林学院,福建 福州 350002,2. 海峡两岸红壤区水土保持协同创新中心,福建 福州 350002
类芦(Neyraudiarey naudiana)是中国南方金属矿区最为常见的耐性植物,且能大量富集重金属,是修复重金属污染的潜能植物。为研究其对重金属胁迫的应答机制,采用营养液培养的方法研究了不同浓度(0、25、50、100 μmol·L-1)Cd、Pb处理24 h后,类芦根系氧化损伤、抗氧化酶活性和非蛋白巯基化合物含量的变化。结果表明,在Cd、Pb胁迫下,类芦根系H2O2和O2·-含量显著增加,且伴随有MDA含量的升高,当Cd、Pb浓度为100 μmol·L-1时,MDA分别达到6.72和16.12 nmol·g-1,发生膜脂质过氧化,造成植物氧化损伤。Pb胁迫下,SOD,POD活性随着处理浓度的增加呈现先上升后下降的趋势;Cd胁迫下SOD活性变化趋势与Pb胁迫的相似,而POD活性呈下降趋势。根系非蛋白巯基化合物含量检测显示,Cd、Pb处理下,GSH和PCs均呈先增加后下降的趋势。综合分析得出,类芦根系对不同重金属的不同浓度胁迫响应不一,其能通过调节抗氧化酶活性和植物螯合肽等的合成水平,降低重金属的毒性及其对植物的伤害,从而维持自身的稳态。
镉、铅;类芦;质膜完整性;抗氧化酶;植物螯合肽
引用格式:罗洁文, 李莹, 苏烁烁, 黄晓敏, 周垂帆. 类芦根系抗氧化酶和植物螯合肽对Cd、Pb胁迫的应答[J]. 生态环境学报, 2016, 25(6): 1047-1053.
LUO Jiewen, LI Ying, SU Shuoshuo, HUANG Xiaomin, ZHUO Chuifan. Response of Antioxidant Enzymes and PCs in Root of Neyraudia reynaudiana to Cd, Pb Stress [J]. Ecology and Environmental Sciences, 2016, 25(6): 1047-1053.
植物修复技术具有不破坏土壤生态环境的优点,对于清除土壤重金属污染与实现可持续发展具有重要的现实意义。近年来,在植物修复中一些生物量大、生长速度快、对污染物吸收能力较强但还达不到超富集植物标准的耐性植物备受关注。其中,类芦(Neyraudiarey naudiana)是中国南方优良的防风固土绿化植物(蔡丽平等,2012),不仅可在重金属矿废弃地上较好生长,且保持有较高的生物量,在重金属废弃地的恶劣环境下表现出较强的适应性(杨期和等,2012)。有研究发现类芦对重金属Cd、Pb具有较强的富集能力(Deng et al.,2004),野外生长的类芦地上部分Pb含量可达773.5 mg·kg-1,生物富集系数的范围为 0.34~1.51,高于普通植物富集系数(戴文娇等,2008),说明类芦可用于Cd、Pb污染土壤的修复,但是目前有关类芦对重金属Cd、Pb的耐性机制研究并不多。
植物受到重金属胁迫时,植物细胞产生多种活性氧(ROS),如超氧阴离子自由基(O2·-)、羟基自由基(OH·-)、过氧化氢(H2O2)等,其中H2O2若不能及时清除,就会转化为毒性更大的分子,过量的活性氧能导致膜脂质过氧化、蛋白质和 DNA分子的氧化修饰与损伤等(王晓蓉,2013)。因此,研究自由基的产生、积累和代谢,能够反映植物体在逆境条件下的氧化胁迫和应激响应状态。植物可以通过提高或降低抗氧化酶系统以及合成谷胱甘肽(GSH)和植物螯合肽(PCs)等一类多肽对胁迫环境作出响应,以消除 ROS或与重金属离子螯合,在重金属积累和解毒过程中发挥重要作用(宋相帝等,2011)。但是,植物不同部位的抗氧化酶活性以及非蛋白巯基化合物作用对不同重金属的响应不同,而根系是直接与土壤接触,在土壤逆境条件下,它是植物最先感受逆境的器官,相较于植物地上部,根系是否拥有一套可增强对重金属耐性的机制显得更为重要。因此,研究根系对重金属胁迫的响应对于揭示植物抵抗重金属胁迫的机理具有重要意义(Li et al.,2009)。鉴于此,为了更好地弄清类芦对Pb、Cd的早期响应,进一步探讨Cd、Pb胁迫对类芦根系的毒害及解毒机理,本试验以南方水土保持先锋植物——类芦作为试验材料,研究不同浓度的Cd、Pb胁迫对类芦根系的活性氧活力、质膜完整性、抗氧化酶活性以及非蛋白巯基化合物等的影响,旨在明确类芦根系对不同重金属胁迫的应答策略,试图揭示植物对重金属的耐受机制和解毒机理,以期为类芦应用于南方土壤重金属污染修复提供理论依据。
1 材料与方法
1.1试验材料
类芦种子购自云南省昆明市某种子公司。2015 年9月种植于温室大棚中,同年12月中旬选择长势均一的类芦幼株转移到培养箱中,移植在泡沫板上并放置于500 mL超纯水中培养2 d,并依次用1/2和完全Hoagland培养液在塑料盆中各培养4 d。培养期间昼、夜温度分别为25 ℃、22 ℃,光照时间为16 h。
1.2试验方法
预培养10 d后,分别添加不同Cd、Pb,Cd以CdCl2,Pb以Pb(NO3)2的形式添加,处理浓度为0、25、50、100 μmol·L-1,每处理3次重复,处理24 h后取样分析。处理期间营养液pH维持在5.5左右,营养液中KH2PO4的浓度设置为0.025 mmol·L-1以避免产生磷酸铅沉淀(Huang et al.,2012)。
1.3分析测定项目
1.3.1H2O2和O2·-含量测定
H2O2含量测定参考Jasinski et al.(2008)的方法,用羟胺氧化反应测定 O2·-含量(王爱国等,1990)。
1.3.2测定质膜完整性
质膜完整性检验采用 Evans blue染色的方法(Wang et al.,2005),将Pb、Cd处理后的植物根系(2 cm)在0.5 mmol·L-1冷冻的CaCl2(pH 4.5)溶液中浸泡5 min 后,洗净吸干,将根浸泡在4 mL伊文思蓝溶液(0.025%伊文斯蓝溶于100 μmol·L-1pH=5.6的 CaCl2溶液中)中30 min,取出后反复用蒸馏水冲洗,在蒸馏水中浸泡15 min,然后在光学显微镜下观察拍照,以测定原生质膜的完整性。
1.3.3抗氧化酶以及MDA含量测定
参考李合生等(2000)的方法测定,丙二醛(MDA)测定采用硫代巴比妥酸法,超氧化物歧化酶(SOD)采用氮蓝四唑法,过氧化物酶(POD)采用愈创木酚法。
1.3.4非蛋白质态巯基总量、谷胱甘肽以及植物螯合肽含量的测定
非蛋白质态巯基总量(TNP-SH)参照De Vos et al.(1992)的方法测定;谷胱甘肽(GSH)含量参照张宗申等(2001)的方法测定,植物螯合肽(PCs)含量等于非蛋白巯基含量与 GSH含量的差值,即用差减法计算(Alfadul et al.,2013)。
1.4数据处理
数据为3次重复样品测定结果的平均值(含标准差)。运用Excel 2007和SPSS 18进行数据统计分析,采用单因素方差分析(One-way ANOVA)和多重比较,用 SNK法对不同处理间数据进行差异显著性分析,以P<0.05表示不同处理间数据差异显著,并用Origin 9.2作图。
2 结果与分析
2.1Cd、Pb胁迫对类芦的氧化胁迫作用
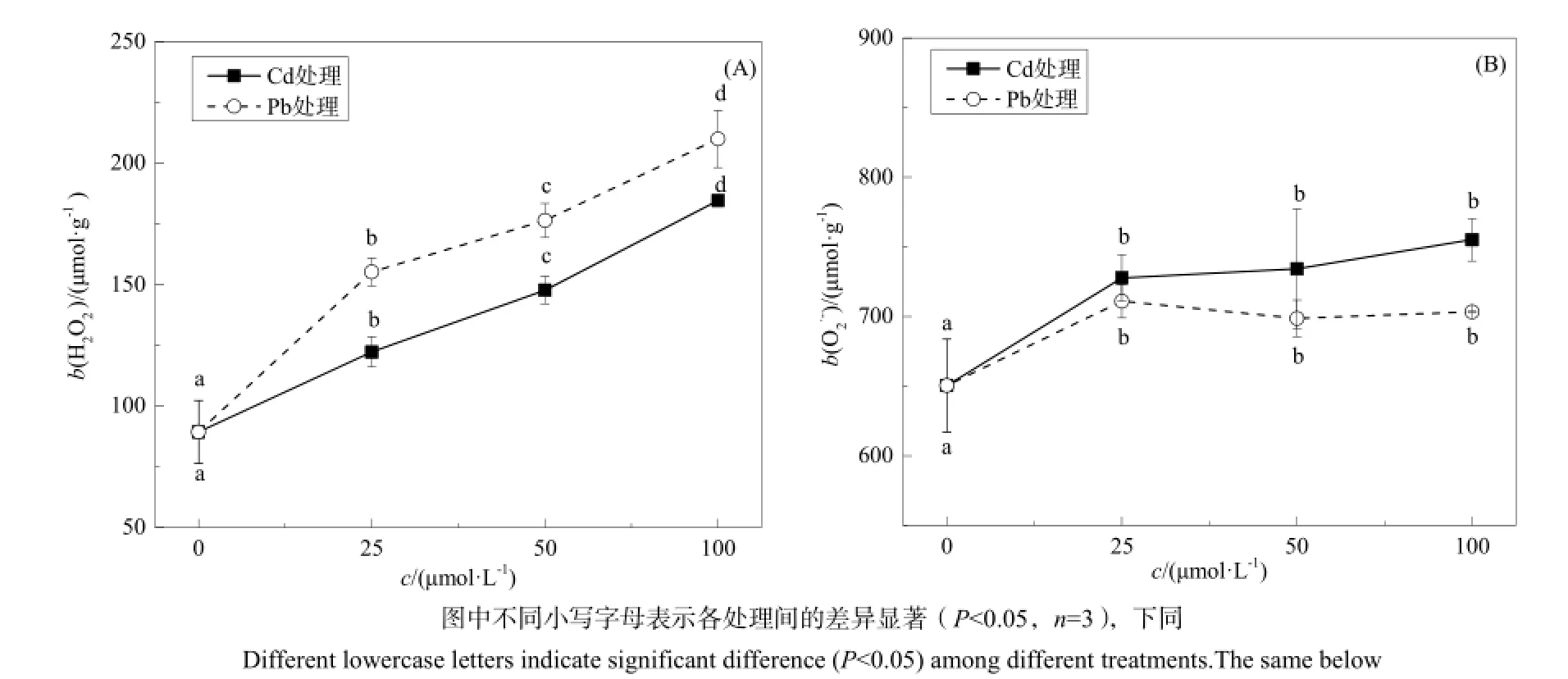
图1 不同浓度Cd、Pb处理下类芦根系的H2O2和O2·-含量Fig. 1 The content of H2O2and O2·—in roots of Neyraudia reynaudiana at different concentrations of Cd, Pb
植物受到重金属胁迫时,体内产生的活性氧将大大增加,当超出机体抗氧化防御能力时,会在机体内积累并导致植物的氧化损伤(王晓蓉,2013)。由图1(A)可见,类芦根系的H2O2含量随着Cd、Pb浓度的增加呈显著上升的趋势(P<0.05),表明溶液中的Cd、Pb对H2O2具有明显的诱导效应,类芦根系受到了Cd、Pb的胁迫。其中,Pb胁迫下类芦根系的 H2O2含量明显高于 Cd胁迫下的,说明Pb对类芦的毒性更强,也有可能是因为类芦体内富集了更多的Pb。由图1(B)可知,Cd、Pb胁迫下类芦根系的 O2·-含量均高于对照,但是不同浓度处理间并无显著差异。随着Cd浓度的增加,O2·-含量也随之增加,不同浓度处理下 O2·-含量与对照相比呈现显著上升趋势(P<0.05)。当 Pb的浓度继续升高,O2·-含量没有保持增长的趋势,而是保持在稳定的水平上。
2.2Cd、Pb胁迫对类芦根系质膜完整性的影响
伊文斯蓝染色主要是用来检测质膜完整性,可以通过着色深浅来评价质膜的完整性。如图2所示,在没有重金属污染的情况下,根尖无明显着色,但是随着Cd、Pb浓度的增加,根尖着色加深,浓度为100 μmol·L-1的Cd、Pb处理下,根尖颜色最深,说明此时根尖质膜受到明显的破坏。

图2 Cd、Pb胁迫下类芦根系质膜完整性Fig. 2 Cd or Pb-induced loss of plasma membrane integrity in the root tips of Neyraudia reynaudiana
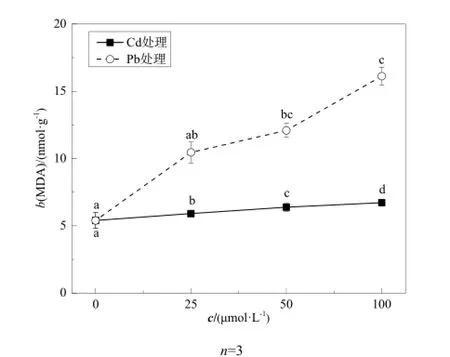
图3 不同浓度Cd、Pb处理下类芦根系的MDA含量Fig. 3 The content of MDA in roots of Neyraudia reynaudiana at different concentrations of Cd, Pb
2.3Cd、Pb胁迫对类芦的膜脂质过氧化作用
MDA是植物体膜脂质过氧化物的代谢产物,可以通过MDA含量的测定来确定细胞的氧化损伤程度。由图3可见,随着Cd、Pb浓度增加,类芦根系体内MDA含量的积累量呈增长趋势。Cd胁迫下,类芦根系的 MDA含量与处理浓度显著相关(P<0.05),随着浓度的增加而增长。Cd浓度为100 μmol·L-1时,MDA含量达到最高,为6.72 nmol·g-1。而 Pb浓度为100 μmol·L-1时,MDA含量为16.12 nmol·g-1,是对照的2.99倍。结果表明,不同浓度的Cd、Pb处理使类芦根系产生不同程度的氧化伤害。
2.4Cd、Pb胁迫对类芦根系抗氧化酶活性的影响
Cd、Pb胁迫下,类芦根系体内的抗氧化酶SOD、POD的活性发生不同变化,如图4所示。由图4(A)可知,SOD活性随着重金属浓度的增加呈先上升后下降的趋势,胁迫下的 SOD活性均高于对照。Pb胁迫下,当浓度为25 μmol·L-1时,SOD活性达到最大值,是对照的2.53倍;而在Cd胁迫下,当浓度为50 μmol·L-1时,SOD活性达到最大值,是对照的2.07倍。当Pb和Cd浓度分别为25 和50 μmol·L-1时,Pb处理的类芦根系SOD活性高于Cd处理,但在浓度为100 μmol·L-1时SOD活性降至与Cd处理相近的水平,Cd、Pb的SOD活性分别为425.96 U·g-1和400.85 U·g-1。这说明作为清除ROS的第一道防线的SOD,其活性的提高可能是由于 ROS的大量积累使其被激活,并随浓度的增加发生不同的变化。类芦根系的 POD活性变化与SOD活性变化趋势不同,如图4(B),POD活性对不同重金属胁迫的响应表现不一。无重金属胁迫时,类芦根系POD活性为99.61 U·g-1·min-1(FW),随着重金属浓度的升高,Cd处理的类芦根系POD活性随 Cd浓度的增加呈下降趋势,50和 100 μmol·L-1胁迫下的 Cd含量与对照相比显著下降(P<0.05),当浓度为100 μmol·L-1时,POD活性降至44 U·g-1·min-1(FW);而Pb处理下的POD活性则是先下降后上升,浓度25 μmol·L-1时,其活性仅为对照的 58.9%,浓度为 100 μmol·L-1时则达到237.33 U·g-1·min-1(FW),是对照的2.38倍。这说明 POD的提高是对 H2O2的积累增多的响应,而POD活性下降可能是因为高浓度的Cd抑制了POD的合成功能,当这种抑制超过类芦根系的耐受能力时,就会使POD的活性不升反降。
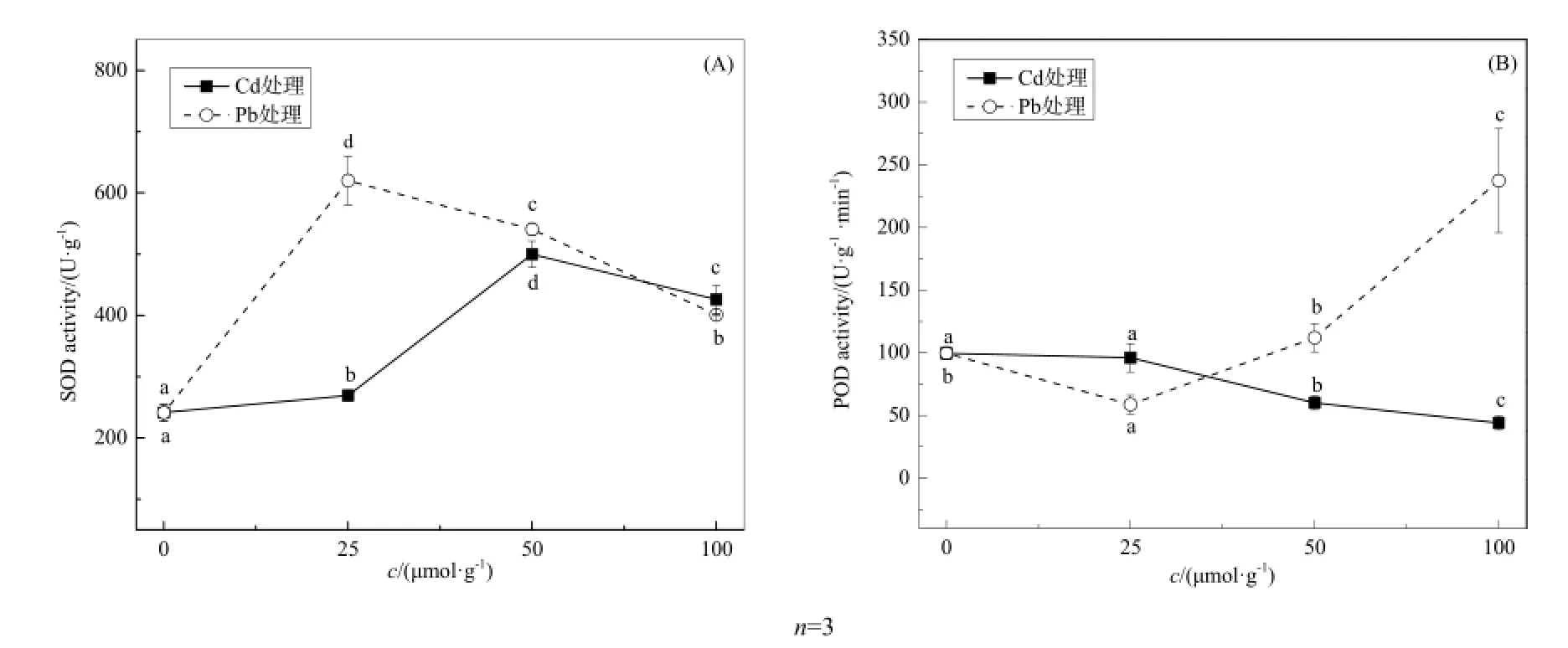
图4 不同浓度Cd、Pb处理下的抗氧化酶活性Fig. 4 Activities of antioxidative enzymes in roots of Neyraudia reynaudiana at different concentrations of Cd, Pb
2.5Cd、Pb胁迫对类芦根系TNP-SH、GSH和PCs含量的影响
不同处理下类芦根系TNP-SH、GSH和PCs含量如图4。Cd、Pb处理下,TNP-SH、GSH和PCs含量都随着重金属浓度的增高而呈现先上升后下降的趋势,并且,在不同浓度处理下均高于对照的含量。如图5(A)所示,无Cd、Pb胁迫时,类芦根系的TNP-SH含量为78.96 μmol·g-1,当Cd浓度为50 μmol·L-1时TNP-SH含量显著上升并达到最大值,为126.41 μmol·g-1;当Pb浓度为25 μmol·L-1时,TNP-SH含量达到最大值,为126.58 μmol·g-1,无论是Cd或Pb胁迫,二者TNP-SH含量的最大值相近,而当重金属浓度为100 μmol·L-1时,TNP-SH含量也下降到相近的水平。由此可以看出,Cd、Pb胁迫对类芦根系TNP-SH含量有显著的影响,并且其TNP-SH含量与重金属种类和浓度密切相关。而类芦根系GSH含量(图5(B))在Pb、Cd处理下,分别在25和50 μmol·L-1时达到最大值,为83.01 和79.27 μmol·g-1,并且在浓度为100 μmol·L-1时,两种胁迫下的GSH含量几乎相等。但是,GSH含量除在Pb浓度为25 μmol·L-1处理下显著上升外,在其他浓度处理下与对照相比并无显著差异。PCs含量的变化规律与TNP-SH基本一致,如图5(C)所示,在无Cd、Pb胁迫时,类芦根系的PCs含量为5.73 μmol·g-1,Cd不同浓度处理下,其PCs含量依次为7.15、47.14、20.83 μmol·g-1,Pb不同浓度处理下,其 PCs含量依次为 42.36、30.18、19.72 μmol·g-1,除Cd浓度为25 μmol·L-1的处理外,其他处理下的PCs含量均与对照相比呈显著上升趋势。这说明在一定的重金属离子浓度下,类芦根系可能通过合成非蛋白巯基化合物来对重金属的胁迫作出响应。

图5 不同浓度Cd、Pb处理下的TNP-SH,GSH和PCs含量的变化(n=3)Fig. 5 The change in TNP-SH, GSH and PCs contents in roots of Neyraudia reynaudiana at different concentrations of Cd, Pb
3 讨论
Cd、Pb影响植物的生长发育,高浓度的Cd、Pb抑制植物根细胞分化,阻碍水分吸收,从而导致植株矮小,叶片泛黄等,对植物产生毒害作用。但是在本研究中,尽管Cd、Pb毒害对类芦造成了氧化胁迫和质膜损伤,类芦在Cd、Pb胁迫24 h后未受到明显的影响,植株均未出现明显中毒症状,这可能与胁迫的时间长短有关,同时也显示了类芦在短时间内具有较强的应对外界环境剧变的能力,能够通过自身一系列的应激反应来降低重金属对其产生的毒害作用。
植物在正常条件下,能够有效地清除体内的ROS使细胞免受伤害,但在重金属毒害胁迫下,植物体内ROS产生速度超过植物清除ROS的速度,造成 ROS在细胞中积累,从而造成氧化损伤。本研究表明,类芦根系在Cd、Pb处理24 h后,H2O2含量与重金属浓度呈剂量-效应的关系,Pb处理下的类芦H2O2含量高于Cd的处理,可能是Pb更多地积累在根尖,诱导 H2O2含量的显著增加。然而Cd处理下O2·-含量均高于Pb处理,可能是Cd诱导O2·-含量增加的作用更强,说明植物启动了体内清除O2·-的机制,有效清除了多余的O2·-。ROS的产生使蛋白质和生物大分子变性及细胞膜脂质过氧化加剧,以往的研究也发现,ROS的积累可以诱导紫穗槐Amorpha fruticosa(Bankaji et al.,2015)、东南景天Sedum alfredii(Huang et al.,2012)等叶片和根系的MDA含量升高。而在本试验中,被胁迫的类芦根尖MDA含量明显上升,说明类芦根系在重金属胁迫下受到的明显的氧化伤害,其中 Pb对类芦根系的氧化损伤程度更大。并且,随着处理浓度的增加,不断积累的 ROS使植物受到的氧化伤害程度增大,其细胞膜组成发生变化,结构遭到破坏。而重金属对植物的氧化损伤效应在组织化学反应的结果中得到了进一步证明(图2),半定量的组织化学结果提供了类芦根系受到Cd、Pb毒害的直观证据,由此可见,Cd、Pb胁迫能够影响类芦根系细胞膜的稳定性和功能的完整性,揭示了重金属胁迫对类芦根系细胞膜系统伤害的机制。
在重金属胁迫,细胞膜等受到损伤的同时,植物自身具有抗氧化的保护酶系统,能够维持自由基在植物体内产生和清除的动态平衡。一般认为,POD、SOD、CAT活性的维持和提高是植物耐受重金属胁迫的物质基础之一。本研究中,不同浓度Cd、Pb处理下,类芦根尖SOD活性均高于对照,表明类芦体内 SOD作为类芦根系抵御重金属毒性的第一道屏障,可清除有害的O2·-并将其转化为H2O2,SOD酶的作用在众多学者的研究中均被验证(Thounaojam et al.,2012;Li et al.,2016)。而POD活性则出现不同的变化。Pb处理下随处理浓度增加POD活性表现出先下降后上升的趋势,高活性的POD酶能够有效地清除多余的H2O2,但是Cd处理下随处理浓度增加 POD活性出现下降的趋势。相似地,田向荣等(2015)的研究同样发现 Cd、Pb复合胁迫下,匍灯藓Plagiomnium POD活性随Pb浓度增加而持续降低。此外,POD活性的下降可能与植物的测定部位、重金属的种类以及浓度、胁迫时间等有关(Gupta et al.,2009;史沛丽等,2013)。因此可以认为,植物抗氧化物酶活性的增加是植物的一种保护机制,表明植物已受到环境的迫害,但是高浓度的重金属胁迫,能导致植物抗氧化酶系统遭到破坏,酶活性降低,影响植物正常生长。综合分析可得出,类芦在应对不同重金属胁迫时,既存在提高 SOD酶活性的生理代谢响应,又存在抑制POD酶活性的特异性反应,类芦通过及时调节SOD、POD活性,以保持细胞内抗氧化酶系统的平衡,减少植物受到的伤害。本研究中未测得 CAT活性,可能由于 CAT活性生成量低,或是因为降解速度快。
除抗氧化酶外,植物另一个应对重金属胁迫的策略是在细胞内合成巯基化合物,金属离子对—SH具有很强的亲和力,其中与重金属解毒关系最为密切的有GSH和PCs等多肽物质。GSH承担着抵御ROS和保护质膜的作用,可以通过与重金属离子发生络合作用实现其解毒功能,并且GSH是合成PCs的底物。以往的研究发现(孙琴等,2008),小麦根系GSH随Cd浓度增加而上升,对Cd污染响应敏感,可以作为Cd污染的生物标记物。Zhao et al. (2015)的研究也发现在Pb胁迫下,矿区生态型华中盖蹄蕨Athyrium wardii根和叶中的GSH含量均有显著的升高。但是有研究认为(Neyi et al.,2012),GSH和 PCs在植物不同部位承担着重金属解毒功能,PCs主要在根部,而GSH则在叶片的解毒上有更显著的作用。在本研究中,类芦根系 TNP-SH、GSH和PCs含量均随着Cd、Pb的浓度增加呈现先上升后下降的趋势,但是GSH含量除在Pb浓度为25 μmol·L-1的处理下有显著上升外,其它处理均与对照无显著差异,可能是因为 GSH通过其它方式参与重金属解毒,如合成PCs、金属螯合物、抗氧化剂等(宋相帝等,2011),这方面的探索还有待进一步的深入。类芦根系PCs与重金属螯合可能是其解除重金属毒害的重要机制,PCs能与重金属直接结合并在液泡内形成区室化,以减少重金属对细胞的损害。大量的试验结果(Zhang et al.,2013;Zhou et al.,2015)证明,PCs在植物对重金属抗性中有重要的作用,并且PCs的合成水平与重金属污染程度密切相关。在本研究中,Cd、Pb对类芦根系内的PCs的合成随处理浓度的增加表现出先促进后抑制的作用,并且PCs的合成对重金属的种类及其浓度的响应不同。低浓度下进入细胞质的少量Cd 或Pb激活了PCs合成酶,进而促进了PCs的合成。
但是随着浓度的增加,PCs含量有所下降,其原因可能有以下3个方面:(1)PCs解除了重金属离子毒性(冯保民等,2003);(2)或由于Cd、Pb与金属硫蛋白(MT)等其他配体结合(冯倩等,2010);(3)重金属使得类芦某些功能受损。结果导致PCs合成酶不再被激活,PCs合成能力下降(孙琴等,2004)。由此推测,类芦根系遭受到中低浓度的Cd、Pb胁迫时能有效的合成PCs,从而降低重金属的毒性和对植物的伤害,维持自身的稳态。但有关Cd、Pb胁迫对类芦根系GSH、PCs的合成与降解及调控机制还有待进一步的研究。而目前已有相关研究(原海燕等,2013)发现,通过添加外源GSH不仅可起着缓解重金属对植物的毒害作用,还可能具有促进重金属往地上部分运转的作用,因此需要通过更进一步的研究来分析其在类芦中的作用。
4 结论
(1)Cd、Pb胁迫使类芦根系受到显著的氧化损伤,ROS积累导致细胞膜遭受破坏,但是类芦并没有出现明显的毒害症状,说明类芦对重金属Cd、Pb有一定的耐受性。
(2)重金属胁迫对类芦根系抗氧化酶和非蛋白巯基化合物有一定的影响,类芦通过调节二者在其体内的水平以增强植物对重金属的抗性,降低重金属胁迫对其产生的毒害程度,但是高浓度的 Cd、Pb抑制了类芦抗氧化酶的活性以及非蛋白巯基化合物的合成。
ALFADUL S M S, AL-FREDAN M A A. 2013. Effects of Cd, Cu, Pb, and Zn Combinations on Phragmites australis Metabolism, Metal Accumulation and Distribution [J]. Arabian Journal Forence & Engineering, 38(1): 11-19.
BANKAJI I, CACADOR I, SLEIMI N. 2015. Physiological and biochemical responses of Suaeda fruticosa to cadmium and copper stresses: growth, nutrient uptake, antioxidant enzymes, phytochelatin,and glutathione levels [J]. Environmental Science & Pollution Research, 22(17): 13058-69.
DE VOS C H R, VONK M J, VOOIJS R, et al. 1992. Glutathione Depletion Due to Copper-Induced Phytochelatin Synthesis Causes Oxidative Stress in Silene cucubalus [J]. Plant Physiology, 98(3): 853-858.
DENG H, YE Z H, WONG M H. 2004. Accumulation of lead, zinc, copper and cadmium by 12 wetland plant species thriving in metal-contaminated sites in China [J]. Environmental Pollution,132(132): 29-40.
GUPTA D K, NICOLOSO F T, SCHETINGER M R C, et al. 2009. Antioxidant defense mechanism in hydroponically grown Zea mays seedlings under moderate lead stress [J]. Journal of Hazardous Materials, 172(1): 479-484.
HUANG H G, GUPTA D K, TIAN S K, et al. 2012. Lead tolerance and physiological adaptation mechanism in roots of accumulating and non-accumulating ecotypes of Sedum alfredii [J]. Environmental Science & Pollution Research International, 19(5): 1640-1651.
JASINSKI M, SUDRE D, SCHANSKER G, et al. 2008. AtOSA1, a member of the Abc1-like family, as a new factor in cadmium and oxidative stress response [J]. Plant Physiology, 147(2): 719-731.
LI T Q, YANG X E, LU L L, et al. 2009. Effects of zinc and cadmium interactions on root morphology and metal translocation in a hyperaccumulating species under hydroponic conditions [J]. Journal of Hazardous Materials, 169(1-3): 734-741.
LI Y, ZHOU C, HUANG M, et al. 2016. Lead tolerance mechanism in Conyza canadensis: subcellular distribution, ultrastructure,antioxidative defense system, and phytochelatins [J]. Journal of Plant Research, 129(2): 251-262.
NEYI E E G, ENRIQUE S D, OMAR Z P, et al. 2012. Glutathione plays a role in protecting leaves of Salvinia minima from Pb2+damage associated with changes in the expression of SmGS genes and increased activity of GS [J]. Environmental & Experimental Botany,75(13): 188-194.
THOUNAOJAM T C, PANDA P, MAZUMDAR P, et al. 2012. Excess copper induced oxidative stress and response of antioxidants in rice [J]. Plant Physiology & Biochemistry, 53(4): 33-39.
Wang Y S, Yang Z M. 2005. Nitric Oxide Reduces Aluminum Toxicity by Preventing Oxidative Stress in the Roots of Cassia tora L. [J]. Plant & Cell Physiology, 46(12): 1915-23.
ZHANG S J, LI T X, HUANG H G, et al. 2013. Phytoremediation of cadmium using plant species of Athyrium wardii (Hook.) [J]. International Journal of Environmental Science & Technology, 11(3): 757-764.
ZHAO L, LI T X, YU H Y, et al. 2015. Changes in chemical forms,subcellular distribution, and thiol compounds involved in Pb accumulation and detoxification in Athyrium wardii (Hook.) [J]. Environmental Science & Pollution Research, 22(16): 1-13.
ZHOU C F, ZHANG K, LIN J W, et al. 2015. Physiological Responses and Tolerance Mechanisms to Cadmium in Conyza Canadensis [J]. International Journal of Phytoremediation, 17(3): 280-289.
蔡丽平, 吴鹏飞, 侯晓龙, 等. 2012. 类芦根系对不同强度干旱胁迫的形态学响应[J]. 中国农学通报, 28(28): 44-48.
戴文娇, 宁平, 刘晓海, 等. 2008. 类芦对铅的耐性及富集能力探讨[J].环境工程学报, 2(7): 1004-1008.
冯保民, 麻密. 2003. 植物络合素及其合酶在重金属抗性中的功能研究进展[J]. 应用与环境生物学报, 9(6): 657-661.
冯倩, 台培东, 付莎莎, 等. 2010. 巯基化合物在万寿菊镉解毒中的作用[J]. 环境工程学报, 4(01): 214-218.
李合生, 孙群, 赵世杰. 2000. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社.
史沛丽, 张玉秀, 柴团耀. 2013. 龙葵叶片和根系抗氧化酶对镉胁迫的响应[J]. 中国科学院大学学报, 30(5): 608-612.
宋相帝, 吕金印, 邸丽俊, 等. 2011. 铬胁迫对青菜(Brassica chinensis L.)植物螯合肽含量及抗氧化特性的影响[J]. 农业环境科学学报, 30(5): 843-848.
孙琴, 王超. 2008. 土壤Cd、Zn复合污染对小麦根系植物络合素和谷胱甘肽合成的影响[J]. 农业环境科学学报, 27(5): 1913-1918.
孙琴, 王晓蓉, 袁信芳, 等. 2004. 有机酸存在下小麦体内Cd的生物毒性和植物络合素(PCs)合成的关系[J]. 生态学报, 24(12): 2804-2809.
田向荣, 吴昊, 李菁, 等. 2015. Cd、Pb复合胁迫下湿地匍灯藓(Plagiomnium acutum)重金属累积效应及抗氧化系统响应[J]. 农业环境科学学报, 34(5): 844-851.
王爱国, 罗广华. 1990. 植物的超氧物自由基与羟胺反应的定量关系[J].植物生理学通讯, (6): 55-57.
王晓蓉. 2013. 污染物微观制毒机制和环境生态风险早期诊断[M]. 北京:
科学出版社.
杨期和, 刘惠娜, 李清华, 等. 2012. 粤东铅锌尾矿区3种优势植物根际土壤微生物的活性研究[J]. 中国农学通报, 28(30): 56-64.
原海燕, 郭智, 佟海英, 等. 2013. Pb胁迫下外源GSH对马蔺体内Pb积累和非蛋白巯基化合物含量的影响[J]. 水土保持学报, 27(4): 212-216.
张宗申, 利容千, 王建波. 2001. 草酸处理对热胁迫下辣椒叶片膜透性和钙分布的影响[J]. 植物生理学报, 27(2): 109-113.
Response of Antioxidant Enzymes and PCs in Root of Neyraudia reynaudiana to Cd, Pb Stress
LUO Jiewen1, 2, LI Ying1, 2, SU Shuoshuo1, 2, HUANG Xiaomin, ZHUO Chuifan1, 2*
1. College of Forestry, Fujian Agriculture and Forestry University, Fuzhou 350002, China;
2. Co-innovation center for soil and water conservation in red soil region of the Cross-straits, Fuzhou 350002, China
Neyraudia reynaudiana is one of the most common heavy-metal tolerant plants surrounding mines. Because N. reynaudiana can accumulate large amounts of heavy metals, it could be an effective plant for phytoremediation. In order to study its response to heavy metal stress, a solution culture experiment was carried out at different lead (Pb) and cadmium (Cd) concentrations (0, 25, 50, and 100 μmol·L-1). After 24 hours, oxidative damage, antioxidant enzyme activity, and non-protein thiol compound content or root tissue were assessed. Under Cd and Pb stress, increases in H2O2and O2·-content were accompanied by malondialdehyde (MDA) content increases. At Pb and Cd concentrations of 100 μmol·L-1, the MDA contents respectively reached 6.72 and 16.12 nmol·g-1, and both lipid peroxidation and oxidative damage had increased. Additionally, enzymatic function was effected, with superoxide dismutase (SOD) and peroxidase (POD) activity initially increasing with metal concentration and then declining under higher Pb stress. SOD activity under Cd stress was similar to that under Pb stress, but POD activity was lower. The non-protein thiol content of roots showed that glutathione and phytochelatins initially increased and then decreased with Cd and Pb concentrations. Comprehensive analysis thus revealed that these two heavy metals at different concentrations have different effects on N. reynaudiana root tissue. Overall, N. reynaudiana can adjust its antioxidant enzyme activity and non-protein thiol synthesis levels in order to reduce heavy metal toxicity and damage.
Cd/Pb; Neyraudia reynaudiana; plasma membrane integrity; antioxidant enzyme; phytochelatins (PCs)
10.16258/j.cnki.1674-5906.2016.06.019
X53
A
1674-5906(2016)06-1047-07
国家科技支撑计划(2014BAD15B02);农业高校产学合作科技重大项目(2013N5002);福建省高校杰出青年科研人才培育计划(2015);福建省自然科学基金项目(2013J01073)
罗洁文(1991年生),女,硕士研究生,研究方向为生态修复。E-mail ellenlll@163.com
2016-05-13

