不同地区稻田土壤甲烷氧化碳同位素分馏特征及其影响因素研究
张晓艳,徐华,马静,刘梅先. 湖南第一师范学院,湖南 长沙 4005;. 土壤与农业可持续发展国家重点实验室,中国科学院南京土壤研究所,江苏 南京 0008;3. 中国科学院亚热带农业生态过程重点实验室,湖南 长沙 405;4. 中国科学院环江喀斯特生态系统观测研究站,广西 环江 54700
不同地区稻田土壤甲烷氧化碳同位素分馏特征及其影响因素研究
张晓艳1,徐华2,马静2,刘梅先3, 4*
1. 湖南第一师范学院,湖南 长沙 410205;2. 土壤与农业可持续发展国家重点实验室,中国科学院南京土壤研究所,江苏 南京 210008;3. 中国科学院亚热带农业生态过程重点实验室,湖南 长沙 410125;4. 中国科学院环江喀斯特生态系统观测研究站,广西 环江 547100
稻田CH4氧化是CH4排放的自然调节,受多种因素的影响。中国水稻种植区分布广,不同地区的气候环境条件以及水肥管理措施,都会影响稻田CH4氧化及碳同位素分馏过程。因此,对比研究不同地区稻田甲烷氧化和同位素分馏规律,甄别其影响因子,有助于进一步认识稻田甲烷氧化规律,也可为稻田温室气体减排调控提供科学依据。文章基于稳定性碳同位素的方法,结合室内好氧培养试验,测定了全国主要水稻产区(四川、湖南、江西、浙江、广东和辽宁)典型稻田土壤的CH4氧化过程,确定了CH4氧化碳同位素分馏系数αox,研究了不同稻田土壤在不同水分条件下的CH4氧化和同位素分馏的差异及规律。结果表明,四川资阳以及湖南宝洞峪的水稻土壤CH4氧化潜力相对偏低,平均为其他地区土壤的六分之一。同时,不同地区稻田土壤CH4氧化同位素分流系数(13C)αox差异较大,且与CH4氧化潜力呈显著负相关。在85% WHC(soil water holding capacity)和1∶1水土质量比时,相关系数分别为-0.85(P=0.032)和-0.82(P=0.047)。进一步研究发现,土壤CH4氧化潜力与土壤活性铁含量呈显著正相关,在85% WHC和1∶1水土质量比时,相关系数分别为0.86(P=0.042)和0.90(P=0.035);而αox则与土壤活性铁含量呈显著负相关,85% WHC和1∶1水土质量比时,相关系数均为-0.92(P=0.026)。由以上结果可知,土壤水分和土壤活性铁是影响CH4氧化潜力和碳同位素分馏的重要因素,而有关其作用机制仍需进一步的研究。
稻田土壤;甲烷排放;甲烷氧化;同位素分馏
引用格式:张晓艳, 徐华, 马静, 刘梅先. 不同地区稻田土壤甲烷氧化碳同位素分馏特征及其影响因素研究[J]. 生态环境学报,2016, 25(6): 927-933.
ZHANG Xiaoyan, XU Hua, MA Jing, LIU Meixian. CH4Oxidation Isotope Fractionation and the Influences in Rice Fields in Different Regions in China [J]. Ecology and Environmental Sciences, 2016, 25(6): 927-933.
近年来,全球范围内极端气候频繁出现,进一步吸引了人们对全球气候变化的关注(Asadieh et al.,2015;Shi et al.,2015)。极端气候事件与气候变暖是密切相关的(Cai et al.,2014;Easterling et al.,2000),而全球气候变暖的主要原因是温室气体的排放,如二氧化碳(CO2)、甲烷(CH4)、氧化亚氮(N2O)和氟利昂等。其中,CH4是仅次于CO2的重要温室气体,单分子 CH4的增温效应是 CO2的 7.6~72倍,对全球温室效应的贡献约为 18% (IPCC,2007)。
稻田是大气CH4的重要来源,其CH4排放量达25.6 Tg·a-1(Yan et al.,2009)。中国水稻种植面积约占世界种植总面积的20%(Institute,2004),稻田 CH4排放在中国温室气体排放中占有较大比例(Zhang et al.,2015)。事实上,稻田CH4排放是土壤中CH4产生、氧化和传输的净效应。尽管稻田土壤整体以淹水还原条件为主,但在根土及土水界面也存在氧化区域,导致土壤中产生的CH4在排放至大气前有相当一部分被土壤甲烷氧化菌氧化(Reeburgh et al.,1997;Smemo et al.,2007;张晓艳等,2010a)。因此,CH4氧化是稻田CH4排放的自然调节,研究 CH4氧化过程对减少和调控稻田CH4排放具有重要意义(张晓艳等,2012)。
目前,测定土壤CH4氧化率的方法中,稳定性碳同位素自然丰度方法与传统的产生-排放差值法和添加甲烷氧化抑制剂法相比,具有可在自然条件下测定CH4氧化率、避免扰动土壤环境的优点,测定结果更加可靠。因此,自20世纪90年代以来,国内外学者已将稳定性碳同位素法广泛应用到CH4的研究中(De Visscher et al.,2004;Templeton et al.,2006;Tyler et al.,1997;Zhang et al.,2015)。稳定性碳同位素法的核心原理是利用甲烷氧化菌在氧化CH4时对12CH4和13CH4的选择性不同,甲烷氧化菌可以更快速地氧化12CH4,导致排向大气的CH4中12C/13C比率发生变化,形成13C富集,这种作用称为“同位素分馏作用”。同位素分馏系数αox即表示甲烷氧化菌喜好12CH4的程度。而稳定性碳同位素方法则是通过测定CH4氧化过程中δ13C值的变化,来计算CH4氧化率的(Zhang et al.,2015),这对估算全球CH4产生和排放具有重要意义。
迄今为止,很多学者研究了如垃圾填埋场、森林土壤、苔原土壤等的同位素分馏系数 αox及其影响因素(De Visscher et al.,2004;Smemo et al.,2007;Templeton et al.,2006;Tyler et al.,1997;Tyler et al.,1994),但关于稻田土壤氧化同位素分馏系数αox的报道尚不多见。根据已有研究成果,CH4氧化同位素分馏存在季节变化,且受温度、CH4氧化速率、甲烷氧化细菌、土壤水分和预处理方式等诸多因素的影响(Chanton et al.,2000;Coleman et al.,1981;Tyler et al.,1994;张晓艳等,2010b)。中国水稻种植面积大、分布广,不同地区水稻种植具有各自鲜明的水肥管理特色,水稻生育期内土壤温度、土壤水分、CH4浓度等环境条件也有较大的差异,这些因素都可能影响稻田 CH4氧化及碳同位素分馏过程。为此,本文在全国选取了一些有代表性的水稻土,通过室内好氧培养的方法,观测了不同水分条件下、不同稻田土壤 CH4氧化潜力以及氧化过程中的同位素分馏效应,旨在探明稻田 CH4氧化过程和同位素分馏系数αox与土壤环境条件之间的关系,以期为定量研究 CH4氧化提供重要参数,为准确估算中国稻田的CH4排放量和稻田CH4调控减排提供理论依据。
1 材料与方法
1.1供试土壤来源及其环境特点

表1 采样点地理位置及气候条件Table 1 Location, climate, precipitation and tempaerature for the sample sites

图1 采样点位置分布Fig. 1 Locations of the samples
本文稻田土壤分别采自辽宁沈阳、四川资阳、广东雷州、湖南桃源、江西鹰潭和浙江嘉兴,具体位置如图1所示。采样点地理位置、气候、降水和气温等信息如表1所示。其中四川土壤取自四川省资阳市松涛镇的响水村流域,属于北亚热带湿润季风气候区,平均海拔 395 m,平均年降水量 965.8 mm,一年中降水分配极不均匀,5—10月期间的降水量约占全年总降水量的 80%,年平均气温16.8 ℃。辽宁稻田土壤采自辽宁省沈阳市沈阳农业大学土壤肥力长期定位试验站,气候属暖温带,水分条件半湿润,为温带季风气候,当地全年降水量在680 mm,年平均气温8.3 ℃。湖南的土壤于2011 年1月取自湖南省常德市桃源县漳江镇宝洞峪村,属中亚热带季风湿润气候,四季分明,干湿两季明显,当地年平均降水量为1448 mm,年平均相对湿度为82%,年平均气温为16.5 ℃。浙江的土壤样品取自浙江省嘉兴市南湖区余新镇,地处北亚热带南缘,属东亚季风区,冬夏季风交替,四季分明,当地年平均降水量1169 mm,年平均气温15.9 ℃。江西的土壤取自江西省鹰潭市南京土壤所鹰潭站,属于亚热带季风气候,当地年平均降水量为 1774 mm,年平均气温为18.1 ℃。广东的土壤取自广东省雷州市英利镇,属于热带海洋性季风气候,当地年平均降水量1712 mm,年平均气温22 ℃。以上采样地点除沈阳为单季稻田外,其余皆为双季稻。另外,所有土样均于水稻生长旺盛的6月份(2012年)采集,并于同块稻田采集3个耕层(0~20 cm)重复样品备用。
1.2好氧培养试验
取50 g土样于三角瓶中,分别加入去离子水调节土壤含水量至85% WHC(土壤持水量)和1∶1水土质量比(质量含水量),密封瓶口。加入一定量高纯 CH4,调节至 CH4初始体积分数为 10000 μL·L-1。其中85% WHC放入培养箱黑暗预培养,而1∶1水土质量比处理放入振荡培养箱(120 rpm)预培养1周。结束后打开瓶塞,使之与外界通气1晚后再次密封,并注入高纯 CH4至体积分数为10000 μL·L-1,放入恒温培养箱黑暗培养30 min后测定瓶内CH4体积分数和δ13CH4,分别记为初始CH4体积分数和初始δ13C值。之后每隔一定时间取样测定 CH4体积分数和 δ13CH4,取样频率取决于CH4降低情况。CH4体积分数分析一般为1天1~2次,δ13CH4样品一般在试验开始和CH4体积分数降至前一取样值的一半时取样。其中,CH4体积分数用装有氢火焰离子检测器(FID)的岛津气相色谱(Shimadzu GC-12A,Kyoto,Japan)测定;CH4稳定性碳同位素组成用带有全自动预气相色谱(GC)浓缩接口(PreCon)的Thermo Finnigan MAT-253同位素质谱仪测定。
1.3土壤理化性质分析
本文所测定的土壤理化性质指标包括NH4+-N、NO3--N、土壤可溶性有机碳(DOC)、土壤pH、土壤有机碳、全氮、活性铁、铝、锰和土壤持水量(WHC)等,其测定方法如表2所示。

表2 土壤理化性质指标及其测定方法Table 2 Soil physiochemical parameters and their measurements
1.4数据分析
本文CH4氧化潜力由以下公式计算:

式(1)中,P为CH4氧化潜力,μg·g-1·d-1;dc/dt为培养瓶内气相 CH4体积分数单位时间的变化,μL·L-1·d-1;VH为培养瓶内上部空间的体积,L;Ws为干土重量,g;MW为CH4的摩尔质量,g;MV为标准状态下摩尔体积,L;T为培养温度,K。
碳同位素分馏系数 αox采用以下公式计算(Coleman et al.,1981):

式(2)中,δCt=0是开始培养时CH4的δ13C;δCt是培养一定时间(t)后剩余CH4的δ13C;f是培养时间(t)时剩余CH4占外加总CH4量的比值。
另外,本文中的数据分析,包括相关分析、回归分析、方差分析及标准偏差等均采用统计软件SPSS 15.0 for Windows(SPSS Inc.,Chicago)和Microsoft Excel 2013完成。
2 结果与分析
2.1不同土壤的基本性质
由于样地位置空间跨度较大,成土母质各不相同,温度、降雨等气候条件也差异较大,另外田间管理,包括施肥量、耕作方式等也不一致,供试土壤理化性质有较大差异,如表3所示。可见,不同土壤中NO3
--N含量差异最大,变异系数为112.2%;其次为活性锰,变异系数为67.6%;再次为全碳、NH4+-N、活性铁等,变异系数为50%左右;变异最小为土壤 pH,除了四川土样外(7.9左右),其余各土样均呈弱酸性,平均为 5.52,变异系数为18.1%。
2.2不同稻田土壤的CH4氧化潜力及CH4氧化碳同位素分馏系数
不同稻田土壤好氧培养条件下CH4浓度变化如图2所示,氧化潜力如图3所示。不同土壤的CH4的氧化过程线有明显差异(图2),其中四川资阳和湖南宝洞峪土壤氧化速率较慢。从氧化潜力来看,在85% WHC的土壤含水量下,沈阳、嘉兴、鹰潭和雷州土壤氧化潜力较高,分别为32.6、54.6、50.2 和53.2 μg·g-1·d-1,资阳以及宝洞峪的土壤CH4的氧化潜力相对较低,分别为9.4和5.9 μg·g-1·d-1,平均仅为雷州等土壤的1/6。当水土质量比为1∶1时,资阳以及南宝洞峪的土壤CH4氧化潜力相对85% WHC有所提高,而广东雷州土壤 CH4的氧化潜力下降,不同土壤之间 CH4氧化潜力的差异也有所降低。另外,比较可知,除资阳以及宝洞峪的土壤外,其他土壤85% WHC含水量时CH4氧化潜力高于水土质量比为1∶1时的氧化潜力。
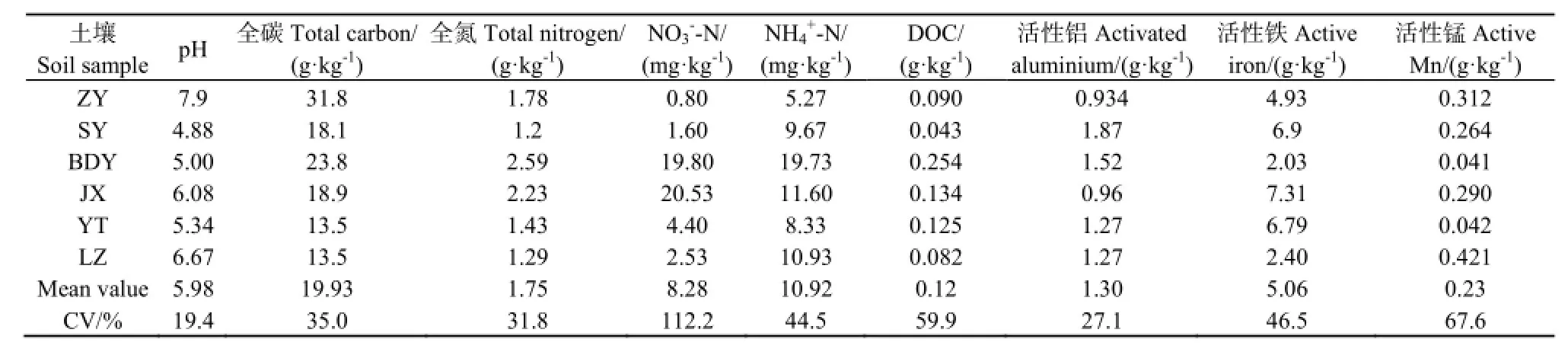
表3 供试土壤基本理化性质Table 3 The main properties for the soil samples

图2 不同土壤的CH4氧化过程Fig. 2 Soil CH4oxidation process

图3 不同水稻土壤CH4氧化潜力Fig. 3 Soil CH4oxidation potential for different paddy soils
两种土壤水分条件下不同稻田土壤 αox如图 4所示。在土壤含水率为85% WHC时,6种土壤的αox平均值为1.026,而1∶1水土质量比时αox平均值为 1.013。但是,不同土壤之间也存在明显差异,由图4可见,在土壤含水率为85% WHC时αox明显高于1∶1水土质量比时αox,且在水土质量比为1∶1时,不同土壤αox变化较大。总体上讲,土壤水分升高导致 αox下降,但不同土壤之间的下降程度不一,其中资阳土壤在水分增高时 αox下降幅度最大,从1.023下降至1.006,而沈阳、宝洞峪、嘉兴、鹰潭和雷州土壤分别降低0.007、0.005、0.014 和0.012。另外,相关分析结果表明,土壤αox与土壤CH4氧化速率呈显著负相关,其中85% WHC和1∶1水土质量比时相关系数分别为-0.85(P=0.032)和-0.82(P=0.047)。

图4 不同土壤CH4氧化的碳同位素分馏系数αoxFig. 4 CH4oxidation carbon isotope fractionation factor αoxfor different paddy soil
2.3土壤CH4氧化潜力和αox的影响因子分析
不同条件下 CH4氧化潜力、αox和土壤基本性质的关系分析结果如表4所示。可知,在85% WHC条件下,土壤CH4氧化潜力与土壤中活性铁和全碳含量呈显著相关,相关系数分别为0.86(P=0.042,n=6)和-0.87(P=0.038,n=6),而与其他因子相关性较弱。在1∶1水土质量比条件下,土壤CH4氧化潜力主要与土壤活性铁呈显著相关,相关系数 r 为0.90(P=0.035,n=6)。与CH4氧化潜力相似,在85% WHC时,αox与土壤活性铁含量呈显著相关,相关系数r为-0.92(P=0.026,n=6),而在1∶1水土质量比条件下,αox与土壤活性铁和NH4+-N显著相关,相关系数r分别为-0.92(P=0.025,n=6)和0.82(P=0.049,n=6)。

表4 CH4氧化潜力与土壤基本性质的相关关系Table 4 The relationship between the CH4oxidation potential and soil properties
3 讨论
稻田甲烷排放是大气温室气体的主要来源之一。事实上,稻田CH4排放是土壤中CH4产生、氧化和传输的结果(蔡祖聪等,1999)。尽管稻田土壤整体以淹水还原条件为主,但在根土及土水界面也存在好氧区域,导致土壤中产生的CH4在排放至大气前部分被土壤中甲烷氧化菌氧化(王明星等,1998;颜晓元等,1996)。CH4氧化是稻田 CH4排放的自然调节,对减少稻田CH4排放具有重要意义(蔡祖聪等,1999)。中国水稻种植分布十分广泛,不同的气候环境条件以及水肥管理措施,都将会影响到稻田CH4氧化及碳同位素分馏过程(Boeckx et al.,1997;Conrad et al.,1991;Ma et al.,2011;Nayak et al.,2007;Zhang et al.,2012;蔡祖聪等,1999;张晓艳等,2010)。因此,对比研究不同地区稻田甲烷氧化和同位素分馏规律,有助于进一步认识稻田甲烷氧化规律,也可为稻田温室气体减排调控提供科学依据。本文以全国主要水稻产区(四川、湖南、江西、浙江、广东和辽宁)典型稻田土壤作为供试土壤,研究了不同地区稻田土壤的CH4氧化过程,探讨了 CH4氧化碳同位素分馏系数 αox及其影响因素。
结果表明,土壤含水量对 CH4氧化潜力以及CH4氧化碳同位素分馏系数 αox均有较大的影响。对于氧化潜力而言,在土壤含水率为85% WHC含水量时,土壤CH4氧化潜力一般高于水土质量比为1∶1时的氧化潜力。而对于氧化碳同位素分馏系数αox则相反,随着土壤水分升高αox下降,这个结果和Tyler et al.(1994)的研究结果是一致的。但是,不同土壤之间的下降程度也不尽相同,主要原因是αox还受到其他因素影响,如甲烷氧化菌的数量、种类等,从而导致不同土壤 αox值对水分变化响应有所不同(Coleman et al.,1981;Templeton et al.,2006)。总体上看,当土壤含水率为85% WHC时,6种土壤的CH4氧化碳同位素分馏系数αox平均值为1.026,而1∶1水土质量比时αox平均值为1.013,这和其他研究得出的结果接近(Coleman et al.,1981;Reeburgh et al.,1997;Snover et al.,2000)。
同时,土壤αox与土壤CH4氧化速率呈显著负相关(P<0.05),其中85% WHC和1∶1水土质量比时两者相关系数分别为-0.85(P=0.032)和-0.82 (P=0.047)。由此可见,氧化速率是αox变化的主要因素之一。事实上,氧化速率和甲烷菌群数量是密切相关的,在一定条件下,甲烷氧化菌数量越大,氧化速率也越大,反之则亦然。Templeton et al. (2006)发现细胞数量较低时αox大于1.030,而细胞数量较高会导致αox值低至1.003,这也是氧化速率高导致 αox值低的主要内在机制之一。另外,αox值与培养温度的关系也可进一步说明其中原因。很多研究结果表明,温度升高导致αox值下降(Borjesson et al.,2001;Tyler et al.,1994),这是因为温度升高会导致甲烷氧化菌活性升高从而降低甲烷氧化菌对12CH4和13CH4的选择性所致。土壤含水量对αox影响的深层次原因也是改变了CH4氧化速率,从而改变甲烷氧化菌对12CH4和13CH4的选择性。
另外,CH4氧化潜力(正相关)、αox(负相关)和土壤中活性铁含量有显著相关关系(表4)。土壤中活性铁是CH4氧化的重要因子之一。土壤中活性铁含量与土壤氧化还原性质密切相关,活性铁属于易氧化成分,较高含量的活性铁表明厌氧环境较明显,而CH4氧化一般需要好氧环境,这两者之间存在一定的矛盾。分析其原因,活性铁的存在可能作为一种激励元素,可促进甲烷氧化菌的活性,从而一方面导致其 CH4氧化潜力升高,而另一方面则降低其对12CH4和13CH4的选择性,使得αox下降。当然,CH4氧化潜力及碳同位素分馏的直接因素仍是CH4氧化菌的生物学机制,包括其种类、数量以及CH4氧化的生化机理等。但是,土壤条件及其他外部环境因素是微生物生长、生活和繁衍的限制性因素,为间接性因素,也是人为调控稻田 CH4排放和氧化的重要切入点,这些都需要进一步的深入研究。
4 结论
土壤水分状况对 CH4氧化和同位素分馏系数αox值有显著的影响,但在不同土壤条件下有所差异。当土壤土壤含水量为85% WHC(土壤持水量)时,四川资阳以及湖南宝洞峪土壤CH4的氧化潜力相对较低,当土壤含水量升高时,土壤CH4氧化潜力基本降低。而对于CH4氧化碳同位素分馏系数则相反,随着土壤含水量升高,αox下降,但不同土壤条件下降幅度有一定差异,其中四川资阳土壤降幅最大。同时,αox与 CH4氧化潜力呈显著负相关关系。另外,不论水分条件如何,CH4氧化潜力和碳同位素分馏系数 αox分别与土壤活性铁呈显著正相关和负相关(P<0.05),说明土壤活性铁是影响水稻土CH4氧化潜力和碳同位素分馏的重要因素,但其中机制尚需进一步研究。
ASADIEH B, KRAKAUER N Y. 2015. Global trends in extreme precipitation: climate models versus observations [J]. Hydrology and Earth System Sciences, 19(2): 877-891.
BOECKX P, VANCLEEMPUT O, VILLARALVO I. 1997. Methane oxidation in soils with different textures and land use [J]. Nutrient Cycling in Agroecosystems, 49(1-3): 91-95.
BORJESSON G, CHANTON J, SVENSSON B H. 2001. Methane oxidation in two Swedish landfill covers measured with carbon-13 to carbon-12 isotope ratios [J]. Journal of Environmental Quality, 30(2): 369-376.
CAI W J, BORLACE S, LENGAIGNE M, et al. 2014. Increasing frequency of extreme El Nino events due to greenhouse warming [J]. Nature Climate Change, 4(2): 111-116.
CHANTON J, LIPTAY K. 2000. Seasonal variation in methane oxidation in a landfill cover soil as determined by an in situ stable isotope technique [J]. Global Biogeochemical Cycles, 14(1): 51-60.
COLEMAN D D, RISATTI J B, SCHOELL M. 1981. Fractionation of Carbon and Hydrogen Isotopes by Methane-Oxidizing Bacteria [J]. ,45(7): 1033-1037.
CONRAD R, ROTHFUSS F. 1991. Methane Oxidation in the Soil Surface-Layer of a Flooded Rice Field and the Effect of Ammonium [J]. Biology and Fertility of Soils, 12(1): 28-32.
DE VISSCHER A, DE POURCQ I, CHANTON J. 2004. Isotope fractionation effects by diffusion and methane oxidation in landfill cover soils [J]. Journal of Geophysical Research Atmospheres,109(D18111).
EASTERLING D R, EVANS J L, GROISMAN P Y, et al. 2000. Observed variability and trends in extreme climate events: A brief review [J]. Bulletin of the American Meteorological Society, 81(3): 417-425.
IRRI. 2004. Ricestat database, Los Baños, Philippines[R]. http://www.irri.org/science/ricestat/index.asp.
IPCC. 2007. Climate Change 2007: The physical science basis. Contribution of working group I to the fourth assessment report of the Intergrovernmental Panel on Climate Change [M]. Cambridge: Cambridge University Press.
MA K, LU Y H. 2011. Regulation of microbial methane production and oxidation by intermittent drainage in rice field soil [J]. Fems Microbiology Ecology, 75(3): 446-456.
NASER H M, NAGATA O, TAMURA S, et al. 2007. Methane emissions from five paddy fields with different amounts of rice straw application in central Hokkaido, Japan [J]. Soil Science Plant Nutrition, 53(1): 95-101.
REEBURGH W S, HIRSCH A I, SANSONE F J, et al. 1997. Carbon kinetic isotope effect accompanying microbial oxidation of methane in boreal forest soils [J]. Geochimica Et Cosmochimica Acta, 61(22): 4761-4767.
SHI X M, DURRAN D R. 2015. Estimating the Response of ExtremePrecipitation over Midlatitude Mountains to Global Warming [J]. Journal of Climate, 28(10): 4246-4262.
SMEMO K A, YAVITT J B. 2007. Evidence for anaerobic CH4 oxidation in freshwater peatlands [J]. Geomicrobiology of Journal, 24(7-8): 583-597.
SNOVER A K, QUAY P D. 2000. Hydrogen and carbon kinetic isotope effects during soil uptake of atmospheric methane [J]. Global Biogeochemical Cycles, 14(1): 25-39.
TEMPLETON A S, CHU K H, ALVAREZ-COHEN L, et al. 2006. Variable carbon isotope fractionation expressed by aerobic CH4-oxidizing bacteria [J]. Geochimica Et Cosmochimica Acta, 70(7): 1739-1752.
TYLER S C, BILEK R S, SASS R L, et al. 1997. Methane oxidation and pathways of production in a Texas paddy field deduced from measurements of flux, delta C-13, and delta D of CH4[J]. Global Biogeochemical Cycles, 11(3): 323-348.
TYLER S C, CRILL P M, BRAILSFORD G W. 1994. C-13/C-12 Fractionation of Methane during Oxidation in a Temperate Forested Soil [J]. Geochimica Et Cosmochimica Acta, 58(6): 1625-1633.
YAN X Y, HIROKO A, KAZUYUKI Y, et al. 2009. Global estimations of the inventory and mitigation potential of methane emissions from rice cultivation conducted using the 2006 Intergovernmental Panel on Climate Change Guidelines [J]. Global Biogeochemical Cycles, 23(2): 627-634.
ZHANG G B, YU H Y, FAN X F, et al. 2015. Effect of rice straw application on stable carbon isotopes, methanogenic pathway, and fraction of CH4oxidized in a continuously flooded rice field in winter season [J]. Soil Biology & Biochemistry, 84: 75-82.
ZHANG X Y, ZHANG G B, JI Y, et al. 2012. Straw Application Altered CH4Emission, Concentration and13C-Isotopic Signature of Dissolved CH4in a Rice Field [J]. Pedosphere, 22(1): 13-21.
蔡祖聪, MOSIER A R. 1999. 土壤水分状况对CH4氧化、N2O和CO2排放的影响[J]. 土壤, 31(6): 289-294, 298.
王明星, 李晶, 郑循华. 1998. 稻田甲烷排放及产生、转化、输送机理[J].大气科学, 22(4): 600-612.
颜晓元, 蔡祖聪. 1996. 土壤对甲烷氧化作用的研究进展[J]. 农村生态环境, 12(2): 33-38.
张晓艳, 马二登, 张广斌, 等. 2010a. 麦季稻秆施用对后续稻季 CH4产生氧化及排放的影响[J]. 农业环境科学学报, 29(9): 1827-1833.
张晓艳, 马静, 李小平, 等. 2012. 稻田甲烷传输的研究进展[J]. 土壤,44(2): 181-187.
张晓艳, 张广斌, 纪洋, 等. 2010b. 冬季淹水稻田CH4产生、氧化和排放规律及其影响因素研究[J]. 生态环境学报, 19(11): 2540-2545.
CH4Oxidation Isotope Fractionation and the Influences in Rice Fields in Different Regions in China
ZHANG Xiaoyan1, XU Hua2, MA Jing2, LIU Meixian3, 4
1. Hunan First Normal University, Changsha 410205, China;2. State Key Laboratory of Soil and Sustainable Agriculture, lnstitute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;3. Key Laboratory for Agro-ecological Processes in Subtropical Region, Institute of Subtropical Agriculture,
Chinese Academy of Sciences, Changsha 410125, China;4. Huanjiang Observation and Research Station for Karst Ecosystem, Chinese Academy of Sciences, Huanjiang 547100, China
CH4oxiddation is the natural regulation of CH4emission in paddy soil. However, the CH4oxiddation is influenced by many factors. Furthermore, rice planting is widely distributed in China, the differences in the environmental factors (such as the climate) and the field managements, should have impacts on the CH4oxiddation processes and the stable carbon isotope fractionation of CH4oxiddation. Hence, studies on the CH4oxiddation and stable carbon isotope fractionation in paddy soils in different area, and clarify the main influences, are crucial for environmental protection and the global warming, and helpful to improve our knowledge in the principle of CH4oxiddation in paddy soils. Trough aerobic incubations and stable carbon isotope method, this study investigated the CH4oxidation potential, CH4oxidation isotope fractionation and the influencing factors in the paddy soils, which differed dramatically in soil biochemical properties. These soil samples were collected from 6 major rice-producing regions of China,including the Ziyang city in Sichuan, Taoyuan city in Hunan, Yingtan city in Jiangxi, Jiaxing city in Zhejiang, Shenyang city in Liaoning and Leizhou city in Guangdong. Results showed that the CH4oxidation potential for the soil from Ziyang (Sichuan) and Baodongyu (Hunan) were generally lower (about 1/6) than that for the other four soils. At the same time, the CH4oxidation (13C)isotope fractionation factor (αox) differed apparently, and was significantly and negatively correlated to the CH4oxidation potential,with the correlation being -0.85 and -0.81 when the soil water was 85% WHC and was 1∶1 soil water ratio, respectively. Moreover,the correlation analysis showed that, the CH4oxidation potential was significantly and positively correlated to the concentration of soil active iron, with the r being 0.86 (P = 0.042) and 0.90 (P = 0.035) when the soil water was 85% WHC (85% of the soil water holding capacity) and soil-water ratio was 1∶1, respectively. Whereas, the αox was significantly and nagetively correlated to the active iron,and the r were -0.92 (P = 0.026) when the soil water was 85%WHC (85% of the soil water holding capacity) and was 1∶1 soil-water ratio. The results indicated that the soil water content and the concentration of soil active iron were the key factors of CH4oxiddation and stable carbon (13C) isotope fractionation in paddy soils. However, the underlying mechanisms need be further study.
paddy soil; CH4emission; CH4oxidation; isotope fractionation
10.16258/j.cnki.1674-5906.2016.06.003
S15; X132
A
1674-5906(2016)06-0927-07
国家自然科学基金项目(41601262);土壤与农业可持续发展国家重点实验室开放基金项目(Y20160037)
张晓艳(1986年生),女,讲师,博士,主要从事全球变化与生态系统响应研究。E-mail: hnfnuxyzhang@sina.com
,E-mail: daodang2008@sina.com
2015-12-28

