3种食源性致病菌的实时荧光PCR快速检测
霍胜楠,孟静,杨振东,郑世超,张然(.山东省食品药品检验研究院,山东济南500;.江南大学食品学院,江苏无锡4)
3种食源性致病菌的实时荧光PCR快速检测
霍胜楠1,孟静1,杨振东2,郑世超1,张然1
(1.山东省食品药品检验研究院,山东济南250101;2.江南大学食品学院,江苏无锡214122)
DNA提取方法采用先钢珠机械破坏细菌细胞壁,再添加丙酮、蛋白酶K溶解去除杂质,大大提高了食源性致病菌基因组DNA的得率和纯度。继而针对金黄色葡萄球菌egc基因、沙门氏菌NA(not availabale)基因、志贺氏菌ipaH基因为靶基因设计特异性引物对样品建立实时荧光定量PCR检测方法。结果试验设计的引物对3种细菌具有很强特异性,除目标细菌外,对单核细胞增生李斯特氏菌、副溶血性弧菌、蜡样芽孢杆菌3种对照菌均未检测到荧光信号。对金黄色葡萄球菌、沙门氏菌和志贺氏菌的检测灵敏度分别达到10-6、10-6、10-7ng/μL。
食源性致病菌;基因组DNA提取;实时荧光定量PCR
食源性致病菌主要引起食源性疾病,对人类健康造成极大的伤害,是食品安全的重大隐患。已报道的食源性致病菌已经超过250种[1],沙门氏菌[2]、金黄色葡萄球菌[3]、志贺氏菌[4]等都是肆虐流行的重要食源性致病菌。食源性致病菌的检测技术是食源性疾病与控制的关键环节。目前包括中国在内的许多国家对这些致病菌的检验大多仍沿用传统的细菌培养及生化鉴定方法,其检验周期长、操作繁琐、灵敏度低,很难适应公共卫生事件应急处理快速反应的需要[5]。实时定量荧光PCR能克服以上缺点,检测在一个密闭环境中进行,无污染和后处理风险,可以快速、准确检测目标核酸,达到定量检测食品中致病菌的目的[6]。
另外,在食品样品检测中,经常会遇到致病菌含量低、食品基质复杂等问题,而以PCR为基础的分子生物学技术对核酸提取的要求既要纯度高又要回收率高,目前单纯的商品试剂盒提取很难满足这种要求[7]。核酸提取的关键在于组织细胞的裂解和核酸纯化,本文采用钢珠破碎结合生化试剂溶解细胞壁方式增加细菌细胞裂解,大大提高了核酸的提取效率,减少了由于细胞破碎不彻底带来的检测失误,是实际样品DNA提取操作的必然之选。
1 材料与方法
1.1材料
1.1.1试剂
细菌增殖培养液LB肉汤、营养琼脂(NA):购自北京陆桥技术有限责任公司;蛋白酶K:购自宝生物工程(大连)有限公司;丙酮、无水乙醇等试剂均为分析纯:购自上海国药公司;细菌基因组DNA提取试剂盒:购自德国Qiagen公司。
1.1.2菌种选择及生化鉴定
金黄色葡萄球菌(Staphylococcus aureus,CICC-21493)、沙门氏菌(Salmonella)、志贺氏菌(Shigella):均购自中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC)。将试验菌株在NA琼脂上进行分离培养,根据GB 4789系列食品安全国家标准对活化菌株进行镜检及相应生理生化鉴定。挑取阳性单菌落接种至LB肉汤中培养过夜备用。
1.2主要仪器
NanoDrop 2000紫外可见分光光度计:美国Thermo公司;7500 FAST实时荧光PCR仪:美国ABI公司;5424R小型冷冻离心机:德国Eppendorf公司;核酸提取用钢珠:美国BIOSPEC公司产品。
1.3基因组DNA提取方法
细菌总DNA提取方法参照Qiagen公司细菌核酸提取试剂盒。但在金黄色葡萄球菌细胞破碎时分别采用蛋白酶K酶解、丙酮溶解、丙酮/酶解、钢珠/丙酮/酶解、丙酮/钢珠/酶解方法。
1.4扩增引物探针的设计与合成
选取金黄色葡萄球菌egc基因、沙门氏菌NA(not availabale)基因、志贺氏菌ipaH基因作为选择特异性基因,首先在Genbank中获得上述3种基因的基因序列,然后利用分子生物学软件进行引物设计。各检测基因的引物、探针序列如表1所示。均由宝生物工程(大连)有限公司合成。

表1实时荧光PCR检测引物、探针Table 1 Specific primers and probes sequences in RT-PCR
1.5实时荧光PCR方法分析
PCR反应体系为25 μL,各组分分别为:2×TaKaRa TaqTMBuffer 12.5 μL,引物 Primer-F和Primer-R(10 μmol/L)各0.5 μL,探针(10 μmol/L)0.5 μL,DNA模板1 μL,加蒸馏水补至25 μL。PCR反应条件为:95°C变性10 s,95°C退火5 s,60°C延伸40 s,经40个循环。试验结果应用ABI 7500FAST Software v2.0.1进行分析处理。判定CT值小于35的扩增结果为致病菌检测阳性结果。
2 结果与分析
2.1试验菌株的生理生化确认
试验菌株在NA上进行分离培养,接种至显色培养基,利用GB 4789系列食品安全国家标准方法对试验菌株进行镜检及相应生理生化鉴定。通过与鉴定表比对,试验菌株均符合相应均属特征,可作为验证试验用菌株。
2.2细菌基因组DNA的提取及纯度检测
在金黄色葡萄球菌基因组DNA提取过程中,单纯酶解或丙酮处理对于DNA的浓度和纯度无显著影响(表2)。当结合钢珠破碎细胞壁步骤后,核酸的得率显著提高,约为单纯丙酮酶解得率的2.5倍。而钢珠破碎步骤与酶解和丙酮处理步骤的先后顺序对核酸得率无显著影响。本试验在细胞破壁释放DNA步骤中,先钢珠机械破壁,再添加丙酮溶脂、蛋白酶K处理的方法具有较高的DNA提取效率,所得DNA浓度大于100 ng/μL,A260/A280值在1.8~2.0之间,DNA纯度高,且经济实惠以及有效防止由于钢珠告诉振动可能造成的有机溶剂泄露,可以满足下一步实时荧光PCR反应的准确性要求。
2.3实时荧光PCR扩增体系的引物特异性验证
针对3种选定菌株,选用单核细胞增生李斯特氏菌、副溶血性弧菌、蜡样芽孢杆菌作为对照菌株,分别用3种引物进行扩增反应,见图1。结果显示,目标菌株均在35个循环内发生显著扩增,而对照菌株均无显著性检测信号,亦没有出现非特异性扩增信号,表明设计的3对引物特异性好,识别度高,无干扰现象。
2.4实时荧光PCR扩增体系的灵敏度分析
以无菌操作将金黄色葡萄球菌、沙门氏菌和志贺氏菌基因组DNA做模板,按10倍递增逐级稀释,自100 ng/μL浓度稀释至10-7ng/μL分别做灵敏度测试。PCR结果如图2所示。3种致病菌基因组DNA浓度从100 ng/μL到10-7ng/μL使用本文所建立的PCR方法均可在40个循环内出现显著扩增。一般认为当Ct值小于35时可判断PCR结果为阳性。当细菌DNA模板浓度稀释至10-6ng/μL时,金黄色葡萄球菌的检测仍可为阳性;当细菌DNA模板浓度稀释至10-5ng/μL,沙门氏菌和志贺氏菌的检测仍然为阳性。
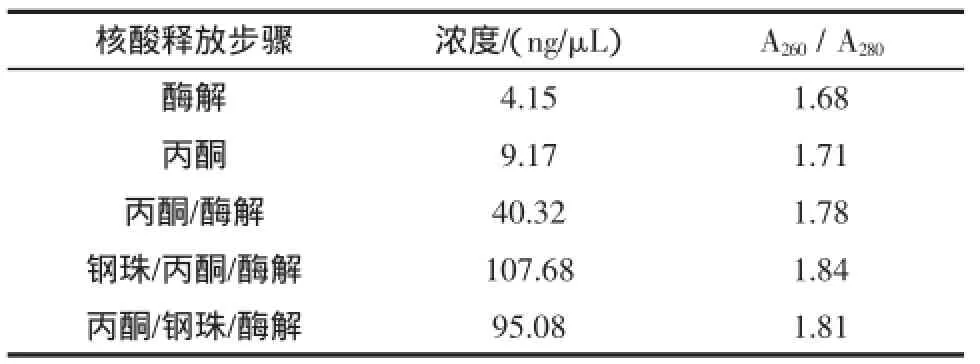
表2 不同核酸释放步骤在金黄色葡萄球菌基因组DNA提取效果比较Table 2 Comparison of different nucleic acid release steps in Staphylococcus aureus genomic DNA extraction effect

图1实时荧光PCR特异性检测结果图Fig.1 Real-time fluorescence quantitative specificity curve of 3 pathogens
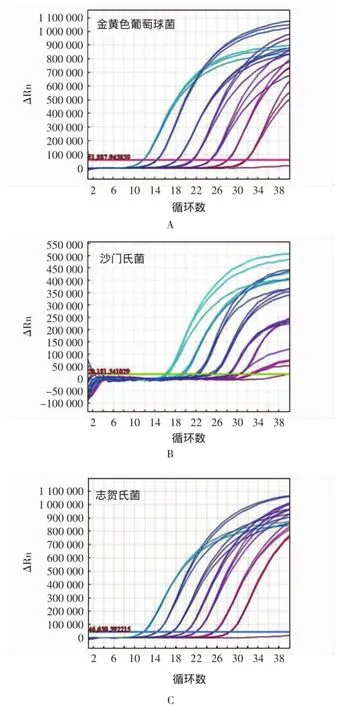
图23种细菌的实时荧光定量PCR灵敏度扩增曲线(常态型)Fig.2 Real-time fluorescence quantitative amplification detection limit curve of 3 pathogens(Normal view)
2.5标准曲线的建立以及线性检测范围
以10倍梯度稀释细菌DNA模板进行实时荧光PCR定量检测。试验得出的常态型扩增曲线(图2)显示:总体上所有曲线的拐点清楚,指数增长期明显,基线平稳无上扬现象,低浓度样本扩增曲线指数明显,一方面说明灵敏度高,另一方面不易出现假阳性、假阴性的误判;曲线指数期斜率大,表明扩增效率高,实际灵敏度、引物和探针效果好;扩增曲线的整体平行性好,相邻浓度标准品扩增曲线与曲线之间的间距都十分接近,是扩增效率都搞的反应。且图2中,基线起峰范围适当,各检测结果都在12~35之间,保证了定量的准确性。
以DNA模板浓度对数为横坐标,CT值为纵坐标建立本研究RT-PCR方法的标准曲线(图3)。金黄色葡萄球菌和沙门氏菌的检测线性范围可以达到8个数量级,志贺氏菌的检测线性范围可以达到9个数量级。CT值和起始模板浓度的相关性好,金黄色葡萄球菌和沙门氏菌的标准曲线线性相关性可以达到0.999以上,而志贺氏菌的标准曲线线性略差,也达到0.99以上,3种细菌的标准曲线均接近理想值。
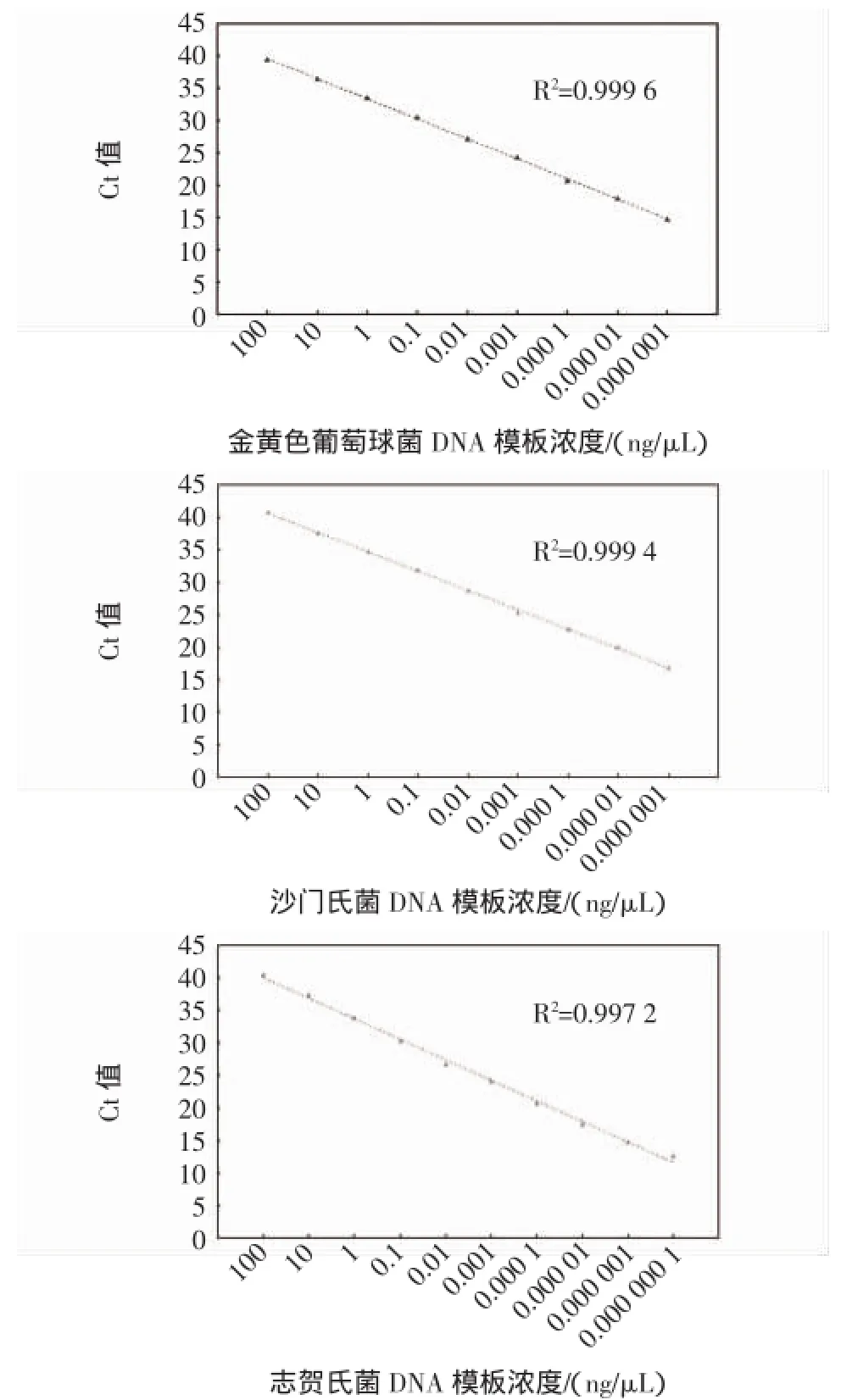
图3 3种细菌的实时荧光定量PCR标准曲线Fig.3 Real-time fluorescence quantitative standard curve of 3 pathogens
3 讨论
高质量的基因组DNA是进行基因检测和研究的前提。近年来随着分子生物学技术在食品检测方面的广泛应用,世界各大实验室都积极致力于更加经济实用效率更高的DNA提取方法。Ramos-Gomez[8]等利用CATB方法提取橄榄油、葵花籽油等多种蔬菜油产品中的DNA,其提取产物纯度和数量都可满足后续q-PCR检测的需要。为检测生猪肉中的沙门氏菌,Lofstrom等研究利用核酸吸附柱提取商品肉中的细菌核酸,并比较实时荧光定量PCR方法与非PCR方法,结果显示实时荧光定量PCR比非PCR方法灵敏度更高特异性更强[9]。Sowmya[10]等利用1%的表面活性剂Triton X-100去除食品样品中的杂质,有效提取牛奶、甘蔗汁和米饭中的金黄色葡萄球菌基因组DNA。但此方法仅适用于选定样品的加标样核酸提取,其他样品推广仍待考究。研究发现,普通细菌基因组DNA提取方法针对肠杆菌科的革兰氏阴性杆菌都有较高的提取效率,但对含芽孢的细菌及金黄色葡球菌、单核细胞增生李斯特氏菌等革兰氏阳性菌的提取效率较低。其主要原因在于革兰氏阳性球菌细胞壁较厚,传统的DNA释放方法热裂解法、酶解法、SDS法、酚/氯仿提取法不能高效的溶解破坏细胞壁,从而导致DNA量少杂质多。为了寻求一种高效的细菌基因组DNA提取方法,提取高质量的细菌基因组DNA,获得更准确的PCR结果,综合各种研究方法的利弊,本研究建立的改良细菌基因组DNA提取方法,在细菌破壁、DNA释放步骤中,通过加入丙酮处理,破坏细胞壁脂质结构,结合钢珠振荡处理机械力与蛋白酶K消化,增强了细胞壁的通透性,促进了DNA的释放。本方法适用于革兰氏阴性细菌及革兰氏阳性细菌基因组DNA的高效提取,较传统核酸提取方法,所提取的基因组DNA浓度、纯度高,可以满足RT-PCR和PCR-RELP对DNA模板高质量的要求。
按照我国食品安全国家标准要求,加工食品中,肉制品、乳制品、饮料等金黄色葡萄球菌、沙门氏菌、志贺氏菌是必检项目,不得检出,上述3种致病菌的快速检测方法开发也成为食品安全检测中的研究热点。本研究选择金黄色葡萄球菌egc、沙门氏菌NA(not available)、志贺氏菌ipaH基因,设计试时荧光PCR方法特异引物和TaqMan探针。经NCBI序列比对,用于实时荧光PCR检测的金黄色葡萄球菌、沙门氏菌、志贺氏菌特异序列均与同属内病原菌有较高的相似性(>93%)。Goto[11]等利用特异性引物采用RT-PCR方法当牛奶样品中金黄色葡萄球菌DNA浓度达到50 ng~50 pg即可准确的检出金黄色葡萄球菌。另一篇报道中Chiang等采用热激蛋白htrA设计新型特异性引物,可以检测到牛奶和肉中最低1 CFU/mL的金黄色葡萄球菌[12]。同样采用实时荧光定量PCR方法,有研究显示可在多种食品中检出多种沙门氏菌,最低检测限可达到0.2 CFU/ mL~2.0 CFU/mL[2]。对于志贺氏菌的检测通常都与金黄色葡萄球菌和沙门氏菌同时进行。有报道显示利用RT-PCR方法,对样品采取先细菌增生再检测的处理,可以检测最低1 CFU/10 g浓度的志贺氏菌,并且这种检测与普通的生化检测结果没有显著性差异[13]。同其他PCR检查方法相比,本试验的灵敏度更低,检测准确性更高。本研究为食品中金黄色葡萄球菌、沙门氏菌、志贺氏菌的快速鉴定探索了有效的检测方法。
4 结论
综上所述,本试验建立的实时荧光PCR检测方法,检测范围宽、灵敏度高,初始细菌DNA模板的浓度可以低至10-5和10-6数量级,是一种稳定性、精确度、特异性好的检测方法。该方法可准确应用于各种材料食品中金黄色葡萄球菌、沙门氏菌和志贺氏菌的检测,为控制食源性致病菌污染提供有效手段。
[1]Yeni F,Acar S,Polat,et al.Rapid and standardized methods for detection of foodborne pathogens and mycotoxins on fresh produce[J]. Food Control,2014,40:359-367
[2] Wallace F M,Andaloro B,Fallon D,et al.Detection of Salmonella species in a variety of foods by the DuPont Bax system real-time PCR assay for Salmonella[J].Jounal of AoacInt,2014,97(8):868-875
[3]Ikeda T,Morimoto Y,Makino S.et al.Surveillance of Staphylococcus aureus in cheese produced in Hokkaido[J].Jounal of Food Prot,2006,69(3):516-519
[4]Lin W S,Cheng C M,Van K T.A quantitative PCR assay for rapid detection of Shigella species in fresh produce[J].Jounal of Food Prot,2010,73(2):221-233
[5]张中湖,高文学,肖杰,等.山东省药品快检、监督抽检发展现状与对策[J].药学研究,2013(4):236-237
[5]熊国华,于莉,杨海龙,等.实时荧光PCR定量检测食品中单增李斯特菌[J].中国食品卫生杂志,2007,19(3):248-251
[6]李静芳,汤水平,张素文,等.实时荧光PCR技术在食品检测中的应用[J].实用预防医学,2008,15(6):1997-1999
[7]李活,曾劲峰,尚桂芳,等.核酸检测中两种核酸提取方法的比较[J].中国自然医学杂志,2008,10(5):388-389
[8]Ramos-Gomez S,Busto M D,Perez-Mateos M,et al.Development of a method to recovery and amplification DNA by real-time PCR from commercial vegetable oils[J].Food Chemistry,2014,158(1):374-383 [9] Lofstrom C,Hansen F,Mansdal S,et al.Detection of Salmonella in meat:comparative and interlaboratory validation of a noncomplex and cost-effective pre-PCR protocol[J].Jounal of AoacInt 2012,95 (1):100-104
[10]Sowmya N,Thakur M S,Manonmani H K.Rapid and simple DNA extraction method for the detection of enterotoxigenic Staphylococcus aureus directly from food samples:comparison of PCR and LAMP methods[J].J ApplMicrobiol,2012,113(1):106-113
[11]Goto M,Takahashi H,Segawa Y,et al.Real-time PCR method for quantification of Staphylococcus aureus in milk[J].J Food Prot,2007,70(1):90-96
[12]Chiang Y C,Fan C M,Liao W W,et al.Real-time PCR detection of Staphylococcus aureus in milk and meat using new primers designed from the heat shock protein gene htrA sequence[J].J Food Prot,2007,70(12):2855-2859
[13]Senachai P,Chomvarin C,Wongboot W,et al.Duplex PCR for detection of Salmonella and Shigellaspp in cockle samples[J].The Southeast Asian journal of tropical medicine and public health,2013,44(5):866-874
Rapid Detection Using Real Time-PCR for Three Foodborne Pathogens
HUO Sheng-nan1,MENG Jing1,YANG Zhen-dong2,ZHENG Shi-chao1,ZHANG Ran1
(1.Shandong Institute for Food and Drug Control,Jinan 250101,Shandong,China;2.The School of Food Science and Technology,Jiangnan University,Wuxi 214122,Jiangsu,China)
The genome DNA of Staphylococcus aureus was extracted by four different method and finally chose a method combined steel ball destruction and acetone,protease K removing impurities to get high purity and output DNA.Then the protein gene(egc)of Staphylococcus aureus,a NA gene of Salmonella,and ipaH gene (iapH)of Shigella were used as the gene targets.And the samples were determined by real-time PCR technique.The results showed that the primers were highly specific.No fluorescence signal was determined in other 3 control pathogens(Listeria monocytogenes,Vibrio parahaemolyticus and Bacillus cereus)but target bacteria. The RT-PCR assay could be specific and rapid,and the detection limits were 10-6,10-6,10-7ng/μL.
foodborne pathogens;DNA extraction;real-time polymerase chain reaction
2016-05-06
霍胜楠(1980—),女(汉),高级工程师,博士研究生,研究方向为食品生物安全风险监测及技术开发。

