高效液相色谱法测定酵母细胞壁中甘露聚糖和β-葡聚糖
徐婷婷,刘 艳,张子健,周雪玲,陈志颖
高效液相色谱法测定酵母细胞壁中甘露聚糖和β-葡聚糖
徐婷婷,刘艳,张子健,周雪玲,陈志颖*
(唐山拓普生物科技有限公司,河北 唐山 063000)
建立了利用高效液相色谱同时检测酵母细胞壁中的甘露聚和β-葡聚糖含量的方法。色谱条件为采用Welch Sugar-Ca(7.8 mm× 300 mm)色谱柱,以纯水为流动相,流速为0.5 mL/min,柱温为80℃,示差折光检测器进行检测。结果表明,甘露聚糖和β-葡聚糖在200~1 000 μg/mL范围内与峰面积呈良好的线性关系,方法的相对标准偏差<1.15%,回收率为98%~100%。该方法简单,准确方便,适用于酵母细胞壁中甘露聚糖和β-葡聚糖含量的检测。
β-葡聚糖;甘露聚糖;高效液相色谱;酵母细胞壁
酵母甘露聚糖(yeast mannan)和β-葡聚糖(β-glucan)是酵母细胞壁的重要组成成分,二者的总量大约占细胞壁总干质量的85%[1],其中甘露聚糖位于细胞壁的外层,约占细胞壁干质量的40%~45%[2],而β-葡聚糖则位于细胞壁的内侧,占细胞壁干质量的26%~30%[3]。
酵母β-葡聚糖是一种以β-1,3-D糖苷键为主链,β-1,6-D糖苷键为侧链的活性多糖[4]。它能够刺激释放白介素以增强机体防御有害物质的能力,提高人体免疫力[5-7]。同时具有抗辐射[8]、抗癌[9]、调节血脂、降低胆固醇[10]和促进伤口愈合[6]等功能。酵母甘露聚糖又称甘露糖蛋白,由两种糖肽键组成,主链为单链,糖苷键以α-1,6形式连接,主链上有丰富的支链[10]。甘露聚糖具有免疫调节[12]、改善肠道健康[13]、选择性吸附病原微生物[14]等功能。
酵母β-葡聚糖和甘露聚糖的检测一般采用不同的方法分开进行检测,酵母β-葡聚糖检测多采用苯酚-硫酸法[14-16]和高效液相色谱法[17-19]进行,甘露聚糖的检测多采用总糖检测方法和紫外分光光度法[20-22]。但此方法灵敏度较低,不能准确的分辨出甘露聚糖和β-葡聚糖以及其他多糖,检测结果存在误差。本研究采用高温水解-高效液相色谱法(high performance liquid chromatography,HPLC)测定酵母细胞壁中β-葡聚糖和甘露聚糖的含量,确定了最佳水解条件,并采用凝胶多糖(curdlan)和甘露聚糖为对照品,对检测结果进行校正,为酵母细胞壁中甘露聚糖和β-葡萄糖的含量测定提供参考。
1 材料与方法
1.1材料与试剂
酵母细胞壁:唐山拓普生物科技有限公司;盐酸(体积分数36%~38%):天津市凯信化学工业有限公司;凝胶多糖(纯度≥99.00%)、甘露聚糖(纯度≥99.00%):美国Sigma公司;D(+)-甘露糖(纯度≥99.99%):德国Dr.Ehrenstorfer公司;氢氧化钠(分析纯):天津市风船化学试剂科技有限公司。
1.2仪器与设备
UltiMate3000高效液相色谱仪:美国戴安公司;BXM-30R立式压力蒸汽灭菌锅:上海博讯实业有限公司;AL204电子天平:梅特勒-托利多仪器(中国)有限公司;微型漩涡混合器:海门市其林贝尔仪器制造有限公司;PHS-3C酸度计:上海康仪仪器有限公司;JHH-2数显恒温水浴锅:北京中兴伟业仪器制造有限公司;KQ-250E型超声波清洗器:昆山市超声仪器有限公司。
1.3方法
1.3.1样品处理方法
精密称取0.400 0 g酵母细胞壁样品置于50 mL具塞试管中,准确加入一定量的盐酸,将试管置于漩涡混合器上混合均匀。置于35℃恒温水浴锅中水浴30 min,每隔10 min取出于混合器中混合20 s。然后将混合均匀的样品转移到250 mL Schott-瓶中,用纯水定容至150 mL,振荡混匀后置于121℃高压灭菌锅中水解60 min。
将水解后的样品取出,冷却至室温,用50%的氢氧化钠溶液调节pH至6~7。将调好pH值的溶液转移至200 mL的容量瓶中并定容,用0.45 μm滤膜过滤,高效液相色谱法测定葡聚糖和甘露聚糖含量。
1.3.2标准曲线的绘制
准确称取0.200 0 g经98~100℃干燥2 h的葡萄糖和甘露糖,用纯水溶解并定容至100 mL,摇匀得到质量浓度为2 g/L的葡萄糖和甘露糖标准储备液,分别吸取1.0 mL、2.0mL、3.0mL、4.0mL、5.0mL上述溶液于10mL容量瓶中,用纯水定容,摇匀得到质量浓度分别为200μg/mL、400μg/mL、600 μg/mL、800 μg/mL、1 000 μg/mL的葡萄糖和甘露糖混合标准溶液,用0.45 μm滤膜过滤,高效液相色谱法测定标准物质质量浓度与色谱峰面积之间的回归方程,绘制标准曲线。
1.3.3色谱条件
Sugar-Ca色谱柱:(7.8 mm×300 mm);流动相:纯水(一级水);流速:0.5 mL/min;柱温:80℃;进样量:50 μL。
1.3.4计算公式
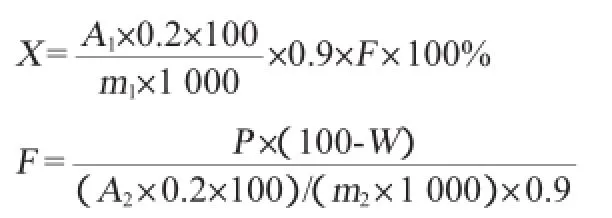
式中:X为样品中葡聚糖或甘露聚糖含量,%;A1为根据样品溶液的峰面积,在标准曲线上查得的样品溶液的葡聚糖、甘露聚糖的含量,mg/L;A2为根据甘露聚糖或凝胶多糖的峰面积,在标准曲线上查得的样品溶液葡聚糖或甘露聚糖含量,mg/L;m1为称取样品的质量,g;m2为称取甘露聚糖对照品或葡聚糖对照品的质量,g;0.2为样品/甘露聚糖对照品定容后的体积,mL;0.9为将甘露糖换算成甘露聚糖(葡萄糖换算成葡聚糖)的系数;F为样品酸水解中甘露聚糖或葡聚糖被破坏造成结果偏低的经验补偿系数;P为甘露聚糖或凝胶多糖对照品的纯度(依据试剂厂家提供的检测报告);W为甘露聚糖或凝胶多糖对照品的水分(依据试剂厂家提供的检测报告)。
2 结果与分析
2.1标准曲线的建立
使用1.3.2配制的葡萄糖和甘露糖混合标准溶液并采用1.1.3的色谱分析条件进行检测,各质量浓度的葡萄糖、甘露糖标准溶液对应的色谱峰面积见表1;以标准溶液的质量浓度(x)为横坐标,峰面积(y)为纵坐标,绘制葡萄糖、甘露糖标准曲线,结果见图1。
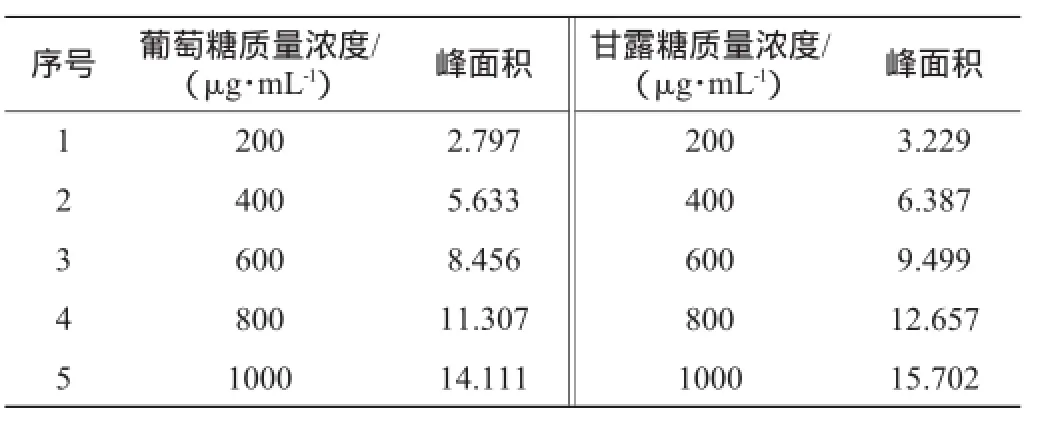
表1 葡萄糖和甘露糖标准溶液HPLC色谱峰面积Table1 HPLC chromatographic peak area of glucose and mannose standard solution
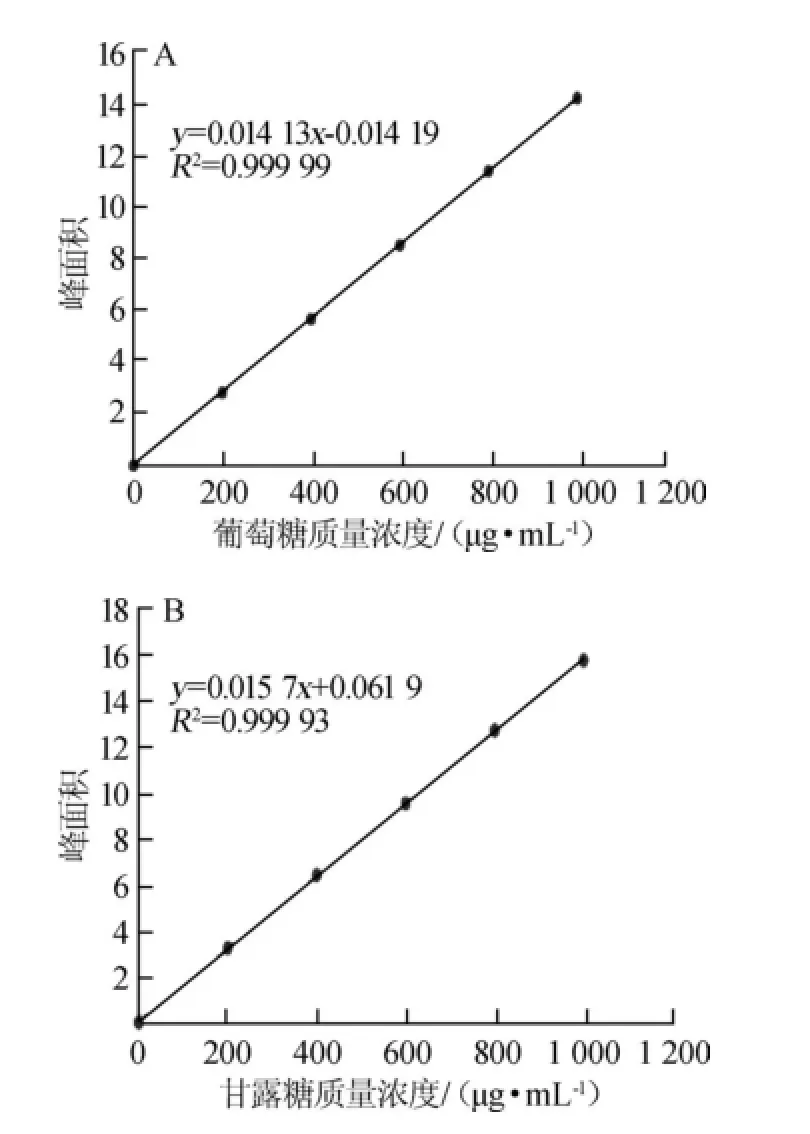
图1 葡萄糖(A)和甘露糖(B)标准曲线Fig.1 Standard curve of glucose(A)and mannose(B)
结果表明,在200~1 000 μg/mL范围内,葡萄糖标准曲线线性回归方程为:y=0.014 13x-0.014 19,相关系数R2= 0.999 9,甘露糖标准曲线线性回归方程为:y=0.015 7x+ 0.061 9,相关系数R2=0.999 3。并且在方法设定的色谱条件下,能够完全将葡萄糖和甘露糖分开,采用同一检测条件可同时检测β-葡聚糖和甘露聚糖,排除了甘露聚糖对β-葡聚糖的干扰,检测色谱图见图2、图3。
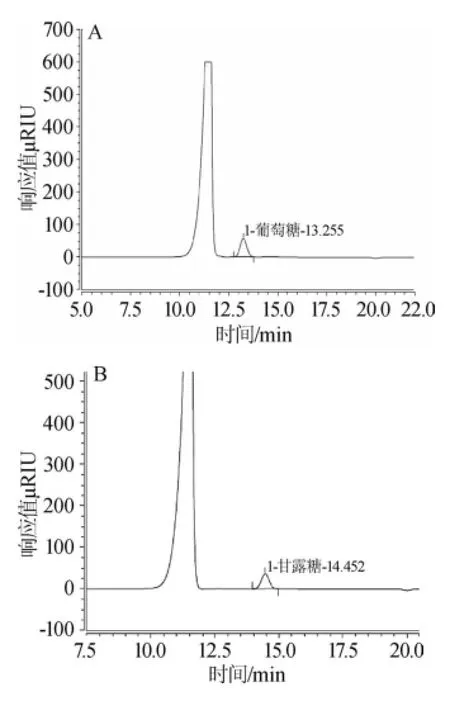
图2 葡萄糖(A)和甘露糖(B)标准品HPLC色谱图Fig.2 HPLC chromatogram of glucose(A)and mannose(B)
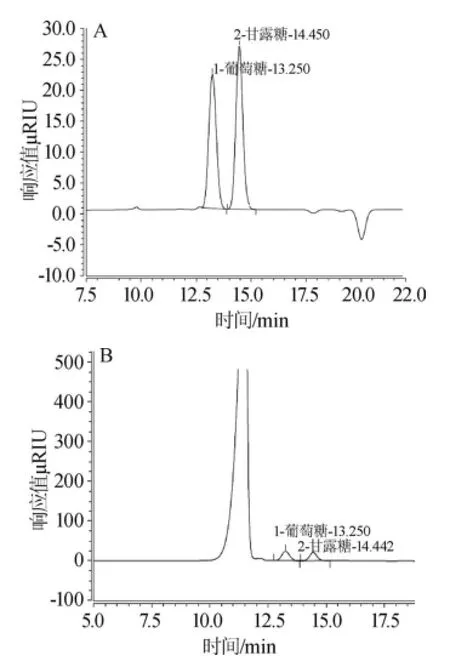
图3 葡萄糖、甘露糖标准混合溶液(A)及酵母细胞壁水解液(B)HPLC色谱图Fig.3 HPLC chromatogram of glucose and mannose standard mixed solution(A)and the hydrolysate(B)of yeast cell wall
2.2标准品校准
在确定酸用量、前期处理时间、温度及水解时间等条件下,酵母细胞壁能够完全水解为葡萄糖和甘露糖。但在此条件下,强酸可能会对β-葡聚糖和甘露聚糖产生一定的破坏,使其降解为了其他的物质,从而导致检测结果的偏差[13]。因此,需要采用凝胶多糖和甘露聚糖作为标准品来对水解条件进行校正。
在已确定的水解条件下水解凝胶多糖和甘露聚糖,检测后计算其含量,通过与理论值进行比较得出一个校正因子F(使用1.3.4中的公式)。在采用本方法水解的条件下,检测凝胶多糖和甘露聚糖的含量,检测结果见表2、表3。
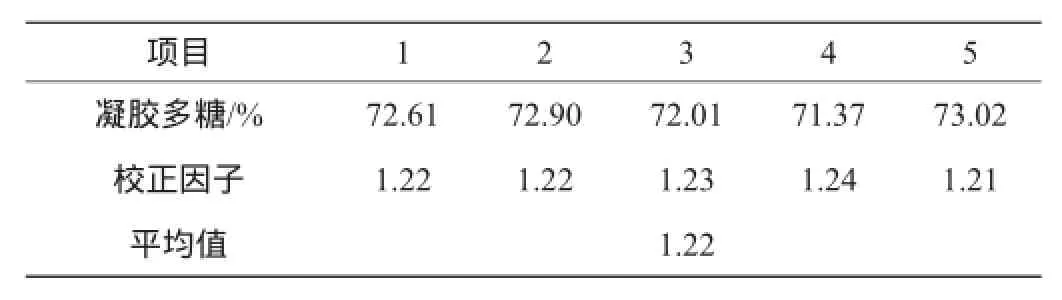
表2 凝胶多糖检测结果Table 2 Detection results of curdlan
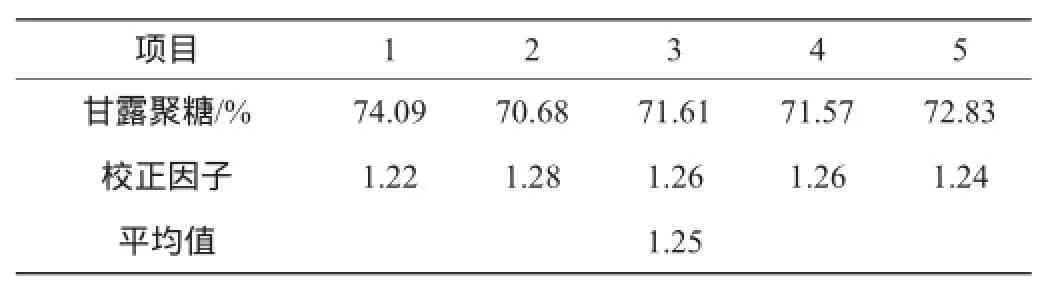
表3 甘露聚糖检测结果Table 3 Detection results of mannan
由表2、表3可知,采用凝胶多糖和甘露聚糖作为标准品测定的校正因子F分别为1.22、1.25。
2.3方法稳定性及回收率
2.3.1稳定性实验
利用1.3.1中所描述的实验方法对样品进行处理及检测,重复检测5次,检测酵母细胞壁中的β-葡聚糖和甘露聚糖含量,结果见表4。
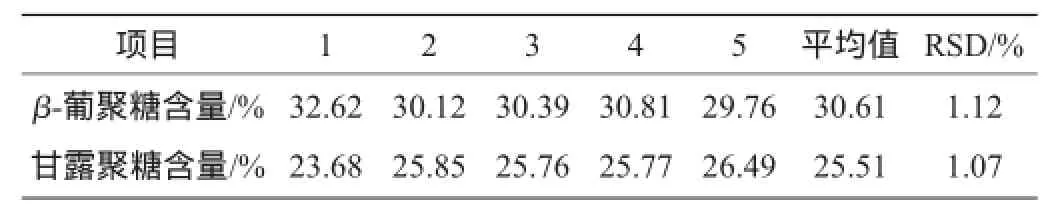
表4 方法稳定性检测结果Table 4 Detection results of stability of the method
由表4可知,在相同的处理条件下,进行稳定性试验测试,检测到的β-葡聚糖和甘露聚糖相对标准偏差(relative standard deviation,RSD)分别为1.12%和1.07%,具有良好的稳定性。
2.3.2回收率实验
准确称取样品,加入葡萄糖和甘露糖标准品,按照1.3.1中的处理方法进行样品处理。将处理好的样品与标品混合物利用HPLC进行测定,进样量为50 μL按峰面积计算出平均回收率及相对标准偏差(relative standard deviation,RSD),测定结果见表5。
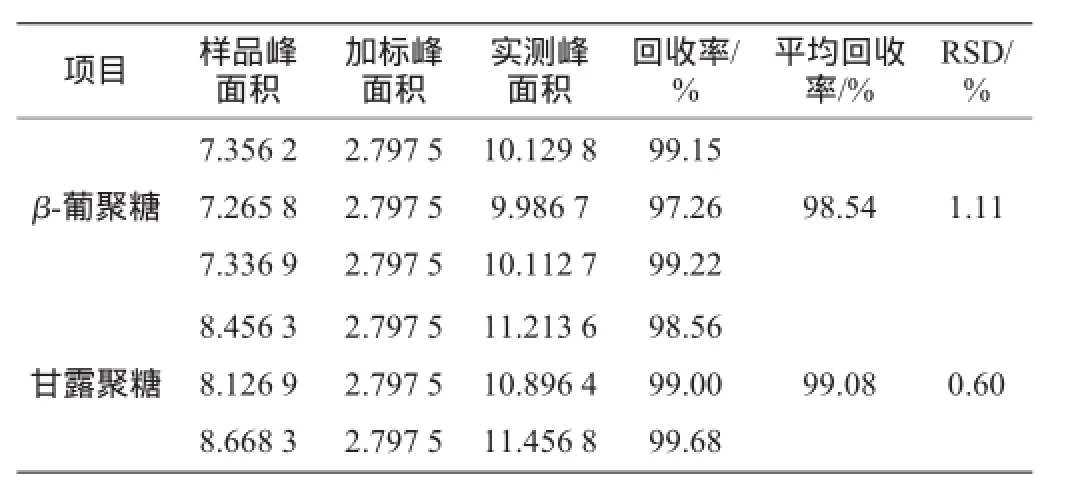
表5 回收率试验结果Table 5 Results of recovery rate experiments
由表5可知,此检测方法中葡聚糖和甘露聚糖的平均回收率分别为98.54%和99.08%,回收率在90%~110%,测定过程中样品损失程度较低,表示检测方法准确度高。
3 结论
采用高温处理-HPLC法同时测定酵母细胞壁中β-葡聚糖和甘露聚糖含量,最佳水解条件为:采用0.55 mol/L的盐酸水解处理30 min,再121℃高温高压处理1 h,调节pH至中性。采用HPLC进行检测,确定最佳的色谱条件,凝胶多糖和甘露聚糖作为校准品,校正酸水解对β-葡聚糖和甘露聚糖降解的影响,形成最优酵母细胞壁中β-葡聚糖和甘露聚糖含量同时检测的方法,重复性好、准确性高、简单易行。
[1]DUFFUS J H,LEVI C,MANNERS D J.Yeast cell wall glucans[J].Adv Microb Physiol,1982(23):151-181.
[2]杨晓光,王元秀,郑明洋,等.酵母甘露聚糖降脂作用研究[J].食品与药品,2013,15(2):92-93.
[3]NGUYEN T H,FLEET G H,ROGERS P L.Composition of the cell walls of several yeast specise[J].Appl Microbiol Biotechnol,1998,50(2):206-212.
[4]杨天娇,孙英峰,王英珍,等.啤酒酵母葡聚糖免疫调节作用及应用研究进展[J].动物医学进展,2008,29(11):92-95.
[5]陈军,何洁,苏建.高效液相色谱法测定酵母葡聚糖的前处理条件的研究及优化[J].轻工科技,2012(6):5-6.
[6]孙培龙,胡君荣,杨开,等.药用,食用菌β-葡聚糖的研究进展[J].中国食用菌,2008,27(1):9-13.
[7]张彦,夏长虹,朱亚敏,等.啤酒酵母多糖抗辐射作用的研究[J].中国公共卫生,2004,20(12):8-9.
[8]BOHN J A,BEMILLER J N.(1,3)-β-D-glucans as biological response modifiers:a review of structure-functional activity relationships[J]. Carbohyd Polym,1995,28(1):3-14.
[9]WOOD P J.Cereal β-glucan in diet and health[J].J Cereal Sci,2007,46(3):230-238.
[10]刘红芝.酿酒酵母甘露聚糖的制备、结构鉴定及免疫活性的研究[D].北京:中国农业科学院,2009.
[11]BALLON L,COHEN R E,BALLOU C E.Saccharomyces cerevisiae mutants that make mannoproteins with a truncated carbohydrate outer chain[J].J Biol Chem,1980,255:5986-5991.
[12]NATHAN S,HALINA L.Carbohydrates in cell recognition[J].Sci Am,1993(1):74-81.
[13]CASTRO D P,MORAES C S,GARCIA E S,et al.Azambuja inhibitory effects of D-mannose on trypanosomatidlysis induced bySerratia marcescens[J].Exp Parasitol,2007,115:200-204.
[14]杨勇杰,姜瑞芝,陈英红,等.苯酚-硫酸法测定杂多糖含量的研究[J].中成药,2005,27(6):706-708.
[15]连喜军,鲁晓翔,林旭辉.苯酚-硫酸法测定β-葡聚糖含量研究[J].粮食与油脂,2005(10):39-43.
[16]徐希柱,辛培超.不溶性酵母多糖分析方法的研究[J].中国酿造,2008,27(13):80-83.
[17]陈少峰,望忠福.高效液相色谱法测定酵母葡聚糖[J].食品科技,2009,34(7):278-280.
[18]韩振泰,赵玉娟,刘惠文,等.高效液相色谱法测定灵芝多糖含量[J].中国科技农业导报,2009,11(S1):68-67.
[19]康祺,朱若华.高效液相色谱法测定葡聚糖含量的研究[J].食品科学,2007,28(2):422-425.
[20]袁志梅,吴道澄,赵薇,等.高效液相色谱法测定魔芋精粉中葡甘露聚糖的含量及其单糖组成[J].中国中药杂志,2003,28(7):621-624.
[21]张运涛,谷文英.紫外分光光度法测定啤酒酵母中甘露糖[J].食品与发酵工业,1999,25(5):32-34.
[22]王照利,吴万兴,李科友.魔芋精粉中甘露聚糖含量测定研究[J].食品科技,1998,13(3):56-58.
Determination of mannan and β-glucan in yeast cell wall by HPLC
XU Tingting,LIU Yan,ZHANG Zijian,ZHOU Xueling,CHEN Zhiying*
(Tangshan TOP Bio-Technology Co.,Ltd.,Tangshan 063000,China)
The determination method of mannan and β-glucan content in the yeast cell wall was established by HPLC.The chromatographic conditions were as follows:the chromatographic column Welch Sugar-Ca(7.8 mm×300 mm),mobile phase was pure water,flow rate was 0.5 ml/min,column temperature was 80℃,and the signal was detected by refractive index detector.The results showed that at the range of 20-1 000 μg/ml,the content of mannan and β-glucan had a good linear relationship with the peak area.The relative standard deviation of the method was less than 1.15%. The recovery rate was 98%-100%.The method was simple,accurate and convenient,which was suitable for the determination of mannan and β-glucan contents in yeast cell wall.
β-glucan;mannan;HPLC;yeast cell wall
TS261.1
0254-5071(2016)07-0180-04
10.11882/j.issn.0254-5071.2016.07.039
2016-03-21
徐婷婷(1987-),女,本科,研究方向为生物技术。
陈志颖(1972-),女,高级工程师,博士,研究方向为酵母及酵母衍生物。

