冶炼烟气干法脱硫过程中CaS与SO2反应的实验及机理研究
昌 晶, 张 聪, 田红景,, 郭庆杰, 吴卫泽
冶炼烟气干法脱硫过程中CaS与SO2反应的实验及机理研究
昌 晶1, 张 聪2, 田红景2,3, 郭庆杰2, 吴卫泽3
(1. 青岛农业大学 资源与环境学院, 山东 青岛 266109; 2. 青岛科技大学 化工学院, 山东 青岛 266042; 3. 北京化工大学 化工资源有效利用国家重点实验室, 北京 100029)
将硫化钙和石英砂机械混合作为脱硫剂,在石英固定床反应器中考查了反应温度、空速、脱硫剂颗粒粒径、有无氧气存在和循环次数对脱硫剂脱除冶炼烟气中SO2气体性能的影响。较高反应温度、较低烟气空速和较小颗粒粒径均可提高脱硫剂的脱硫率。温度500℃、空速250 h-1条件下,脱硫率在100 min内均保持在96.4% 以上。脱硫剂在无氧和有氧条件下循环实验中表现出的脱硫活性均较为稳定。随循环次数的增加,脱硫剂颗粒的比表面积和吸附量缓慢减小,分别从反应前的32.2 m2×g-1和21.6 cm3×g-1降至10次循环后的26.5 m2×g-1和16.2 m3×g-1,而颗粒平均粒径逐渐增加。基于Gaussian 09程序,采用密度泛函理论(DFT)对CaS与SO2反应脱硫的微观机理进行了研究,在B3LYP/6-311G+(d,p)水平上优化得到反应物、中间体、过渡态和产物的几何构型,对各驻点进行了单点能计算。中间体IM4到产物P(CaSO4+S2)的过程被推测为反应的速率控制步骤。
硫化钙(CaS);冶炼烟气;脱硫;反应机理
1 引 言
有色金属元素多与硫伴生成为硫化矿、山锌矿、方铅矿等,是冶金工业的重要原料。在火法冶金工艺中,硫化矿高温焙烧后硫元素生成SO2气体随焙烧烟气排出,既浪费了大量硫资源,也严重污染环境[1,2]。我国有色冶炼烟气含硫浓度大,锌精矿采用沸腾炉氧化焙烧产生的烟气中SO2浓度可达10%~13%,铜精矿闪速熔炼烟气中SO2浓度8%~9%[3]。另外,冶炼烟气温度较电站烟气温度高,闪速炉出口烟气温度高于1000℃,经余热回收后温度仍在350~550℃ 范围内[4]。冶炼烟气中SO2浓度不同,为了回收再利用SO2气体,SO2浓度大于8% 时采用接触法生产硫酸,SO2浓度较低时采用有机胺吸收法[5]和催化还原制硫磺法。我国硫酸产能明显过剩,但硫磺进口量逐年增加[6]。合理回收利用冶炼烟气中的硫资源,有利于解决我国硫酸市场的倒挂现象。
催化还原法利用焦炭、CO、H2和CH4等还原剂将SO2气体转化为硫磺。目前,大部分催化还原方法是在无氧条件下进行研究[7~12],氧气的存在既降低催化剂活性,又易与还原剂剧烈反应造成安全隐患。[7]研究了无氧条件下Sn-Zr复合催化剂催化CO还原SO2的活性,结果表明,催化剂在350℃条件下具有较高的活性和选择性,脱硫率和硫单质产率分别可达90% 和63%,但有少量副产物COS产生。Han等[8]对Ce1-xZrO2催化剂在CO、H2还原SO2过程中的催化行为进行研究,结果表明CO的还原效果优于H。在400~550℃范围内,以CO为还原剂时,脱硫率和硫单质产率分别为94.4%和91.3%。赵毅等[9]研究了微波辐照下基于活性炭载体的几种催化剂催化烟气同时脱硫脱硝的性能。结果表明,微波和催化剂的加入均提高了脱硫脱硝的效率,Mn(NO)3的催化活性最佳,可将同时脱硫脱硝的效率提高至95%。
美国Utah大学的Sohn教授曾提出一种基于化学链的冶炼烟气脱硫技术,证明了CaS可作为烟气脱硫剂多次循环使用的可行性[13~16]。本文将CaS与石英砂机械混合作为脱硫剂脱除模拟冶炼烟气中的SO2,然后将脱硫剂置于还原性气氛下再生,实现脱硫剂的循环使用。与催化还原方法相比,该方法避免了高温下气体还原剂与氧气剧烈反应生成的火焰,安全性好,也可达到较高的脱硫效率。与催化剂不同,CaS脱硫剂可由硫酸钙置于还原性气氛下生成,成本很低。脱硫过程中,冶炼烟气中的O2与部分CaS发生强放热反应[17],标准摩尔反应焓DH298.15可达-963.08 kJ×mol-1,为反应器中同时进行的CaS与SO2间的脱硫反应提供热量,有利于反应器自热运行。本文以模拟冶炼烟气为研究对象,在400~550℃围考查CaS的脱硫活性,并在有氧条件下通过多次脱硫/再生循环实验研究了CaS的稳定性。由于本实验还原过程温度较低,在600℃ 的还原过程中并未检测到SO2气体的产生。
2 实验方法
实验组总清扫淋巴数量较对照组多,两组对比差异有统计学意义(P<0.05);实验组Ⅰ~Ⅱ期清扫淋巴结数与对照组相比,差异无统计学意义(P>0.05);实验组Ⅲ期清扫淋巴结数、淋巴结阳性数量较对照组多,差异有统计学意义(P<0.05),见表3。
2.1 实验流程和检测方法
脱硫剂脱硫活性的评价是在内径18 mm的固定床反应器中进行的,实验装置流程图如图1所示。脱硫剂为97%(wt)纯度的CaS(衡阳市化工原料公司,杂质为CaSO4),粒度为200目,石英砂为分析纯(国药集团化学试剂有限公司购买),25~50目。将CaS和石英砂置于研钵内充分研磨混合,将混合物在N2氛围下于500℃ 焙烧5 h装袋备用。实验前将脱硫剂和石英砂的混合物装填入石英玻璃材质的固定床反应器,CaS和石英砂脱硫剂的装填量为3 g和5 g,床层高径比为2.56。通入N2将整个装置内的空气置换,然后升温至指定温度,高纯N2和高纯SO2气体(青岛爱若气体化工有限公司)配制为SO2含量3.45%的模拟烟气,通入反应器开始脱硫反应。在考虑有氧条件下脱硫剂的循环性能时,模拟烟气按照90.55% 的N2、3.45% 的SO2气体和6.00% 的高纯O2配制,还原性气体按照85% 的N2和15% 的H2配制(O2和H2均为青岛爱若气体化工有限公司生产)。出口含硫气体的浓度由气相色谱仪(BEIFEN 3420A,北京北分瑞利分析仪器有限责任公司制造)检测,尾气由NaOH溶液吸收处理。
脱硫过程结束后,通入N2吹扫30min,升高温度至600℃,然后打开H2气路,通入还原性气体,保持足够的反应时间使脱硫产物中的CaSO4还原为CaS。还原过程后再次切换为模拟烟气,进行脱硫剂的循环脱硫。
2.2 脱硫剂表征
脱硫剂的比表面积、微介孔孔体积和孔面积等参数通过全自动比表面和孔径分布分析仪(Autos- orb-1C型,美国Quantachrome公司)测定。首先将待测样品在180℃真空脱气6 h,然后于-196℃ 吸附液氮至饱和,N2为吸附介质。采用BET方程计算被测样品的比表面积,DA方程表征微孔比表面积和微孔体积,HK方程表征微孔分布,由BJH法计算被测样品的孔径分布。脱硫剂颗粒的粒径由激光粒度分析仪(RISE2002型,济南润之科技有限公司)测定。测量范围0.1~600 μm,准确性误差 ±1%,重复性偏差 ±1%,电压220±10 V,频率50 Hz,功率 200 W。
2.3 评价方法
用SO2脱除率作为脱硫剂脱硫性能的评价指标。脱硫率通过式(1)计算可得:
3 实验结果及讨论
3.1 温度对脱硫率的影响
控制模拟冶炼烟气空速为250 h-1,图2为不同温度下100 min内脱硫剂脱硫率随时间的变化曲线,考察了温度对脱硫剂脱硫性能的影响。图中各脱硫率均为脱硫剂在各5 min时间段内脱硫率的平均值。由图2可知,400~500℃ 范围内脱硫剂在前30 min脱硫率变化不大,脱硫率均达到99% 以上,反应如方程式(2)进行。温度对脱硫剂脱硫性能影响显著,脱硫率随温度升高明显增大。反应温度为500℃ 时,整个100 min脱硫过程的脱硫率均高于96.4 %,尤其是前40 min脱硫率高于99.6%。
3.2 空速对脱硫剂脱硫率的影响
当反应温度为500℃ 时,空速对脱硫剂脱硫活性的影响如图3所示。图3为不同空速下前100 min脱硫过程内脱硫率随时间的变化曲线。如图所示,对于图中所示的4个空速,前30 min脱硫率差别较小,均高于99.75%。在40~100 min脱硫阶段内,脱硫率随烟气空速增加而明显降低。这是因为,较低的烟气空速条件下,烟气在反应器床层内的停留时间较大,SO2气体与脱硫剂颗粒的接触时间也较长,脱硫过程更为充分,脱硫剂脱硫率随之增大。
3.3 脱硫剂颗粒粒径对脱硫率的影响
图4为当反应温度为500℃ 和反应器空速250 h-1时,不同粒径脱硫剂颗粒的脱硫活性之间的对比变化。不同粒径的脱硫剂颗粒可由标准筛多次筛分而得,脱硫剂的平均粒径经激光粒度分析仪测得。由图可得,三个平均粒径的脱硫剂脱硫活性差别不大,脱硫活性随脱硫剂颗粒粒径减小而略有增强。这是因为小粒径的脱硫剂颗粒具有较大的比表面积,与SO2气体的接触更加充分,促进脱硫反应的进行。
3.4 氧气浓度和石英砂对脱硫率的影响
保持反应温度为500℃,图5对比了脱硫剂在无氧和有氧条件下对模拟冶炼烟气中SO2气体的脱除率。有氧条件下模拟冶炼烟气的组成为90.55% 的N2、3.45% 的SO2气体和6.00% 的O2。由图5可知,在脱硫过程的前40 min时间段内,脱硫剂在无氧和有氧条件下达到的脱硫率差别很小,均高于99.3%。但在40 min之后,无氧条件下的脱硫率明显高于有氧条件,且随反应进行差距越来越大。这可能是因为CaS颗粒在反应初期的比表面积较大,为它与O2、SO2气体间的反应提供了充足的反应面积,表现出较强的反应活性,容易与全部O2、SO2气体反应。此时O2和SO2竞争同CaS反应的现象对脱硫反应影响较小。
随着反应进行,越来越多的CaSO4产物覆盖于CaS颗粒表面,减少了CaS与O2、SO2气体间的接触面积,CaS颗粒的反应活性有所减弱。此时,活性更强的O2优先于SO2同CaS反应,O2与SO2间的竞争作用造成脱硫剂的脱硫过程越来越困难,脱硫率也随之降低。因此,CaS脱硫剂在有氧条件下的脱硫时间不宜过长,应保证在脱硫剂的高效区范围内进行。
图5也分别对比了有氧、无氧条件下床层内有无石英砂颗粒时脱硫剂的脱硫效果和单一石英砂颗粒的脱硫效果。从图中可知,在有氧、无氧两种条件下石英砂在床层内的掺入均改善了CaS脱硫剂与SO2的反应性能,有石英砂颗粒掺入时的脱硫效率明显高于无石英砂颗粒掺入时。另外,也可从图中可知,单一的石英砂组分对SO2气体并无任何吸附效果。但是,石英砂的掺入增大了脱硫剂床层高度,延长了SO2在其中的停留时间;同时,脱硫剂床层内石英砂对CaS的“稀释”作用使得床层内温度分布更为均匀[18],减小了反应过程中CaS颗粒相互团聚的概率,提高了脱硫剂的脱硫性能。
3.5 循环次数对脱硫率的影响
为了考查CaS脱硫剂的脱硫稳定性,对其进行了脱硫/再生循环实验。实验中脱硫反应条件控制为500℃ 反应温度,CaS脱硫剂装填量3 g,反应器空速250 h-1,还原再生反应温度控制为600℃。
图6是在无氧条件下,10次循环实验中脱硫剂脱硫率随脱硫时间的变化曲线。可以看到,脱硫剂在10次循环实验中脱硫活性较为稳定,在全部循环的前30 min脱硫过程中脱硫率均高于99.5%,在前100 min脱硫过程中脱硫率均高于93.5%。但随循环次数增多,脱硫活性略有下降。脱硫过程进行到第100 min时的脱硫率由第一次的96.7%降至第十次的93.8%。脱硫剂脱硫活性下降的主要原因是随循环次数的增多,脱硫剂中生成的CaSO4产物越来越多,它与CaS组分共存时在较低温度下形成液态共熔体[19],造成脱硫剂颗粒中的孔隙缩小,脱硫剂颗粒粒径变大,脱硫剂的活性也随之降低。以下对脱硫剂的比表面积测试和颗粒粒径测试结果也验证了该点。
图7反映了有氧条件下,脱硫剂在5次循环实验中脱硫率随脱硫时间的变化。从图中可知,在脱硫过程的前40 min,5次循环实验中的脱硫率相差较小,均大于98.2%。40 min之后,脱硫剂的脱硫率随循环次数增加而缓慢下降。需要指出的是,不管是无氧条件还是有氧条件,经气相色谱对脱硫剂在还原性气氛下被H2还原再生过程中排出的尾气进行检测,均未发现有SO2和H2S气体。这说明在600℃的低温下,CaSO4同H2等还原性气体的反应中并未有含硫气体的产生[20]。
由于实验操作条件有限,论文采用的模拟烟气并非真实的冶炼烟气,真实烟气中的SO2浓度随冶炼工艺不同也有较大差异,提升CaS脱硫剂循环过程中的稳定性将是下一步工作的重点。
3.6 脱硫剂表征与分析
3.6.1 比表面积与孔径分布表征
采用氮气吸-脱附方法测定了无氧条件下,反应温度500℃ 时,CaS脱硫剂在脱硫反应前、2次循环后、6次循环后和10次循环后的比表面积和孔径分布。 图8即为4种条件下脱硫剂颗粒的吸-脱附等温线。
由图8可知,新鲜脱硫剂的吸附量达到21.6 cm3×g-1。随着循环次数的增加最大氮气吸附量逐渐减小,第10次循环后,脱硫剂的吸附量降至16.2 cm3×g-1。根据国际纯粹与应用化学联合会(IUPAC)对吸附等温线的分类可知,4种情况下的吸附、脱附线均构成了H3型滞后环[21]。从图中可以看到,脱硫剂的吸附量在低压段和中压段很低且变化较小,但在/0= 0.8~1.0高压段有明显的上升。图9为脱硫剂颗粒在4种情况下的BJH粒径分布图,从图中也显示出脱硫剂颗粒的微孔和介孔数目很少。这说明脱硫剂颗粒自身表面基本无孔,脱硫剂的特征孔应为颗粒间形成的堆积孔,吸附仅发生在堆积孔的狭长孔隙中。随着循环次数的增加,脱硫剂颗粒团聚现象加重,且CaS、CaSO4两种组分在形成共熔体时也加剧了颗粒间的团聚,导致堆积孔隙塌陷,降低脱硫剂的孔容。因此,随脱硫剂循环次数增多,其吸附能力逐渐减弱。
表1所示为不同循环次数下脱硫剂孔容及平均孔径的变化。可知随着循环次数的增加,脱硫剂的比表面积和中孔孔容均逐渐减小,平均孔径反而缓慢增加。这说明循环过程中孔道的数量有了大幅减少。考虑到中孔主要提供气体扩散通道和脱硫反应场所,脱硫剂中孔孔容在循环过程中的减少,不利于SO2气体的扩散,减缓了脱硫反应的进行,导致脱硫率下降。
表1 不同循环次数下脱硫剂的孔结构参数
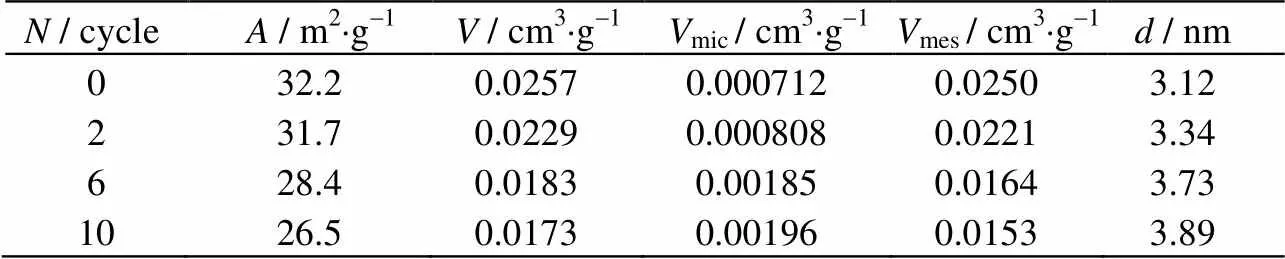
Table 1 Pore structure parameters of the desulfurizer at different cycles
3.6.2 脱硫剂粒度分析
为了探究脱硫剂循环过程中粒径分布的变化,使用激光粒度分析仪进行颗粒粒径的测试。实验中分别对新鲜未反应的脱硫剂,第2次循环后、第6次循环后和第10次脱硫后的脱硫剂进行了粒度分析,粒度微分分布图和累积分布图分别如图10和图11所示。
由图10和图11可得,反应前脱硫剂平均粒径约为34.55 µm,经10次循环后平均粒径达43.38 µm。随循环次数的增加,颗粒平均粒径缓慢递增,粒径微分分布曲线和累积分布曲线均向粒径增大的方向有轻微偏移。这也是由于高温下脱硫剂颗粒在循环过程中发生烧结和团聚所致。
3.6.3 脱硫剂物相分析
图12为脱硫剂反应前、5次脱硫实验后和5次再生实验后的XRD谱图。从图中可知,新鲜的脱硫剂主要由石英砂和CaS组成,杂质很少,5次脱硫实验后可从图中看到明显的CaSO4物相的出现,CaS物相的衍射峰强度相应减弱,SiO2衍射峰强度的增强可能是因为床料中石英砂分布不均匀所致。5次再生实验后CaSO4物相的衍射峰又显著降低,CaS随之增强,说明脱硫剂重新再生为CaS物相。脱硫和再生过程均未出现CaS/CaSO4与SiO2烧结产生的Ca2SiO4等杂质成分,这是因为脱硫、再生温度尚未达到烧结反应发生的温度,和已有文献的结论[22]是一致的。
4 机理计算
4.1 计算方法
计算工作由Gaussian 09量子化学程序完成。在B3LYP/6-311G+(d,p)水平上[23],对反应通道上所有驻点,包括反应物、过渡态、中间体和产物的几何构型进行了构型优化和频率计算。同时采用内禀反应坐标(IRC)计算法确认了过渡态与中间体之间的关系。
4.2 CaS和SO2的反应路径
图13为优化后得到的反应物、中间体、过渡态及产物的几何构型,经在B3LYP/ 6-311G+(d,p)水平上计算得到各个稳定驻点的振动频率均为正值,说明在反应过程中这些驻点稳定存在。由图13可知,CaS和SO2反应的路径为R→IM1→TS→IM2→ IM3→IM4→P。首先,CaS和SO2经过络合生成中间体IM1,然后经分子内重排生成过渡态TS。过渡态TS经分子内单个原子的折叠,生成含四元环的中间产物IM2。中间体IM2属于一种不稳定络合物,进而转化为稳定络合物IM3。随后,中间体IM3经过化学键的折叠,络合物分子间的重排转化为中间体IM4。中间体IM4经过分子内重排,最终生成产物CaSO4和硫单质。
4.3 从各驻点的能量分析反应机理
图14为CaS与SO2反应在B3LYP/ 6-311G+(d,p)水平上的路径示意图,所有驻点的总能量和相对能量均以反应物的总能量为基准进行计算。图中标注的数值为反应路径上各驻点的相对能量,通过能量分析确定速率决定步骤。由IM1生成IM2经过过渡态TS,过渡态TS的相对能量为-491.17 kJ×mol-1。中间体IM3的能量是势能极小值,相对能量为-592.87 kJ×mol-1。由中间体IM4到产物的能垒最大,暗示由IM4生成产物的过程可能为脱硫反应的速率决定步骤。
5 结 论
在400~500℃范围内,升高温度可提高CaS的脱硫率。在250~1000 h-1空速范围内,较低的空速可提高CaS的脱硫率。脱硫剂粒径对其脱硫活性影响较小。在的前40 min的脱硫过程中,脱硫剂在无氧和有氧条件下达到的脱硫率相差很小。随循环次数增多,由于脱硫剂比表面积减少,粒径增大,脱硫剂在无氧和有氧条件下的脱硫活性均缓慢下降。通过量子化学计算发现,用CaS与SO2的反应路径有1个过渡态,路径为R→IM1 →TS→IM2→IM3→IM4→P。
[1] Montenegro V, Sano H, Fujisawa T. Recirculation of high arsenic content copper smelting dust to smelting and converting processes [J]. Minerals Engineering, 2013, 49: 184-189.
[2] Zhang Y, Tang X L, Yi H H,. Estimation of SO2emission factors from copper smelting industry in Yunnan Province, China [J]. Journal of Central South University of Technology, 2013, 20(3): 742-748.
[3] GUO Zhi-sheng (郭智生), HUANG Wei-hua (黄卫华). Present situation and development prospect of metallurgical acid production techngies (有色冶炼烟气制酸技术的现状及发展趋势) [J]. Sulphuric Acid Industry(硫酸工业), 2007(2): 13-21.
[4] YU Hai (于海). Research on waste heat recovery and reuse of typical nonferrous metallurgy flue gas (典型有色金属冶炼烟气余热回收利用研究) [D]. Shenyang (沈阳), Northeast University (东北大学), 2011.
[5] WANG Lang-lang (王郎郎), WANG Xue-qian (王学谦), NING Ping (宁平),SO2removal from simulated smelting gas with (NH4)2S and sulfur recycling ((NH4)2S吸收净化冶炼烟气中 SO2回收硫资源的方法) [J]. CIESC Journal (化工学报), 2014, 65(11): 4586-4592.
[6] QI Yan (齐焉). Analysis on production situation of China’ s sulphuric acid and phosphate fertilizer in 2012 (2012年我国硫酸磷肥行业运行态势分析) [J]. Sulphuric Acid Industry (硫酸工业), 2013, (2): 1-5.
[7] Park N K, Park J Y, Lee T J,. Catalytic reduction of SO2over Sn–Zr based catalysts for DSRP under high pressure [J]. Catalysis Today, 2011, 174(1): 46-53.
[8] Han G B, Park N K, Ryu S O,. Catalytic reduction of sulfur dioxide using hydrogen or carbon monoxide over Ce1-ZrO2catalysts for the recovery of elemental sulfur [J]. Catalysis Today, 2008, 131(1-4): 330-338.
[9] ZHAO Yi (赵毅), LIU Wei (刘威), ZHU Xiao-yu (祝晓雨),. Experimental study on simultaneous activated carbon-based desulfurization and denitration under microwave irradiation (微波辐照活性炭同时脱硫脱硝的试验研究) [J]. Journal of Chinese Society of Power Engineering (动力工程学报), 2013, 33(11): 878-882.
[10] WANG Hai-bo (王海波). Study of preparation of calcium sulfide and its reaction process with sulfur dioxide(硫化钙的制备及其与二氧化硫的反应过程研究) [D]. Changsha (长沙): Central South University (中南大学), 2014.
[11] CHEN Wan-miao (陈万苗), LIU Qing-hang (刘庆航), YANG Chang-tao (杨昌涛),. Catalytic oxidation of slip ammonia in flue gas over modified SCR catalyst (改性SCR催化剂对逃逸氨的催化分解作用) [J]. J Chem Eng of Chinese Univ (高校化学工程学报), 2013, 27(6): 1058-1063.
[12] ZHANG Yan-ting (张燕婷), PAN Hua (潘华), LI Wei (李伟),. SCR of NOwith C3H8over Co/H-beta modified by Zn at high GHSV (高空速条件Zn改性Co/H-beta催化剂上C3H8催化还原NO) [J]. J Chem Eng of Chinese Univ (高校化学工程学报), 2009, 23(2): 236-239.
[13] Cho M E, Sohn H Y, Ahmed Y,. Effect of CaSO4pelletization conditions on a novel process for converting SO2to elemental sulfur by reaction cycles involving CaSO4/CaS-Part II: reduction of SO2with CaS [J]. Chemical Engineering & Technology, 2007, 30(7): 951-954.
[14] Sohn H Y, Kim B S. A new process for converting SO2to sulfur without generating secondary pollutants through reactions involving CaS and CaSO4[J]. Environmental Science & Technology, 2002, 36(13): 3020-3024.
[15] Sohn H Y. Thermodynamics of a new cyclic reaction system involving BaS and BaSO4for converting sulfur dioxide to elemental sulfur [J]. Industrial & Engineering Chemistry Research, 2003, 42(23): 5946-5948.
[16] Sohn H Y, Savic M, Padilla R,. A novel reaction system involving BaS and BaSO4for converting SO2to elemental sulfur without generating pollutants: Part I. Feasibility and kinetics of SO2reduction with BaS [J]. Chemical Engineering Science, 2006, 61(15): 5082-5087.
[17] ZHANG Shuai (张帅), XIAO Rui (肖睿), YANG Yi-chao (杨一超),. Experimental study of desulfurization of chemical-looping combustion of coal with calcium-based oxygen carrier (钙基载氧体煤化学链燃烧脱硫试验研究) [J]. Journal of Engineering Thermophysics(工程热物理学报), 2012, 33(3): 525-528.
[18] CHEN Xiao-na (陈晓娜), ZHANG Yong-min (张永民), TANG Jun (唐军),. Initial fluidization processes of binary quartz sand particles with equal density (石英砂二元混合颗粒初始流化过程的研究) [J]. J Chem Eng of Chinese Univ (高校化学工程学报), 2013, 27(5): 729-736.
[19] Kamphius B, Potma A W, Prins W,. The reductive decomposition of calcium sulphate I. Kinetics of the apparent solid-solid reaction [J]. Chemical Engineering Science, 1992, 48(1): 105-116.
[20] Zhang S A, Xiao R, Liu J,. Performance of Fe2O3/CaSO4composite oxygen carrier on inhibition of sulfur release in calcium-based chemical looping combustion [J]. International Journal of Greenhouse Gas Control, 2013, 17: 1-12.
[21] ZHANG Fan (张帆), WU Rong (吴嵘), WU Su-fang (吴素芳). Preparation of a NiO-CaO/Al2O3sorption complex catalyst by hydrothermal precipitation method and its application in ReSER process (水热沉淀法制备NiO-CaO/Al2O3复合催化剂及其在ReSER制氢中的应用) [J]. J Chem Eng of Chinese Univ (高校化学工程学报), 2014, 28(5): 985-991.
[22] Naoto M, Dalibor K, Yoshihiro K,. Reductive decomposition of waste gypsum with SiO2, A12O3, and Fe2O3additives [J]. Journal of Material Cycles and Waste Management, 2007, 9(1): 21-26.
[23] SHI Cong-yun (石从云), HE Zheng-quan (何正泉), LIU Xing-zhong (刘兴重). Reaction mechanism of sulfur dioxide with calclum oxide during the dry desulphurization process (干法脱硫过程中 CaO 与 SO2反应机理研究) [J]. Journal of Wuhan University of Science and Technology (武汉科技大学学报), 2010, 33(4): 445-448.
Experimental Studies and Mechanism of CaS and SO2Reaction during Smelting Gas Dry Desulphurization Processes
CHANG Jing1, ZHANG Cong2, TIAN Hong-jing2,3, GUO Qing-jie2, WU Wei-ze3
(1. College of Resources and Environment, Qingdao Agricultural University, Qingdao 266109, China; 2. College of Chemical Engineering, Qingdao University of Science & Technology, Qingdao 266042, China; 3. State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Technology, Beijing 100029, China)
A mixture of calcium sulfide and quartz sand was used as desulfurizer to remove sulfur dioxide from smelter off-gas in a quartz fixed-bed reactor. The effects of reaction temperature, space velocity, particle size, presence of oxygen and cycle repetition on the desulfurization efficiency were studied. The results show that high temperature, low space velocity and small desulfurizer particles are beneficial to improve desulfurization efficiency. The desulfurization efficiency is above 96.4% when studied within 100 mins under 500℃ and a space velocity of 250 h-1. The desulfurizer shows a stable reactivity in the multi-cycle tests both in the presence and absence of oxygen. The specific surface area and adsorption capacity decrease slowly from 32.2 m2×g-1and 21.6 cm3×g-1before the recycle tests to 26.5 m2×g-1and 16.2 cm3×g-1after ten cycles, respectively. However, the particle size increases gradually. The mechanism of the CaS and SO2reaction was studied using the density functional theory (DFT) of the Gaussian 09 software. The configurations of reactants, isomers, transition states and products were optimized at the B3LYP/6-311G+(d,p) level and the single point energy of each stationary point was calculated. The reaction of IM4 (intermediate) turns into P(CaSO4+S2) (product) was predicted to be the rate-limiting step.
calcium sulfide(CaS); smelting gas; desulfurization; reaction mechanism
1003-9015(2016)01-0240-08
X511
A
10.3969/j.issn.1003-9015.2016.01.036
2015-01-13;
2015-05-25。
国家自然科学基金(51106077);山东省自然科学基金(ZR2015PE026);化工资源有效利用国家重点实验室开放课题(CRE-2013-C-302);国家级大学生创新创业训练计划(201510435047)。
昌晶(1980-),女,山东青岛人,青岛农业大学副教授,博士。通讯联系人:田红景,E-mail:hj_tian@aliyun.com

