富血小板血浆凝胶联合脂肪干细胞促进大鼠创面修复的实验研究
金长鑫,吴 琼,刘 烨,刘 波,刘 卫,黄进军
·论著·
富血小板血浆凝胶联合脂肪干细胞促进大鼠创面修复的实验研究
金长鑫1,吴琼2,刘烨3,刘波4,刘卫5,黄进军3
目的探讨富血小板血浆(PRP)凝胶联合脂肪干细胞(ADSCs)对大鼠创面修复的影响,为其临床应用提供理论基础。方法体外分离、培养、鉴定大鼠ADSCs。取16只SD大鼠,制备大鼠自体PRP凝胶,采用自身对照的方法,每只实验大鼠背部制作4个1 cm2的正方形皮肤全层缺损创面,分为AP组、A组、P组、O组,分别给予ADSCs+PRP 处理、ADSCs处理、PRP处理以及空白对照处理,观察术后各组创面愈合情况。并于术后3、5、7、14 d分别随机处死4只实验大鼠,取创面组织,HE染色进行病理组织学观察,血小板-内皮细胞黏附分子(CD31)免疫组化分析各时间点新生血管化情况,天狼猩红染色对Ⅰ型胶原含量和Ⅲ型胶原含量进行检测,并对创面组织的转化生长因子β1(TGF-β1)表达情况进行逆转录聚合酶链反应(RT-PCR)检测。结果大体观察AP组和P组较A组和O组结痂快、创缘收缩也较快;微血管计数CD31细胞阳性表达率及I型胶原蛋白含量AP组、A组、P组均高于O组,且AP组与O组差异更为显著,差异有统计学意义(P<0.05);创面愈合过程中,AP组创面组织的TGF-β1表达也明显高于空白对照组,差异有统计学意义(P<0.05)。结论ADSCs与PRP凝胶的应用能加速新生血管化及增加胶原蛋白合成,可有效加速创面愈合。
脂肪干细胞;富血小板血浆凝胶;皮肤缺损;创面修复
战伤是军事医学的重点研究对象,由于战伤导致的皮肤与软组织缺损,将直接影响战斗力和战士战后的生活质量,是亟待解决的课题之一。脂肪干细胞(ADSCs)可增加真皮细胞外基质中胶原的合成,促进皮肤创面愈合[1];富血小板血浆(PRP)在血管发生、组织修复和炎症过程中也起重要作用,促进创面愈合。本实验研究通过建立皮肤全层缺损的动物模型,观察应用ADSCs和富血小板血浆修复皮肤全层缺损后创面愈合、组织学变化,对创面组织的血小板-内皮细胞黏附分子(CD31)的表达、转化生长因子β1(TGF-β1)的表达以及I型胶原和Ⅲ型胶原含量进行检测。探讨ADSCs和PRP促进战伤创面愈合的机制,为其临床应用提供理论基础。
1 材料与方法
1.1主要试剂和设备DMEM/F12培养基,含EDTA0.25%胰蛋白酶(美国 Hyclone公司),PBS缓冲液(美国 Hyclone公司),DMEM溶液,一抗CD31(abcam,ab28364),二抗Envision,anti-rabbit-HRP(DAKO,K4003),DAB染色液(DAKO,K5007),天狼猩红染色混合液,TRE-Trizol(Invitrogen), Primers(上海生工),PrimeScript II 1st Strand cDNA Synthesis Kit(TaKaRa),SYBR Premix Ex Taq II(TaKaRa),CO2培养箱(Heraeus,German),拍照系统(Olympus,DP71),高速冷冻离心机(SIGMA 3K15,德国SIGMA公司),Real Time PCR仪(CFX96,美国Bio-Rad公司)等。
1.2方法
1.2.1SD大鼠ADSCs体外分离、培养与扩增取4周龄SPF级雄性SD大鼠,使用水合氯醛(7%,0.3 mL/100 g)腹腔注射麻醉,取两侧腹股沟脂肪垫组织,用PBS缓冲液反复漂洗去除组织中的小血管、外包膜和明显的结缔组织,剪碎至靡状。0.2%一型胶原酶恒温消化40~50 min。采用基础培养液中和一型胶原酶后,以1500 r/min离心10 min(离心机半径为15 cm),弃杂质及上清后,沉淀混悬后200目滤网过滤,再以1000 r/min离心5 min,弃上清,含10%FBS的DMEM/F12混悬细胞后,按细胞数1×104~2×104个/培养瓶接种于25 cm2培养瓶中,培养瓶中加入3 mL全培,置入37 ℃,5%CO2及饱和湿度恒温培养箱中培养,48 h换液,后每3~4 d换液一次,倒置显微镜下观察细胞生长情况,原代细胞培养6~7 d后细胞融合达80%~90%时进行传代。细胞传代时弃去原培养液,PBS洗涤1次,以去除血清,加入适量0.25%胰蛋白酶+0.03%EDTA进行消化,在倒置显微镜下观察见胞质回缩、细胞间隙增大,细胞变圆,立即加入适量完全培养基终止消化,用吸管反复轻柔吹打,将细胞吹打下来,1000 r/min离心5 min,含10%胎牛血清,1%青、链霉素原液的高糖DMEM培养基重悬沉积细胞,按1传3的比例进行传代。当传代细胞生长接近单层汇合达到70%以上时,可继续传代。
1.2.2ADSCs多能分化及流式细胞表面标记物的鉴定取生长良好的第3代细胞消化后,以5×104/mL接种于放有玻片的6孔板中,分别加入成脂及成骨分化诱导液培养基进行诱导分化,每3 d更换诱导培养基1次;成脂诱导分化组进行诱导分化处理后2周行油红O染色倒置显微镜下观察,成骨诱导分化组进行诱导分化处理后4 周后行茜素红染色观察鉴定。
1.2.3PRP凝胶的制备利用改良Cascade-Esforax法制备PRP[2-4],用Ca2+激活制成PRP凝胶[5]。7%水合氯醛(0.3 ml/100 g)经腹腔内注射成功麻醉大鼠后,用装有0.3 mL 4%枸橼酸钠抗凝剂的5 mL注射器连接硬膜外管进行颈静脉插管抽取大鼠静脉血3 mL,将抽取的静脉血等分两份分别以1100g离心10 min,之后分别加入0.15 mL 50 mg/mL氯化钙激活,静置后,取出中间层的淡黄色凝胶,即PRP凝胶备用。
1.2.4大鼠皮肤软组织缺损创面模型的构建与分组造模前10 min将ADSCs自培养瓶中消化下来,以DMEM溶液混悬,制成ADSCs为3×106/mL的DMEM混悬液备用。大鼠在提取PRP后,在其背部正中脊柱两侧相距2 cm处,等距分别设计四个边长为1 cm的方形创面,全背部用1%碘伏消毒3次后,沿标记线全层切除皮肤,形成皮肤软组织缺损创面,并用硅胶板对创面边缘进行固定,防止创面愈合早期过度收缩,同一只大鼠背部四个创面进行随机分组,AP组为ADSCs+PRP 处理组,A组为ADSCs处理组,P组为PRP处理组,O组为空白对照组。
1.2.5组织标本的制备与处理术后3、5、7、14 d分别处死四只大鼠,取愈伤组织及其周围部分组织,使用4%甲醛固定,脱梯度脱水、浸蜡、包埋后制成约5 μm厚的切片。使用HE染色对愈合后的创面组织进行组织病理学观察。使用CD31免疫组化染色,衡量新生微血管密度。可视化量化Ⅰ型和Ⅲ型胶原蛋白的比例,使用天狼星红染色,偏振光下观察两种胶原蛋白的比例。I型胶原纤维呈现红色或黄色,Ⅲ型胶原蛋白呈现绿色。提取各时间点各组愈伤组织中的核糖核酸(RNA),逆转录聚合酶链反应(RT-PCR)检测其中TGF-β1的表达情况。
1.3统计学处理采用 SPSS 17.0 统计软件进行统计学分析,采用单因素方差分析,各组间的两两比较采用Bonferroni法,以P<0.05为差异有统计学意义。
2 结 果
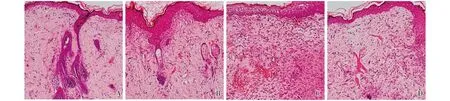
2.1ADSCs体外诱导多向分化及流式细胞鉴定第3代细胞置于培养基诱导分化2周后细胞体积增大,胞浆内充满圆形脂滴呈葡萄串状,这时进行油红O染色阳性:圆形细胞内出现亮红色的颗粒,说明细胞可向脂肪细胞分化。成骨分化培养基内诱导分化4周后,经茜素红染色阳性,可见红色钙结节,证明成骨诱导后细胞可向成骨细胞系分化。流式细胞分析显示细胞表型为CD29、CD90阳性,CD34、CD45阴性,与ADSCs表型相符。见图1、图2。
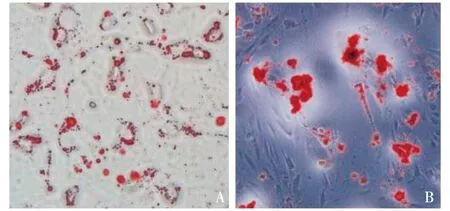
图1 A:ADSCs体外诱导 ADSCs成脂诱导分化,2周后油红O染色(×200);B:ADSCs成骨诱导分化,4周后茜素红染色(×200)
2.2大体观察结果实验第3天,肉眼观察下可见AP、P组表面可见覆盖PRP凝胶处形成淡红色血痂,且该两组创面较A组、O组干燥; 实验第7天,肉眼观察到创面大小、深度AP组 2.3组织学分析 2.3.1HE染色组织学分析观察创面愈合后组织切片,AP组腺体样结构层次分明,新生血管较多,胶原纤维排列与正常皮肤组织类似;A组腺体样结构较多,新生血管较 AP组少,胶原纤维排列较AP组紊乱;P组新生毛细血管较多,腺体样结构较少,但其胶原纤维排列有序;O组新生血管形成,视野里被紊乱排列的胶原纤维填充,腺体样组织较少。见图3。 2.3.2CD31染色观察微血管密度各组随时间的迁移CD31阳性表达率呈上升趋势,其中术后第14天,ADSCs+PRP组与其他3组比较,差异有统计学意义(P<0.05)。见图4。 2.3.3胶原蛋白合成分析I型胶原蛋白,在天狼星红染色过程中被染成红色或黄色,是各组创面含量最为丰富的胶原蛋白。III型胶原蛋白(未成熟的胶原蛋白、被染成绿色)含量较少。结果显示I型胶原含量在14 d内随时间的迁移而增加,其中3 d时,除A组与P组组间差异无统计学意义(P>0.05),其余各组间差异均有统计学意义(P<0.05),即AP组I型胶原蛋白含量较其余三组高,A组、P组I型胶原蛋白含量均较O组高;5 d时,除A组与P组组间差异无统计学意义(P>0.05),其余各组间差异均有统计学意义(P<0.05),即AP组I型胶原蛋白含量较其余三组高,A组、P组I型胶原蛋白含量均较O组高;7 d,AP组、A组、P组、O组各组间差异均有统计学意义(P<0.05),即I型胶原蛋白含量AP组>P组>A组>O组;14 d时,AP组、A组、P组、O组各组间差异均有统计学意义(P<0.05),即I型胶原蛋白含量AP组>A组>P组>O组。见图5。 图2 流式细胞表型鉴定:CD29、CD90阳性,CD34、CD45阴性 A:ADSCs+PRP组;B:PRP组;C:ADSCs组;D:空白对照组图3 术后第14天,各组HE染色(×100) O组:空白对照组;A组:ADSCs组;P组:PRP组;AP组:ADSCs+PRP组 图4 各组各时间点创面组织的CD31染色(×100) O组:空白对照组;A组:ADSCs组;P组:PRP组;AP组:ADSCs+PRP组图5 各组各时间点创面组织的天狼猩红染色(×100) 2.4TGF-β1含量的RT-PCR检测结果各组TGF-β1的表达在术后第1周内均呈上升趋势, AP组、A组及P组的上升情况高于O组,其中AP组上升更为明显;在术后第2周时TGF-β1的表达下降,AP组下降较为显著,与O组差异有统计学意义(P<0.05)。 3.1PRP联合ADSCs可有效促进新生血管再生许多成熟组织中含有干细胞,用于组织损伤修复过程。自脂肪组织中分离干细胞已有十几年,并且越来越多地用于临床前和临床模型,ADSCs可提供有效的血管生成生长因子,包括血管内皮生长因子、成纤维细胞生长因子、肝细胞生长因子等,促进病灶的新生血管化。大量实验研究发现单一的生长因子不会促进细胞增殖及细胞转移,只有当多种细胞因子结合在一起时才能发挥作用,促进创面愈合。而PRP是全血经离心后得到的血小板浓缩物,被Ca2+激活后,可释放大量生长因子,如血小板衍生生长因子(PDFG)、转化生长因子-β(TGF-β)和类胰岛素生长因子1(IGF-1)等[6]。本实验中我们发现,ADSCs联合PRP凝胶使局部创面组织血管化的程度优于单纯ADSCs组及PRP组。这种差异在我们第2周的研究中更加明显。值得注意的是,PRP凝胶对ADSCs在新生血管化方面起着协同作用,并且可能加强了ADSCs的增殖及对生长因子的分泌。 3.2PRP联合ADSCs可增加胶原蛋白合成皮肤的强度及耐力主要与真皮中胶原蛋白的组成有关,通常起主要作用的是I型胶原蛋白(85%~95%),其次是Ⅲ型胶原蛋白(10%~15%)。在本研究中,我们发现,ADSCs联合PRP凝胶组I型胶原蛋白的含量较其他几组明显增加。这种差异在第2周时更为明显,表明胶原蛋白再生已经加速,并形成了高质量的瘢痕。之前有研究可以解释该结果的产生,ADSCs可通过TGF-β等细胞因子调控其旁分泌作用,从而加速成纤维细胞的迁移和增殖[7-8]。TGF-β是一种多功能蛋白质,作用于细胞增殖、分化和细胞外基质分泌,参与调控生物体免疫调节、血管形成、胚胎发育、创伤愈合骨的重建等生理过程。其中TGF-β1有动物实验表明它可以促进伤口愈合和典型肉芽组织形成等[9-10]。亦有实验证明TGF-β1治疗可以提高I、III型胶原mRNA的表达[11]。所以TGF-β1在治疗伤口愈合方面有潜在的应用前景。在本实验中可见在AP组、A组P组及O组TGF-β1的表达在术后第1周内均呈上升趋势,且AP组较其他各组增加尤为明显,而在术后第 2周时表达下降,这一结果可能和TGF-β1在预防瘢痕方面有关。研究认为TGF-β1这种细胞因子的过度表达可以致瘢痕形成,而在创面愈合后期适当的抑制可以减少瘢痕的产生[12]。这种现象说明PRP联合ADSCs可以通过改变TGF-β1的提前表达加速创面组织的愈合,同时后期表达的下降可以减少瘢痕组织的形成。 综上所述,本研究结果表明,联合ADSCs与PRP凝胶的应用能加速新生血管化及增加胶原蛋白合成,可有效加速创面愈合。未来的实验可侧重于如何完整上皮化的研究,从而使这项技术早日应用于临床。 [1]杨爱珍,文献,张志敏,等.脂肪源性干细胞的临床转化研究[J].东南国防医药,2013,15(5):503-507. [2]Anitua E, Andia I, Ardanza B, et al.Autologous platelets as a source of proteins for healing and tissue regeneration[J]. Thromb Haemost,2004,91(1):4-15. [3]Azzena B, Mazzoleni F, Abatangelo G, et al. Autologous platelet-rich plasma as an adipocyte in vivo delivery system: case report[J]. Aesth Plast Surg, 2008,32(1):155-158. [4]Anitua E. Plasma rich in growth factors: preliminary resultsof use in the preparation of future sites for implants[J]. Int J Oral Maxillofac Implants, 1999,14(4):529-535. [5]Cervelli V,Gentile P,Scioli MG,et al.Orlandi A application of platelet-rich plasma in plastic surgery: clinical and in vitro evaluation[J].Tissue Eng Part C Methods, 2009, 15(4): 625-634. [6]Soffer E,Ouhayoun JP,Anagnostou F.Fibrin sealants and platelet preparations in bone and periodontal healing[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2003, 95(5): 521-528. [7]Kim WS, Park BS, Sung JH, et al. Wound healing effect of adipose-derived stem cells: A critical role of secretory factors on human dermal fibroblasts[J]. J Dermatol Sci, 2007, 48(1): 15-24. [8]Kim WS, Park BS, Park SH, et al. Antiwrinkle effect of adipose-derived stem cell: Activation of dermal fibroblast by secretory factors[J]. J Dermatol Sci, 2009, 53(2): 96-102. [9]Hou Y,Mao Z,Wei X,et al.The roles of TGF-beta1 gene transfer on collagen formation during Achilles tendon healing[J].Biochem Biophys Res Commun,2009,383(2): 235-239. [10]Hou Y,Mao Z,Wei X,et al.Effects of transforming growth factor-beta1 and vascular endothelial growth factor 165 gene transfer on Achilles tendon healing[J].Matrix Biol,2009,28(6): 324-335. [11]Kashiwagi K,Mochizuki Y,Yasunaga Y,et al.Effects of transforming growth factor-β1 on the early stages of healing of the achilles tendon in a rat model[J].Scand J Plast Reconstr Surg Hand Surg,2004,38(4): 193-197. [12]Chang J,Thunder R,Most D,et al.Studies in flexor tendon wound healing:neutralizing antibody to TGF-b1 increases postoperative range of motion[J].Plast Reconstr Surg,2000,105(1): 148-155. (本文编辑:黄攸生;英文编辑:王建东) Thereseach of platelet rich plasma gel combined with adipose-derived stem cells in repairing soft tissue wounds in rats JIN Chang-xin1, WU Qiong2, LIU Ye3,LIUBo4,LIUWei5,HUANGJin-jun3. 1.DepartmentofPlasticSurgery,XijingHospital,FourthMilitaryMedicalUniversity,Xi’an,Shanxi710032,China; 2.DepartmentofPlasticandReconstructiveSurgery,ZhujiangHospital,SouthernMedicalUniversity,Guangzhou,Guangdong510282,China; 3.DepartmentofPlasticandAestheticSurgery, 4.DepartmentofInfectionDiseases, 5.DepartmentofGastroenterology, 105HospitalofPLA,Hefei,Anhui230031,China ObjectiveTo explore the role of ADSCs and PRP in skin defect repairing, and to provide theoretical basis for clinical application. MethodsAdipose tissues from inguinalis fat pad of SD rats were harvested, isolated, cultured, and identified. 16 SD rats were taken, and autologous PRP gel was prepared. 4 square shaped full-thickness skin defect (a=1 cm2) was made on the rat back using self-control method. The wounds were divided into 4 groups randomly, of which group AP was treated with ADSCs and PRP; group A was treated with ADSCs; group P was treated with PRP and group O is blank control group. The wound healing process was observed. HE, sirius red, CD31 stain were observed at 3 d, 5 d,7 d, 14 d after surgery. TGF-beta 1 expression was detected by Rt-PCR in wound tissue. ResultsThe wound contraction of group AP and group P were faster than the group A and O; CD31 positive expression rate and content of type I collagen of microvascular counts in group A, group P and group AP were higher than that of O group. There was significant difference between group AP and group O (P<0.05). In the process of wound healing, the expression of TGF - beta 1 in wound tissue of group AP was significantly higher than the blank control group (P<0.05). ConclusionApplication of ADSCs comnined with PRP gel by means of accelerating new blood vessels and increasing collagen synthesis can effectively accelerate wound healing. adipose stem cell; platelet-rich plasma gel; skin defects; wound healing 南京军区医药科研项目(12MA033) 1. 710032陕西西安,第四军医大学西京医院整形外科;2. 510280广东广州,南方医科大学珠江医院整形外科;3. 230031安徽合肥,解放军105医院整形美容外科,4. 感染科,5. 消化科 黄进军,E-mail: surgeonhuangjj@163.com R641 A 10.3969/j.issn.1672-271X.2016.04.004 2016-02-23; 2016-05-04) 引用格式:金长鑫,吴琼,刘烨,等.富血小板血浆凝胶联合脂肪干细胞促进大鼠创面修复的实验研究[J].东南国防医药,2016,18(4):349-353.


3 讨 论

