激光损伤后不同时间点鼠视网膜中水通道蛋白-1的表达
潘海涛,潘士勇,丁 淳,赵迎峰
·论著·
激光损伤后不同时间点鼠视网膜中水通道蛋白-1的表达
潘海涛,潘士勇,丁淳,赵迎峰
目的采用免疫组化、荧光定量PCR法观察激光损伤后不同时间鼠视网膜中水通道蛋白-1(aquaporin-1,AQP-1)的分布及其mRNA表达的变化。方法Brown Norway(BN)大鼠激光损伤视网膜后,脊椎脱臼法处死,摘除眼球,4%福尔马林固定,石蜡包埋。平行视神经矢状连续切片,HE染色、免疫组化染色和阴性对照。用已知有AQP-1表达的正常大鼠眼球眶周组织中的血管切片为阳性对照。另取出大鼠眼视网膜组织,行实时定量PCR检测。结果免疫组化切片显示,褐色粗颗粒出现在大鼠眼组织细胞中为阳性,无则为阴性。实时荧光定量PCR结果显示,正常组AQP-1 mRNA表达量为:(1.15±0.01),激光损伤即刻:(1.10±0.01);12 h:(1.10±0.03);24 h:(1.16±0.01);72 h:(1.13±0.01)。结论AQP-1在眼内阳性表达于多个与水代谢有关的部位,视网膜上AQP-1 mRNA的表达在激光损伤后呈现动态变化,激光损伤初期呈上调,损伤后期呈下调表达。
水通道蛋白-1;免疫组化;荧光定量PCR;BN大鼠
近些年,我国人口老龄化进程不断加速,老年性黄斑变性等一系列视网膜性疾病逐渐成为老年人中主要致盲性眼病。在糖尿病性视网膜病变等新生血管性疾病的发病过程中,视网膜色素上皮细胞的损伤常常被认为是它们的始动因素,它可导致局部视网膜处于低氧状态,继而引起视网膜屏障破坏,视网膜水肿等一系列问题[1-2]。本实验通过应用免疫组化法及实时荧光定量PCR法观察激光照射后不同时间鼠视网膜中水通道蛋白-1(aquaporin-1,AQP-1)的分布及mRNA的变化,并分析其变化特征,以期为下一步探索激光损伤视网膜,探讨AQP-1在激光所致视网膜水肿形成发展中的作用及其相关机制打下基础。现将研究结果报告如下。
1 材料与方法
1.1实验动物南京总医院动物实验中心提供的12周龄雄性、健康Brown Norway(BN)大鼠30只,体重170~220 g。实验动物合格证号SCXK(军)2012-0014,实验动物许可证号SYXK(军)2012-0046。

图1 激光损伤鼠视网膜模型
1.2动物模型建立、分组及取材BN大鼠随机分成5个组:正常对照组、激光损伤后即刻、12 h、24 h、72 h,每组6只。单眼充分散瞳,盖玻片接触角膜,激光光凝散瞳眼视网膜,离视盘约2个视盘直径外4个象限均匀光凝50个点。多次预实验后,设置氩激光参数:532 nm波长,曝光时间0.1 s,光斑为50 μm,能量100 mw,正常眼为对照分析。大鼠视网膜激光损伤后,摘除眼球,庆大霉素(50 U/mL)+0.9%生理盐水彻底冲洗。去除眼前段组织,镊子轻轻夹取视网膜组织放置冻存管中,立即保存于-80 ℃温度下,整个操作过程力求保持无菌。正常对照的BN大鼠不需激光处理以同样的方式取出视网膜。
1.3主要仪器设备及试剂光学显微镜及摄像系统OLYMPUS CKX41(日本),视网膜系统分离仪Viridis Twin(法国),ZT-12H生物组织自动脱水机(湖北亚光),YB-6生物组织包埋机(湖北亚光),超薄切片机LEICA RM2235(德国),DAB显色试剂盒(Dako公司),羊抗兔IgG-HRP(杭州华安),兔抗鼠AQP-1多克隆抗体(abcam公司),4%多聚甲醛溶液(南京化学公司)。
1.4免疫组织化学检查脊椎脱臼法处死大鼠,摘除眼球,4%多聚甲醛固定;石蜡包埋,平行视神经矢状位连续切厚4 μm的切片,每个标本切2片用于HE染色和AQP-1染色;脱蜡,水化后置入3%甲醇、0.5%H2O2中37 ℃温度下孵育30 min以清除内源性过氧化物酶;蒸馏水冲洗后分别滴加正常兔血清30 μL,兔抗鼠AQP-1多克隆抗体工作液(一抗)及稀释液配制的辣根过氧化酶化羊抗兔IgG二抗工作液,37 ℃温度下孵育30 min。磷酸盐缓冲液充分洗涤;吸干PBS液,滴加DAB染色,蒸馏水冲洗;苏木素复染3 min,氨水返蓝;酒精梯度顺序脱水,二甲苯透明,中性树脂胶封片,加盖玻片,拍照。1.5实时荧光定量PCR检查样品总RNA用TRIzol法提取,将RNA反转录成cDNA;根据基因序列设计特异性引物(G ̄A ̄P ̄D ̄H ̄- ̄F ̄: ̄T ̄G ̄T ̄G ̄T ̄C ̄C ̄G ̄T ̄C ̄G ̄T ̄G ̄G ̄A ̄T ̄C ̄T ̄G ̄A ̄; ̄G ̄A ̄P ̄D ̄H ̄- ̄R ̄: ̄T ̄T ̄G ̄C ̄T ̄G ̄T ̄T ̄G ̄A ̄A ̄G ̄T ̄C ̄G ̄C ̄A ̄G ̄G ̄A ̄G ̄) ̄,以GAPDH为内参基因,做相对定量检测。

2 结 果
2.1激光损伤鼠视网膜模型如图1所示:围绕视乳头,距离视乳头边缘约2个视盘直径外可见激光损伤照射点,均匀分布于四个象限之中,避开网膜血管,激光斑区域网膜色泽灰白,透亮,激光斑周围网膜局部水肿。
2.2免疫组化染色光镜下AQP-1免疫组化切片显示,褐色粗颗粒出现在大鼠眼组织细胞中为阳性,无则为阴性。棕色颗粒颜色越深,表示阳性强度越大。以已知大鼠眼球眶周脂肪组织中的血管管壁AQP-1染色的为阳性对照(图2),正常大鼠眼视网膜组织中AQP-1阳性表达部位主要位于:视网膜神经节细胞层,内核层(图3)。图4~7为激光损伤后不同时间点的视网膜组织结构图。

图2 AQP-1染色的为阳性对照(×200)

图3 正常大鼠眼视网膜组织中AQP-1阳性表达部位(×200)

图4 光损伤即刻视网膜组织结构图(×200)

图5 光损伤12 h视网膜组织结构图(×200)

图6 光损伤24 h视网膜组织结构图(×200)

图7 光损伤72 h视网膜组织结构图(×200)
2.3荧光定量PCR检测实时定量PCR结果显示(表1),正常组AQP-1 mRNA表达量为:(1.15±0.01),激光损伤组分别为:即刻:(1.10±0.01),激光损伤后12 h:(1.10±0.03),激光损伤后24 h:(1.16±0.01),激光损伤后72 h:(1.13±0.01)。与正常组相比,激光损伤即刻组与激光损伤12 h组差异均有统计学意义(均P<0.01);激光损伤24 h组和激光损伤72 h组的差异均没有统计学意义(均P>0.05)。图8激光照射诱导后不同时间点鼠视网膜中AQP-1 mRNA的相对表达柱状图示:激光损伤后鼠视网膜中AQP-1 mRNA的表达呈动态变化,在损伤前12 h其表达不断上调,至12 h达顶峰,后随着时间的延长不断下调表达。每个标本做3次复孔反应,ct值相接近,说明该实验的重复性好(ct:荧光信号到达预先设定的阂值时所发生的重复次数)。
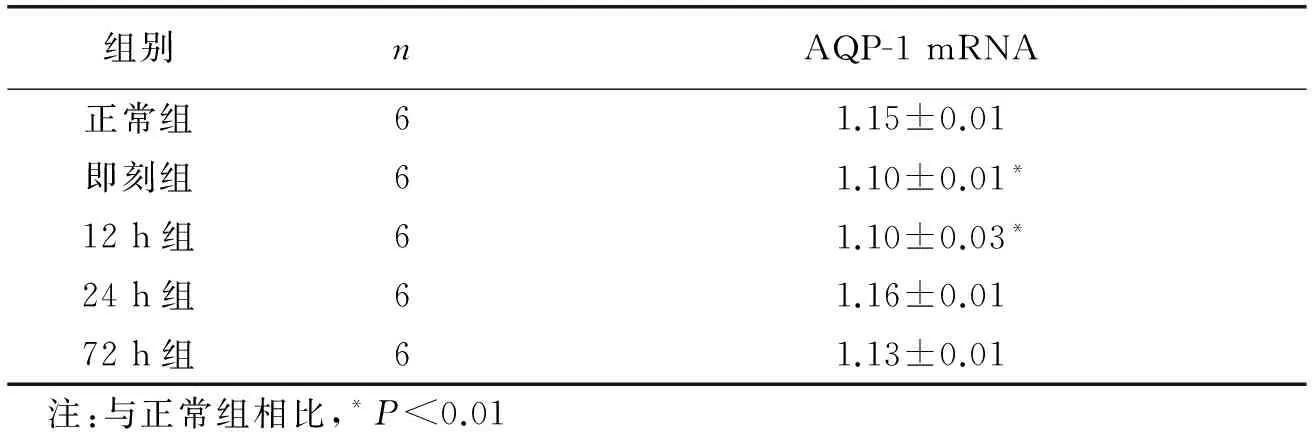
表1 激光照射诱导后不同时间点
3 讨 论
水通道蛋白(AQPS)是近些年来发现的一组能够快速跨膜转运水运动的非选择性细胞膜转运蛋白,它普遍存在于动、植物和微生物中[3]。它主要参与体内液体的分泌和吸收,在调节和维持机体器官和组织的生理功能中发挥重要作用。AQP-1和AQP4是目前视网膜上仅发现的两种亚型蛋白,其中AQP-1的含量约为AQP4的7倍[4-5]。AQP-1在视网膜的无长突细胞[6]、色素上皮细胞[7]和光感受器细胞[8]等多种细胞均有表达,主要分布于外侧视网膜。这种特征性的分布模式提示,AQP-1在调节视网膜内水、电解质转运均衡以及维持正常视觉功能中发挥非常重要的作用。
视网膜色素上皮细胞与视网膜激光损伤发生和修复的全过程联系,视网膜激光照射后形成激光斑,激光斑范围视网膜光感受器细胞凋亡、坏死,形成瘢痕组织,视网膜色素上皮、神经上皮与布鲁赫膜产生粘连,视网膜色素上皮液体转运功能增强。同时,激光斑周围网膜发生局限性水肿,而这一般为神经节细胞和水平细胞的水肿。大量的研究表明,视网膜水肿形成是青光眼等高眼压病人的主要病理改变,它是导致视网膜神经细胞损伤,视觉功能下降的重要原因[9]。之前大量文献报道了AQP-4与视网膜水肿的相关性,而AQP-1报道的相对较少。
实时定量PCR技术是一种定量分析处理方式,它是在半定量、定性PCR技术原理上被提出来的,成为当下研究mRNA表达水平最热门的技术之一[10-11]。本实验运用免疫组化法、实时荧光定量PCR法观察激光照射诱导后不同时间鼠视网膜中AQP-1的分布及其mRNA表达的变化。免疫组化染色证实AQP-1在眼内与水代谢有关的多个部位呈阳性表达,实时荧光定量PCR结果显示,与正常组AQP-1 mRNA表达量相比,激光损伤后4个时间点中,只有激光损伤后即刻组与激光损伤12 h组差异有统计学意义(P<0.01)。我们观察到AQP-1的表达在视网膜激光损伤后呈现动态变化:在激光损伤初期其呈上调表达,在激光损伤后其呈下调表达。先前有研究提示视网膜挫伤后视网膜会发生水肿,并且视网膜水肿是动态变化的[12]。因此我们大胆推测激光损伤视网膜上AQP-1表达的动态变化与视网膜水肿的动态变化这两者之间可能存在一定的关联性,如图4~7所示,与正常网膜结构比较后发现,激光损伤后不同时间的网膜组织中,视神经细胞层与内核层均有不同程度的水肿。AQP-1可能促进视网膜水肿的形成和发展,也有可能起到保护作用,具体作用暂不能定论,还有待进一步的研究探索。眼组织中AQP-1的调节机制目前尚不十分清楚,在分子与基因水平还存在着组织特异性调节,调节的因素包括细胞因子、神经递质和激素等[13-15]。离子浓度、细胞成分、容积渗透压等平衡均跟水含量密切相关,它们的异常表达会影响基因的表达、蛋白质分子的功能与结构,从而影响细胞的结构与功能。眼组织中AQP-1适量表达和功能活性正常,是保证这一切正常的先决条件。
[1]潘海涛,周伟,黄振平,等.水通道蛋白-1及其与糖尿病视网膜病变的相关性[J].东南国防医药,2015,17(3):294-297.
[2]徐幼桥,李伟求,江时森,等.老年2型糖尿病患者急性心肌梗死早期血糖变异对冠状动脉病变的影响[J].东南国防医药,2013,15(2):122-124.
[3]Zelenina M, Zelenin S, Aperia A.Water channels (aquaporins) and their role for postnatal adaptation[J]. Pediatr Res, 2005, 57(5 Pt 2):47R-53R.
[4]Patil RV,Saito I,Yang X,et al.Expression of aquaporins in the rat ocular tissue[J].Exp Eye Res, 1997, 64:203-209.
[5]Nagelhus EA,Veruki ML,Torp R,et al.Aquaporin-4 water channel protein in the rat retina and optic nerve:polarized expression in MÜller cells and fibrous astrocytes[J].J Neurosci,1998, 18:2506-2519.
[6]Kim IB,Oh SJ,Nielsen S,et al.Immunocytochemical localization of aquaporin 1 in the rat retina[J].Neurosci Lett, 1998, 244(1):52-54.
[7]Ianors Iandiev,Thomas Pannicke,Martin B, et al.Expression of aquaporin-1 immunoreactivity by photoreceptor cells in the mouse retina[J]. Neurosci Lett, 2005, 388 (2): 96-99.
[8]Stamer WD,Bok D,Hu J,et al.Aquaporin-1 channels in human retinal pigment epithelium: role in transepithelial water movement[J].Invest Ophthalmol Vis Sci, 2003, 44(6):2803-2808.
[9]Yang XG,Li JM.Study on ischemia reperfusion retinal damage of experimental ocular hypertension rats[J]. Fourth Mil Med Univers,2002,23(2):126-129.
[10]陈英剑,胡成进.荧光实时逆转录PCR定量研究进展[J].国外医学临床生物化学与检验学分册,2004,25(4):348-3351.
[11]张蓓,沈立松.实时荧光定量PCR的研究进展及其应用[J].国外医学临床生物化学与检验学分册,2003,24(6):327-329.
[12]付群,王志玉.实验性兔视网膜挫伤后不同时段的视网膜厚度研究[J].临床眼科杂志,2008,16(3):262-264.
[13]Li J,Patil RV,Verkman AS.Mildly abnormal retinal function in transgenic mice without muller cell aquaporin-4 water channels[J].Invest Ophthalmol Vis Sci,2002,43(2):573-579.
[14]李莉,葛坚.水通道蛋白与眼病[J].国外医学眼科学分册,2001,25(2):69-73.
[15]林明楷,葛坚,黄楚龙,等.地塞米松对人眼小梁细胞水通道蛋白-1表达的影响[J].中国药房,2002,13(12):713-714.
(本文编辑:张仲书;英文编辑:王建东)
Expression of aquaporin-1 in rat retina at different time points after laser injury
PAN hai-tao,PAN Shi-yong,DING Chun,ZHAO Ying-feng.
DepartmentofCadreHealth,NanjingGeneralHospitalofNanjingMilitaryCommand,PLA,Nanjing210002,Jiangsu,China
ObjectiveUsing immunohistochemistry method, fluorescence quantitative polymerase chain reaction (PCR) to observe the AQP-1 distribution at rat retina and mRNA expression changes in different time after laser injury. MethodsThe Brown Norway (BN) rats were killed by spinal dislocation method after laser damaged, removed the eyeball, fixed in 4% formalin and embedded in paraffin. Parallel optic sagittal serial sections, HE staining, immunohistochemical staining and negative control were performed. Use the vascular slice in normal rat eyes’periorbital tissue, in which AQP-1 expression was known as a positive control. Remove the eye retina tissue of rats and check it with line real-time quantitative PCR. ResultsAQP-1 immunohistochemical examination showed brown coarse particles in rat ocular tissues and cells as positive, no as negative. Real-time PCR results showed normal AQP-1 mRNA expression level: 1.15±0.01; laser damage instantly: 1.10±0.01; 12 hours: 1.10±0.03; 24 hours:1.16±0.01; 72 hours:1.13±0.01. ConclusionAQP-1 is expressed in many parts of the water metabolism, and the expression of AQP-1 mRNA in the retina after laser injury shows dynamic changes, which of the initial laser damage was up, and the latter was down.
aquaporin-1; immunohistochemistry; fluorescence quantitative PCR; BN rats
南京军区医学科技创新项目(12MA086)
210002江苏南京,南京总医院干部保健科
赵迎峰,E-mail:419569735@qq.com
R774.1
A
10.3969/j.issn.1672-271X.2016.04.005
2016-03-11;
2016-05-25)
引用格式:潘海涛,潘士勇,丁淳,等.激光损伤后不同时间点鼠视网膜中水通道蛋白-1的表达[J].东南国防医药,2016,18(4):354-357.

