牙本质基质蛋白1和肿瘤坏死因子-α对汉滩病毒感染的脐静脉内皮细胞的作用*
史东沙,董艳迎,赵丽华,谢明
(1.西安交通大学医学部 免疫学与病原生物学系,陕西 西安 710061;2.西安交通大学第二附属医院 检验科,陕西 西安 710061)
论著
牙本质基质蛋白1和肿瘤坏死因子-α对汉滩病毒感染的脐静脉内皮细胞的作用*
史东沙1,董艳迎1,赵丽华2,谢明1
(1.西安交通大学医学部 免疫学与病原生物学系,陕西 西安 710061;2.西安交通大学第二附属医院 检验科,陕西 西安 710061)
目的探讨肿瘤坏死因子-α和牙本质基质蛋白1对汉滩病毒感染的脐静脉内皮细胞通透性的影响,为阐明肾综合征出血热发病过程中通透性增高的机制提供实验基础。方法首先用免疫细胞化学方法检测牙本质基质蛋白1在脐静脉内皮细胞的表达情况,然后通过Transwell单层细胞模型系统检测外源性肿瘤坏死因子-α和牙本质基质蛋白1对汉滩病毒感染的血管内皮细胞通透性的影响。结果牙本质基质蛋白1可以在血管内皮细胞表达,汉滩病毒感染对牙本质基质蛋白1表达量无显著性影响,汉滩病毒感染后加入肿瘤坏死因子-α使牙本质基质蛋白1表达量显著性增加(P<0.05)。单纯汉滩病毒感染后,通透性无显著性变化(P>0.05),而感染细胞加入外源性肿瘤坏死因子-α或牙本质基质蛋白1后,内皮细胞通透性显著增加(P<0.05),两者联合作用能促进通透性进一步增加(P<0.05)。结论牙本质基质蛋白1广泛表达在血管内皮细胞,肿瘤坏死因子-α和牙本质基质蛋白1均可使汉滩病毒感染的脐静脉内皮细胞通透性显著增高,且两者存在联合作用。
肾综合征出血热;transw ell单层细胞模型系统;通透性
肾综合征出血热(hemorrhagic fever renal syndrome,HFRS)是一种以发热、出血和急性肾功能损害为主要特征的急性传染病,汉坦病毒(Hantavirus,HV)是HFRS的病原体,目前已经确认的汉坦病毒有23种,在我国流行的主要为汉滩型(hantaan virus,HTNV)[1-2]。HFRS的具体机制尚未阐明,但是HFRS发病过程中存在的免疫病理损伤已被公认,其基本病变是血管内皮细胞损伤和渗透性增加导致的有效血容量下降,研究表明HFRS血管内皮损伤的机制可能为病毒感染的免疫细胞释放的细胞因子作用:如病毒感染的单核/巨噬细胞释放的肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)在病程中表达异常并与血管内皮细胞损伤相关,TNF-α在HFRS患者中水平增高,且与疾病的严重程度密切相关,但TNF-α发挥作用的具体机制尚不清楚[3]。
牙本质基质蛋白1(dentin matrix protein 1,DMP1)属于小整合素结合配体N端联接糖蛋白家族(small integrin-binding ligand N-linked glycoprotein family,SIBLING)[4]。最早在牙本质和骨组织中被发现,近期发现DMP1表达广泛,在颌下腺组织和肿瘤组织中均有表达[5-6]。近期研究发现,DMP1可以通过激活其伴侣基质金属蛋白酶-9(matrix metalloproteinase 9,MMP-9)降解基底膜的Ⅳ型胶原和黏着连接的组成成分血管内皮钙黏蛋白(vascular endothelial cadherin,VE-cadherin),该过程可能会导致通透性的增高。而近期有研究显示TNF-α可以促进MMP9的表达[7],因而推测TNF-α和DMP1可能在HFRS患者通透性增高过程中发挥联合作用。
本研究的目的是,通过免疫细胞化学技术检测DMP1在 HTNV感染的脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)的表达情况,以及TNF-α对其表达量的影响。并通过Transwell单层细胞模型系统检测DMP1及TNF-α对HTNV感染的HUVEC通透性的影响。为阐明HFRS发病过程中通透性增高的机制提供实验基础。
1 材料与方法
1.1细胞和病毒
原代HUVEC购自上海澳赛尔斯公司,采用该公司的内皮细胞完全培养基培养,内含内皮基础培养液,10%的胎牛血清和2%的生长因子添加剂(含表皮细胞生长因子、碱性成纤维细胞生长因子、环磷酸腺苷、肝素、醋酸氢化可的松、青霉素、链霉素、两性霉素B溶液等)。细胞培养瓶提前用0.25%的明胶(美国Sigma公司)包被以保证细胞能均匀生长。所有实验均保证细胞控制在p3到p5代内使用。非洲绿猴肾细胞(African green monkey kidney cell,VERO)和汉滩病毒国际标准株HTNV 76-118由第四军医大学唐都医院感染科王平忠教授惠赠。采用免疫荧光化学方法鉴定病毒在细胞的复制情况,并采用Reed-Muench法测定病毒滴度。
1.2间接免疫荧光检测病毒感染情况
VERO细胞在24孔板培养,待细胞融合至50%~60%时弃去培养基,加入HTNV悬液37℃培养2 h后弃去病毒悬液加入新鲜培养基继续培养,病毒感染3 d后采用间接免疫荧光方法进行检测。首先,用4%的多聚甲醛4℃固定20min,然后采用0.5%的TritonX-100室温通透10min,5%的牛血清白蛋白(bovine serum albumin,BSA)封闭30min,然后加入鼠抗人HTNV 1A8抗体(第四军医大学唐都医院感染科王平忠教授惠赠,1∶1 000稀释)4℃过夜。然后加入羊抗鼠异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-免疫球蛋白G(Immunoglobulin G,IgG)(中国北京中杉金桥生物公司)37℃孵育1 h。每一步结束后均用磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗3次,每次5min。最后在荧光显微镜(日本奥林巴斯公司)上观察。
1.3免疫细胞化学法检测DMP1在HUVEC的表达
将HUVEC爬片后用HTNV(感染复数=1)感染,3 d后加入TNF-α刺激30 min,PBS冲洗后加入4%的多聚甲醛4℃固定20min,加入0.5%的TritonX-100室温通透10min,PBS冲洗3×5min,除去PBS,每张玻片加50μl内源性过氧化物酶阻断剂,室温下孵育10min,PBS冲洗3×5min,除去PBS,每张玻片加入50μl二抗动物非免疫血清,室温下孵育15min;甩干玻片上的血清,每张盖玻片上滴加鼠抗人DMP1一抗(美国Santa Cruz公司,1∶100稀释)4℃过夜,PBS冲洗3×5min,除去PBS,每张玻片加50μl生物素标记的羊抗鼠二抗(福州迈新生物技术开发有限公司),37℃放置1 h,PBS冲洗3×5min;除去PBS,每张玻片滴加50μl链霉素抗生物素过氧化物酶溶液,室温下孵育10min,PBS冲洗3×5min;除去PBS,每张玻片滴加一滴新鲜配制的二氨基联苯胺显色液,室温下显色2~10min,在显微镜下控制染色时间;将染色液冲洗干净,干燥后中性树胶封片,将样品置于显微镜下观察。阴性对照组用PBS代替一抗进行反应。图像半定量分析:显微镜观察,每组随机取15个视野,Image-Pro Plus 6.0分析各视野下平均光密度值(average optical density,AOD)。AOD为阳性目标光密度和阳性面积比(IOD/area),代表待测抗原的量。
1.4Transwell单层细胞模型系统检测HUVEC的通透性变化
HUVEC接种于基质胶(10μg/m l)包被的Costar Transwell单层细胞模型系统(孔径3μm),HUVEC生长在内皮细胞完全培养基,细胞密度是3×104个;HTNV感染transwell系统中的HUVEC 3 d后,细胞密度接近100%,长成均匀致密单层,HUVEC在内皮基础培养基中饥饿过夜;FITC标记的葡聚糖(FITC-dextran,0.5mg/m l)加入Transwell的上室,在相应组加入TNF-α(10 ng/ml),DMP1(100 nmol/L),一式3份。反应30min后,从每个transwell的下室吸取100μl样品,样品中葡聚糖的含量在荧光酶标仪(490 nm处激发,530 nm处发射)中检测,以检测样本中的相对荧光强度来反映TNF-α,DMP1与HTNV对HUVEC通透性的影响。
1.5统计学方法
采用SPSS 18.0和GraphPad Prism 5.0统计软件进行数据分析,计量资料用均数±标准差()表示,免疫组织化学AOD值及transwell的相对荧光强度分别用单因素方差分析(one way-ANOVA),两两比较采用LSD检验,P<0.05表示差异有统计学意义。
2 结果
2.1VERO细胞及原代脐静脉内皮细胞生长状态良好(见图1)
2.2HTNV感染的VERO和HUVEC鉴定及病毒滴度测定
HTNV感染72 h后几乎所有的VERO细胞均被感染,HUVEC在HTNV感染72 h后也被感染,阴性对照组均无荧光。Reed-Muench法测定病毒的TCID 50为6.31×106/ml。
2.3DMP1在HUVEC的表达情况
免疫细胞化学检测显示DMP1可以表达在HUVEC;HTNV感染可以导致其表达的轻微上升;感染细胞加入TNF-α后DMP1的表达量显著升高(P=0.009);单独TNF-α刺激对DMP1的表达量无显著性影响,见图2和表1。
2.4DMP1、TNF-α对HTNV感染的HUVEC的通透性影响
DMP1和TNF-α均可显著提高HTNV感染的HUVEC的通透性(见图3A,3B),且两者联合作用后,感染HUVEC的通透性进一步增加,与单独作用比较差异有统计学意义(见图3C,3D)。而DMP1,TNF-α单独作用对于通透性的影响明显低于HTNV感染组(见图3A,3B)。如表2所示,HTNV单独作用并不能提高HUVEC的通透性。
图1 细胞培养结果
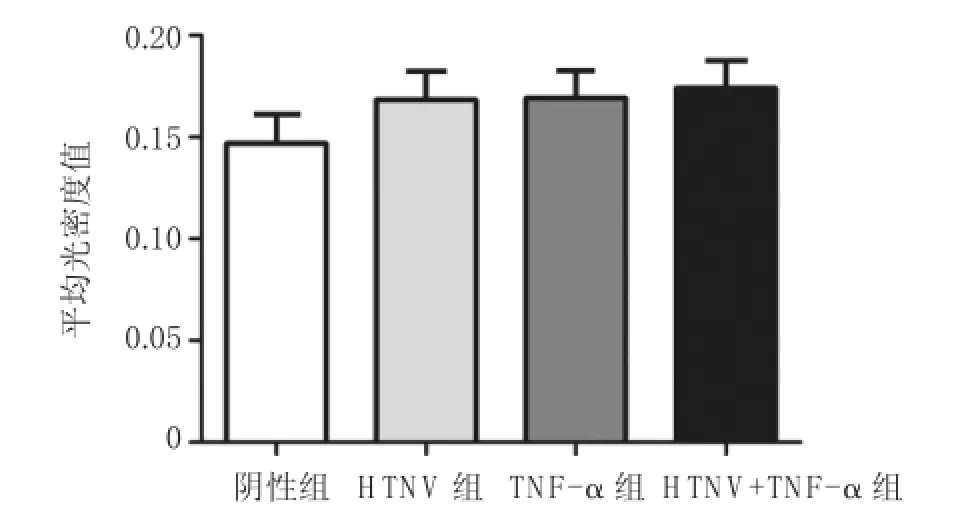
图2 DMP1在HUVEC的表达变化
表1 各组DMP1表达变化 ()

表1 各组DMP1表达变化 ()
组别TNF-α(+)HTNV(-) 0.147±0.019 0.169±0.018 HTNV(+) 0.168±0.014 0.174±0.014 TNF-α(-)
表2 各组通透性变化情况 ()
表2 各组通透性变化情况 ()
组别DMP1+TNF-α HTNV(-) 573±60 713±78 759±162 735±78 HTNV(+) 557±76 1113±254 985±149 1426±283空白组TNF-α DMP1
确定DMP1可以表达在HTNV感染的HUVEC后,笔者进一步检测DMP1和TNF-α对HTNV感染的HUVEC通透性的影响。结果显示,DMP1和TNF-α均可显著提高HTNV感染的HUVEC的通透性(P=0.000),且两者联合作用后感染HUVEC的通透性进一步增加,与单独作用比较差异有统计学意义(与HTNV+TNF-α组比较,P=0.002,与HTNV+DMP1组比较,P=0.000)。而DMP1,TNF-α单独作用对于通透性的影响远远低于HTNV感染组分别为(P=0.033和0.000)。HTNV单独作用并不能提高HUVEC的通透性。见图3和表2。
图3 Transwell技术检测HUVEC的通透性
3 讨论
HTNV的主要靶细胞是血管内皮细胞和单核巨噬细胞,在病毒侵入人体后不久,机体产生细胞和体液免疫应答,参与HFRS的发病过程。TNF-α是主要由单核巨噬细胞和血管内皮细胞等产生的一种调节机体免疫和代谢过程的多功能细胞因子,是机体免疫防御、炎症损伤和休克等发生的重要介质。TNF-α在体内维持一定浓度对机体发挥生理功能有重要作用,但血中浓度过高,则可能会对机体造成损害,已有研究证实,HFRS患者中的TNF-α的水平增高且与疾病进程密切相关[3]。HFRS基本的病理生理改变为全身微血管损伤,通透性增加,而TNF-α又可进一步增加血管的通透性。然而TNF-α引起通透性增高的具体机制鲜有报道。
DMP1是一种非胶原蛋白,近年来发现其表达十分广泛,在肾、脑、肿瘤组织等均有表达[8]。有研究证实,DMP1能通过激活其伴侣MMP9降解基底膜的IV胶原等成分,基底膜是一种特化的细胞外基质,是细胞间物质转移的物理屏障[9]。本文证实,DMP1可以表达在HTNV感染的血管内皮细胞,这说明DMP1可能在HFRS的发病中扮演一定角色。HTNV单独作用于HUVEC并不能引起通透性增高,病毒感染细胞加入TNF-α之后,DMP1的表达量显著增加。DMP1可以活化重组人基质金属蛋白酶前体-9并增强MMP-9酶解活性,通过破坏局部组织结构降解基底膜屏障,改建细胞外基质,使通透性增加[9]。故笔者推测在HFRS的发病过程中,TNF-α通过促进DMP1表达增加促使通透性增高。
进一步的实验证实,DMP1和TNF-α均可使体外HTNV感染的单层血管内皮细胞的通透性增加,且两者联合作用对通透性的增高作用明显高于各自独立作用,差异有统计学意义。TNF-α可以促进血管内皮钙黏蛋白VE-cadherin的磷酸化、内化,并可以促进血管内皮生长因子VEGF和MMP-9的表达[10]。血管内皮钙黏蛋白是内皮细胞间黏着连接的主要成分[11],钙黏蛋白的内化会导致黏着连接的解体,细胞间隙增大,这可能是TNF-α引起通透性增高的一方面原因。另一方面,TNF-α可以促进MMP-9的表达[10],而DMP1可以激活MMP-9,两者可能联合参与了降解基底膜的过程从而使通透性大大增加,实验结果中DMP1和TNF-α的共同作用使HTNV感染的HUVEC通透性增加明显,显著高于单独作用组,也支持这一推断。
综上所述,本文通过免疫细胞化学技术实验证明DMP1可以表达在HTNV感染的HUVEC,且进一步实验证明TNF-α和DMP1在可以促进HTNV感染的血管内皮细胞通透性增加,且两者存在联合作用,该结果为阐明TNF-α引起通透性增高的机制提供实验数据支持,MMP-9在HFRS中的直接作用将在接下来的实验中进行研究。
[1]姜东伯,孙元杰,董忱,等,国际汉坦病毒研究进展-第9届肾综合征出血热、汉坦病毒肺综合征及汉坦病毒国际会议概况[J].细胞与分子免疫学杂志,2013,(10):1-3.
[2]于蒙蒙.汉坦病毒感染THP-1细胞激活炎症小体通路及其分子机制的初步研究[D].陕西:第四军医大学,2013.
[3]DONG Y,SHI D,LI M,et al.Elevated serum levels of decoy receptor 3 are associated with disease severity in patients with hemorrhagic fever with renal syndrome[J].Intern Emerg Med,2015,10(5):567-573.
[4]杨晓娟,王文瑞.我国肾综合征出血热研究进展[J].世界最新医学信息文摘,2014,14(7):50-51.
[5]LI C,XIE X,WANG X,et al.Differential expression and localization of dentin matrix protein 1(DMP1)fragments in mouse submandibular glands[J].JMol Histol,2013,44(2):231-239.
[6]陈慧鲜,裴路.牙本质基质蛋白-1的研究近况 [J].口腔医学,2014,34(2):141-143.
[7]WANG J H,SU F,WANG S,et al.CXCR6 deficiency attenuates pressure overload-induced monocytes migration and cardiac fibrosis through downregulating TNF-alpha-dependent MMP9 pathway[J].Int JClin Exp Pathol,2014,7(10):6514-6523.
[8]占柳,谢淑娟,潘卫红.牙本质基质蛋白-1及其特异性表达的研究进展[J].现代口腔医学杂志,2013,27(1):55-58.
[9]AKDENIZ O,AKDUMAN D,HAKSEVER M,et al.Relationships between clinical behavior of laryngeal squamous cell carcinomas and expression of VEGF,MMP-9 and E-Cadherin[J]. Asian Pacific Journal of Cancer Prevention,2013,14(9): 5301-5310.
[10]JAYASOORIYA R G,DILSHARA M G,PARK S R,et al.18 beta-Glycyrrhetinic acid suppresses TNF-alpha induced matrix metalloproteinase-9 and vascular endothelial growth factor by suppressing the Akt-dependent NF-kappa B pathway[J].Toxicol In Vitro,2014,28(5):751-758.
[11]黄达阳,赵鹃.血管内皮钙粘蛋白与血管性疾病的研究进展[J].中国循环杂志,2014,29(2):152-154.
(张蕾编辑)
Function of DMP1 and TNF-αin hemorrhagic fever of renal syndrome*
Dong-sha Shi1,Yan-ying Dong1,Li-hua Zhao2,Ming Xie1
(1.Department of Immunology and Pathogenic Biology,School ofMedicine,Xi'an Jiaotong University,Xi'an,Shaanxi 710061,China;2.Clinical Laboratory,the Second Affiliated Hospital of Xi'an Jiaotong University,Xi'an,Shaanxi710061,China)
Objective To exp lore the mechanism of hyper-permeability in hemorrhagic fever of renal syndrome(HFRS).M ethods Immunocytochemistry was used to detect the production of dentin matrix protein 1(DMP1).The penetrability changes of human umbilical vein endothelial cells were detected by transwell monolayer system. Uninfected vein endothelial cells were used as the negative control in each experiment.Immunofluorescence was used to guarantee that cells were infected by HTNV before each experiment.Results HTNV infection alone did not change the penetrability of vein endothelial cells.but the penetrability elevated remarkably after TNF-αor DMP1 were added,and increased evenmore when both two were added.Conclusions TNF-αand DMP1 can increase the penetrability of HTNV infected endothelial cells,and there were combined effects.They may play a role in the immunopathogenesis of HFRS.
hemorrhagic fever of renal syndrome;transwellmonolayer system;penetrability
R 373.32
A
10.3969/j.issn.1005-8982.2016.12.007
1005-8982(2016)12-0030-05
2015-12-02
陕西省科技计划项目基金资助课题(No:2012SF2-12)

