远红外Hg2+荧光探针的研制及其在生物成像中的应用
吴向阳,朱伯淞,韩志湘,王春柳,梁世伟,陈文卉,崔蕴晗
(江苏大学环境与安全工程学院,江苏 镇江 212013)
远红外Hg2+荧光探针的研制及其在生物成像中的应用
吴向阳,朱伯淞,韩志湘,王春柳,梁世伟,陈文卉,崔蕴晗
(江苏大学环境与安全工程学院,江苏镇江212013)
基于Hg2+诱导罗丹明内硫酯“关-开”环原理,设计合成了一种简便的罗丹明101内硫酯(1)荧光探针分子并用于环境水样中汞离子的定量检测及活细胞内汞离子荧光成像检测.结果表明:在测试体系中加入汞离子,探针分子1(10 μmol/L)溶液荧光显著增强,当加入等当量的汞离子时,溶液的荧光强度增强了68倍,溶液的颜色也从无色变为了粉红色;探针分子1(10 μmol/L)对0.1~10 μmol/L浓度范围内的汞离子响应呈线性关系,R2=0.994 9,检出限为0.04 μmol/L.选择性和竞争性实验结果表明:探针分子1对汞离子有较高的选择性和较高的灵敏度;探针分子1可成功用于细胞内汞离子的荧光成像可视化检测.
远红外;荧光探针;罗丹明101内硫酯;Hg2+;荧光成像;生物成像
汞离子是一类痕量存在即可对人畜造成严重危害的高毒元素,可以造成大脑、神经系统、内分泌系统甚至是肾脏的损伤[1-2].因此,开发一种经济、快速、简便的Hg2+检测方法并应用于环境和生物样品中Hg2+的检测具有重要的意义.与传统技术相比,荧光探针技术具有高灵敏性、高选择性和快速分析的特点,尤其是其可利用荧光成像技术实现生物体内分析物的可视化检测[3-5].
罗丹明类染料因其杰出的光谱性质,如大的摩尔消光系数、高的荧光量子产率、良好的光学稳定性和长波长处的激发和发射,而被广泛应用在激光染料、荧光标记等生物研究中[6-7].更重要的是,具有螺环结构的罗丹明衍生物因在可见光区无激发和发射而具有在生物应用中提供零荧光背景的可能;而其开环结构在大于500 nm处具有很强的吸收和荧光发射[8].自从1997年Czarnik率先利用罗丹明的这种“关-开”环前后光学性质发生显著差异的性质设计出检测Cu2+的荧光探针以来,基于该机理而发展出来的荧光探针方兴未艾[9-12].
利用Hg2+的亲硫性和硫原子的亲核性,罗丹明B内硫酯和罗丹明6G内硫酯及其衍生物被用来检测Hg2+,并表现出很好的选择性和灵敏度[13-15].与罗丹明B和罗丹明6G相比,罗丹明101的最大发射波长达到了远红外区(>600 nm),在此区域可有效避免生物分子体内自身的背景荧光干扰,更适合于生物样品中Hg2+荧光成像检测.目前,仅有几个罗丹明101的Cu2+、Zn2+和HOCl荧光探针报道[16-19],而识别Hg2+的罗丹明101荧光探针未见报道.鉴于此,本文设计、合成了罗丹明101内硫酯(化合物1)并成功用于活细胞内Hg2+荧光成像可视化检测.
1 实验部分
1.1实验试剂与仪器
所用试剂包括:1,2-二氯乙烷、N,N-二甲基甲酰胺(DMF)、乙酸乙酯、二氯甲烷、硫化钠、无水硫酸镁,均为国药集团化学试剂有限公司产品;100-200目柱层析硅胶,青岛海洋化工有限公司产品;无水1,2-二氯乙烷,加入氢化钙回流后蒸馏得到;其它溶剂不经纯化直接使用;实验过程用水均为二次蒸馏水.
所用仪器包括:Lumina型荧光分光光度计,美国Thermo fisher scientific公司产品;UV-2400型紫外-可见分光光度计,日本岛津公司产品;INOVA-400型核磁共振仪,美国Varian公司产品;PB-10型精密pH计,德国Sartorius公司产品;AxioObserverA1型倒置荧光显微镜,德国CarlZeiss公司产品.
1.2罗丹明101内硫酯(化合物1)的合成
化合物1的合成路线如图1所示.在25 mL圆底烧瓶中,将122 mg(0.25 mmol)罗丹明101溶解于5 mL 1,2-二氯乙烷中,逐滴加入0.5 mL三氯氧磷(不少于5min).回流反应4h后,冷却至室温.旋除溶剂,加入3 mL饱和Na2S溶液,室温下搅拌过夜.反应后溶液用乙酸乙酯多次萃取,无水硫酸镁干燥,过滤.旋除溶剂得到的粗产物以硅胶柱柱层析(二氯甲烷为淋洗剂)分离,得到淡黄色固体53 mg,产率为41.9%.

图1 化合物1的合成路线Fig.1 Synthesis routine of compound 1
1.3性能测试与表征
(1)荧光光谱测量:汞离子标准溶液由pH=7.40 Tris-HCl缓冲溶液逐级稀释10 mmol/L HgCl2储备液得到.将1.0 mL 20 μmol/L的探针分子1溶液分别和1.0 mL 0.2~40 μmol/L的汞离子标准溶液混合,此时测试体系中探针分子1的浓度为10 μmol/L,汞离子浓度为0.1~20 μmol/L.使用荧光分光光度计在激发波长为550 nm、激发和发射狭缝宽度均为5 nm的条件下记录565~750 nm范围内上述溶液的荧光发射光谱强度变化.
(2)紫外光谱测量:使用紫外可见分光光度计对(1)中混合溶液在300~660 nm范围内进行波长扫描,得到紫外吸收曲线.
(3)酸碱耐受性实验:分别用pH 3~9的缓冲溶液稀释汞离子储备液至20 μmol/L.将1.0 mL 20 μmol/ L的探针分子1溶液和1.0 mL上述用不同pH值缓冲溶液稀释的汞离子标准溶液混合,测定溶液的荧光强度,得出pH对探针响应的影响曲线.探针分子1自身酸碱耐受性实验中只加入不同pH值的缓冲溶液,不加入汞离子进行测量.
(4)响应时间实验:使用荧光分光光度计,TimeS-can模式下设置激发波长为550 nm,扫描时间间隔为30 s,测定1.0 mL 20 μmol/L探针分子1溶液中加入1.0 mL 20 μmol/L汞离子标准溶液后在发射波长620 nm处荧光强度随时间变化的曲线.
(5)选择性实验:在1.0 mL 20 μmol/L探针分子1溶液中分别加入1.0 mL 20 μmol/L的不同金属离子溶液,测定发射波长为620 nm处的荧光强度.
(6)竞争性实验:在1.0 mL 20 μmol/L探针分子1溶液中加入0.5 mL 40 μmol/L的除汞离子外的金属离子溶液,然后再加入0.5 mL 40 μmol/L的汞离子,测定发射波长为620 nm处的荧光强度.
(7)细胞成像试验:肝癌细胞(Humanhepatoma G2,HepG2)培养借鉴于美国标准菌库ATCCHB-8065,通过含体积分数10%胎牛血清(FBS)的完全培养基进行传代培养.使用倒置荧光显微镜拍摄加入汞离子前后的细胞荧光成像.
2 结果与讨论
2.1化合物1的合成与表征
化合物1由罗丹明101首先在POCl3作用下生成罗丹明101酰氯;然后不经任何处理,直接与硫化钠饱和溶液发生关环反应即可得到.该方法合成步骤简单、目标化合物产率高.其1HNMR、13CNMR及MS表征如下:

2.2光谱性质
图2所示为探针分子1(10 μmol/L)在测试体系中对0,0.1,0.5,1,2,3,4,5,6,7,8,9,10,20 μmol/L Hg2+响应的荧光光谱图.
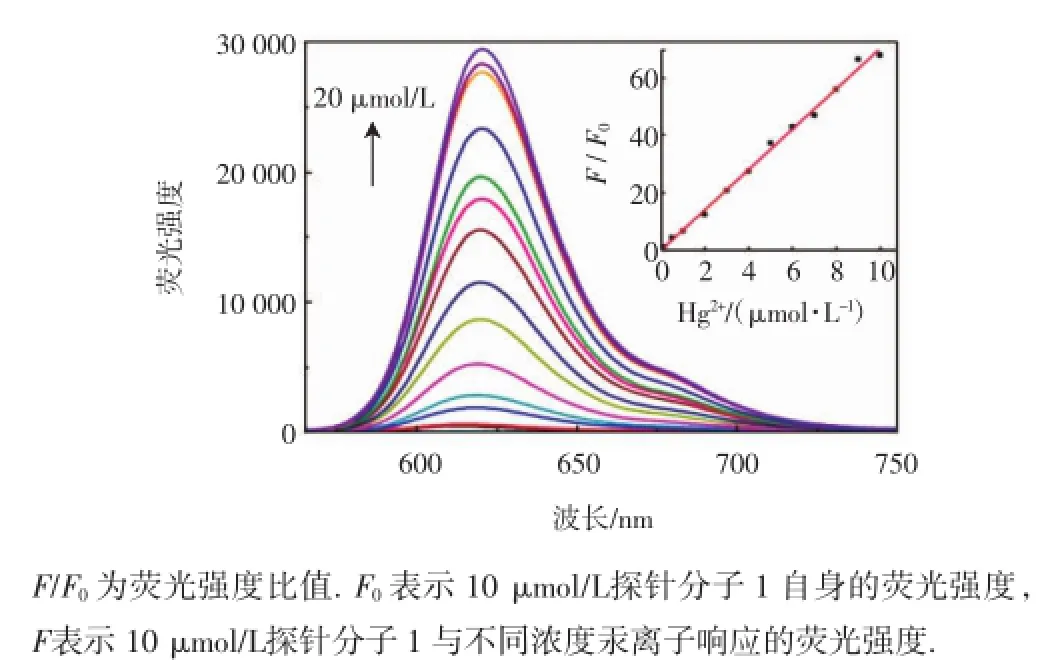
图2 探针分子1对Hg2+响应的荧光光谱Fig.2 Fluorescence spectra of probe 1 response to Hg2+
由图2可知,加入Hg2+之前,测试体系中探针分子1自身荧光强度较弱;加入Hg2+之后,体系随着Hg2+浓度的增加,其荧光强度逐渐增强.这表明Hg2+的加入诱导了探针分子1发生开环反应,从而增大了体系的共轭,使得体系荧光明显增强.当加入等当量的汞离子(10 μmol/L)时,荧光强度增强的倍数达68倍;但继续增加汞离子浓度,荧光增强的数值F/F0上升不明显.探针分子1(10 μmol/L)对0.1~10 μmol/L浓度范围内的汞离子响应呈现出良好的线性关系(R2=0.994 9),检出限为0.04 μmol/L.同时还可观察到溶液荧光发生明显改变,由无荧光变为橘黄色强荧光.
图3所示为探针分子1(10 μmol/L)与0,0.1,0.5,1,2,3,4,5,6,7,8,9,10,20 μmol/L汞离子反应后的紫外-可见吸收光谱图.

图3 探针分子对汞离子响应的紫外光谱Fig.3 UV spectra of probe 1 response to Hg2+
由图3可以看出,探针分子1本身在大于500 nm处几乎无吸收;随着汞离子加入,吸收光谱发生显著的改变,在584 nm处出现一个新的吸收峰且随着汞离子浓度上升逐渐增强,说明探针分子1在Hg2+加入后诱导了罗丹明101内硫酯的开环.同时溶液的颜色由无色变为紫红色.
在测试体系中固定探针分子1和Hg2+的总浓度为20 μmol/L,通过连续改变二者之间的摩尔比,绘出Job’s plot曲线,如图4(a)所示.可以看出,二者之间的摩尔比为0.5时,吸收强度最大,表明汞离子与探针分子1之间的络合比为1∶1.同时,探针分子1与汞离子结合后的产物通过ESI质谱分析得到了一个743.32的质荷比信号,对应于[1+HgCl]+的质荷比.基于以上实验结果,本文提出了探针分子1与汞离子的可能结合模式如图4(b)所示.

图4 探针分子1和Hg2+的Job′s plot曲线及其可能结合方式Fig.4 Job′s plot curve and proposed binding model of probe 1 with Hg2+
2.3pH影响
探针分子的酸碱耐受性是荧光探针性能的一个重要指标.在测试体系中,考察了探针分子1(10 μmol/ L)加汞前后在pH=3~9范围内的荧光性能,结果如图5所示.
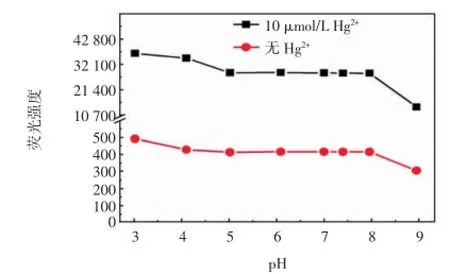
图5 pH对探针响应Hg2+的影响Fig.5 Effect of pH on response to Hg2+of probe 1
由图5可以看出,在620 nm处,探针分子1本身在pH=4~8范围内不受pH影响,而加入10 μmol/L Hg2+后,其在pH=5~8范围内不受pH变化的影响,表明该探针工作pH范围较宽且可以在生理pH范围内检测Hg2+,具有应用在生物系统内的潜力.
2.4响应时间
图6所示为探针分子1对Hg2+的时间响应曲线.

图6 探针分子与Hg2+响应的时间曲线Fig.6 Time dependent fluorescence intensity changes of probe 1 in prescence of Hg2+
由图6可以看出,探针分子1对Hg2+表现出了快速响应的能力(小于30 s),说明探针分子1对汞离子具有极高的灵敏度.
2.5选择性
选择性优劣也是荧光探针很重要的一个指标.固定汞离子和其他金属离子的浓度均为10 μmol/L,分别考察了探针分子1对Hg2+和其他金属离子的响应识别效果,如图7所示.由图7可见,只有加入Hg2+时,探针分子1的荧光强度有显著增强(68倍).Ag+的加入只能引起溶液荧光强度的微弱增强(小于3倍).这表明探针分子1对汞离子具有很好的选择性.
竞争性实验被用于研究探针分子1对汞离子响应的实际应用可能性,结果如图8所示.
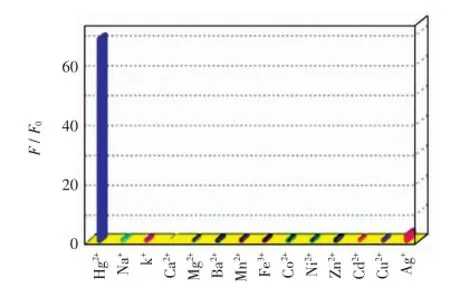
图7 探针分子1对不同金属离子的选择性Fig.7 Fluorescence responses of probe 1 to selected metal ions

图8 探针分子1在不同金属离子存在下对汞离子的响应(竞争性实验)Fig.8 Fluorescence response of probe 1 to Hg2+in prescence of other metal ions(competitive experiments)
由图8可以看出,在10 μmol/L其他金属离子存在的探针分子1(10 μmol/L)溶液中分别加入10 μmol/L Hg2+,均不影响汞离子的检测.以上结果均表明,本文设计的探针分子1对Hg2+具有非常显著的选择性,符合环境和生物中应用的要求.
2.6汞离子的细胞内荧光成像
为进一步研究探针1在生物成像中的应用,对细胞内Hg2+的荧光成像使用倒置显微镜拍照,如图9所示.

图9 HepG2细胞中,探针分子1与汞离子结合前后的成像图Fig.9 Images of Hg2+in HepG2 cells with probe 1
图9(a)为明场观察到的HepG2细胞形态,首先用10 μmol/L探针分子1在37℃孵育30 min,荧光倒置成像显微镜几乎观察不到任何荧光,如图9(b)所示;但当其再与10 μmol/L HgCl2在PBS中孵育30 min后,可以观察到非常强的荧光,如图9(c)所示.从图中可以看出细胞形态完好,表明探针毒性小,对细胞无损伤.这表明荧光探针分子1可以用于活细胞内Hg2+的可视化检测.
3 结论
通过“一锅煮”方法简便合成了罗丹明101内硫酯(探针分子1),并利用核磁共振氢谱(1H NMR)、核磁共振碳谱(13C NMR)和电喷雾离子源质谱(ESI-MS)对其进行了表征,考察了该化合物对汞离子识别的荧光、紫外性质、pH影响、选择性、灵敏度及活细胞内荧光成像,研究表明:
(1)探针分子1对Hg2+响应识别的线性浓度范围宽(0.1~10 μmol/L),检出限低(0.04 μmol/L).
(2)加入Hg2+前后探针分子1溶液颜色变化明显(无色到紫红色),可以实现“裸眼”检测.
(3)探针分子1对Hg2+选择性好、荧光增强倍数大(68倍),响应速度快(小于30 s).
(4)探针分子1与Hg2+结合的化学计量比为1∶1,二者反应后形成了1-HgCl络合物,质谱验证了该结合模式.
(5)探针分子1对Hg2+识别酸碱耐受性强(pH为5~8),应用前景好.
(6)结合荧光成像技术,探针分子1可用于肝癌细胞中Hg2+可视化检测.
[1]CLARKSON T W,MAGOS L,MYERS G J.The toxicology of mercury-current exposures and clinical manifestations[J].New Engl Med,2003,349:1731-1737.
[2]EMSLEY J.In Nature′s Building Blocks:An A-Z Guide to The Elements[M].Oxford:Oxford University Press,2001.
[3]NOLAN E M,LIPPARD S J.Tools and tactics for the optical detection of mercuric ion[J].Chem Rev,2008,108:3443-3480.
[4]MAHATO P,SAHA S,DAS P,et al.An overview of the recent developments on Hg2+recognition[J].RSC Adv,2014,4 (68):36140-36174.
[5]SRIVASTAVA P,RAZI S S,ALI R,et al.Selective nakedeye detection of Hg2+through an efficient turn-on photo induced electron transfer fluorescent probe and its real applications[J].Anal Chem,2014,86:8693-8699.
[6]ZOLLINGER H.Color Chemistry:Syntheses,Properties,and Applications of Organic Dyes and Pigments[M].2nded.VCH:Wein-heim,1991.
[7] HAUGLAND R P.Handbook of Fluorescent Probes and Research Chemicals[M].9th ed.Eugene:Molecular Probes,2002.
[8]DUJOLS V,FORD F,CZARNIK A W.Long-wavelength fluorescent chemodosimeter selective for Cu(II)ion inwater[J].Am Chem Soc,1997,119:7386-7387.
[9] CHEN X Q,PRADHAN T,WANG F,et al.Fluorescent chemosensors based on spiroring-opening of xanthenes and relatedderivatives[J].Chem Rev,2012,112:1910-1956.
[10]HAN Z X,ZHU B S,WU T L,et al.A fluorescent probe for Hg2+sensing in solutions and living cells with a wide working pH range[J].Chin Chem,Lett,2014,25:73-76.
[11]YANG X H,LI S,TANG Z S,et al.A simple,water-soluble,Fe3+-selective fluorescent probe and its application in bioimaging[J].Chin Chem,Lett,2015,26:129-132.
[12]ZHOU L Y,WANG Q Q,ZHANG X B,et al.Through-bond energy transfer-based ratiometric two-photon probe for fluorescent imaging of Pd2+ions in living cells and tissues[J].Anal Chem,2015,87:4503-4507.
[13]SHI W,MA H M.Rhodamine B thiolactone:A simple chemosensor for Hg2+in aqueous media[J].Chem Commun,2008,16:1856-1858.
[14]ZHAN X Q,QIAN Z H,ZHENG H,et al.Rhodamine thiospirolactone:Highly selective and sensitive reversible sensing of Hg(II)[J].Chem Commun,2008,16:1859-1861.
[15]CHEN X Q,NAM S W,JOU M J,et al.Hg2+selective fluorescent and colorimetric sensor:Its crystal structure and application to bioimaging[J].Org Lett,2008,10:5235-5238.
[16]SASAKI H,HANAOKA K,URANO Y,et al.Design and synthesis of anovel fluorescence probe for Zn2+based on the spirolactam ring-opening process of rhodamine derivatives[J]. Bioorg Med Chem,2011,19:1072-1078.
[17]XIE P H,GUO F Q,LI D,et al.A Cu2+chemodosimeter based on amplified fluorescence in the red region[J].Lumin,2011,131:104-108.
[18]SREENATH K,CLARK R J,ZHU L.Tricolor emission of a fluorescent heteroditopic ligand over a concentration gradient of zinc(ii)ions[J].Org Chem,2012,77:8268-8279.
[19]CHEN X Q,LEE K A,HA E M,et al.A specific and sensitive method for detection of hypochlorous acid for the imaging ofmicrobe-inducedHOClproduction[J].Chem Commun,2011,15:4373-4375.
Preparation of far-red fluorescence probe for Hg2+and its application to bioimaging
WU Xiang-yang,ZHU Bo-song,HAN Zhi-xiang,WANG Chun-liu,LIANG Shi-wei,CHEN Wen-hui,CUI Yun-han
(School of Environment and Safety Engineering,Jiangsu University,Zhenjiang 212013,Jiangsu Province,China)
A facile probe 1(rhodamine 101 thiolactone)was synthesized,and applied to quantitatively detect the level of Hg2+in aqueous media and visualize its distribution in living cells via Hg2+-induced thiospirolactone ring-opening mechanism.The results show that probe 1 shows significant fluorescence enhancement,and reaches almost 68-fold when 1.0 equiv Hg2+was added to the test solution.In the meanwhile,the color of the test solution changes from colorless to pink.The proposed probe can be applied to monitor the level of Hg2+with a linear range covering from 0.1 to 10 μmol/L(R2=0.994 9)and the detection limit is 0.04 μmol/L.Selective and competitive experiments both suggested that probe 1 can detect Hg2+with high selectivity and sensitivity in comparison with other cations.Finally,the probe was successfully employed to visually detect Hg2+in living cells with the aids of fluorescent imaging technique.
far-red;fluorescent probe;rhodamine 101 thiolactone;Hg2+;fluorescent imaging;bioimaging
X820
A
1671-024(2016)04-0034-05
10.3969/j.issn.1671-024x.2016.04.005

