一株荧蒽降解菌Rhodococcus erythropolis PJR1的筛选、鉴定及降解特性研究
靳竞男,刘文娟,刘建丽,姚 俊
(北京科技大学土木与环境工程学院,北京 100083)
一株荧蒽降解菌Rhodococcus erythropolis PJR1的筛选、鉴定及降解特性研究
靳竞男,刘文娟,刘建丽,姚俊
(北京科技大学土木与环境工程学院,北京 100083)
采用富集培养方法从大港油田原油样品中筛选到一株荧蒽降解菌,对其降解特性进行了研究。通过16S rDNA序列比对,鉴定该菌株为Rhodococcus属红串红球菌(Rhodococcuserythropolis),并命名为PJR1。菌株PJR1对荧蒽的降解速率与其生长活性呈正相关:在第5~20 d,菌株PJR1对荧蒽的降解速率随其生长活性的增强而不断加快;20 d后,则随其生长活性的减弱而减慢;30 d完成降解,降解率达到76.18%。GC-MS分析表明荧蒽代谢产物为9-芴酮、邻苯二甲酸和苯甲酸。为进一步探讨荧蒽在Rhodococcus属中的代谢路径及机制奠定了基础。
生物降解;荧蒽;红球菌属;降解特性
多环芳烃(polycyclicaromatichydrocarbons,PAHs)是含有2个以上芳香环的有机类环境污染物质,主要来源于石油、煤炭和固体废弃物等含碳化合物在高温下的不完全燃烧[1-2]。美国环境保护署已经将16类PAHs认定为优先控制的环境污染物[3]。由于PAHs对人类具有潜在的毒性、致癌性和致突变性,已引起研究者的广泛关注。化学结构的复杂性和高疏水性导致PAHs在环境中的残留时间较长,并且难以去除[4]。荧蒽是一种具有4个稠合芳香环的高分子量PAHs,其化学结构与其它致癌性的高分子量PAHs具有一定的相似性。因此,它通常被作为模式化合物来研究高分子量PAHs的降解机制及毒理学性质[5]。
生物修复是利用微生物代谢多样性的特点来达到去除污染物的目的[6],是一种生态友好、低成本的污染治理技术。作者通过生物富集培养方法从大港油田原油样品中筛选到1株高效降解荧蒽的菌株,并对其代谢产物进行定性研究,对荧蒽在该菌株作用下的代谢路径进行探讨,拟为荧蒽的微生物降解机制研究提供有效的科学依据。
1 实验
1.1材料与培养基
原油样品取自大港油田港西43-3-3#油井。
无机盐液体培养基(1L):0.50gKH2PO4,1.26gNa2HPO4·12H2O,3.00g(NH4)2SO4,0.54gMgSO4·7H2O,0.15mgMnSO4·H2O,0.50mgFeCl3·6H2O,0.24mgZnSO4·7H2O,3.66mgCoCl2·6H2O,0.30mgFeSO4·7H2O。在121 ℃高温灭菌30min。
无机盐固体培养基:在无机盐液体培养基中添加1.6%的琼脂。
1.2菌株的富集培养与分离
将5%的原油样品添加到含有1g·L-1荧蒽的100mL无机盐液体培养基中,于30 ℃、150r·min-1振荡培养10d,富集培养3次。将溶于乙酸乙酯的荧蒽溶液涂布于无机盐固体培养基上,然后接种上述培养液,30 ℃恒温培养10d,至单菌落形成。挑取边缘整齐生长迅速的单菌落于无机盐液体培养基中复筛,重复3次,得到单一的目的菌株[7]。
1.3菌株的鉴定
取2mL培养至对数期的菌液,于10 000r·min-1离心1min,弃上清液,收集菌体。通过细菌基因组DNA提取试剂盒(美国Omega公司)提取总DNA。利用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACCTTGTTACGACTT-3′)进行PCR扩增。反应总体系25μL:2×TaqMasterMix12.50μL,正向和反向引物各1.00μL,总DNA0.50μL,ddH2O10.00μL。PCR扩增程序:94 ℃预变性1min;94 ℃变性1min,54 ℃退火1min,72 ℃延伸1min,循环30次;72 ℃延伸10min。PCR产物经纯化后用琼脂糖凝胶电泳进行检测。
菌株16SrDNA序列的测定由上海生工生物工程股份有限公司完成。采用BLAST程序与GenBank数据库中的同属已知序列的核苷酸序列进行比对,通过MEGA5.0中的Neighbor-Joining模型构建系统发育树,对该菌株进行鉴定。
1.4菌株对荧蒽的降解特性研究
1.4.1荧蒽降解率的测定
在100 mL无机盐液体培养基中加入100 mg·L-1荧蒽,随后加入1 mL菌悬液(OD600=0.20),30 ℃培养30 d。每5 d取样测定培养液中荧蒽的残留量,计算荧蒽降解率,考察菌株对荧蒽的降解特性。以加入热灭活菌悬液的样品作为对照。每个样品设3个重复。
1.4.2荧蒽代谢产物的GC-MS分析
取5 mL培养液,加入15 mL乙酸乙酯提取3次,合并提取液。用无水Na2SO4填充柱去除提取液中残留的水分,再通过旋转蒸发仪将提取液浓缩至2 mL,用QP2010SE型GC-MS(日本岛津公司)分析荧蒽代谢产物[7]。
GC-MS条件:HP-5色谱柱(30.00 m×0.32 mm,0.25 μm),以氦气作为载气(40 cm3·s-1);柱温在60 ℃保持1 min,然后以10 ℃·min-1的速度升温至320 ℃,保持10 min;质谱设置为电子轰击模式,电离能为70 eV,离子源温度为230 ℃。
2 结果与讨论
2.1菌株的鉴定
以荧蒽作为唯一碳源和能源,通过富集培养,分离筛选到一株能够有效降解荧蒽的菌株。通过16S rDNA基因序列的测定,最终得到1 426 bp的部分保守核苷酸序列。BLAST比对结果表明,该菌株的16S rDNA序列与Rhodococcus属的细菌具有高度同源性,其中与Rhodococcuserythropolisstrain BZ4的同源性高达99%。采用Neighbor-Joining模型构建系统发育树,Bootstrap值为1 000,并用Bootstrap对进化树的可信度进行检验,进一步确定该菌株的分类学地位(图1),最终将该菌株鉴定为红串红球菌(Rhodococcuserythropolis),命名为PJR1。该菌株的16S rDNA基因序列已保存在GenBank数据库中,编号KP257578。根据《伯杰氏系统细菌学手册》,红串红球菌是介于Nocardiaceae科和 Rhodococcus科之间的一类微生物,属于革兰氏阳性菌,菌落为乳白色,隆起,边缘完整,表面光滑,不透明,好氧,化能异养。这一结果也得到了本实验的验证。

图1荧蒽降解菌RhodococcuserythropolisPJR1的系统发育树
Fig.1Phylogenetic tree of fluoranthene-degrading strainRhodococcuserythropolisPJR1
2.2菌株PJR1对荧蒽的降解特性
菌株PJR1的生长曲线及其对荧蒽的降解率如图2所示。
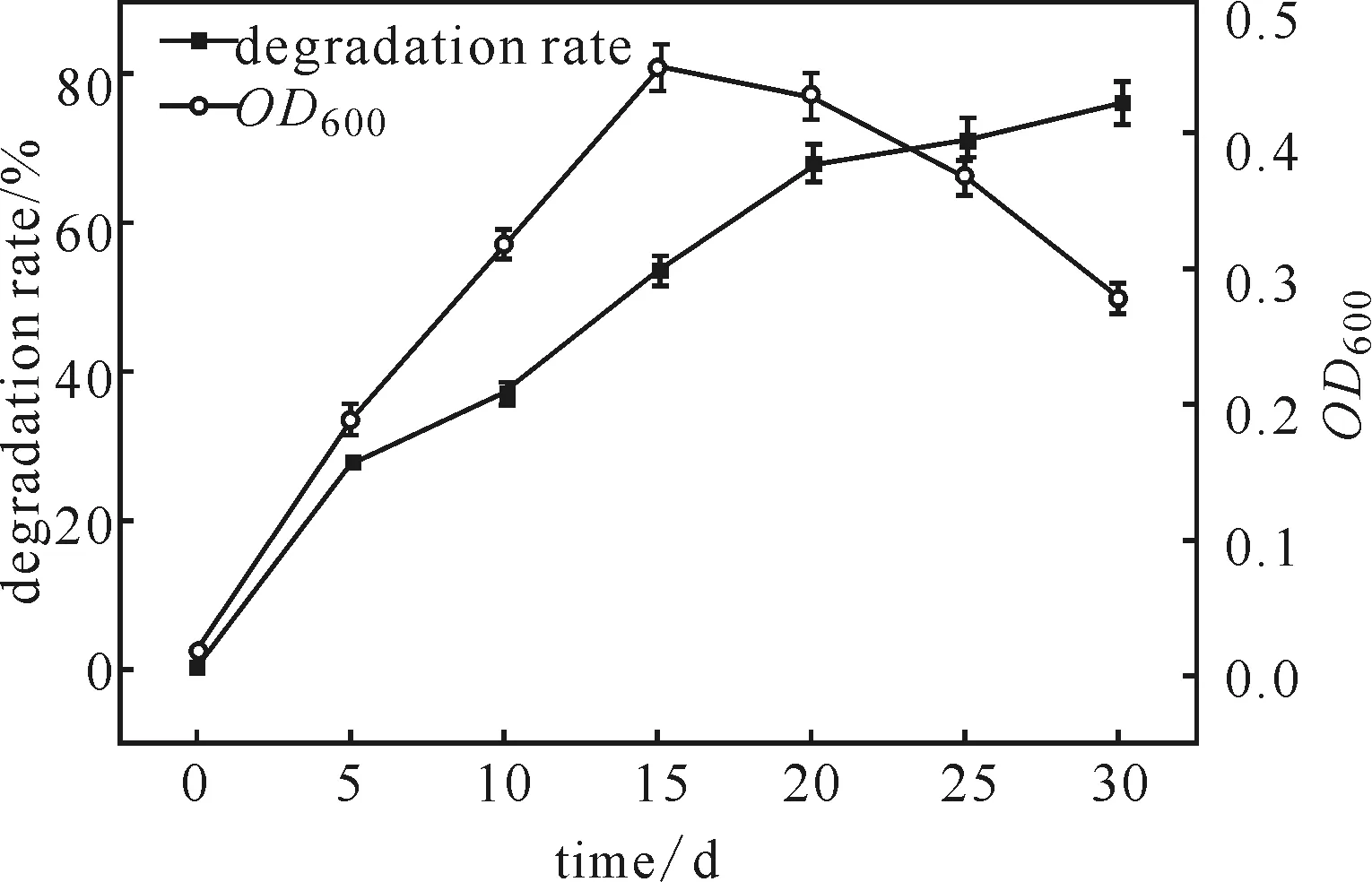
图2 菌株PJR1的生长曲线及其对荧蒽的降解率
由图2可以看出,降解初始,细菌的生长活性与荧蒽的降解率呈正相关,呈现出快速上升的趋势;在第5~20 d,降解速率较快,降解率为27.58%~68.08%;但随着培养时间的延长,细菌生长活性下降,菌株PJR1对荧蒽的降解速率减缓;第30 d时,降解率达到76.18%。表明菌株PJR1对荧蒽具有良好的降解能力。
2.3荧蒽代谢产物分析
对培养液进行GC-MS分析,共检测到3种荧蒽代谢产物:9-芴酮、邻苯二甲酸和苯甲酸,具体的保留时间(tR)和碎片离子的m/z见表1。
表1荧蒽及其代谢产物的保留时间(tR)和碎片离子的m/z
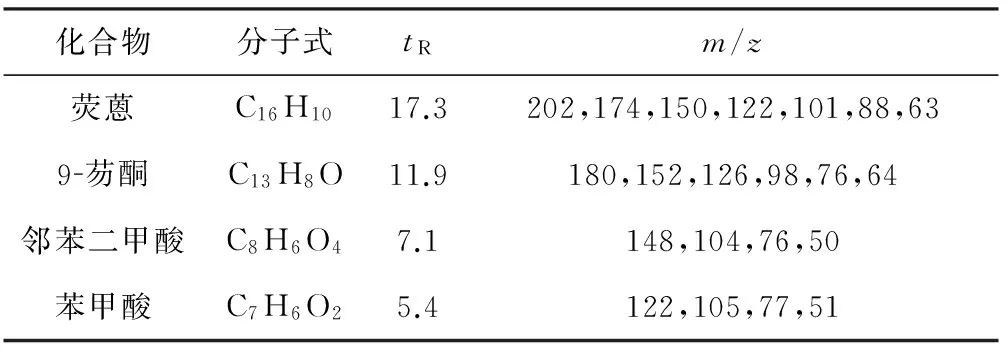
Tab.1 Retention time(tR) and m/z of fragment ions of fluoranthene and its metabolites
Kelley等研究表明,荧蒽的降解起始于荧蒽芳香环上C1-C2原子的双羟基化反应,形成中间体1,2-二羟基荧蒽;在微生物各种氧化还原酶的作用下,中间体9-芴酮-1-甲酸形成并发生脱羧反应,生成9-芴酮[8-9];随之9-芴酮作为代谢中间体经过与芴和萘相同的代谢路径,其邻位碳原子发生双氧化反应,形成中间体邻苯二甲酸[10-11],邻苯二甲酸进一步脱羧形成苯甲酸[12]。
菌株PJR1在降解荧蒽的过程中,通过一系列的氧化还原反应形成中间体9-芴酮,之后通过邻苯二甲酸代谢路径进一步降解,生成无毒或毒性更低的小分子物质,最终通过三羧酸循环生成二氧化碳和水,如图3所示。
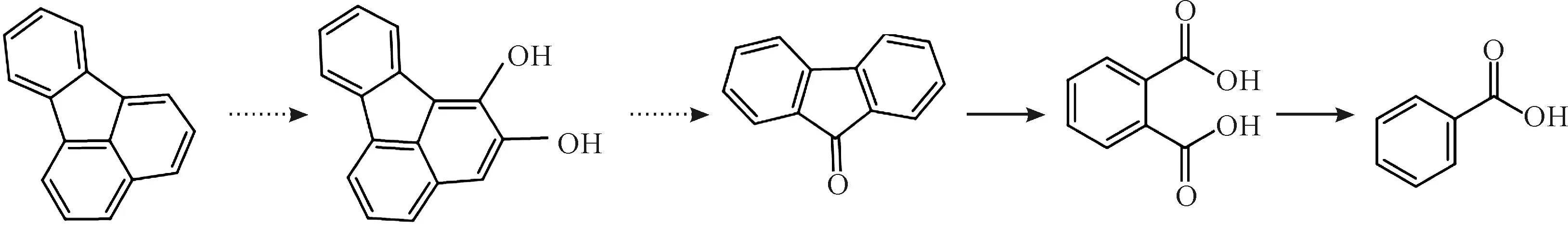
图3 荧蒽在菌株PJR1中的代谢路径
3 结论
从大港油田原油样品中筛选到一株荧蒽高效降解菌。通过16S rDNA序列比对,鉴定该菌株属于Rhodococcus属红串红球菌(Rhodococcuserythropolis),命名为PJR1。菌株PJR1对荧蒽的降解速率与细菌生长活性呈正相关,30 d的降解率达到76.18%。GC-MS检测到3种荧蒽代谢产物,分别是9-芴酮、邻苯二甲酸和苯甲酸,由此得出,邻苯二甲酸代谢路径参与了菌株PJR1对荧蒽的降解过程。为进一步研究荧蒽在Rhodococcus属细菌中的降解机理奠定了理论基础。
[1]GAN S,LAU E V,NG H K.Remediation of soils contaminated with polycyclic aromatic hydrocarbons(PAHs)[J].Journal of Hazardous Materials,2009,172(2):532-549.
[2]VILA J,LOPEZ Z,SABATE J,et al.Identification of a novel metabolite in the degradation of pyrene byMycobacteriumsp.strain AP1:actions of the isolate on two- and three-ring polycyclic aromatic hydrocarbons[J].Applied and Environmental Microbiology,2001,67(12):5497-5505.
[3]HAN X M,LIU Y R,ZHENG Y M,et al.Response of bacterialpdo1,nah,andC12Ogenes to aged soil PAH pollution in a coke factory area[J].Environmental Science and Pollution Research,2014,21(16):9754-9763.
[4]DAILIANIS S,TSARPALI V,MELAS K,et al.Aqueous phenanthrene toxicity after high-frequency ultrasound degradation[J].Aquatic Toxicology,2014,147:32-40.
[5]CAO J,LAI Q,YUAN J,et al.Genomic and metabolic analysis of fluoranthene degradation pathway inCeleribacterindicusP73T[J].Scientific Reports,2015,5:7741.
[6]SHENG X F,HE L Y,ZHOU L,et al.Characterization ofMicro-
bacteriumsp.F10a and its role in polycyclic aromatic hydrocarbon removal in low-temperature soil[J].Canadian Journal of Microbiology,2009,55(5):529-535.
[7]JIN J N,YAO J,ZHANG Q Y,et al.An integrated approach of bioassay and molecular docking to study the dihydroxylation mechanism of pyrene by naphthalene dioxygenase inRhodococcussp.ustb-1[J].Chemosphere,2015,128:307-313.
[8]KELLEY I,FREEMAN J P,EVANS F E,et al.Identification of metabolites from the degradation of fluoranthene byMycobacteriumsp.strain PYR-1[J].Applied and Environmental Microbiology,1993,59(3):800-806.
[9]SEO J S,KEUM Y S,LI Q X.Bacterial degradation of aromatic compounds[J].International Journal of Environmental Research and Public Health,2009,6(1):278-309.
[10]BOLDRIN B,TIEHM A,FRITZSCHE C.Degradation of phenanthrene,fluorene,fluoranthene,and pyrene by aMycobacteriumsp.[J].Applied and Environmental Microbiology,1993,59(6):1927-1930.
[11]GRIFOLL M,SELIFONOV S A,CHAPMAN P J.Transformation of substituted fluorenes and fluorene analogs byPseudomonassp.strain F274[J].Applied and Environmental Microbiology,1995,61(9):3490-3493.
[12]MA J,XU L,JIA L Y.Characterization of pyrene degradation byPseudomonassp.strain Jpyr-1 isolated from active sewage sludge[J].Bioresource Technology,2013,140:15-21.
Screening,Identification and Degradation Properties of a Fluoranthene-Degrading StrainRhodococcuserythropolisPJR1
JIN Jing-nan,LIU Wen-juan,LIU Jian-li,YAO Jun
(SchoolofCivilandEnvironmentalEngineering,UniversityofScienceandTechnologyBeijing,Beijing100083,China)
Afluoranthene-degradingstrainwasisolatedfromcrudeoilinDagangOilfieldbyenrichmentculture,anditsdegradationpropertieswerestudied.Basedonthesequencealignmentof16SrDNA,itwasidentifiedasRhodococcus erythropoliswhichbelongedtoRhodococcusandnamedasPJR1.ThedegradationspeedofstrainPJR1waspositivecorrelationwithitsgrowthactivity.Duringtheperiodof5~20dculture,thedegradationspeedofstrainPJR1increasedwiththeimprovementofgrowthactivity,20dlater,bothofthedegradationspeedandgrowthactivitydecreased.Finally,thedegradationcompletedin30dwithdegradationrateof76.18%.GC-MSAnalysisshowedthat,metabolitesoffluoranthenewere9-fluorenone,phthalicacidandbenzoicacid.ThisstudyprovidesatheoreticalbasisforthefurtherresearchofmetabolicrouteandmechanismoffluorantheneinRhodococcus.
biodegradation;fluoranthene;Rhodococcus;degradationproperty
10.3969/j.issn.1672-5425.2016.08.008
国家自然科学基金杰出青年科学基金资助项目(41273092)
2016-03-09
靳竞男(1986-),女,河南焦作人,博士研究生,研究方向:有机污染物的生物修复,E-mail:jinjingnan2010@163.com;通讯作者:姚俊,教授,E-mail:yaojun@163.com。
Q 939.9
A
1672-5425(2016)08-0035-04
靳竞男,刘文娟,刘建丽,等.一株荧蒽降解菌RhodococcuserythropolisPJR1的筛选、鉴定及降解特性研究[J].化学与生物工程,2016,33(8):35-38.

