上转换发光纳米技术在食品安全检测中的应用研究进展
梁紫璐,毕水莲,黄琬淳(.广东药学院公共卫生学院,广东 广州 5030;.广东药学院 食品科学学院,广东 中山58458)
上转换发光纳米技术在食品安全检测中的应用研究进展
梁紫璐1,毕水莲2,黄琬淳2
(1.广东药学院公共卫生学院,广东 广州 510310;2.广东药学院 食品科学学院,广东 中山528458)
上转换发光纳米技术由于其具有灵敏度高、稳定性好、操作简单、不损伤样本且无背景荧光等诸多优点,正成为研究的热点。文章介绍了上转换发光纳米技术的发光材料、发光机制以及在食品安全检测中应用的最新进展。
上转换发光纳米技术;食品安全;检测
食品安全问题是一个全球性话题,它不仅影响着人们的身体健康,甚至也影响着各国的经济和社会发展。近年来,国内外有关食品安全恶性事件不断发生,造成了巨大的人员伤亡和经济损失。由此可见,尽早地发现食品存在的安全隐患,做好食品安全的检测工作,对于保障人体健康具有非常重要意义。
在食品安全检测方法方面,较多采用聚合酶链式反应(polymease chain reaction,PCR)、气相色谱-质谱法联用(gas chromatography-mass spectrometry,GC-MS)[1]、高效毛细管电泳法(high performance capillary electrophoresis,HPCE)[2]、固相萃取-高效液相色谱法(solid phase extraction-high performance liquid chromatography,SPEHPLC)[3]等仪器分析检测方法。这些方法要求对检测样本先进行提取、净化、浓缩和衍生化等前处理,而且样品前处理的过程也较为复杂、耗时费力、成本偏高。相对于常用的检测方法,酶联免疫吸附技术(enzyme-linked immu-nosorbent assay,ELISA)[4]以及胶体金免疫层析法(immune colloidal gold technique,GICT)[5]等免疫学快速检测方法,可直接使用稀释样本或提取液来进行检测,因此减少了近70%的工作量。但是,对于某些特殊的检测靶标来说,这些免疫学快速检测方法很难在短时间内迅速圆满完成检测,会出现检测时间过长或者灵敏度不高的情况。然而,运用上转换发光纳米技术(upconversion fluorescence nanoparticles technology,UPNT)可以大幅度地提高特定抗体的检测灵敏度,为食品安全检测提供了新的思路。本文主要介绍上转换发光纳米的发光材料、发光机制以及在食品安全检测中应用的最新进展。
1 上转换发光材料及其特点
在食品安全检测中,经常利用荧光染料与研究对象吸附或共价结合形成化合物,然后通过化合物的荧光特性反映有关研究对象性能的信息。这些结合后的化合物在紫外波段下发生激发光时,有可能会使生物组织及其肽、蛋白质、核酸等产生强烈的背景荧光[5]。但某些荧光素会产生生物学毒性,导致抗原或抗体的灵敏度和选择性下降,影响实际检测效果或严重危害到被检测的生物体[6,7]。
上转换发光材料(up converting phosphor,UCP)是新型的低毒性荧光材料,能够在能量较低的长波辐射激发下,发射出能量较高的短波辐射。而且新型的UCP是采用纳米材料对生物进行标记的,可形成上转换发光纳米颗粒(upconverting nanoparticles,UCNPs)。与有机荧光染料和量子点等发光材料相比,UCNPs具有背景荧光极弱、反斯托克斯效应大、发射带宽窄、不易光漂白[8]、光散射更少和组织穿透力更深[9]等优点。这些优点使得UCNPs可以在单一激发光源的激发下,同时发射出不同颜色的可见光,方便运用于小动物体内或其浅表组织的多色成像[10],也为食品安全检测提供了新的进展方向。
2 上转换发光纳米技术的发光机制
UPNT是基于UCNPs的一种新兴技术,其本质为反斯托克斯发光效应[11]。与斯托克斯定律不同的是,上转换发光是基于双光子或多光子机制,将长波长激发光转换成短波长发射光。UPNT中的反斯托克斯发光过程,必须基于双光子或者多光子效应,实现上转换纳米离子能级之间的跃迁(即上转换纳米离子禁戒的f-f跃迁),确保发光中心的亚稳态拥有较长的能级寿命,从而释放长波长。
一般来说,上转换发光的基本机制分为激发态吸收(excited state absorption,ESA)、能量转移(energy transfer,ET)和光子雪崩(photon avalanche,PA)3个过程,完成上转换荧光过程大致需要6个步骤,分别为光子添加能量转移过程(additionde photonspar transfensd energie,APTE)、激发态吸收(excited state absorption,ESA)、合作敏化(cooperative sensitization,COS)、合作发光过程(cooperative luminescence,COL)、双子光激发过程(two photon absorbed excitation,TPAE)和光子雪崩过程(photon avalanche,PA)[11-13],如图1。
3 UPNT在食品安全检测中的应用
食品安全检测中运用UPNT,必须先对UCNPs进行氨基化、醛基化、羧基化的表面修饰,增强UCNPs在水溶液中的分散性和稳定性,使其易于和生物大分子相结合,便于运用在食品安全检测中。一般会采用溶胶-凝胶法、共沉淀法、微乳液法、微波水热法、水热合成法等方法合成。
目前国内外也逐步将UPNT运用于食品安全领域,主要研究在细菌毒素、真菌毒素、食源微生物、药物残留等食品安全检测方面。
3.1细菌毒素、真菌毒素的检测
3.1.1细菌毒素 细菌可产生内、外毒素,从而引发细菌性食源性疾病。细菌性食源性疾病常造成群发性腹泻、呕吐等,给人们的身体健康带来危害。
吴世嘉[15]建立了基于核酸适配体识别的上转换荧光纳米探针技术检测金黄色葡萄球菌肠毒素B (staphylococcal enterotoxin B,SEB)的方法。该方法灵敏度高,SEB的检出限可达0.3 pg/mL,在0.001~1 ng/ mL浓度范围内呈良好的线性关系,已经成功应用于牛奶样品中SEB的检测分析。汪俊丽[16]釆用水热法合成了上转换纳米颗粒,以硝酸纤维素膜作为载体,建立了毒素的夹心式荧光免疫分析方法。在SEB毒素检测中,检测限最低为0.01 ng/mL。
3.1.2真菌毒素 真菌毒素是真菌所产生的次生代谢产物,它们可通过食品或饲料进入人和动物体内,引起人和动物的急性或慢性毒性,损害机体的肝脏、肾脏、神经组织、造血组织及皮肤组织等。
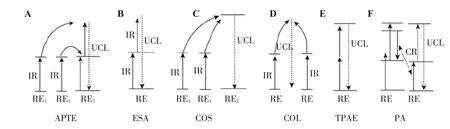
图1 上转换纳米发光机制[14]Figure 1 Mechanism of upconversion nanoparticle photoluminescence[14]
段诺等[17]建立了核酸适配体识别-荧光探针技术检测赭曲霉毒素A(ochratoxin A,OTA)的新方法,引起荧光信号发生变化,从而实现对OTA的定量检测。其检出限为1×10-8g/L,检测线性范围为2.0×10-8~1.0× 10-5g/L,已成功应用于玉米粉中OTA的检测。吴世嘉[15]也通过组装建立基于磁分离富集-核酸适配体识别-上转换荧光纳米探针技术,得出OTA的检出限为1×10-13g/mL,在1×10-13~1×10-9g/mL范围内与荧光值呈线性关系。
吴世嘉[15]在黄曲霉毒素B1(aflatoxin B1,AFB1)检测中,运用水热法和氨基化修饰的纳米颗粒,制备出了anti-AFB1-NaYF4:Yb,Tm的UCNPs和Er UCNPs信号探针。结果发现,AFB1检出限为0.01 ng/mL。Shim等[18]检验玉米样品中的AFB1,采用了化学发光竞争性适配体,将G-四联体-Hemin辣根过氧化物模拟DNA酶与一个特定的AFB1的适体相连接,该实验检出限为0.11 ng/mL。刘晓等[19]采用竞争免疫反应建立了黄曲霉毒素M1(aflatoxin M1,AFM1)上转换发光免疫层析技术,检测奶粉及牛奶中的AFM1。奶粉中的检测下限可达0.1 μg/kg,在0.1~0.7 μg/kg之间具有较好的线性关系,而牛奶中的检测限为0.3 μg/L,在0.3~0.7 μg/L之间具有较好的线性关系。
在伏马菌素B1(Fumonisin B1,FB1)的检测方面,吴世嘉等[20]采用水热法合成了NaYF4:Yb,Ho,建立了上转换纳米颗粒-金纳米颗粒标记分子信标的新型检测技术。结果表明,FB1在0.01~100 ng/mL浓度范围内呈良好的线性关系,检出限达到0.01 ng/mL。於然等[21]在脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)的检测中,制备出了羧基修饰的核壳结构的上转换纳米颗粒NaYF4:Yb,检验的灵敏度为0.7 ng/mL,检测范围为0.7~50.0 ng/mL。
3.2食源性微生物的检测
食源性微生物能够使食物发生腐败变质,并导致食源性疾病的发生,影响人体健康。主要有大肠杆菌(Escherichia coli)、沙门菌(Salmonella)、金黄色葡萄球菌(Staphylococcus aureus)、霍乱弧菌(Vibrio cholera)、副溶血弧菌(Vibrio parahemolyticus)等。
李伟等[22]将上转磷光检测技术和免疫层析技术(双抗体夹心法)结合,建立了快速检测炭疽芽孢的方法。该方法可在30 min内检测面粉、淀粉等材料中掺入的炭疽芽孢,其特异性良好,检测灵敏性为104个芽孢。马小媛等[23]以上转换荧光纳米颗粒为荧光显示探针,结合磁性纳米材料的磁分离富集作用实现了对沙门菌目标DNA的高灵敏检测,检出下限达3 fmol/L,在0.01~10 pmol/L范围内呈现良好的线性关系。段诺等[24]也采建立了基于磁分离富集-核酸适配体识别-上转换荧光纳米探针方法,用于检测鼠伤寒沙门菌(S. typhimurium)、金黄色葡萄球菌。检测限分别为5 CFU/mL和8 CFU/mL,检测线性范围均为101~105CFU/mL。曲勍等[25]成功研制出用于检测动物样品中布鲁氏菌(Brucella)的上转换荧光免疫层析检测技术,检测限为5×106CFU/mL,灵敏度变化范围为2.0×103~3.9×105CFU/mg。
郝民[26]利用UPNT的免疫层析法对水体中霍乱弧菌O1群与霍乱弧菌O139群全菌进行定性和定量检测。检测结果表明,霍乱弧菌O1群与霍乱弧菌O139群的灵敏度分别为 1.69×104CFU/mL、1.24×104CFU/ mL,其线性范围均为105~108CFU/mL。王燕[27]建立基于磁分离富集-上转换荧光材料标记的副溶血性弧菌免疫检测方法。该方法检测的最优反应时间为60 min,检出限为103CFU/mL,在5×103~5×105CFU/mL范围内菌落数与荧光强度呈现良好的线性关系。因此,UPNT在食源性致病菌检测方面的应用仅局限于大肠杆菌、沙门细菌、金黄色色葡萄球菌、霍乱弧菌和副溶血性弧菌等少数几个菌种。
3.3农药和兽药残留的检测
在农作物的生产和禽畜动物类的养殖过程中通常会添加农药和兽药。而农药和兽药经过动植物的代谢后,并不会完全消除,它们会随着自然循环进入到人体内,对人体健康造成影响。长期食用低剂量农药超标的农副产品,可能引起人和动物的慢性中毒,甚至诱发癌症,影响到下一代;而食用大量含高毒、剧毒农药残留的食物会导致人、畜发生急性中毒事故。近年来,UPNT在农药、兽药残留的检测方面仍然处于起步阶段。
方聪聪[28]利用高温热解热法和水热溶剂热法,制备得到了两种不同晶型的UCNPs,分别为NaYF4:Yb,Er与NaYF4:Yb,Tm,采用反相微乳法对所制备的UCNPs进行SiO2包覆,制备了上转换纳米粒子。该方法检测牛奶中土霉素(oxytetracycline),检测限为0.036 ng/mL,浓度在0.05~100 ng/mL范围内。张旋旋[29]利用上转换技术检测蔬菜、果汁与水样中烯啶虫胺(nitenpyram)的残留。运用水热法合成 NaYF4:Er3+,Yb3+(OA-UCNPs),然后通过聚丙烯酸(polyacrylic acid,PAA)在高温下配体交换对OA-UCNPs进行表面羧基修饰与活化,形成水溶性的PAA-UCNPs。该方法检测限为1 ng/mL,线性范围为1~103ng/mL。
王喜亮等[30]采用上转换发光颗粒标记磺胺嘧啶(sulfadiazine,SD)单克隆抗体,利用磺胺嘧啶竞争物包被于硝酸纤维素层析膜上作为捕获试剂,制成免疫层析试纸卡。该免疫层析试纸卡可以在15 min内完成对磺胺嘧啶残留的定量检测。该方法在不同动物源性食品(鸡肉、猪肉、牛奶、虾)的检测范围为0.1~30 ng/ mL。相类似的,李丽波等[31]采用上转换发光颗粒标记恩诺沙星(enrofloxacin,ENR)单克隆抗体,通过恩诺沙星竞争物包被于硝酸纤维素层析膜上作为捕获试剂,制成免疫层析试纸卡。该免疫层析试纸卡可在15 min内完成对恩诺沙星残留的定量检测。该方法检测动物源性食品(猪肉、鸡肉、虾)中恩诺沙星的检测范围为0.5~50 ng/mL。
4 结语
总的来说,在食品安全检测中运用UPNT可以提高检测的灵敏度,得到稳定的实验结果,能更有效、更快速地检测食品中的有害物质。但目前UPNT在食品安全检测中的应用仍处于起步阶段,主要集中在细菌毒素、真菌毒素、食源性微生物和化学残留物质方面的研究,对转基因食品、食品中所含寄生虫等检测的研究则很少。此外,UPNT若要真正广泛运用在食品安全检测中,必须重点着手合成粒径均一、可控、单分散的纳米颗粒,改变纳米颗粒表面疏水和不具活性基团的性能,加强上转换发光纳米技术与层析法的结合,才能够使上转换发光纳米技术在食品安全检测的各领域得到更有效的开发和应用。
[1]HERNANDEZ F,PORTOLES T,PITARCH E,et al.Gas chromatography coupled to high resolution time of flight mass spectrometry to analyze trace-level organic compounds in the environment,food safety and toxicology[J].Trac-Trend Anal Chem,2011,30(2): 388-400.
[2]BERGAMO A B,FRACASSI da SILVA J A,PEREIRA da JESUS D
P.Simultaneous determination of aspartame,cyclamate,saccharin and acesulfame-K in soft drinks and tabletop sweetener formulations by capillary electrophoresis with capacitively coupled contactless conductivity detection[J].Food Chem,2011,124(4):1714-1717.
[3]刘长武,刘潇威,翟广书,等.固相萃取高效液相色谱法测定蔬菜、水果中的氨基甲酸酯杀虫剂及其代谢物残留[J].色谱,2003,21(3):255-257.
[4]ZHANG Jue,GAO Lei,ZHOU Bin,et al.Simultaneous detection of deoxynivalenolandzearalenonebydual-labeltime-resolved fluorescence immunoassay[J].J Sci Food Agr,2011,91(2):193-197.
[5]WU Xuejin,ZHANG Qingbin,WANG Xin,et al.One-pot synthesis of carboxyl functionalized rare earth fluoride nanocrystals with monodispersity,ultrasmall size and very bright luminescence[J]. Eur J Inorg Chem,2011,2011(13):2158-2163.
[6]CHATTERJEE D K,RUFAIHAH A J,ZHANG Y.Upcoversion fluorescence imagine of cells and small animal using lanthanide doped nanocrystals[J].Biomaterials,2008,29(7):937-943.
[7]JANCZEWSKI D,ZHANG Yan,DAS G K,et al.Bimodal magnetic fluorescence probes for bioimaging[J].Microsc Res Tech,2010,74 (7):563-576.
[8]WANG Feng,BANERJEE D,LIU Yong,et al.Upconversion nanoparticles in biological labeling,imaging,and therapy[J]. Analyst,2010,135(8):1839-1854.
[9]VETRONE F,CAPOBIANCO J A.Lanthanide-doped fluoride nanoparticles:luminescence,upconversion,andbiological applications[J].Int J Nanotechnol,2008,5(9-12):1306-1339.
[10]BUNZLI JCG.Lanthanide luminescence for biomedical analyses and imaging[J].Chem Rev,2010,110(5):2729-2755.
[11]HAASE M,SCHAFER H.Upconverting nanopartic[J].Angew Chem Int Edit,2011,50(26):5808-5829.
[12]郭海,乔艳敏.稀土纳米上转换发光材料研究进展[J].浙江师范大学学报(自然版),2007,30(4):377-382.
[13]密丛丛.稀土氟化物上转换荧光纳米粒子的磁化功能和生物应用[D].沈阳:东北大学,2009.
[14]梁森.高质量稀土掺杂上转换纳米粒子的制备及复合组装[D].吉林:吉林大学,2012.
[15]吴世嘉.基于上转换荧光纳米探针的高灵敏微生物毒素检测方法研究[D].无锡:江南大学,2013.
[16]汪俊丽.基于上转换纳米粒子的SEB毒素及雌二醇荧光免疫分析[D].长沙:湖南师范大学,2013.
[17]段诺,吴世嘉,王周平.核酸适配体识别-荧光法检测赭曲霉素A[J].分析化学,2001,39(3):300-304.
[18]SHIM W B,MUN H,JOUNG H A,et al.Chemiluminescence competitive aptamer assay for the detection of aflatoxin B1incorn samples[J].Food Control,2014,36(1):30-35.
[19]刘晓,王立平,周蕾,等.基于上转发光技术的奶粉及牛奶中黄曲霉毒素M1快速定量检测方法研究[J].军事医学,2014,38 (11):850-854.
[20]WU Shijia,DUAN Nuo,LI Xiangli,et al.Homogenous detection of fumonisin B1with a molecular beacon based on fluorescence resonance energy transfer between NaYF4:Yb,Ho upconversion nanoparticles and gold nanoparticles[J].Talanta,2013,116(22): 611-618.
[21]於然,马雪梅,谢飞.基于上转换免疫层析技术的真菌毒素检测[J].北京工业大学学报,2015,44(12):1915-1920.
[22]李伟,周蕾,王静,等.应用上转磷光免疫层析技术快速定量检测炭疽芽孢[J].中华微生物学和免疫学杂志,2006,26(8): 761-764.
[23]马小媛,李双,吴世嘉,等.基于上转换荧光标记和磁分离技术的沙门氏菌DNA检测新方法[J].食品与生物技术学报,2013,32(12):1303-1310.
[24]DUAN Nuo,WU Shijia,ZHU Changqing,et al.Dual-color upconversion fluorescence and aptamer functionalized magnetic nanoparticles-based bioassay for the simultaneous detection of Salmonella Typhimurium and Staphylococcus aureus[J].Anal Chem Acta,2012,723(8):1-6.
[25]QU Qing,ZHU Ziwen,WANG Yufei,et al.Rapid and quantitative detection of brucella by upconverting phosphor technology based lateral flow assay[J].J Microbiol Meth,2009,79(1):121-123.
[26]郝民.应用基于上转换发光技术的免疫层析法检测霍乱弧菌[D].北京:中国疾病预防控制中心,2010.
[27]王燕.副溶血性弧菌免疫检测新方法研究[D].无锡:江南大学,2013.
[28]方聪聪.上转换发光纳米材料的制备及其在土霉素检测中的应用[D].无锡:江南大学,2015.
[29]张旋旋.烯啶虫胺上转换荧光标记免疫检测技术的研究[D].天津:天津科技大学,2014.
[30]王喜亮,金秀娥,李奎,等.免疫层析法测定动物源性食品中磺胺嘧啶残留[J].中国抗生素杂志,2008,33(6):350-354.
[31]李丽波,姚焱,刘中瑞,等.免疫层析技术检测动物源性食品中的恩诺沙星残留[J].中国原子能科学研究院年报,2011(1): 230.
(责任编辑:王昌栋)
Progress on the application of upconversion fluorescence nanoparticles technology in food inspection
LIANG Zilu1,BI Shuilian2,HUANG Wanchun2
(1.College of Public Health,Guangdong Pharmaceutical University,Guangzhou 510006,China;2.College of Food Science,Guangdong Pharmaceutical University,Zhongshan 528458,China)
Upconversion fluorescence nanoparticles technology(UPNT)has attracted increasing attention in recent years,because it owns unique advantages such as high detection sensitivity,high stability,easy operation,no damage to the sample,and no background fluorescence.This paper reviews luminescent materials,luminescent mechanisms,and the application of UFNT in food safety detection.
upconversion fluorescent nanoparticle technology;food safety;inspection
R155
A
1006-8783(2016)04-0541-04
10.16809/j.cnki.1006-8783.2016031601
2016-03-16
国家自然科学基金资助项目(31401596);广东省科技计划项目(2014A040401087、2016A020210132);广东省自然科学基金资助项目(S2013040013491);广东省医学科研基金资助项目(B2014205)、广东药学院大学生创新创业培育项目
梁紫璐(1991—),女,2015级硕士研究生,Email:dxplzl@163.com;通信作者:毕水莲(1982—),博士,副教授,主要从事食品质量安全及检测技术研究,Email:shuilianbi@foxmail.com。
网络出版时间:2016-05-026 14:53 网络出版地址:http://www.cnki.net/kcms/detail/44.1413.R.20160526.1453.001.html

