IL-17A对柯萨奇B3病毒性心肌炎小鼠心肌的影响
董志兵 陈云鹏浙江省温岭市第一人民医院心血管内科,浙江台州 317500
IL-17A对柯萨奇B3病毒性心肌炎小鼠心肌的影响
董志兵 陈云鹏
浙江省温岭市第一人民医院心血管内科,浙江台州 317500
目的 探讨IL-17A对IL-17A基因敲除柯萨奇B3病毒性心肌炎小鼠心肌的影响。 方法 取15只IL-17A基因敲除型小鼠作为IL-17A基因敲除型组,15只WT小鼠作为对照组,各组小鼠腹腔内注射Nancy株柯萨奇病毒建立病毒性心肌炎小鼠模型,观察两组小鼠的心肌HE染色、心肌组织病理积分、血清细胞因子和心肌组织TGF-β1蛋白水平情况。 结果 HE染色结果显示:两组小鼠建模后第7、14、28天时心肌组织均出现炎症反应,IL-17A基因敲除组小鼠各时间点心肌组织的炎症反应均较对照组轻,第14天时,两组小鼠心肌组织炎性反应均最严重,对照组小鼠心肌炎症较IL-17A基因敲除组小鼠严重,出现广泛的炎症细胞浸润,心肌纤维化和心肌细胞坏死比较严重,IL-17A基因敲除组小鼠心肌组织炎症较对照组轻。IL-17A基因敲除组第7、14、28天心肌组织病理积分均低于对照组,差异有统计学意义(P<0.05)。IL-17A基因敲除组小鼠血清INF-γ高于对照组,IL-17A基因敲除组小鼠血清TNF-α、IL-17和IL-6水平低于对照组,差异有统计学意义(P<0.05)。IL-17A基因敲除组第7、14、28天小鼠心肌组织TGF-β1蛋白水平均低于对照组,差异有统计学意义(P<0.05)。 结论 敲除IL-17A基因能够降低病毒性心肌炎小鼠的心肌炎症,降低心肌组织病理积分,影响血清细胞因子水平,降低心肌组织TGF-β1蛋白水平。
IL-17A;病毒性心肌炎;株柯萨奇病毒B3;小鼠
病毒性心肌炎的发病和柯萨奇病毒B3、埃可病毒、脊髓灰质炎病毒以及流感病毒的病毒感染关系密切[1-2],柯萨奇病毒B3引起病毒性心肌炎最常见的病毒[3-4]。病毒性心肌炎的发病可能和病毒感染后再心肌细胞内大量复制,对心肌组织造成直接损伤,以及病毒感染后引起的免疫损伤和各种细胞因子参与的免疫反应等因素有关。IL-17是由Th17细胞分泌合成的[5],是一种炎症介质[6],能够导致炎症细胞浸润和组
织损伤破坏,引起组织炎性反应[7]。本研究探讨IL-17A对柯萨奇B3病毒性心肌炎小鼠心肌的影响。
1 材料与方法
1.1 实验对象
15只IL-17A基因敲除型BALB/c小鼠由东京大学医科学研究所提供;15只WT BALB/c小鼠购自湖南实验动物中心;Nancy株柯萨奇病毒B3购自复旦大学。
1.2 试剂和仪器
甲醛 (成都市科龙化工试剂厂)、ELISA试剂盒(美国Fermentas公司)、PBS液(美国Sigma公司)等;离心机(美国Sigma公司)、震荡器(美国Thermo公司)等。
1.3 方法
1.3.1 建立病毒性心肌炎小鼠模型及分组 PBS液将病毒原液稀释为1×10-5,所有小鼠腹腔内注射0.1 mL 100TCID50为1×10-5的Nancy株柯萨奇病毒建立病毒性心肌炎小鼠模型,IL-17A基因敲除型小鼠作为IL-17A基因敲除型组,WT小鼠作为对照组。建模后第7、14、28天每组各处死5只小鼠,留取心脏组织,建模第14天处死小鼠前摘除眼球取血进行血清化验。
1.3.2 各组小鼠心肌组织的HE染色 各时间段小鼠常规进行HE染色,细胞核染色质和细胞质核糖体被染成紫蓝色,细胞质成分和细胞外基质被染成红色。
1.3.3 计算心肌组织病理积分 采用Rezkalla半定量分析法进行计算,每张切片取5个高倍视野,计算每个视野中损伤坏死和炎性细胞浸润区域面积/整个视野面积。心肌组织病理积分评分标准为:0分为没有心肌损伤,或者有可疑炎症损伤;1分为病变面积<25%;2分为25%≤病变面积<50%;3分为50%≤病变面积≤75%;4分为病变面积>75%。
1.3.4 各组小鼠血清细胞因子检测 采用蛋白质芯片技术检测各组小鼠血清细胞因子,激光扫描仪扫描荧光信号,数据分析软件分析数据结果。
1.3.5 各组小鼠心肌组织TGF-β1蛋白水平测定 采用ELISA法按照试剂盒说明书进行测定。
1.4 主要观察指标
两组小鼠的心肌HE染色、心肌组织病理积分、血清细胞因子和心肌组织TGF-β1蛋白水平情况。
1.5 统计学方法
采用SPSS 12.0对数据进行分析,正态分布的计量资料以均数±标准差(±s)表示,两组间比较采用t检验;计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 IL-17A基因敲除组和对照组小鼠的心肌HE染色情况
第7天时,IL-17A基因敲除组小鼠心肌组织有炎性细胞浸润,伴有心肌纤维断裂和细胞坏死,对照组小鼠心肌细胞的炎性程度较IL-17A基因敲除组小鼠严重(图1A、B);第14天时,IL-17A基因敲除组小鼠的心肌炎症明显加重,对照组小鼠心肌炎症较IL-17A基因敲除组小鼠严重,出现广泛的炎症细胞浸润,心肌纤维化和心肌细胞坏死比较严重(图1C、D);第28天,两组小鼠的心肌炎症均较前减轻,IL-17A基因敲除组小鼠心肌炎症减轻更明显(图1E、F)。
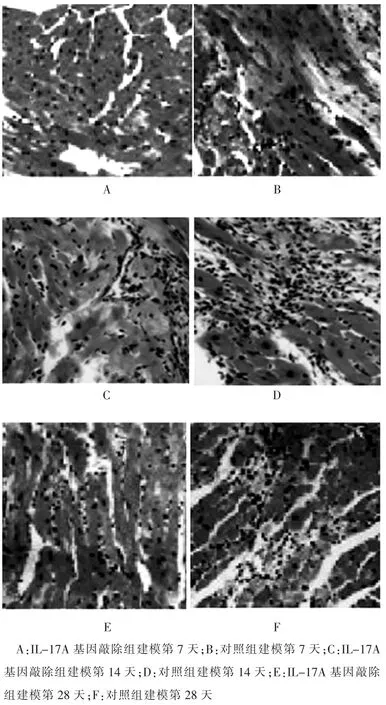
图1 IL-17A基因敲除组和对照组小鼠心肌HE染色情况(400×)
2.2 IL-17A基因敲除组和对照组小鼠的心肌组织病理积分比较
IL-17A基因敲除组第7、14、28天心肌组织病理积分均低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 IL-17A基因敲除组和对照组小鼠的心肌组织病理积分比较(分,±s)

表1 IL-17A基因敲除组和对照组小鼠的心肌组织病理积分比较(分,±s)
组别 动物只数 第7天 第14天 第28天IL-17A基因敲除组对照组t值P值55 1.45±0.22 1.87±0.31 3.674 <0.05 2.39±0.28 3.02±0.34 5.124 <0.05 0.88±0.17 1.53±0.22 4.274 <0.05
2.3 IL-17A基因敲除组和对照组小鼠血清细胞因子比较
IL-17A基因敲除组小鼠血清INF-γ高于对照组,IL-17A基因敲除组小鼠血清TNF-α、IL-17和IL-6水平低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 IL-17A基因敲除组和对照组小鼠血清细胞因子比较(ng/L,±s)
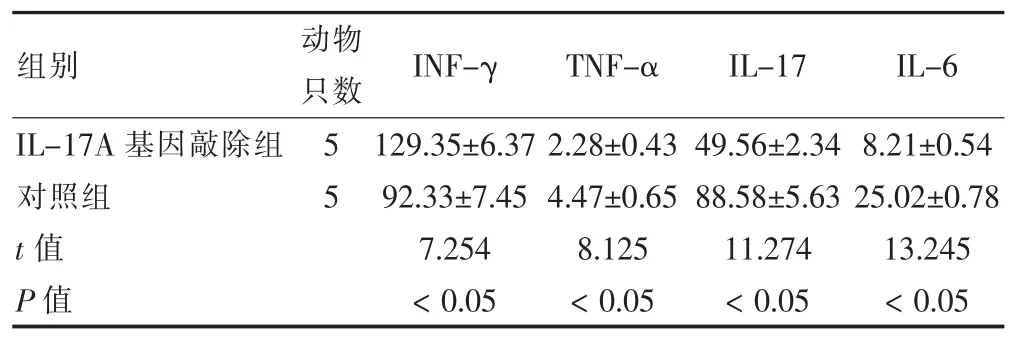
表2 IL-17A基因敲除组和对照组小鼠血清细胞因子比较(ng/L,±s)
组别 动物只数 INF-γ TNF-α IL-17 IL-6 IL-17A基因敲除组对照组t值P值55 129.35±6.37 92.33±7.45 7.254 <0.05 2.28±0.43 4.47±0.65 8.125 <0.05 49.56±2.34 88.58±5.63 11.274 <0.05 8.21±0.54 25.02±0.78 13.245 <0.05
2.4 IL-17A基因敲除组和对照组小鼠心肌组织TGF-β1蛋白水平比较
IL-17A基因敲除组第7、14、28天小鼠心肌组织TGF-β1蛋白水平均低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 IL-17A基因敲除组和对照组小鼠心肌组织TGF-β1蛋白水平比较(ng/mg,±s)

表3 IL-17A基因敲除组和对照组小鼠心肌组织TGF-β1蛋白水平比较(ng/mg,±s)
组别 动物只数 第7天 第14天 第28天IL-17A基因敲除组对照组t值P值55 0.07±0.01 0.13±0.02 3.984 <0.05 0.14±0.01 0.28±0.00 7.246 <0.05 0.07±0.00 0.16±0.02 6.374 <0.05
3 讨论
病毒性心肌炎的发病和多种病毒感染关系密切,其中柯萨奇病毒B3是病毒性心肌炎最常见的感染病毒[8-9],病毒性心肌炎的发病率有增高趋势,对人类健康造成严重危害[10]。大多数病毒性心肌炎经过治疗后能够痊愈,少数疾病继续发展,引起心律失常、心衰等严重并发症[11]。既往研究认为病毒性心肌炎的免疫损伤主要由Th1/Th2细胞介导,Th1细胞亚群产生的INF-γ和白细胞介素-2等细胞因子参与细胞免疫应答[12]。近来有研究发现Th17细胞在病毒性心肌炎的发病中国发挥关键作用[13-14],Th17细胞亚群主要通过IL-23和IL-1β诱导分化产生,Th17细胞能够分泌IL-17细胞因子,IL-17细胞因子有 IL-17F和 IL-17A,Th17细胞还可以分泌合成IL-6、IL-22、TNF-α 和IL-23等细胞因子[15-16],Th17细胞通过合成和分泌多种细胞因子,引起细胞因子网络失去平衡,引起组织炎症的发生,在病毒性心肌炎的发生发展过程中发挥重要作用[17]。
IL-17是Th17细胞分泌的主要效应分子在病毒性心肌炎急性期介导病毒复制,引起自身免疫反应和组织炎症损伤,参与病毒性心肌炎的发病[18]。在病毒性心肌炎小鼠的心肌组织中IL-17mRNA的表达升高,心肌组织中IL-17A的表达和柯萨奇病毒B3的复制呈正相关,在病毒性心肌炎患者血清中IL-17的水平较正常人提高,表明IL-17参与病毒性心肌炎的发病过程[19-20]。本研究通过对IL-17A基因敲除病毒性心肌炎小鼠的心肌组织进行研究,探讨IL-17A对柯萨奇B3病毒性心肌炎小鼠心肌的影响。本研究HE染色结果显示:两组小鼠建模后心肌组织出现炎症反应,IL-17A基因敲除组小鼠心肌组织的炎症反应均轻。IL-17A基因敲除组的心肌组织病理积分较低。IL-17A基因敲除组小鼠血清细胞因子出现异常。表明敲除IL-17A基因能够降低病毒性心肌炎小鼠的心肌炎症,降低心肌组织病理积分,影响血清细胞因子水平,降低心肌组织TGF-β1蛋白水平[21]。IL-17A基因敲除病毒性心肌炎小鼠血清中IL-17水平降低,血清INF-γ水平升高,过表达的INF-γ有助于控制心肌组织中病毒的复制,抑制心肌间质炎性细胞浸润和心肌细胞变性坏死,减轻心肌损伤,IL-17A基因敲除病毒性心肌炎小鼠血清TNF-α、IL-17和IL-6水平降低,表明IL-17A可能通过TNF-α、IL-17和IL-6等细胞因子参与病毒性心肌炎的炎性反应[22]。
[1]Patil KG,Salagre SB,Itolikar SM.Left ventricular non-compaction with viral myocarditis:a rare presentation of a rarer disease[J].J Assoc Physicians India,2014,62(3):261-263.
[2]Wang Y,Gao B,Xiong S.Involvement of NLRP3 inflammasome in CVB3-induced viral myocarditis[J].Am J Physiol Heart Circ Physiol,2014,307(10):H1438-H1447.
[3]Jenke A,Holzhauser L,M,et al.Adiponectin promotes coxsackievirus B3 myocarditis by suppression of acute antiviral immune responses[J].Basic Res Cardiol,2014,109(3):408.
[4]Lee CJ,Huang YC,Yang S,et al.Clinical features of coxsackievirus A4,B3 and B4 infections in children[J].PLoS One,2014,9(2):e87391.
[5]Xie Y,Li M,Wang X,et al.In vivo delivery of adenoviral vector containing interleukin-17 receptor a reduces cardiac remodeling and improves myocardial function in viral myocarditis leading to dilated cardiomyopathy [J].PLoS One,2013,8(8):e72158.
[6]Kong Q,Xue Y,Wu W,et al.IL-22 exacerbates the severity of CVB3-induced acute viral myocarditis in IL-17A-deficient mice[J].Mol Med Rep,2013,7(4):1329-1335.
[7]潘晓芬.IL-17A对病毒性心肌炎小鼠的心肌炎症和心肌纤维化的影响[D].南宁:广西医科大学,2014.
[8]Kishimoto C,Takamatsu N,Ochiai H,et al.Nucleotide differences of coxsackievirus B3 and chronic myocarditis[J]. Heart Vessels,2015,30(1):126-135.
[9]Koenig A,Sateriale A,Budd RC,et al.The role of sex differences in autophagy in the heart during coxsackievirus B3-inducedmyocarditis [J].J Cardiovasc Transl Res,2014,7(2):182-191.
[10]Bao JL,Lin L.MiR-155 and miR-148a reduce cardiac injury by inhibiting NF-κB pathway during acute viralmyocarditis[J].Eur Rev Med Pharmacol Sci,2014,18 (16):2349-2356.
[11]Sinnecker D,Laugwitz KL,Moretti A.Extending human induced pluripotent stem cell technology to infectious diseases:new model forviral myocarditis [J].Circ Res,2014,115(6):537-539.
[12]Yue Y,Gui J,Xu W,et al.Gene therapy with CCL2 (MCP-1)mutant protects CVB3-induced myocarditis by compromising Th1 polarization[J].Mol Immunol,2011,48 (4):706-713.
[13]Zhu H,Lou C,Liu P.Interleukin-27 ameliorates coxsackievirus-B3-induced viral myocarditis by inhibiting Th17 cells[J].Virol J,2015,12:189.
[14]Yu M,Hu J,Zhu MX,et al.Cardiac fibroblasts recruit Th17 cells infiltration into myocardium by secreting CCL20 in CVB3-induced acute viral myocarditis[J]. Cell Physiol Biochem,2013,32(5):1437-1450.
[15]Xie Y,Zhang X,Tian Z,et al.Preexposure to PM2.5 exacerbates acute viral myocarditis associated with Th17 cell[J].Int J Cardiol,2013,168(4):3837-3845.
[16]Liu YL,Wu W,Xue Y,et al.MicroRNA-21 and-146b are involved in the pathogenesis of murine viral myocarditis by regulating TH-17 differentiation [J].Arch Virol,2013,158(9):1953-1563.
[17]Xie Y,Chen R,Zhang X,et al.The role of Th17 cells and regulatory T cells in Coxsackievirus B3-induced myocarditis[J].Virology,2011,421(1):78-84.
[18]Zhou SF,Yuan J,Liao MY,et al.IL-17A promotes ventricular remodeling after myocardial infarction [J].J Mol Med(Berl),2014,92(10):1105-1116.
[19]Sato F,Omura S,Kawai E,et al.Distinct kinetics of viral replication,T cell infiltration,and fibrosis in three phases of myocarditisfollowing Theiler's virus infection [J].Cell Immunol,2014,292(1-2):85-93.
[20]薛贻敏,伍伟锋,高梦莎,等.白细胞介素17A对小鼠柯萨奇B3病毒性心肌炎心肌纤维化的影响[J].岭南心血管病杂志,2013,19(3):346-351,359.
[21]邓巍,李彦红,朱华,等.BALB/c小鼠和雪貂感染H7N9禽流感病毒后的肺组织动态病理学变化[J].中国实验动物学报,2014,22(1):13-17.
[22]李兴朝,王茜,谢集建,等.新生儿心肌炎临床特征及血清白细胞介素-6、肿瘤坏死因子-α水平的变化[J].疑难病杂志,2014,12(7):668-670.
Effect of IL-17A on Coxsackie B3 viral myocarditis mice myocardium
DONG Zhibing CHEN Yunpeng
Department of Cardiovascular Medicine,Wenling First People's Hospital,Zhejiang Province,Wenling 317500,China
Objective To study the myocardium of IL-17A gene knockout viral myocarditis mice,and explore the effect of IL-17A on Coxsackie B3 viral myocarditis mice myocardium.Methods 15 IL-17A gene knockout mice were selected as IL-17A gene knockout group,15 WT mice were selected as control group,mice of each group were injected Nancy strain coxsackievirus to establish viral myocarditis mice model,observed myocardial HE staining,myocardial pathological scores,serum cytokines and myocardial tissue TGF-β1protein level of two groups mice.Results HE staining showed∶mice of two groups all showed myocardial inflammation at 7th,14th,28th day after modeling,cardiac tissue inflammation reaction of IL-17A gene knockout group mice was lighter than control group,at the 14th day,cardiac tissue inflammatory reaction of two groups mice were the most serious,the control group mice appeared widespread inflammatory cell infiltration,myocardial necrosis and myocardial fibrosis compare serious,cardiac tissue inflammation reaction of IL-17A gene knockout mice lighter than control group.The myocardial pathological scores of IL-17A gene knockout group were lower than those of control group at 7th,14th,28 day,the difference was statistically significant (P<0.05).The serum INF-γ of IL-17A gene knockout group mice was higher than that of control group,the serum TNF-α,IL-17 and IL-6 levels of IL-17A gene knockout group mice were lower than those of control group,the differences were statistically significant(P<0.05).The myocardial TGF-β1protein levels of IL-17A gene knockout group mice were lower than control group at 7th,14th,28 day,the differences were statistically significant(P<0.05).Conclusion IL-17A gene knockout can reduce viral myocarditis mice myocardial inflammation,reduce myocardial histopathologic score,influence serum cytokine levels,reduce myocardial tissue TGF-β1protein levels.
IL-17A;Viral myocarditis;Strains of Coxsackie virus B3;Mice
R285.5
A
1673-7210(2016)06(a)-0023-04
2016-03-06本文编辑:苏 畅)
浙江省温岭市科学技术局科技项目(2011WLCB0087)。

