长江中下游地区亚洲镰刀菌NX-2毒素群体的检测
罗 文, 张 昊, 许景升, 徐 进, 冯 洁
(中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193)
长江中下游地区亚洲镰刀菌NX-2毒素群体的检测
罗文,张昊,许景升,徐进,冯洁*
(中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京100193)
由禾谷镰刀菌复合种(Fusariumgraminearumspecies complex,FGSC)引起的麦类赤霉病,是农业生产上的重要病害。为明确中国长江中下游冬小麦主产区小麦赤霉病菌种的构成及其地理分布,对2008年从江苏、浙江和湖北3省采集的656株小麦赤霉病菌株进行了分类鉴定。结果显示,其中558个菌株为亚洲镰刀菌(Fusariumasiaticum),98个菌株为禾谷镰刀菌(Fusariumgraminearumsensu stricto),表明中国长江中下游冬小麦主产区小麦赤霉病的主要致病菌是亚洲镰刀菌。选择亚洲镰刀菌(F.asiaticum)为研究对象,通过PCR-RFLP的方法对其进行产NX-2毒素菌株的检测。结果没有检测到产NX-2毒素菌株,表明中国长江中下游冬小麦主产区并未出现NX-2毒素群体。本研究旨在了解NX-2毒素群体在中国长江中下游地区的地理分布,为进一步研究麦类赤霉病菌群体遗传多样性和演化趋势奠定基础,为麦类赤霉病的防治和毒素污染的控制提供理论依据。
小麦赤霉病;亚洲镰刀菌;NX-2
由禾谷镰刀菌复合种(Fusariumgraminearumspecies complex,FGSC)引起的麦类赤霉病,是农业生产上的重要病害,广泛发生于世界湿润和半湿润地区[1-2]。近年来,随着全球气候变暖的加剧和麦田耕作制度的变化,赤霉病在亚洲、加拿大、欧洲和北美等地区频繁发生,严重影响粮食产量,造成巨大的经济损失。
我国幅员辽阔,气候多样,再加上较为普遍的水稻、小麦和玉米轮作的种植制度,为赤霉病的发生提供了非常有利的条件。2012年,我国小麦赤霉病暴发程度历史罕见,受害面积达到1 000万hm2,约占全国小麦总面积的1/2。感病后的麦穗不仅籽粒皱缩,品质下降[3],而且病菌产生的单端孢霉烯族毒素(trichothecenes)可抑制真核细胞蛋白质的合成[4],破坏人和动物的免疫系统,出现头晕、呕吐、口腔病损、炎症、器官出血等症状,严重威胁人畜的健康安全[5]。
单端孢霉烯族毒素是结构相似的倍半萜烯类化合物的总称,根据化学结构和产毒菌株来源不同,可分为A、B、C、D 4种毒素类型。其中B型单端孢霉烯族毒素(B-trichothecenes)是感染麦类赤霉病菌的病穗中积累的最主要的毒素,包括脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)及其衍生物3-乙酰基脱氧雪腐镰刀菌烯醇(3-acetyldeoxynivalenol,3-ADON)、15-乙酰基脱氧雪腐镰刀菌烯醇(15-acetyldeoxynivalenol,15-ADON)和雪腐镰刀菌烯醇(nivalenol,NIV)。
在中国流行危害的禾谷镰刀菌复合种(FGSC)主要是禾谷镰刀菌(Fusariumgraminearumsensu stricto)和亚洲镰刀菌(Fusariumasiaticum),其中黄河流域以北地区以禾谷镰刀菌为主,长江中下游地区以亚洲镰刀菌为主[6-8]。Zhang等研究发现长江中下游麦区的亚洲镰刀菌主要产生3-ADON,而禾谷镰刀菌只产生15-ADON毒素[8]。
2014年,Liang等在美国的明尼苏达州分离到一种禾谷镰刀菌[9],这种禾谷镰刀菌早在2010年Gale等人就报道过,发现它不产生B型单端孢霉烯族毒素中的任何一种类型的毒素[10],而产生一种新的毒素(3α-乙酰基-7α,15-二羟基-12,13-环氧单端孢霉烯-9烯),Varga等人将其命名为NX-2[11]。Liang等将NX-2与B型单端孢霉烯族毒素中的DON、3-ADON、15-ADON和NIV的化学结构进行比较,发现NX-2与3-ADON的化学结构有很高的一致性,只在C-8位缺了一个酮基[9](图1)。
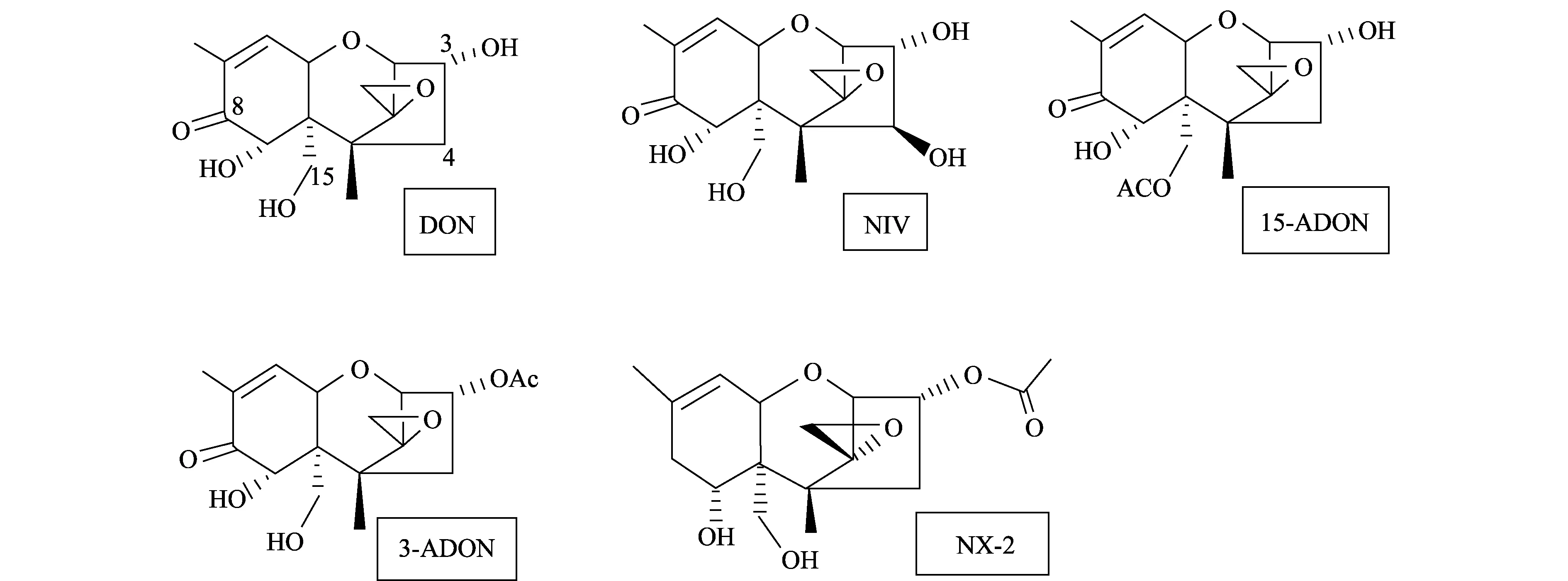
图1 B型单端孢霉烯族毒素和NX-2毒素的化学结构Fig.1 Chemotype of toxins B-trichothecenes and NX-2
McCormick等研究发现拟枝孢镰刀菌(Fusariumsporotrichioides)和禾谷镰刀菌(F.graminearums. str.)的Tri1基因都能编码催化单端孢霉烯族毒素羟基化的酶[12]。FsTri1编码细胞色素P450单氧酶,催化A型单端孢霉烯族毒素(A-trichothecenes)C-8位羟基化;而FgTri1编码细胞色素P450加氧酶,催化B型单端孢霉烯族毒素(B-trichothecenes)C-7位和C-8位羟基化,使C-7位生成一个羟基,C-8位生成一个酮基[13-14]。新发现的NX-2型毒素仅在C-7位生成一个羟基,推测产NX-2型毒素菌株的FgTri1等位基因可能编码一种细胞色素P450单氧酶,只催化C-7位羟基化。Liang等将产生NX-2的菌株与产生DON的菌株的Tri1序列进行比对分析,设计出1对引物Tri1F/Tri1R[9],采用PCR-RFLP检测禾谷镰刀菌中产NX-2毒素的菌株,结果共检测到产NX-2毒素菌株13株,占总数的2.8%,并发现若按照原来基于Tri3和Tri12基因的分子检测方法,这些产生NX-2的菌株均被误认为是3-ADON化学型[9]。Liang等对3-ADON毒素群体的地理分布及出现频率进行分析发现,NX-2毒素群体与3-ADON群体表现出相似的动态变化规律[9],推测在NX-2毒素群体与3-ADON毒素群体间可能存在一定的联系。
Ward等的研究发现,与15-ADON毒素群体相比,3-ADON群体能产生更多的毒素,表现出更强的繁殖能力和更快的生长速率[15]。说明3-ADON毒素群体具有更强的生态适应性,有取代15-ADON群体的趋势。因此,尽管Liang等在美国发现的NX-2毒素群体所占比例很小(2.8%),但是它的发现是否意味着一种具有更强生态适应性的种群的出现,是否会对农业生产带来更多的威胁,需要我们进一步研究。
目前,在中国尚未有NX-2毒素群体的相关报道。本研究于2008年从中国冬小麦主产区江苏、浙江和湖北采集大量菌株,对这些菌株进行了分类鉴定。选择其中主要产生3-ADON毒素的亚洲镰刀菌(F.asiaticum)为研究对象,检测其是否为产NX-2毒素的菌株,旨在了解NX-2毒素群体在中国长江中下游地区的地理分布,为揭示小麦赤霉菌群体演化趋势,研发新的综合控制途径等提供理论依据。
1 材料与方法
1.1小麦赤霉病菌的分离和培养
2008年,从江苏、浙江和湖北3省的冬小麦田中采集感染小麦赤霉病的病穗,进行病原真菌的单孢分离[16],并对分离的菌株进行纯化及初步的表型鉴定,共获得菌株656个。将供试菌株接种于PDA平板上,28℃条件下培养。

表1 供试菌株信息Table 1 Information of strains used in this study
1.2真菌基因组DNA的提取
供试菌株长满平皿后,刮取菌丝,用真菌基因组DNA提取试剂盒D3390- 02(Omega,美国)提取其基因组DNA。
1.3菌株的鉴定
利用引物Fg16F(5′-CTCCGGATATGTTGCGTCAA-3′)和Fg16R(5′-GGTAGGTATCCGACATGGCAA-3′)[17]进行PCR扩增,PCR反应体系为:真菌DNA 约20 ng、2×TaqMix 10 μL、10 μmol/L Fg16F/Fg16R 各1 μL、加ddH2O至20 μL;PCR反应程序为: 95℃预变性 3 min;95℃变性30 s,52℃退火30 s,72℃延伸30 s,30个循环;72℃延伸10 min。扩增产物采用1.5%的琼脂糖凝胶电泳检测,其中禾谷镰刀菌扩增片段大小为400 bp;亚洲镰刀菌为500 bp。
1.4亚洲镰刀菌(F.asiaticum)Tri1基因测序
利用引物Tri16-IF1(5′-GCCTSATAGCGACGATCTTGC-3′)和Fg_Tri1-R1(5′-AACAAGTGGCGAGATCAAACC-3′)[9],以亚洲镰刀菌(F.asiaticum)DNA为模板,进行PCR扩增,获得含有FaTri1基因序列的PCR产物。
PCR反应体系为:DNA模板约20 ng、PrimeSTAR HS (Premix)25 μL、10 μmol/L Tri16-IF1 1 μL、10 μmol/L Fg_Tri1-R1 1 μL、加ddH2O至50 μL。PCR反应程序为:96℃预变性2 min;94℃变性 30 s;53℃退火30 s,68℃延伸2 min,35个循环;72℃延伸10 min、产物4℃保存。扩增产物采用1%的琼脂糖凝胶电泳检测,目的条带送上海生物工程有限公司测序。
将测序反馈的含有FaTri1基因的序列与FgTri1基因序列进行比对,发现存在少数SNP位点,因此,已报道的引物Tri1F(5′-ATGGCTCTCATCACCAG-3′)和Tri1R(5′-CAATTCCAATCGCAGACAA-3′)[9]无法成功扩增F.asiaticum菌株。根据FaTri1基因序列设计亚洲镰刀菌特异的FaTri1基因正向引物FaTri1F(5′-ATGGCTATCATCAGCAAC-3′),反向引物仍为FgTri1基因序列的反向引物Tri1R。采用F.asiaticum标准菌株进行验证。
1.5产NX-2毒素菌株的检测
采用PCR-RFLP检测亚洲镰刀菌中产NX-2毒素的菌株。PCR反应体系为:模板DNA约20 ng、2×TaqMix 10 μL、10 μmol/L FaTri1F 1 μL、10 μmol/L Tri1R 1 μL,加ddH2O至20 μL。PCR反应程序为:94℃预变性2 min;94℃变性1 min,56℃退火1 min,72℃延伸1 min 45 s,25个循环;72℃延伸10 min。产物4℃保存。扩增产物采用1%的琼脂糖凝胶电泳检测,检测到目的条带后,对扩增产物进行酶切验证。酶切体系为:扩增产物10 μL、ApoⅠ(10U/μL)0.15 μL、100×BSA 0.15 μL、10×NEB buffer 1.5 μL、加ddH2O至15 μL,反应液置于50℃,水浴2 h。酶切产物采用1.5%的琼脂糖凝胶电泳检测。
2 结果与分析
2.1菌株的鉴定结果
利用引物Fg16F/Fg16R对656个菌株进行了PCR扩增,其中558个菌株能够稳定地扩增出500 bp的片段,属于亚洲镰刀菌(F.asiaticum)。另有98个
菌株能够稳定地扩增出400 bp的片段,属于禾谷镰刀菌(F.graminearums.str.)(表2,图2)。其中从江苏省分离的189个菌株中,有166个为F.asiaticum,23个为F.graminearums.str;从浙江省分离的188个菌株中,有172个为F.asiaticum,16个为F.graminearums.str;从湖北省分离的279个菌株中,有220个为F.asiaticum,59个为F.graminearums.str,表明长江中下游地区以F.asiaticum为主。
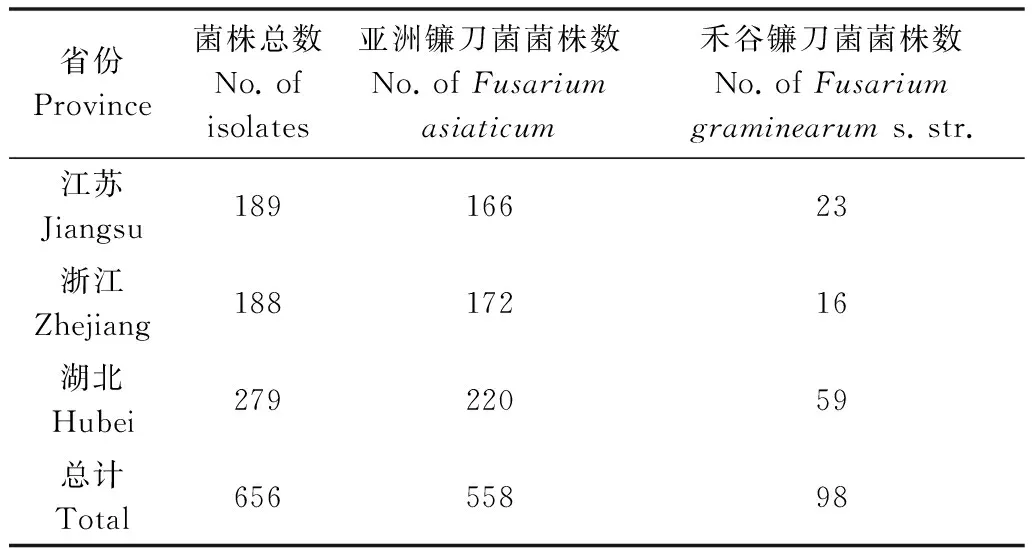
表2 利用引物Fg16F/Fg16R对供试菌株的鉴定结果Table 2 Identification result of strains using primers Fg16F/Fg16R in this study
图2 表1中部分菌株的Fg16F/Fg16R扩增产物Fig.2 PCR products of part of strains in table 1 using primers Fg16F/Fg16R
2.2NX-2毒素菌株的检测结果
采用PCR-RFLP,用引物FaTri1F和Tri1R对558个亚洲镰刀菌(F.asiaticum)、3-ADON型F.asiaticum标准菌株NRRL6101和NIV型F.asiaticum标准菌株NRRL13818的Tri1基因进行PCR扩增,扩增产物经ApoⅠ酶切。产3-ADON和NIV毒素的菌株,其扩增产物酶切后产生888 bp和851 bp 2个片段,但由于这2个片段长度只相差37 bp,无法被琼脂糖凝胶分离,因此电泳后只显示出一条带;而产NX-2毒素的菌株,则会出现407、482和851 bp 3个片段[9]。酶切结果显示,标准菌株和558个被测菌株均能够稳定的扩增出一条接近1 740 bp的片段(图3~4),但经ApoⅠ酶切后标准菌株和558个被测菌株均产生888 bp和851 bp的片段(图5),表明江苏、浙江和湖北3省未出现产NX-2毒素的菌株。
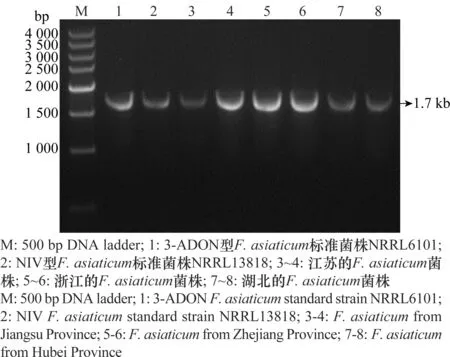
图3 采用引物FaTri1F和Tri1R检测供试 Fusarium asiaticum菌株Tri1基因Fig.3 Detection result of Tri1 in Fusarium asiaticum strains using primers FaTri1F and Tri1R
图4 采用FaTri1F和Tri1R引物检测部分湖北Fusarium asiaticum菌株的Tri1基因Fig.4 Detection result of Tri1 in Fusarium asiaticum strains from Hubei using primers FaTri1F and Tri1R
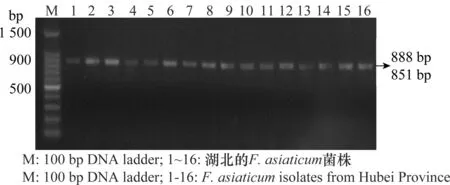
图5 Fusarium asiaticum菌株Tri1基因的PCR-RFLP结果Fig.5 PCR-RFLP result of Tri1 gene in Fusarium asiaticum strains
3 讨论
NX-2是最近在美国明尼苏达州发现的由禾谷镰刀菌产生的一种新的毒素,其结构与3-ADON毒素有很高的一致性,只在C-8位缺了一个酮基[9]。研究发现,Tri1基因在不同镰刀菌种中的序列差异很大,在拟枝孢镰刀菌(F.sporotrichioides)中,FsTri1编码的酶催化A型单端孢霉烯族毒素(A-trichothecenes)C-8位羟基化,而在禾谷镰刀菌(F.graminearums. str.)中,FgTri1编码的酶催化B型单端孢霉烯族毒素(B-trichothecenes)C-7位和C-8位羟基化[13-14]。Liang等发现的NX-2型毒素菌株的Tri1基因编码的酶仅催化C-7位羟基化,而不作用于C-8位,推测Tri1基因的多态性可能与NX-2毒素合成有关。而原有毒素化学型检测方法无法区分NX-2与3-ADON化学型,并且NX-2毒素群体波动起伏的频率与3-ADON毒素群体相似,推测NX-2毒素群体和3-ADON毒素群体间可能存在某种联系[9]。Ward等研究发现,北美产3-ADON毒素的F.graminearums. str.群体由东向西扩张,逐渐取代15-ADON群体[15]。这说明NX-2群体也可能通过同样的方式进行群体扩张。在中国也发现了类似的情况,在长江中下游地区小麦赤霉病菌的优势种群是产3-ADON毒素的亚洲镰刀菌(F.asiaticum),其具有取代NIV群体的扩张趋势[7]。中国是否存在NX-2型菌株,其与3-ADON群体有何关系,目前尚无相关报道。由于NX-2毒素群体与3-ADON群体在基因型和流行趋势方面十分相似,对主要由3-ADON化学型组成的亚洲镰刀菌(F.asiaticum)群体进行筛选鉴定具有更强的针对性。通过F.asiaticum与F.graminearums. str.的Tri1基因序列比对分析,发现存在少数SNP位点,因此已报道的引物无法成功扩增F.asiaticum菌株。我们重新设计了FaTri1基因特异性引物FaTri1F,改进了Liang等的PCR-RFLP的方法。并对长江中下游地区江苏、浙江、湖北3省是否存在NX-2群体进行了检测。
本研究对2008年分离自中国冬小麦主产区江苏、浙江、湖北3省的656株赤霉病菌株进行了鉴定和分析。研究结果表明,长江中下游地区江苏、浙江、湖北3省的赤霉病菌由亚洲镰刀菌(F.asiaticum)和禾谷镰刀菌(F.graminearums. str.)组成,其中亚洲镰刀菌是优势群体,与之前的报道一致。
在产NX-2毒素菌株的检测中,江苏、浙江、湖北3省的亚洲镰刀菌(F.asiaticum)中都未检测出产NX-2毒素菌株,表明这3省都还没有出现产NX-2毒素菌株。但是不少研究都表明,与其他B型单端孢霉烯族毒素比较,3-ADON毒素群体能够产生更多的毒素,具有更强的繁殖能力和更快的生长速率,并且它的群体正逐渐扩张。而Liang等的研究表明,NX-2毒素群体的出现和3-ADON毒素群体间有一定相关性[9]。目前,NX-2毒素群体的生长特性,产毒量和致病力并没有相关的报道。但是若NX-2毒素群体与3-ADON毒素群体一样,表现出更强的生态适应性,那么它将在基因组水平上具有潜在的扩张趋势,可能给世界麦类作物造成严重的危害。因此,加强NX-2毒素群体时空动态变化的监测对小麦赤霉病菌防治十分重要。
本研究采用PCR-RFLP对长江中下游地区的江苏、浙江、湖北3省是否存在产NX-2毒素菌株进行了检测,明确了我国长江中下游冬小麦主产区小麦赤霉病菌种的构成及其地理分布,发现了需要重点监控的群体,为进一步研究麦类赤霉病菌群体遗传多样性和演化趋势奠定了基础,也为麦类赤霉病的防治和毒素污染的控制提供了理论依据。
[1]Miedaner T, Cumagun C J R, Chakraborty S. Population genetics of three important head blight pathogensFusariumgraminearum,F.pseudograminearumandF.culmorum[J]. Journal of Phytopathology, 2008, 156(3): 129-139.
[2]Nganje W E, Bangsund D A, Leistritz F L, et al. Estimating the economic impact of a crop disease: the case ofFusariumhead blight in U.S [C]∥Wheat and Barley. National Fusarium Head Blight Forum Proceedings, 2002:275-281.
[3]Goswami R S, Kistler H C. Heading for disaster:Fusariumgraminearumon cereal crops [J]. Molecular Plant Pathology, 2004, 5(6): 515-525.
[4]Ueno Y, Nakajima M, Sakai K, et al. Comparative toxicology of trichothec mycotoxins: inhibition of protein synthesis in animal cells[J]. Journal of Biochemistry, 1973, 74(2): 285-296.
[5]Pestka J J, Smolinski A T. Deoxynivalenol toxicology and potential effects on humans [J]. Journal of Toxicology and Environmental Health, Part B Critical Reviews, 2005, 8(1): 39-69.
[6]Yang L, van der Lee T, Yang X, et al.Fusariumpopulations on Chinese barley show a dramatic gradient in mycotoxin profiles [J]. Phytopathology, 2008, 98(6): 719-727.
[7]Zhang Hao, Van der Lee T, Waalwijk C, et al. Population analysis of theFusariumgraminearumspecies complex from wheat in China show a shift to more aggressive isolates[J]. PLoS ONE, 2012, 7(2): e31722.
[8]Zhang Jingbo, Li Heping, Dang Fujun, et al. Determination of the trichothecene mycotoxin chemotypes and associated geographical distribution and phylogenetic species of theFusariumgraminearumclade from China[J]. Mycological Research, 2007, 111: 967-975.
[9]Liang J M, Xayamongkhon H, Broz K, et al. Temporal dynamics and population genetic structure ofFusariumgraminearumin the upper Midwestern United States [J]. Fungal Genetics and Biology, 2014, 73: 83-92.
[10]Gale L R, Ward T J, Kistler H C. A subset of the newly discovered Northland population ofFusariumgraminearumfrom the U.S does not produce the B-type trichothecenes DON, 15ADON, 3ADON or NIV in U.S [C]∥Wheat and Barley Scab Initiative. Proceedings of the 2010 National Fusarium Head Blight Forum,Session 2:Pathogen Biology & Genetics, Hyatt Regency Milwaukee, WI USA, 2010: 48-49.
[11]Varga E, Wiesenberger G, Hametner C, et al. New tricks of an old enemy: Isolates ofFusariumgraminearumproduce a novel type A trichothecene mycotoxin [J]. Environmental Microbiology, 2015, 17(8):2588-2600.
[12]McCormick S P, Alexander N J, Proctor R H. Heterologous expression of two trichothecene P450 genes inFusariumverticillioides[J]. Canadian Journal of Microbiology, 2006, 52(3): 220-226.
[13]Alexander N J, McCormick S P, Waalwijk C, et al. The genetic basis for 3-ADON and 15-ADON trichothecene chemotypes inFusarium[J].Fungal Genetics and Biology,2011,48(5):485-495.
[14]McCormick S P, Harris L J, Alexander N J, et al.Tri1 inFusariumgraminearumencodes a P450 oxygenase [J].Applied and Environmental Microbiology,2004,70(4):2044-2051.
[15]Ward T J, Clear R M, Rooney A P, et al. An adaptive evolutionary shift in Fusarium head blight pathogen populations is driving the rapid spread of more toxigenicFusariumgraminearumin North America [J]. Fungal Genetics and Biology, 2008, 45(4): 473-484.
[16]张昊, 张争, 许景升,等. 一种简单快速的赤霉病菌单孢分离方法-平板稀释画线分离法[J]. 植物保护, 2008, 34(6): 134-136.
[17]Nicholson P, Simpson D R, Weston G, et al. Detection and quantification ofFusariumculmorumandFusariumgraminearumin cereals using PCR assays [J]. Physiological and Molecular Plant Pathology, 1998, 53(1): 17-37.
(责任编辑:杨明丽)
Detection of NX-2 producingFusariumasiaticumstrains in the Middle and Lower Reaches of Yangtze River
Luo Wen,Zhang Hao,Xu Jingsheng,Xu Jin,Feng Jie
(State Key Laboratory for Biology of Plant Diseases and Insect Pests,Institute of Plant Protection,Chinese Academy of Agricultural Sciences, Beijing100193, China)
Fusariumhead blight (FHB)caused byFusariumgraminearumspecies complex is a very important disease in agricultural production. To analyze the composition and geographic distribution ofF.graminearumspecies complex in the main areas of wheat production in the Middle and Lower Reaches of Yangtze River in China, wheat spikes with FHB symptoms were collected from 3 provinces including Jiangsu, Zhejiang and Hubei in 2008. A total of 656 strains were isolated. The results showed that 558 strains wereF.asiaticumand 98 strains wereF.graminearums. str among the 656 isolates. Population ofF.asiaticumis predominant.F.asiaticumwas selected to detect NX-2 producing strains through the PCR-RFLP method. The results showed that there were no NX-2 producing strains in the main areas of wheat production in the Middle and Lower Reaches of Yangtze River in China. The aim of this research is to get a detailed geographic distribution of NX-2 producing strains in the Middle and Lower Reaches of Yangtze River in China, lay the foundation for further study of the population genetic diversity, and provide theoretical basis for disease and mycotoxin control.
Fusariumhead blight;Fusariumasiaticum;NX-2
2015-01-14
2015-03-12
国家自然科学基金(31201477);国家国际合作专项(2013DFG31930);公益性行业(农业)科研专项(201303016)
E-mail: jfeng@ippcaas.cn
S 435.12
A
10.3969/j.issn.0529-1542.2016.02.035

