牦牛骨免疫活性肽的酶解制备研究
瞿 瑗,李 诚,程乐涛,夏春明,晏芳芳
(四川农业大学食品学院,四川雅安 625014)
牦牛骨免疫活性肽的酶解制备研究
瞿瑗,李诚*,程乐涛,夏春明,晏芳芳
(四川农业大学食品学院,四川雅安 625014)
本文以脾淋巴细胞增殖率作为评价指标,比较了碱性蛋白酶、胃蛋白酶、胰蛋白酶、木瓜蛋白酶对利用牦牛骨制备免疫活性肽的酶解效果。在单因素实验的基础上,采用正交实验优化免疫活性肽酶解制备条件。结果表明,木瓜蛋白酶适合酶解牦牛骨制备免疫活性肽,其最佳酶解工艺参数为:酶解时间4 h,pH6.5,酶解温度60 ℃,酶与底物比5000 U/g,底物质量浓度6 g/100 mL,对应的活性肽浓度为1.92 g/100 mL,此条件下脾淋巴细胞增殖率达72.09%。
牦牛骨,免疫活性肽,木瓜蛋白酶,酶解,脾淋巴细胞增殖
牦牛长期生活在高寒缺氧地带,具有“高原之舟”之称,全身营养价值颇高。其中占牦牛躯体总生物量三分之一的骨骼营养丰富,富含人体所需优质蛋白质、各种氨基酸、生理活性物质、维生素、矿物质,具有提高人体钙质、减缓人体衰老、增强免疫力等功效[1-3],因此,牦牛骨具有极大的开发利用价值。目前,对畜禽骨的利用研究主要集中于鱼骨、羊骨、猪骨等动物的副产物上,而对牦牛骨鲜有研究,因此,对其进行深入研究具有重要意义。
目前,免疫活性肽以其活性强、用量少、稳定性强、生物活性高的独特优势,而备受关注,其工业化生产已成为食品和医药行业的发展趋势。近年来相关研究中,Hou等[4]从阿拉斯加鳕鱼的骨架中分离出三种免疫活性肽,Asn-Gly-Met-Thr-Tyr、Asn-Gly-Leu-Ala-Pro 和Trp-Thr,其脾淋巴细胞增殖率分别为35.92%、32.96%和31.35%。免疫活性肽存在于许多食物中,而且这些食物在自然界里也较为丰富[5]。其中从骨骼这种相对便宜且可以利用的副产物里提取生物活性多肽,既可降低生产成本,又不失为一个有效的废料处理方式[6]。因此,如何高效率的利用牦牛骨资源,从牦牛骨中提取具有免疫活性的多肽,不仅会为畜禽骨的深加工开拓新思路,还为人类对于免疫调节食品及药物辅助剂的筛选提供了新选择。
酶解法提取骨蛋白广受国内外研究者的青睐,较其他提取骨蛋白的方法,酶解法具有防止环境污染、缩短提取时间等优势。本文从四种蛋白酶中筛选出酶解效果最好的一种,采用正交实验法优化酶解条件,获得牦牛骨蛋白的免疫活性肽制备的最佳工艺,以期为牦牛骨资源的开发利用提供依据。
1 材料与方法
1.1材料与仪器
牦牛骨粉牦牛骨经超微粉碎,粒度200目,四川省大渡河食品有限公司;昆明种小鼠体重25 g,6周龄,雄性,四川农业大学动物医学院提供;碱性蛋白酶(2×105U/g)、胃蛋白酶(3×104U/g)、胰蛋白酶(2.5×105U/g)、木瓜蛋白酶(11×104U/g)源叶生物科技有限公司;其他试剂均为分析纯。
BR4i型多功能冷冻离心机法国THERMO JOUAN公司;BT 12S电子天平上海越平科学仪器有限公司;311型CO2培养箱美国Thermo Scientific公司;QT-2旋窝混合器上海琪特分析仪器有限公司;iMark酶联免疫检测仪美国伯乐公司;HH-6数显恒温水浴锅国华电器有限公司;AS10200A超声波清洗仪天津奥特赛恩斯仪器有限公司;PHS-3C酸度计上海佑科仪器仪表有限公司。
1.2实验方法
1.2.1牦牛骨免疫活性肽的酶解制备工艺流程称取一定量的牦牛骨粉→加入蒸馏水(100 mL)→混匀→预处理(90 ℃,10 min)→缓慢冷却至常温→调节pH到指定值→加入一定量的酶在指定温度下酶解一定的时间→灭酶(100 ℃,10 min)→离心过滤(8000 g,20 min)。
1.2.2蛋白酶的选择以酶解液脾淋巴细胞增殖率为评价指标,比较碱性蛋白酶、胃蛋白酶、胰蛋白酶、木瓜蛋白酶在各自的最适酶解条件下,按1.2.1中酶解工艺对牦牛骨蛋白进行酶解,筛选出适合用于酶法制备牦牛骨免疫活性肽的蛋白酶,各蛋白酶酶解条件见表1。
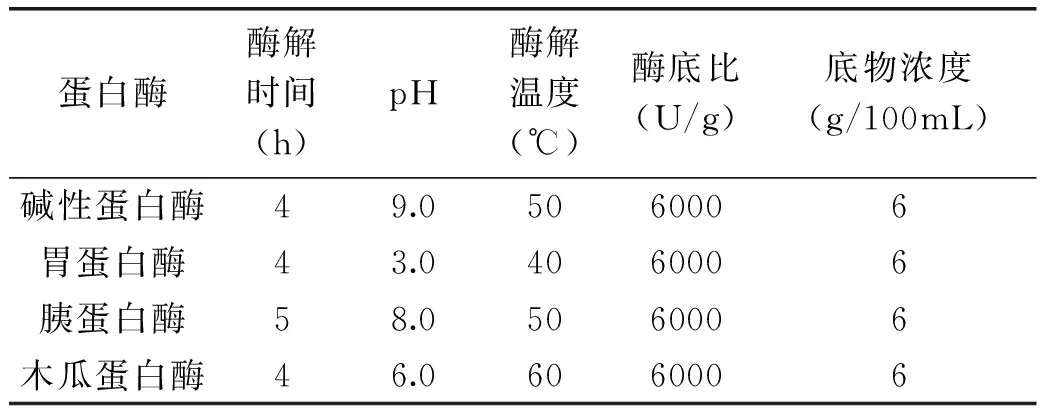
表1 各蛋白酶酶解条件[7-9]Table 1 Kinds of proteases enzyme conditions[7-9]
1.2.3单因素实验根据1.2.2实验结果,确定适合酶解的酶,再分别考察酶解时间、pH、酶解温度、酶与底物比(E/S)、底物质量浓度五种影响因素对酶解液脾淋巴细胞增殖率的影响。
1.2.3.1酶解时间的影响控制底物质量浓度6 g/100 mL、pH6、酶解温度60 ℃、酶与底物比6000 U/g,研究不同酶解时间2、3、4、5、6 h对酶解效果的影响。
1.2.3.2pH的影响控制底物质量浓度6 g/100 mL、酶解温度60 ℃、酶与底物比6000 U/g、酶解时间4 h,研究不同pH5.0、5.5、6.0、6.5、7.0对酶解效果的影响。
1.2.3.3酶解温度的影响控制底物质量浓度6 g/100 mL、pH6、酶底比6000 U/g、酶解时间4 h,研究不同酶解温度50、55、60、65、70 ℃对酶解效果的影响。
1.2.3.4酶与底物比(E/S)的影响控制底物质量浓度6 g/100 mL、酶解温度60 ℃、pH6、酶解时间4 h,研究不同酶与底物比4000、5000、6000、7000、8000 U/g对酶解效果的影响。
1.2.3.5底物质量浓度的影响控制pH6、酶与底物比6000 U/g、酶解时间4 h、酶解温度60 ℃,研究不同底物质量浓度2、4、6、8、10 g/100 mL对酶解效果的影响。
1.2.4正交实验根据单因素实验结果,采用L9(34)正交实验设计,以脾淋巴细胞增殖率为指标,选择酶解时间、pH、酶解温度、酶与底物比(E/S)进行工艺优化,其因素水平表见表2。
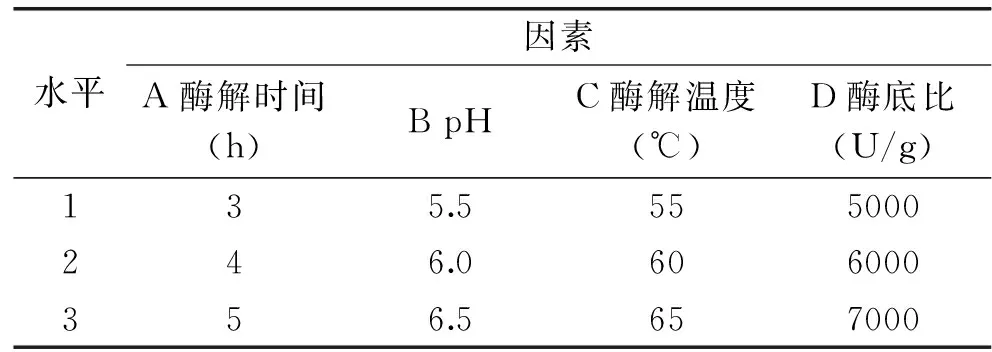
表2 正交实验设计因素水平表Table 2 Levels and factors of orthogonal experimental design
1.2.5指标测定
1.2.5.1蛋白质采用凯氏定氮法(GB 5009.5-2010)测定。
1.2.5.2酶活性采用福林酚法(SB/T 10317-1999)测定。
1.2.5.3肽含量的测定双缩脲法[10]。
1.2.5.4脾淋巴细胞增殖率采用MTT法测定。小鼠禁食12 h后,放于超净工作台上,用75%的酒精擦拭腹腔,剖开腹腔,取出小鼠脾脏,去除外周结缔组织,放于含有无菌Hanks液的平板中。用无菌注射器芯挤压研磨,用Hanks液洗3次,离心10 min(1500 r/min),弃上清液。然后加入2 mL的RPMI 1640完全培养液制成5.0×106个/mL[11-12]细胞悬浮液。
设实验组和对照组(均复设3孔)。将脾细胞悬液加入到96孔板中,100 μL/孔,空白组加入RPMI 1640细胞培养液,100 μL/孔,实验组加入酶解液,100 μL/孔。置于37 ℃下5% CO2培养箱中培养68 h,然后加50 μL MTT培养4 h后,于1500 r/min离心10 min后,每孔吸取150 μL上清液弃去,再每孔加入150 μL酸性异丙醇,吹打混匀,使紫色结晶完全溶解。室温下放置15 min后,用酶联免疫检测仪,以570 nm波长测定光密度值[13]。脾淋巴细胞增殖率按下式计算。
1.2.6数据分析方法利用Excel 提供的各种函数进行L9(34)正交实验数据的处理,利用SPSS中的Duncan法进行多组样本间差异显著性分析。
2 结果与分析
2.1蛋白酶的确定
碱性蛋白酶、胃蛋白酶、胰蛋白酶、木瓜蛋白酶酶解牦牛骨蛋白后对酶解液脾淋巴细胞增殖率的影响见表3。
从表3中可以看出:牦牛骨酶解产物对脾淋巴细胞有增殖作用。其中,木瓜蛋白酶酶解牦牛骨的产物对脾淋巴细胞的增殖作用最大,增殖作用最小的是胰蛋白酶,增殖作用从大到小依次为木瓜蛋白酶、胃蛋白酶、碱性蛋白酶、胰蛋白酶,所以木瓜蛋白酶对牦牛骨蛋白酶解效果最好,因此,选择木瓜蛋白酶为酶解牦牛骨蛋白制备免疫活性肽的适宜催化剂。

表3 4种蛋白酶对酶解效果的影响Table 3 The effect of four kinds of proteases on the enzymatic
注:表中不同小写字母之间存在显著性差异,p<0.05。
2.2单因素实验结果与分析
2.2.1酶解时间对酶解效果的影响由图1可知,酶解时间在2~4 h范围内,随着时间的增加,脾细胞增殖活性逐渐增强,时间为4 h时,脾淋巴细胞增殖率达到最高,超过4 h后增殖活性显著降低。这主要是因为在酶解初期,底物质量浓度较高,酶活性较高,酶解较快;但是酶解pH在酸性环境下,随着酶解时间的增加,底物逐渐被转化而导致酶解速度下降,产生的具有免疫活性的多肽被继续酶解成更小分子质量的小肽,使得脾细胞增殖活性显著降低。因此,选择酶解时间为3~5 h进行后续实验。

图1 酶解时间对酶解效果的影响Fig.1 Influence of time on the enzymatic hydrolysis注:图中不同小写字母之间存在显著性差异, p<0.05;图2~图5同。
2.2.2pH对酶解效果的影响由图2可知,pH在6.0之前,随着pH的升高,脾淋巴细胞增殖活性显著增强,在pH为6.0时,脾淋巴细胞增殖率达到最大;pH继续增大,脾淋巴细胞增殖活性显著降低。这是因为底物和酶的构象受pH的影响,进而影响酶与底物的结合,最终影响酶促催化效果。因此,选择pH为5.5~6.5进行后续实验。

图2 pH对酶解效果的影响Fig.2 Influence of pH on the enzymatic hydrolysis
2.2.3酶解温度对酶解效果的影响由图3可知,随着酶解温度升高,脾淋巴细胞增殖活性呈先升高后下降的趋势,主要是因为在一定范围内,随着温度升高,酶活力增强,反应速率加快;但太高的温度会使酶变性失活,产物形成方向发生转变。酶解产物的脾淋巴细胞活性在60 ℃时达到最大。因此,选择酶解温度为55~65 ℃进行后续实验。

图3 酶解温度对酶解效果的影响Fig.3 Influence of temperature on the enzymatic hydrolysis
2.2.4酶与底物浓度比对酶解效果的影响由图4可知,酶底比在4000~6000 U/g范围,随着酶底比的升高,脾淋巴细胞增殖率显著升高,酶底比为6000 U/g时,脾淋巴细胞增殖率达最大值,而后脾淋巴细胞增殖率开始下降。这主要是因为在底物充足的情况下,提高酶量可促进底物与酶结合,从而加快反应速率;但酶量持续增加至酶分子基本饱和后,而底物不足,使得反应速率降低,并且酶会作用于具免疫活性的肽链,使其降解。因此,选择酶底比为5000~7000 U/g进行后续实验。
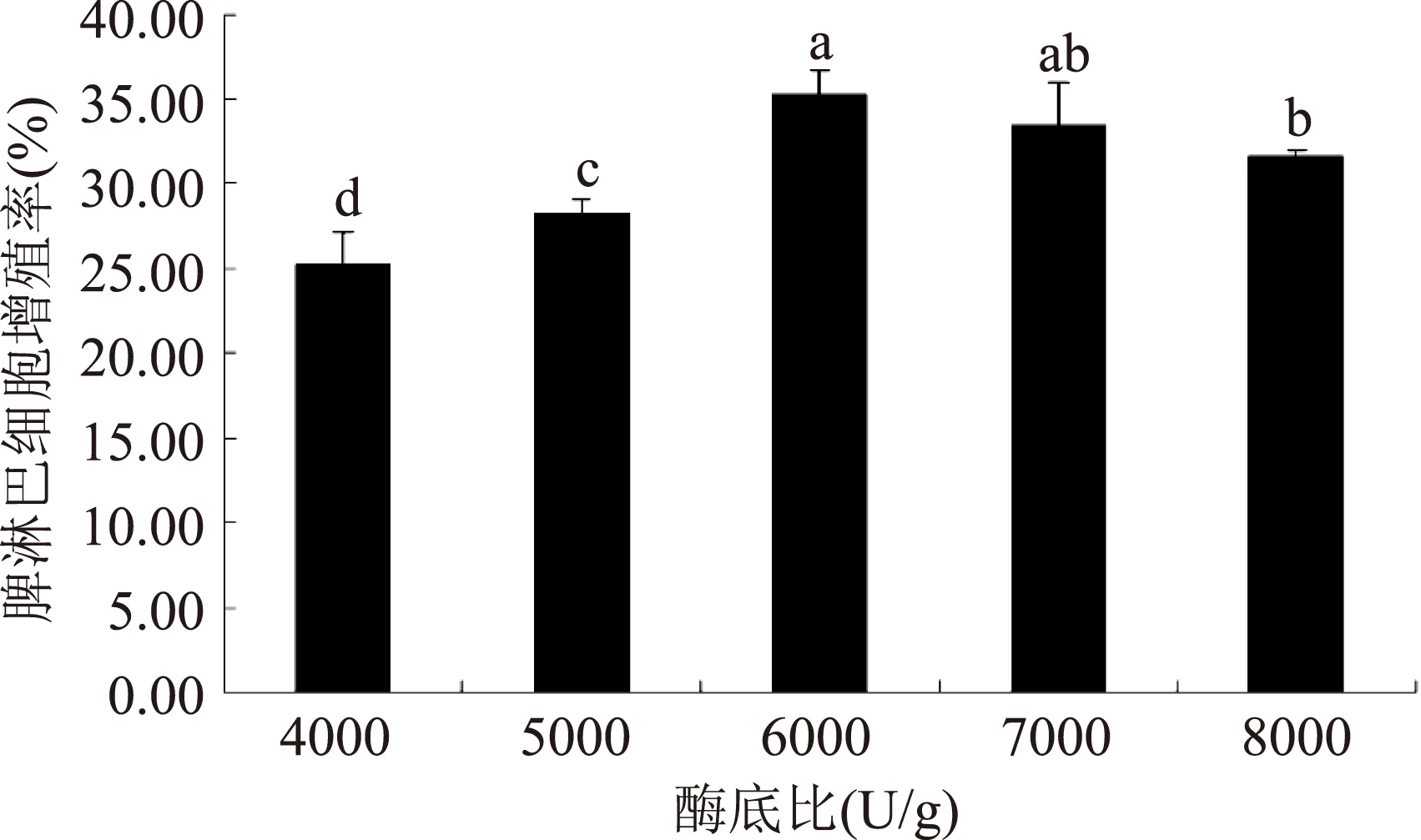
图4 酶与底物浓度比对酶解效果的影响Fig.4 Influence of E/S on the enzymatic hydrolysis
2.2.5底物浓度对酶解效果的影响当底物浓度太高,酶的活性部位被底物分子占据,使得酶促反应速度趋于极限;底物浓度过低时,酶的活性部位与底物分子结合几率减小,使得酶促反应速度减慢[14]。由图5可知,底物浓度在6 g/100 mL之前,随着底物浓度的增加,脾淋巴细胞增殖率显著升高,在6 g/100 mL时脾淋巴细胞增殖率达到最高,而后脾淋巴细胞增殖率显著降低,这可能是因为在底物质量浓度较低时,酶相对过量,随着浓度增大,酶与底物结合的几率提高,酶能充分发挥作用。由于底物浓度对酶解效果的影响较其它各因素的影响较小,所以木瓜蛋白酶酶解牦牛骨蛋白制备免疫活性肽的适宜底物质量浓度为6 g/100 mL。

图5 底物浓度对酶解效果的影响Fig.5 Influence of substrate concentration on the enzymatic hydrolysis
2.3正交实验
木瓜蛋白酶酶解牦牛骨蛋白制备免疫活性肽的正交优化实验结果及分析见表4和表5所示。

表4 正交实验结果Table 4 The results of orthogonal experiment

表5 脾淋巴细胞增殖率的方差分析表Table 5 Analysis of Variance on proliferation rates of spleen cell
通过极差分析和方差分析可知,在木瓜蛋白酶酶解牦牛骨蛋白制备免疫活性肽正交实验中,酶解时间、pH、酶解温度、酶与底物比(E/S)四个因素对脾淋巴细胞增殖活性作用的大小依次为:酶解时间>pH>酶解温度>酶与底物比(E/S),其中酶解时间的影响极显著(p<0.01),pH的影响显著(p<0.05),最佳工艺参数为:酶解时间4 h,pH6.5,酶解温度60 ℃,酶与底物比5000 U/g。此最优酶解条件下的活性肽浓度为1.92 g/100 mL。对优化后的参数进行3组验证性实验,酶解液脾淋巴细胞增殖率分别达到69.09%、73.62%、73.55%,平均值为72.09%,明显高于正交实验组合实验值。因此,木瓜蛋白酶酶解牦牛骨制备免疫活性肽的工艺参数准确可靠,具有较高实用价值。
3 结论
在选用的四种蛋白酶中,木瓜蛋白酶酶解制得的肽段脾淋巴细胞增殖活性最强,故选择其为酶解牦牛骨蛋白制备免疫活性肽的适宜催化剂;采用该酶酶解牦牛骨制备免疫活性肽的最佳工艺参数为:酶解时间4 h,pH6.5,酶解温度60 ℃,酶与底物比5000 U/g,底物质量浓度6 g/100 mL,对应的活性肽浓度为1.92 g/100 mL,此时脾淋巴细胞增殖率为72.09%。马俪珍[15]以鲶鱼头、骨为原料,分别用中性蛋白酶、碱性蛋白酶、胃蛋白酶、木瓜蛋白酶和胰蛋白酶对其酶解制备免疫活性肽,最终得出木瓜蛋白酶酶解制得的肽段脾淋巴细胞增殖活性最高,本研究与其结果一致。
本实验研究结果为牦牛骨资源的开发利用提供依据。但是,实验仅系统的研究了利用牦牛骨制备免疫活性肽的酶解条件,因此需要进一步探讨其分离纯化,以便其精细化利用。
[1]杨迎伍,张利,李正国. 畜骨的营养价值、开发现状及发展前景[J]. 食品科技,2002(1):60-61.
[2]周利兵. 青海高原牦牛骨和牦牛角中微量元素的化学计量分析[J]. 西北农业学报,2011,20(5):59-63.
[3]向聪,马美湖. 畜骨综合利用与产品开发研究进展[J]. 肉类研究,2009(6):78-84.
[4]Hu Hou,Yan Fan,Bafang Li,et al. Purification and identification of immunomodulating peptides from enzymatic hydrolysates of Alaska pollock frame[J]. Food Chemistry,2012,134(2):821-828.
[5]Hartmann R,Meisel H. Food-derived peptides with biological activity:from research to food applications[J]. Curr Opin Biotechnol,2007,18(2):163-169.
[6]Agyei D,Danquah M K. Industrial-scale manufacturing of pharmaceutical-grade bioactive peptides[J]. Biotechnol Adv,2011,29(3):272-277.
[7]蔡丽华,马美湖. 4种常用蛋白酶对牛骨蛋白的酶解动力学研究[J]. 食品科学,2010,31(5):150-154.
[8]李帆,贾冬英,姚开,等. 牦牛骨蛋白的酶解条件研究[J]. 氨基酸和生物资源,2006,28(4):7-10.
[9]曾珍. 猪骨免疫活性肽的酶解工艺优化及其分离纯化的研究[D]. 雅安:四川农业大学,2014.
[10]鲁伟,任国谱,宋俊梅. 蛋白水解液中多肽含量的测定方法[J]. 食品科学,2005,26(7):167-171.
[11]刘建文,殷明,季光,等. 药理实验方法学——新技术与新方法[M]. 北京:化学工业出版社,2008:128-131.
[12]司书毅,张月琴. 药物筛选——方法与实践[M]. 北京:化学工业出版社,2007:341.
[13]中华人民共和国卫生部. 保健食品检验与评价技术规范(2003年版)[M]. 北京中华人民共和国卫生部,2003:20-25.
[14]Ali B,Naima N A,Laila M,et al. Purification and identificationof novel antioxidant peptides from enzymatic hydrolysates of sardinelle(Sardinellaaurita)by-products proteins[J]. Food Chemistry,2010,118(3):559-565.
[15]马俪珍,甄润英,张建荣,等. 具免疫活性的鲶鱼胶原多肽酶解工艺研究[J]. 食品工业科技,2008(4):152-155.
Study on yak bone immune active peptide preparation by enzymatic hydrolysis
QU Yuan,LI Cheng*,CHENG Le-tao,XIA Chun-ming,YAN Fang-fang
(College of Food Science,Sichuan Agricultural University,Ya’an 625014,China)
The proliferation of hydrolysates on spleen lymphocyte was selected as an indicator. The effects of alkaline protease,pepsin,trypsin and papain on the hydrolysis of yak bone were compared. Based on single factor experiment,orthogonal experiment was used to optimize the enzymatic hydrolysis conditions for immune active peptide preparation. The result showed that papain was suitable for producing yak bone immune active peptide and the optimum enzymatic hydrolysis conditions were determined as follows:4 h of enzymatic hydrolysis time,6.5 of pH,60 ℃ of enzymatic hydrolysis temperature,5000 U/g of ratio of enzyme and substrate,6 g/100 mL of substrate concentration,and the corresponding active peptide concentration was 1.92 g/100 mL. Under such conditions,the proliferation rates of spleen lymphocyte was 72.09%.
yak bone;immune active peptide;papain;enzymatic hydrolysis;spleen lymphocyte
2015-06-03
瞿瑗(1993-),女,本科,研究方向:食品质量与安全(食品检测技术方向),E-mail:112119120a@163.com。
李诚(1962-),男,硕士,教授,研究方向:畜产品质量及安全控制,E-mail:lichenglcp@163.com。
四川省科技成果转化项目“牦牛壮骨面产业化开发研究”(13CGZHZX0206)。
TS251.94
B
1002-0306(2016)03-0271-05
10.13386/j.issn1002-0306.2016.03.048

