阿魏酸对人胃癌MGC-803细胞增殖的影响
张艳,李海龙,王虎平,,顾静,马春林,,吴红彦,.甘肃中医药大学基础医学院,甘肃 兰州 730000;.甘肃省中医方药挖掘与创新转化重点实验室,甘肃省中药新产品创制工程实验室,甘肃 兰州 730000
阿魏酸对人胃癌MGC-803细胞增殖的影响
张艳1,李海龙2,王虎平1,2,顾静2,马春林1,2,吴红彦1,2
1.甘肃中医药大学基础医学院,甘肃 兰州 730000;
2.甘肃省中医方药挖掘与创新转化重点实验室,甘肃省中药新产品创制工程实验室,甘肃 兰州 730000
目的 观察阿魏酸对人胃癌MGC-803细胞增殖的影响,探讨其诱导胃癌细胞凋亡的作用机制。方法 不同浓度阿魏酸干预体外培养人胃癌MGC-803细胞,作用24、48、72 h后,MTT法检测细胞增殖;不同浓度(0、5、7.5、10 mg/mL)阿魏酸作用MGC-803细胞48 h,Annexin V-FITC/PI法和流式细胞仪检测细胞凋亡,RT-qPCR和Western-blot检测Capase-3、Capase-9、Bax、Bcl-2和Xiap的mRNA和蛋白表达。结果 与对照组比较,5、7.5、10、12.5 mg/mL阿魏酸作用MGC-803细胞的OD值明显降低,阿魏酸抑瘤作用明显,阿魏酸作用MGC-803细胞24、48、72 h的IC50分别为12.93、9.73、5.52 mg/mL;5、7.5、10 mg/mL阿魏酸作用MGC-803细胞48 h后均能诱导MGC-803细胞凋亡,5、7.5、10 mg/mL阿魏酸均能上调Capase-3、Capase-9和Bax的mRNA和蛋白表达,下调Bcl-2和Xiap的mRNA和蛋白表达。结论 阿魏酸能有效抑制MGC-803细胞增殖,并能诱导MGC-803细胞凋亡,其作用机制与内源性线粒体凋亡途径和下调Xiap的表达有关。
阿魏酸;胃癌;细胞增殖;细胞凋亡
阿魏酸是多种中药如川芎、当归、升麻、木贼、蒲公英、酸枣仁等的有效成分之一,现代药理研究表明,阿魏酸具有抗氧化、抗动脉粥样硬化、抗炎、抗凝、解毒、保肝、调节免疫等功效[1]。近年来研究发现,阿魏酸乙酯可抑制胃癌SGC-7901细胞增殖并且诱导凋亡[2]。然而,阿魏酸是否可抑制胃癌SGC-7901细胞增殖并且诱导凋亡尚不清楚。本实验拟用阿魏酸干预胃癌MGC-803细胞,观察其对胃癌细胞增殖的影响,并探讨其诱导胃癌细胞凋亡的机制。
1 实验材料
1.1细胞株
胃癌MGC-803细胞,北京协和肿瘤研究所。
1.2主要试剂与仪器
高糖DMED培养基(健顺生物公司),胎牛血清(杭州四季青公司),阿魏酸(上海紫一试剂厂),反转录试剂盒(大连宝生物公司),PCR扩增试剂盒(上海柏业生物公司),一抗兔抗Caspase-3、Caspase-9、Bcl-2、Bax、Xiap和GAPDH(Affinity公司),二抗(Immunoway生物公司),噻唑蓝(MTT,北京索来宝科技有限公司)。CO2培养箱(力康公司),低温离心机(Beckman公司),电泳仪(北京六一仪器厂),微量上样器(上海生工生物工程有限公司)。
2 实验方法
2.1细胞培养
用含10%FBS高糖DMEM,加入青霉素100 U/mL、链霉素 1 mg/mL,37 ℃、5%CO2培养箱常规培养MGC-803细胞。每隔2 d换完全培养基,待细胞密度达90%时按1∶2比例传代。取对数期细胞用于下一步实验。
2.2MTT法检测细胞增殖
取对数生长期胃癌细胞,制成单细胞悬液,细胞计数,按照5×103个/mL密度接种于96孔板,每孔100 μL(另设只加PBS的空白调零孔),每组8孔,37 ℃孵育过夜。正常组加100 μL DMEM完全培养基,药物组加80 μL DMEM完全培养基及药物20 μL,使终体积为200 μL。药物作用24、48、72 h后各组每孔加20 μL MTT,继续孵育4 h,小心吸去上清液,每孔加150 μL二甲基亚砜(DMSO),振荡10 min,于酶标仪波长490 nm处检测各孔光密度(OD)值,计算细胞抑制率。细胞抑制率(%)=1-(实验组平均值÷对照组平均值)×100%。
2.3流式细胞术检测细胞凋亡
不同浓度阿魏酸(0、5、7.5、10 mg/mL)作用于对数期MGC-803细胞48 h,用胰酶消化并收集细胞,用PBS洗涤细胞并吹打成细胞悬液,取部分细胞悬液加入Binding Buffer,再加5 μL Annexin V混匀后,加5 μL碘化丙啶混匀,室温、避光反应10 min,流式细胞仪检测。实验重复3次。
2.4RT-qPCR检测 Caspase-3、Caspase-9、Bcl-2 和Bax mRNA表达
不同浓度阿魏酸(0、5、7.5、10 mg/mL)作用于对数期MGC-803细胞48 h,提取各加药组和对照组(只加培养液)的总RNA,37 ℃、15 min,85 ℃、5 s反转录成cDNA,PCR引物均由大连宝生物公司合成(见表1)。扩增条件:95 ℃、10 min,95 ℃、15 s,60 ℃、30 s,40个循环扩增,RT-qPCR检测Caspase-3、Caspase-9、Bcl-2和Bax的mRNA表达,实验重复3次。PCR反应结束后分析融解曲线,从而判定扩增产物是否有非特异性扩增;分析扩增曲线,计算Ct值,2‾ΔΔCt法计算基因的相对表达量。

表1 PCR引物序列
2.5Western blot检测 Caspase-3、Caspase-9、Bcl-2和Bax蛋白表达
不同浓度阿魏酸(0、5、7.5、10 mg/mL)作用于对数生长期MGC-803细胞干预48 h,加入蛋白裂解液(RIPA∶PMSF=100∶1)提取总蛋白,将蛋白煮沸变性后,经8%SDS-PAGE凝胶电泳将蛋白分离,湿转至 PVDF膜上,5%脱脂奶粉封闭 1.5 h,一抗(Caspase-3、Caspase-9、Bcl-2、Bax和Xiap)孵育过夜,TBST洗膜3次,二抗孵育2 h,TBST洗膜3次,加入ECL于Bio-rad凝胶成像仪中进行反应,采用美国Image J2x软件对Western blot结果进行定量分析,灰度值以累积吸光度值表示,结果以目的蛋白与GAPDH累积吸光度的比值表示。
3 统计学方法
4 结果
4.1阿魏酸对胃癌MGC-803细胞增殖的影响
与对照组比较,5、7.5、10、12.5 mg/mL阿魏酸作用胃癌MGC-803细胞各时点OD值明显降低,阿魏酸各剂量组抑瘤作用明显,差异有统计学意义(P<0.05,P<0.01),并与浓度呈正相关,见表2。阿魏酸作用胃癌MGC-803细胞24、48、72 h的IC50分别为12.93、9.73、5.52 mg/mL。
表2 各组胃癌MGC-803细胞增殖比较(±s)
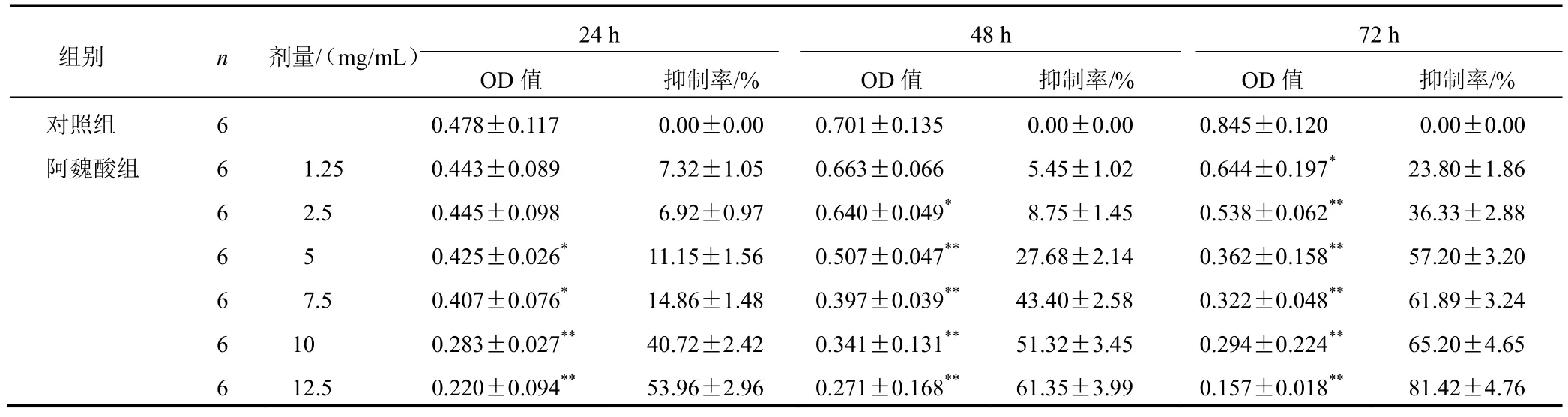
表2 各组胃癌MGC-803细胞增殖比较(±s)
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001(下同)
组别 n 剂量/(mg/mL) 24 h 48 h 72 h OD值 抑制率/% OD值 抑制率/% OD值 抑制率/%对照组 6 0.478±0.117 0.00±0.00 0.701±0.135 0.00±0.00 0.845±0.120 0.00±0.00阿魏酸组 6 1.25 0.443±0.089 7.32±1.05 0.663±0.066 5.45±1.02 0.644±0.197* 23.80±1.86 6 2.5 0.445±0.098 6.92±0.97 0.640±0.049* 8.75±1.45 0.538±0.062** 36.33±2.88 6 5 0.425±0.026* 11.15±1.56 0.507±0.047** 27.68±2.14 0.362±0.158** 57.20±3.20 6 7.5 0.407±0.076* 14.86±1.48 0.397±0.039** 43.40±2.58 0.322±0.048** 61.89±3.24 6 10 0.283±0.027** 40.72±2.42 0.341±0.131** 51.32±3.45 0.294±0.224** 65.20±4.65 6 12.5 0.220±0.094** 53.96±2.96 0.271±0.168** 61.35±3.99 0.157±0.018** 81.42±4.76
4.2阿魏酸对胃癌MGC-803细胞凋亡的影响
流式细胞术检测显示,5、7.5、10 mg/mL阿魏酸可明显诱导人胃癌MGC-803细胞发生凋亡,见图1。其细胞凋亡率分别为(22.47±3.20)%、(47.45± 8.76)%、(74.55±10.34)%,较对照组(2.50±0.42)%明显升高。
4.3阿魏酸对胃癌 MGC-803细胞 Caspase-3、Caspase-9、Bcl-2、Bax和Xiap mRNA表达的影响
与对照组比较,5、7.5、10 mg/mL阿魏酸可使胃癌MGC-803细胞Caspase-3、Caspase-9、Bax mRNA表达上调,Bcl-2和Xiap mRNA表达下调,差异有统计学意义(P<0.01,P<0.001),溶解曲线分析表明扩增产物特异性好。结果见表3。
表3 各组胃癌MGC-803细胞Caspase-3、Caspase-9、Bax、Bcl-2和Xiap mRNA表达比较(±s)

表3 各组胃癌MGC-803细胞Caspase-3、Caspase-9、Bax、Bcl-2和Xiap mRNA表达比较(±s)
组别 n 剂量/(mg /mL) Caspase-3 Caspase-9 Bax Bcl-2 Xiap对照组 3 1 1 1 1 1阿魏酸组 3 5 1.569±0.629** 1.979±0.402*** 3.405±0.440*** 0.765±0.081*** 0.073±0.048***3 7.5 1.752±0.649** 2.930±0.771*** 4.084±1.135*** 0.512±0.064*** 0.067±0.006***3 10 2.401±1.152*** 3.375±0.880*** 7.224±1.100*** 0.168±0.035*** 0.051±0.002***
4.4阿魏酸对胃癌 MGC-803细胞 Caspase-3、Caspase-9、Bcl-2、Bax和Xiap蛋白表达的影响
与对照组比较,5、7.5、10 mg/mL阿魏酸可使胃癌MGC-803细胞Caspase-3、Caspase-9、Bax蛋白表达不同程度上调,Bcl-2和Xiap蛋白表达不同程度下调(P<0.05,P<0.001)。结果见表4、图2。
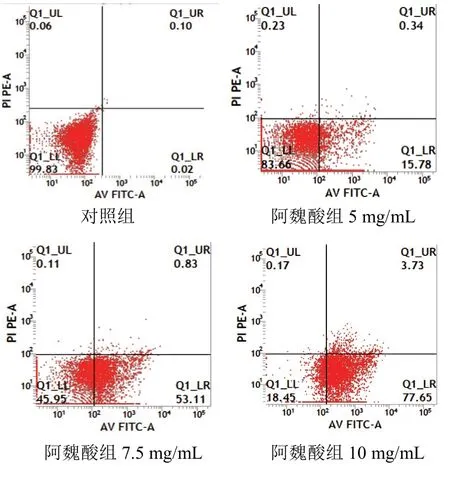
图1 各组胃癌MGC-803细胞凋亡流式细胞图
表4 各组胃癌MGC-803细胞Caspase-3、Caspase-9、Bax、Bcl-2和Xiap蛋白表达比较(±s)
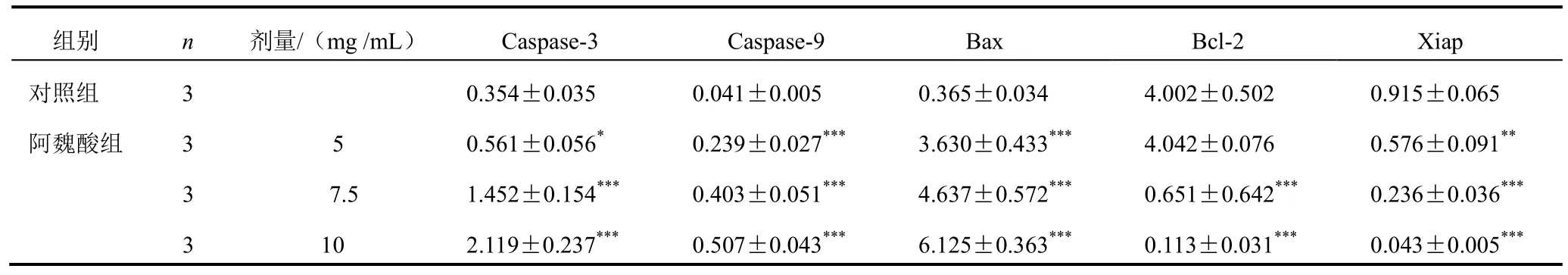
表4 各组胃癌MGC-803细胞Caspase-3、Caspase-9、Bax、Bcl-2和Xiap蛋白表达比较(±s)
组别 n 剂量/(mg /mL) Caspase-3 Caspase-9 Bax Bcl-2 Xiap对照组 3 0.354±0.035 0.041±0.005 0.365±0.034 4.002±0.502 0.915±0.065阿魏酸组 3 5 0.561±0.056* 0.239±0.027*** 3.630±0.433*** 4.042±0.076 0.576±0.091**3 7.5 1.452±0.154*** 0.403±0.051*** 4.637±0.572*** 0.651±0.642*** 0.236±0.036***3 10 2.119±0.237*** 0.507±0.043*** 6.125±0.363*** 0.113±0.031*** 0.043±0.005***
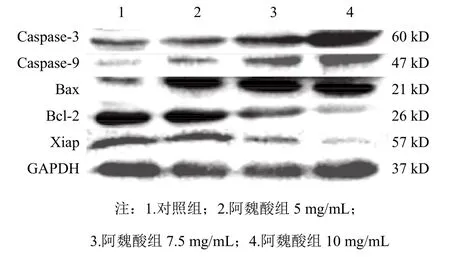
图2 各组胃癌MGC-803细胞Caspase-3、Caspase-9、Bax、Bcl-2 和Xiap蛋白表达免疫印迹电泳图
5 讨论
细胞凋亡是一种有序的或程序性的死亡方式,受多种基因调控,是细胞核受某些特定信号刺激后进行的正常生理反应。细胞凋亡途径包括线粒体凋亡途径、内质网信号途径、死亡受体途径。细胞凋亡的启动和进行受到精确调控,具有独特而复杂的信号传导系统,其中,Bax和Bcl-2是Bcl-2家族的2个成员,通常以复合物的形式存在。前者为促凋亡因子,后者为抗凋亡因子,在细胞凋亡过程,促凋亡蛋白Bax可促进线粒体通透性转变而开放,进而导致线粒体膜电位的下降,细胞色素C释放,进而激活Caspase,最终导致细胞死亡。抗凋亡蛋白Bcl-2则可拮抗Bax的上述作用而抑制细胞凋亡。Caspase-3是Caspase家族中最重要的细胞凋亡执行者之一,在蛋白酶级联切割过程中处于核心位置,一旦Caspase被激活就会导致细胞凋亡。它可以通过死亡受体介导途径与线粒体依赖途径来诱发细胞凋亡,Caspase-9属于上游起始Caspase,主要在内源性细胞凋亡途径中活化从而激活效应Caspase-3导致细胞凋亡[3]。
Xiap充当凋亡抑制蛋白,并可能与通过其BIR2 和BIR3结构域与Caspase-9的相互作用,抑制其活化并因此激活下游 Caspase-3[4]。相关研究表明,使用siRNA技术沉默Xiap基因后,可抑制骨肉瘤细胞的生长,并增加细胞死亡[5];增强骨肉瘤细胞对阿霉素、顺铂的敏感度[6],增加白血病细胞[7]和膀胱癌细胞[8]对阿霉素诱导的细胞凋亡的敏感度。慢病毒介导的shRNA沉默Xiap基因后在体外和体内抑制SW1990胰腺癌细胞的增殖[9]。
本实验结果显示,5、7.5、10 mg/mL阿魏酸可使MGC-803胃癌细胞 Caspase-3、Caspase-9、Bax的mRNA和蛋白表达不同程度上调,Bcl-2和 Xiap的mRNA和蛋白表达不同程度下调,表明阿魏酸可能通过 Bcl-2、Bax蛋白表达的改变进而通过上述途径导致线粒体膜电位下降,细胞色素 C释放,Caspase-9 和Caspase-3激活,导致细胞凋亡。因此,阿魏酸诱导胃癌 MGC-803细胞凋亡通过线粒体途径发挥作用。阿魏酸及其钠盐发挥抗肿瘤作用涉及诱导细胞凋亡、化疗增敏、抗血管生成等多个方面[10],其中诱导凋亡是阿魏酸发挥抗肿瘤作用的重要途径之一,而其他作用机制仍有待进一步研究。
[1]马逢时,李家明,李传润,等.阿魏酸衍生物及其生物活性[J].药学进展,2008,32(8):345-350.
[2]喻丽红,唐福才,胡娅嫚,等.阿魏酸乙酯对胃癌 SGC-7901细胞增殖及凋亡的影响[J].广东医学,2015,36(5):693-696.
[3]GUICCUARDI M E, GORSE G J. Life and death by death receptors[J]. FASEB J,2009,23(6):1625-1637.
[4]MANSOURI A, ZHANG Q, RIDGWAY L D, et al. Cisplatin resistance inan ovarian carcinoma is associated with a defect in programmed cell death control through XIAP regulation[J]. Oncol Res,2003,13(6-10):399-404.
[5]KIM D W, SEO S W, CHO S K, et al. Targeting of cell survival genes using small interfering RNAs (siRNAs) enhances radiosensitivity of Grade Ⅱ chondrosarcoma cells[J]. J Orthop Res,2007,25(6):820-828.
[6]QU Y, XIA P, ZHANG S, et al. Silencing XIAP suppresses osteosarcoma cell growth, and enhances the sensitivity of osteosarcoma cells to doxorubicin and cisplatin[J]. Oncol Rep,2015,33(3):1177-1184.
[7]LIU J, ZHANG X, LIU A, et al. Berberine induces apoptosis in p53-null leukemia cells by down-regulating XIAP at the posttranscriptional level[J]. Cell Phy Biochem,2013,32(5):1213-1224.
[8]KUNZE D, KRAEMER K, ERDMANN K, et al. Simultaneous siRNA-mediated knockdown of antiapoptotic BCL2, Bcl-xL, XIAP and survivin in bladder cancer cells[J]. Int J Oncol,2012,41(4):1271-1277.
[9]JIANG C, TAN T, YI X P, et al. Lentivirus-mediated shRNA targeting XIAP and survivin inhibit SW1990 pancreatic cancer cell proliferation in vitro and in vivo[J]. Mol Med Rep,2011,4(4):667-674.
[10]刘宝瑞,钱晓萍,孟宪志,等.阿魏酸钠对人大肠癌 Moser细胞和乳腺癌MCT7细胞增殖和凋亡的影响[J].中国中西医结合杂志,2002,22(6):188-190.
(修回日期:2015-12-01;编辑:华强)
Effects of Ferulic Acid on Gastric Cancer Cell Line MGC-803 Proliferation
ZHANG Yan1,LI Hai-long2, WANG Hu-ping1,2, GU Jing2, MA Chun-lin1,2, WU Hong-yan1,2(1. Basic Medical School, Gansu University of Chinese Medicine, Lanzhou 730000, China; 2. Key Laboratory of Traditional Chinese Herbs and Prescription Innovation and Transformation of Gansu Province, Key Laboratory for TCM New Products Development Engineering of Gansu Province, Lanzhou 730000, China)
Objective To explore the effects of ferulic acid on gastric cancer cell line MGC-803 proliferation; To discuss the mechanism of apoptosis induced by ferulic acid. Methods Ferulic acid with a variety of concentrations was used to treat gastric cancer cell line MGC-803 for 24, 48, 72 h; MTT experiment was used to detect the growth of gastric cancer cells. After gastric cancer cell line MGC-803 were treated with ferulic acid with a variety of concentrations (0, 5, 7.5, 10 mg/mL) for 48 h, all gastric cancer cells were collected and stained by Annexin V-FITC/PI for the detection of apoptosis by flow cytometry. RT-qPCR and Western-blot methods were used to detect mRNA and protein levels of Caspase-3, Caspase-9, Bax, Bcl-2 and Xiap. Results Compared with the control group,the OD value of cell line MGC-803 treated by ferulic acid with a variety of concentrations (5, 7.5, 10, 12.5 mg/mL)decreased significantly; the anti-tumor effect of ferulic acid was obvious; IC50of 24, 48, and 72 hours after treated by ferulic acid was 12.93, 9.73 and 5.52 mg/mL respectively. Cell lineMGC-803 treated by ferulic acid with a variety of concentrations (5, 7.5, 10 mg/mL) after 48 h could induce the apoptosis of MGC-803 cells, up-regulate mRNA and protein levels of Caspase-3, Caspase-9, and Bax, down-regulate mRNA and protein levels of Bcl-2 and Xiap. Conclusion Ferulic acid can inhibit the proliferation of MGC-803 cells effectively and induce the apoptosis of MGC-803 cells, which mechanism is related to mitochondria apoptosis pathway and the down-regulation of Xiap expression.
ferulic acid; gastric cancer; cell proliferation; cell apoptosis
10.3969/j.issn.1005-5304.2016.09.017
R285.5
A
1005-5304(2016)09-0070-04
甘肃省自然科学基金(1212RJZA083)
吴红彦,E-mail:2012964366@qq.com
2015-10-23)

