正交试验法优化稗属植物 ISSR-PCR反应体系
刘德好,陆永良,娄玉霞,郭水良*(上海师范大学生命与环境科学学院,上海 0034;中国水稻研究所,杭州 30006)
正交试验法优化稗属植物ISSR-PCR反应体系
刘德好1,陆永良2,娄玉霞1,郭水良1*
(1上海师范大学生命与环境科学学院,上海200234;2中国水稻研究所,杭州310006)
利用正交设计方法,对稗属植物ISSR-PCR反应体系的4个因素(TaqdNA聚合酶、引物、dNTPs和模板DNA)在4个水平上进行优化,建立了稗属植物ISSR-PCR的最佳反应体系(20μL):TaqdNA聚合酶0.5 U、引物0.1μmol/L、dNTPs 200μmol/L、DNA模板150 ng。共筛选出9条适合稗属植物ISSR-PCR的引物,并确定了每条引物的最适退火温度,可为后续利用ISSR技术开展稗属植物鉴定和多样性研究提供技术支持。
稗属植物;正交设计;ISSR-PCR;反应体系
稗属(Echinochloa Beauv.)杂草是一种在全球范围均有分布的恶性杂草,对农作物造成了严重的危害。受生态环境、耕作方式等多方面因素的影响,稗属种内在形态甚至基因上都出现了不同程度的变异,增加了稗属杂草的分类以及防除的难度[1]。ISSR分子标记技术有相对可靠的稳定性和重复性,具有多态性水平高、DNA用量少和成本低等优点,已广泛应用于遗传多样性分析和种质鉴别等研究[2-3]。
ISSR是一种基于PCR的分子标记技术,不同的反应体系和反应程序会导致不同的结果,为了得到稳定可靠的试验结果,对ISSR-PCR反应体系进行优化十分必要。本试验采用正交设计法对稗属植物ISSRPCR反应体系的4个因素(TaqdNA聚合酶、引物、dNTPs和模板DNA)在4个水平上进行优化,以期建立稗属植物最优反应体系,为其遗传多样性分析和种质鉴别提供技术依据。
1 材料与方法
1.1材料
本试验所用材料为长芒稗(Echinochloa caudata Roshev.),采自福建省三明市尤溪县新阳镇大坋村。
1.2试剂
TAKARA LA Taq(Code No.RR02MA),附带试剂10×LA PCR BufferⅡ(Mg2+Plus)、dNTPs Mixture (2.5 mmol/L each)。采用哥伦比亚大学设计公布的ISSR引物(http://www.michaelsmith.ubc.ca/services/ NAPS/Primer_Sets/Primers_Oct2006.pdf),由上海生工合成。
1.3方法
1.3.1DNA的提取和浓度检测
使用天根植物基因组试剂盒提取长芒稗叶片DNA,利用BeckmandU-640核酸蛋白分析仪测定DNA浓度和纯度。DNA样品保存于-20℃冰箱中备用,作为PCR扩增的模板。
1.3.2PCR正交试验的设计
针对酶量、模板DNA、dNTPs及引物4个因素设计4个水平(表1),选用L16(4×4)正交表,设计PCR扩增体系优化的因素-水平正交设计试验表(表2)。

表 1 正交设计水平因素表Table 1 Factors and levels of orthogonaldesign

表 2 稗属植物 ISSR-PCR正交试验设计表 L16(4×4)Table 2 ISSR-PCR reaction of L16(4×4)for Echinochloa
试验共设16个处理,每个处理重复3次,反应体系20μL,引物选用UBC807。反应程序:94℃预变性5 min;94℃变性30s,52℃退火30s,72℃复性1 min,35个循环;72℃下延伸10 min后,4℃保存。PCR产物使用1%琼脂糖凝胶电泳,电泳电压100 V,电泳50 min。以2 000 bpdNA标准分子量作为分子量标记。使用Tanon 2500凝胶图像分析系统进行拍照和分析。
1.3.3引物的筛选和退火温度的确定
由于每个引物的碱基序列不一样,同一序列在不同物种基因组中出现的频率也不一致,在合成的100个引物中不是所有的引物都可以扩增出稳定的条带,扩增出的条带也不一定具有多样性,所以在正式试验前需要对90个引物进行初步的筛选。本试验选取长芒稗DNA作为模板,用正交试验所得最佳反应条件对90个引物进行扩增,选取扩增条带丰富、背景清晰和稳定性好的引物。
退火温度不仅和引物的序列有关,而且和物种基因组序列有关[4]。同一引物在对不同物种基因组进行扩增时,所需要的最佳退火温度也是不一致的。因此,适宜的退火温度对于稗属植物ISSR扩增反应的结果十分重要。本试验退火温度的跨度设置为12℃,由PCR仪自动生成12个温度梯度。对所筛选出的所有引物逐一进行温度梯度PCR,以确定每个引物的最佳退火温度。使用正交试验得到的最佳反应体系对哥伦比亚大学设计并公布的100条ISSR常用引物进行筛选,并采用温度梯度PCR模式,设定温度48—60℃,自动生成12个温度梯度:48.0℃、48.3℃、49.0℃、50.2℃、51.7℃、53.3℃、54.7℃、56.3℃、57.8℃、59.0℃、59.7℃、60.0℃,逐一确定特异性引物的最适退火温度。
1.3.4正交试验结果的极差和方差分析
参照何正文等[5]的方法,依据电泳条带丰富度、清晰度和背景色深度对16个泳道分别进行赋值:条带最丰富、主带清晰以及背景亮度低为最佳,定为16分;与此相反的则评为1分。3次重复试验独立评分,合并统计分析。统计同一水平下各因素的分数之和(K1、K2、K3和K4),计算出各因素的极差R。极差一定程度上反应了该因素对整个反应体系的影响程度,极差越大,表明该因素对反应的影响越强烈。
以各因素对4个水平下的3次重复处理的电泳结果(赋值)为基础,对各因素在4个不同处理水平之间的差异作单因素方差分析。
2 结果与分析
2.1稗属植物ISSR-PCR反应体系的优化
2.1.1正交试验结果的对比分析
扩增产物凝胶电泳结果(图1)表明,处理T4、T6、T7、T12和T13条带数较多,处理T12和T13主带明亮、背景清晰。因此,用直接对比法可以推断出处理T12和T13对于稗属植物ISSR-PCR扩增结果最好。

图1 正交试验 PCR产物电泳图Fig.1 PCR electrophoresis map of orthogonal tests
2.1.2正交试验结果的极差分析
正交试验各因素处理水平和对应处理所得结果的赋值累积分见表3,各因素在4个处理水平下的试验结果赋值累积总值的极差见表4。16个处理中,累积分值以T12、T13较大,分别为46和47(表3),各因素的极差由大到小分别是dNTPs(85)、引物(57)、Taq酶(43)和DNA模板(36)(表4),即dNTPs对稗属植物ISSR-PCR反应影响最显著,引物次之,随后是Taq酶,模板对反应结果的影响最弱。
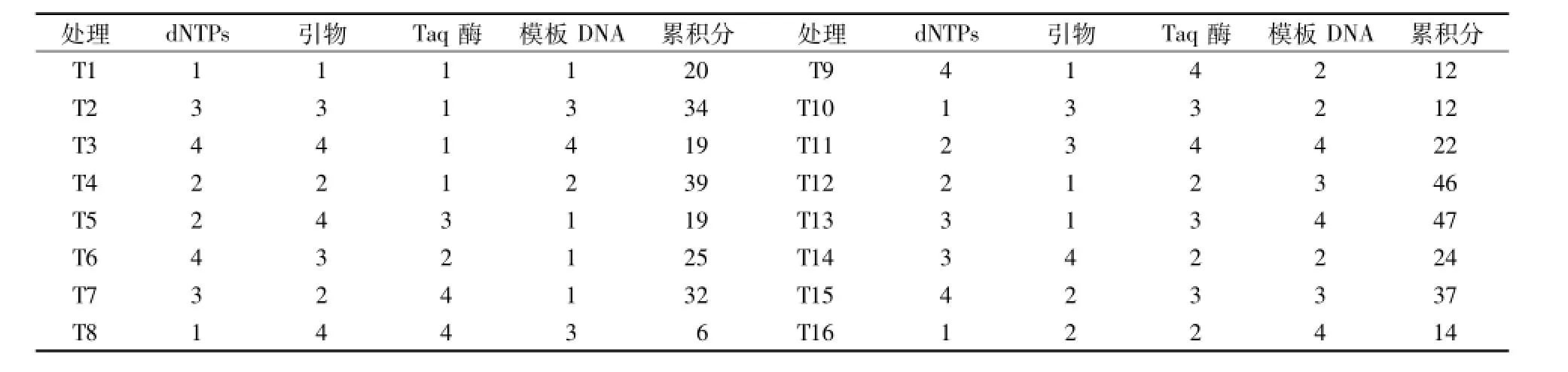
表3 正交试验各因素处理水平和对应处理所得结果的赋值累积分Table 3 Levels of each factor of orthogonal tests and their assignment cumulativescores

表4 dNTPs、引物、Taq酶和模板在4个处理水平下的分别累积分总和及极差Table 4 Total assigned values and range ofdNTPs,primer,TaqdNA polymerase and template of 4 treatment levels
2.1.3各因素对ISSR-PCR扩增影响的方差分析
方差分析同样表明,dNTPs不同浓度水平对稗属植物ISSR扩增反应结果的影响最为显著,引物浓度次之,模板浓度对反应的影响最小(表5)。
图2直观地表达了dNTPs、引物、Taq酶和模板DNA浓度对ISSR-PCR反应的影响,结果表明:dTNPs浓度在200—300μmol/L、引物浓度在0.1μmol/L、Taq酶在1.5 U、模板DNA在150 ng时有最好的扩增结果,对应的处理分别是12和13。
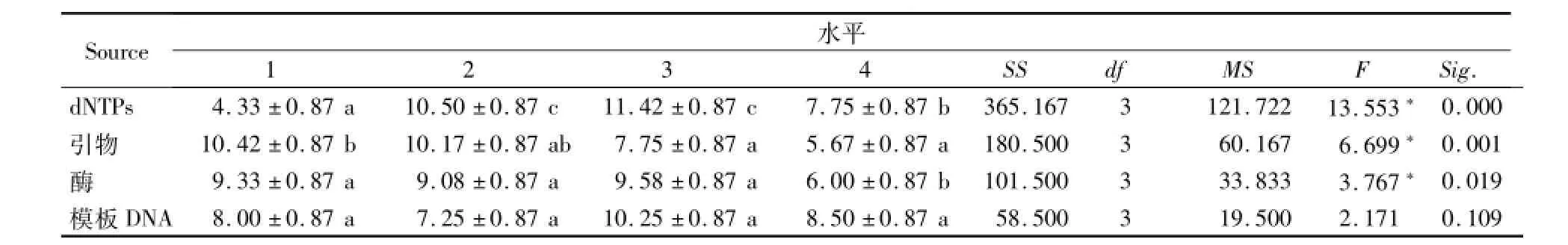
表5 ISSR-PCR正交试验各因素间的方差分析Table 5 Variance analysis for factors of orthogonal tests of ISSR-PCR

图2 各因素的不同水平对稗属植物 ISSR-PCR反应的影响Fig.2 Influence ofdifferent levels of each factor on ISSR-PCR reaction of Echinochloa
2.2稗属植物ISSR-PCR扩增引物的筛选和退火温度的确定
本试验选取长芒稗作为模板,用正交试验所得最佳反应条件对90个引物进行扩增,选取扩增条带丰富、背景清晰和稳定性好的引物。经过PCR扩增对90条引物进行筛选后,对筛选出的引物逐一进行温度梯度PCR,结果发现808、826、827、856、857、888、889、890、891这9条引物有较好的扩增结果(图3)。对筛选出的9条引物逐一进行温度梯度PCR,确定每个引物的最佳退火温度(图4、表6)。
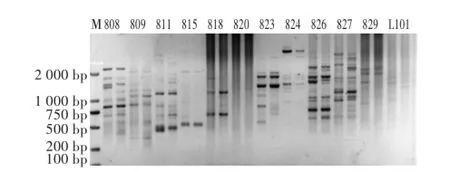
图3 筛选引物的PCR产物部分电泳图Fig.3 Partial electrophoresis map of PCR forscreening primers

图4 部分引物的温度梯度 PCR产物电泳图Fig.4 Electrophoresis map oftemperaturegradient PCR ofsome primers
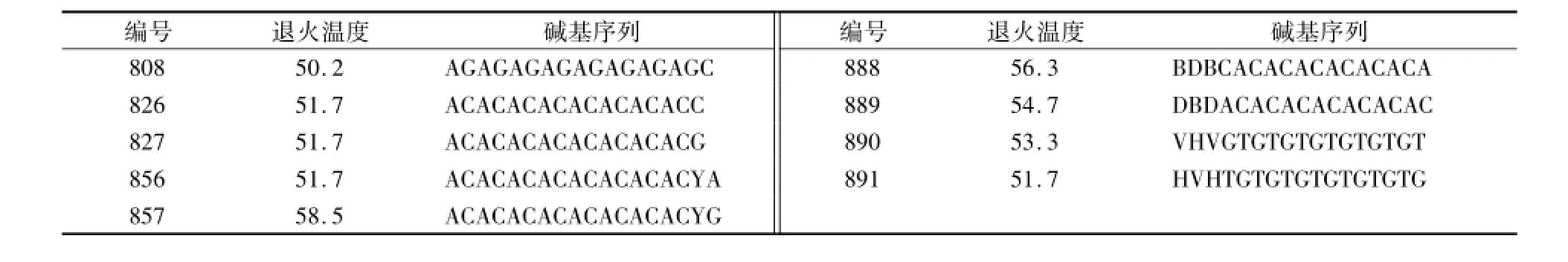
表6 筛选得到的9个引物及其退火温度Table 6 Screening of the 9 primers and their annealing temperature for ISSR
3 讨论
PCR扩增过程中,当dNTPs浓度过小时,dNTPs在扩增反应结束前消耗殆尽,导致扩增产物量降低;而dNTPs浓度过高又会产生不必要的浪费,而且过多的dNTPs还会和Mg2+结合,降低Mg2+相对浓度,导致LA Taq酶活性降低。根据方差分析结果,在本试验中,dNTPs对PCR扩增反应的影响最大,这与周凌瑜等[6]的研究结果相似。从图2A可看出,dNTPs浓度在100—300μmol/L范围内结果均值随浓度的增加而增加,在300μmol/L时反应效果最佳,但是方差分析发现,200—300μmol/L范围内差异不显著,为了节约成本,把dNTPs的最佳反应浓度定在200μmol/L。
一般PCR扩增反应中,引物浓度通常在0.5μmol/L左右[7]。扩增反应中,引物过少会导致扩增产量不足;而引物过多又会增加非特异的扩增,导致条带模糊,背景色加深。在本试验设计浓度范围内,扩增得到的条带数随着引物浓度的增加而降低(图2B),但是这种差异不显著,因此将引物浓度定在0.1μmol/L。
本试验中,Taq酶浓度对稗属植物ISSR扩增反应结果影响显著。高浓度的酶会显著减少扩增的条带数。当Taq酶浓度为1.5U/(20μL)时,结果均值达到最大9.538(图2C)。但是Taq酶浓度在0.5—1.5U/(20μL)范围内对稗属植物ISSR扩增反应结果无明显影响,所以Taq酶选择0.5U/(20μL)。
前人研究表明,模板浓度对扩增反应结果的影响较小,最适扩增反应浓度通常情况下会有一个很大的跨度[8]。本试验也发现模板浓度在4个水平下的扩增效果没有明显差异,只是在150 ng/(20μL)时稍佳(图2D)。
不同引物有着各自的最佳退火温度,适宜的退火温度有利于提高扩增条带的清晰度、丰富度以及扩增结果的稳定性。
综上所述,利用正交试验方法优化稗属植物ISSR-PCR反应条件,最终确定稗属植物20μL最佳反应体系:10×buffer 2μL、dNTPs 200μmol/L、Taq酶0.5U、模板150ng、引物0.1μmol/L。反应程序为:94℃预变性5min;94℃变性30s、52℃(实际温度依各引物最佳退火温度为准)退火30s、72℃延伸1 min,35个循环;72℃延伸10 min,最后4℃保存。
[1]National Field Researchgroup.China’s field weeds regionization[J].J Weedsci,1989,3(2):1-5.
[2]QIAN W,GEs,HONGd Y.Genetic variation within and alnong populations of a wild rice Oryzagranulata from Chinadetected by RAPD and ISSR markers[J].Theor APPLgenet,2001,102:440-449.
[3]DEVARUMATH R M,NANDYs,RANI V,et al.RAPD,ISSR and RFLP fingerprintings as useful markers to evaluategenetic integrity of micro propagated plants of threediploid and triploid elite tea clones representing Camelliasinensis(China type)and C.assamicassp[J].Plant Cell Reports,2002,21:166-173.
[4]ZENG J,ZOU Y P,BAI J Y,et al.Preparation of TotaldNA from“Recalcitrant Plant Taxa”[J].Acta Botsin,2002,44(6):694-697.
[5]何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998,23(4):403-404.
[6]周凌瑜,吴晨炜,唐东芹,等.利用正交设计优化小苍兰ISSR-PCR反应体系[J].植物研究,2008,2(4):402-407.
[7]林萍,张含国,谢运海.正交设计优化落叶松ISSR-PCR反应体系[J].生物技术,2005,15(5):34-37.
[8]杨志玲,冯刚利,谭梓峰,等.红花石蒜ISSR-PCR反应体系的建立[J].林业科学研究,2006,19(4):509-512.
(责任编辑:闫其涛)
Optimization of ISSR-PCR reactionsystem of Echinochloa by orthogonaldesign
LIUde-hao1,LU Yong-liang2,LOU Yu-xia1,GUOshui-liang1*
(1College of Life and Environmentsciences,Shanghai Normal University,Shanghai 200234,China;2China National Rice Research Institute,Hangzhou 310006,China)
By orthogonaldesign,four factors includingdNTPs,TaqdNA polymerase,primers and templatedNA werestudied to establish an optimum ISSR-PCR reactionsystem.The optimum reactionsystem in 20μL contained 0.5 U TaqdNA polymerase,0.1μmol/L primers,200μmol/LdNTPs and 150 ng templatedNA.Nine primers wereselected for Echinochloa ISSR-PCR.Through thegradient PCR test,the optimal annealing temperatures for ISSR-PCR reaction of 9 primers were alsodetermined,respectively.Thissystem provides a technicalsupport for the identification,diversitystudy of Echinochloa.
Echinochloa;Orthogonaldesign;ISSR;PCR reactionsystem
Q78
A
1000-3924(2016)04-017-05
2015-05-19
国家水稻产业体系项目(nycytx-01)“稻田杂草防控技术研究与示范”作者简介:刘德好(1986—),男,硕士,研究方向为杂草科学
,E-mail:gsg@shnu.edu.cn

