用于检测生物硫醇的新型萘酰亚胺荧光探针的合成与应用
陈 颂,王 静,侯 鹏,刘 磊,王 鑫
(齐齐哈尔医学院药学院,黑龙江 齐齐哈尔 161006)
用于检测生物硫醇的新型萘酰亚胺荧光探针的合成与应用
陈颂,王静,侯鹏,刘磊,王鑫
(齐齐哈尔医学院药学院,黑龙江齐齐哈尔 161006)
该文利用硫醇诱导的2,4-二硝基苯磺酰基基团的断裂反应生成具有供-吸电能力的荧光团,成功设计合成一种基于萘酰亚胺识别硫醇的荧光探针。相对于其他氨基酸,该探针在生理pH(7.40)值下,对于含硫醇的氨基酸具有高度的选择性和灵敏度。探针对硫醇具有显著的荧光增强响应,其荧光强度可以恢复197倍。此外,细胞内硫醇的荧光成像实验,证明该荧光探针具有潜在检测细胞内生物硫醇的能力。
生物硫醇;合成;萘酰亚胺;氨基酸;断裂反应;荧光探针
0 引言
生物体内的硫醇化合物如半胱氨酸(Cys)、高半胱氨酸(Hcy)和谷胱甘肽(GSH)在生理系统中具有重要的作用[1-2],其体内含量异常与多种疾病(如阿尔兹海默病、帕金森综合症、各种心血管疾病、肝损伤、癌症以及艾滋病毒的感染等)有着密切的关系[3-5]。因此,对这些硫醇化合物的高选择性和高灵敏度的检测引起了研究者广泛的兴趣。自19世纪80年代Tsien课题组报道了首例荧光探针检测Ca2+,之后荧光探针被认为是对生物小分子的成像和检测十分有效的工具[6]。尽管已有文献报道了一些检测生物硫醇化合物的荧光探针[7-10];但是,开发一种高选择性、高灵敏度同时能够应用于生物成像的荧光探针,仍是广大科研工作者关注的热点。1,8-萘酰亚胺及其衍生物是典型的分子内电荷转移(ICT)荧光团,具有良好的光学性质,如较好的光稳定性、较高的荧光量子产率、Stokes位移较大、吸收和发射光谱在可见光谱范围内;此外,其光物理性质比较容易通过结构的改造来修饰[11-14]。因此,萘酰亚胺衍生物在荧光成像和检测离子方面扮演了重要的角色。本文以4-羟基萘酰亚胺为荧光团,2,4-二硝基苯磺酰酯为硫醇的识别基团,合成了新型的荧光探针1。探针1在没有生物硫醇存在时,由于2,4-二硝基苯磺酰基基团上的氮原子外层存在孤对电子,在光诱导下,容易发生电子转移作用(PET),使探针1的荧光淬灭(见图1)。然而,当与生物硫醇作用后,由于硫醇可以使2,4-二硝基苯磺酰基脱保护,光无法诱导电子发生转移,导致PET作用受到抑制,使探针1的荧光得以恢复。以此,构建一种检测生物硫醇的分析方法。

图1 探针1的合成及硫醇可能的识别机理
1 实验部分
1.1仪器与试剂
BRUKER AV400光谱仪(400 MHz,美国Bruker);Bruker ultraflex II基质辅助时间飞行质谱(美国Bruker);F4600-荧光分光光度计(日本日立);荧光倒置显微镜(日本Nikon Eclipse TE300)。
2,4-二硝基苯磺酰氯(梯希爱化成工业发展有限公司);三乙胺(国药集团化学试剂有限公司);二氯甲烷(天津市凯通化学试剂有限公司);测试所用氨基酸(Gly,Asp,Met,Lys,Tyr,Trp,Arg,His,Asn,Glu,GSH,Hcy,Cys)均购置于上海国药试剂有限公司。
1.2探针的合成与表征
氩气保护下,50 mL圆底单颈烧瓶中,加入化合物2:4-羟基萘酰亚胺[15](135mg,0.5mmol)和三乙胺(61 mg,0.6 mmol)于20 mL干燥的二氯甲烷溶液中,室温搅拌15min后,向上述溶液中加入2,4-二硝基苯磺酰氯(160mg,0.6mmol),反应液室温搅拌过夜,用30mL水淬灭反应,将溶液用20mL二氯甲烷萃取,无水硫酸钠干燥,除去溶剂后柱层析纯化(二氯甲烷),得到产物:探针1(110 mg,44%)。1H NMR (400 MHz,CDCl3):δ ppm=8.75(d,J=2.0 Hz,1H),8.66(dd,J=0.8 Hz,7.2 Hz,1H),8.60~8.55(m,2H),8.45(dd,J=1.2 Hz,8.4 Hz,1H),8.32(d,J=8.4 Hz,1H),7.84~7.82(m,1H),7.66(d,J=8.0 Hz,1H),4.17(t,J= 7.6 Hz,2H),1.71(s,2H),1.44(d,J=7.6 Hz,2H),0.98(t,J=7.6 Hz,3H)m/z(HRMS)M-1:calculated,498.07;found,497.94。
2 结果与分析
2.1荧光光谱研究
探针1的光学信号行为如图2所示,在含有50%乙腈的4-羟乙基哌嗪乙磺酸 (HEPES)(pH 7.4)缓冲溶液中,由于探针1分子结构内存在光诱导电子转移机制(PET),导致单独的探针1(10μmol/L)在溶液中表现出很弱的荧光。

图2 探针1加入不同浓度Cys荧光光谱的变化情况(λex=444nm)
然而,当加入Cys(1~100 μmol/L)后,探针溶液在555nm处出现了一个明显的荧光发射峰,并且随着Cys摩尔浓度的增加,这个发射峰强度逐渐增大,在Cys达到100μmol/L时,555 nm处的荧光强度相对于探针1自身背景的荧光强度增强了197倍。同时,在紫外灯照射下,可以观测到随着Cys的加入,探针1溶液的荧光由无色变为黄色。在相同的测试条件下,将探针1(10 μmol/L)分别与Hcy和GSH作用均可观察到相似的实验结果。以上研究结果表明,探针1对生物硫醇表现出高度灵敏的识别能力。
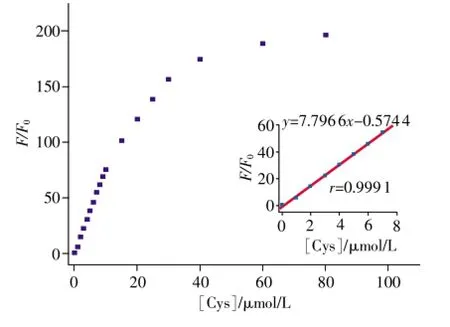
图3 探针1随Cys浓度增加的荧光强度的变化情况 (λex=444nm)
分析探针1(10μmol/L)与不同摩尔浓度Cys的荧光发射光谱的数据,如图3所示,以荧光强度为纵坐标,以Cys浓度(1~8 μmol/L)为横坐标作图,得到一条Plot曲线,拟合后得到的方程为y=7.796 6x-0.5744,相关系数r=0.9991。根据文献[16]报道的方法,计算荧光探针摩尔浓度为10μmol/L时,Cys,Hcy,GSH的检测限分别为0.22,0.35,0.11μmol/L。以上结果表明,在生理条件下探针1可以有效地对生物硫醇进行定量检测。
2.2选择性和干扰实验
评价硫醇识别探针,其对专一硫醇良好的选择性是一个十分重要的参数。本实验选择了一些典型的氨基酸(Gly,Asp,Met,Lys,Tyr,Trp,Arg,His,Asn,Glu,GSH,Hcy,Cys)作为分析物,对探针1的识别能力进行研究。如图4所示,探针1对生物硫醇表现出显著的荧光增强。然而,当加入其他测试物时,探针1的荧光行为几乎没有变化。为了进一步验证探针1的实际应用能力,本文探讨了多种氨基酸对探针1与Cys反应之间的干扰情况。如图5所示,在其他干扰物质存在时,探针1对Cys的检测几乎没有受到影响。以上研究结果表明,探针1对生物硫醇具有极高的专一性。

图4 Cys及其他氨基酸(100μmol/L)的加入对探针1 (10μmol/L)荧光光谱(λex=444nm)的影响

图5 探针1与各种氨基酸反应后荧光(λex=444nm)强度变化

图6 探针1加入不同浓度Cys后,在555nm荧光强度随时间变化情况
2.3反应时间
为了确定探针1与Cys的反应速率,本文进行了时间荧光动力学研究。如图6所示,向探针1(10μmol/L)溶液中分别加入不同浓度(0,25,50,100 μmol/L)的Cys后,反应体系的荧光强度均与反应时间成正比关系;其中,在100μmol/L加入后,反应速率明显加快,大约10min便可以达到平衡。然而,在相同的条件下,单独探针1溶液的荧光强度随时间几乎没有什么变化,可以稳定存在。以上结果表明,该探针分子具有良好的稳定性,可以在水溶液中实现对Cys的快速检测。
2.4荧光成像
为了实现细胞内生物硫醇的检测,这里选用了人肝癌细胞(HepG2)来探讨探针1对生物硫醇的荧光成像实验。如图7所示,将HepG2细胞在含有探针1(10 μmol/L)的溶液中孵化,通过荧光显微镜可以观察到显著的黄色荧光。在相同条件下,将HepG2细胞预先用巯基阻断剂N-乙基马来酰亚胺(NEM)(1mmol/L)处理后,确保细胞中不存在游离的巯基物质,再加入含有探针分子1(10μmol/L)的溶液进行孵化,此时荧光显微镜下只能看到微弱的荧光出现在细胞内。细胞实验表明,利用反应前后鲜明的荧光差异,探针分子1可以适用于在活体细胞内对生物硫醇的检测。

图7 细胞成像
3 结束语
本文以4-羟基萘酰亚胺为母体,通过引入2,4-二硝基苯磺酰氯作为识别基团,合成了新型的生物硫醇荧光探针。该法基于硫醇引发2,4-二硝基苯磺酰基脱保护,电子转移作用受到抑制,从而使反应体系的荧光信号显著升高。相对于其他分析物,该探针在生理pH范围内对含硫醇的氨基酸具有较高的专一性和灵敏度;同时,探针对于含硫醇的氨基酸显示出在黄色光谱区域显著的荧光增强(197倍),可以检测相对较低浓度的生物硫醇;此外,该探针可成功应用于HepG2细胞内硫醇的荧光成像实验。
[1]DALTON T D,SHERTZER H G,PUGA A.Regulation of gene expression by reactive oxygen[J].Annual Review of Pharmacology and Toxicology,1999(39):67-101.
[2]RAHMANI,MACNEEW.Regulation of redox glutathione levels and gene transcription in lung inflammation:therapeutic approaches[J].Free Radical Biology and Medicine,2000,28(9):1405-1420.
[3]TOWNSENDDM,TEWKD,TAPIEROH.The importance of glutathione in human disease[J].Biomedicine &Pharmacotherapy,2003,57(3-4):145-155.
[4]ESTRELA J M,ORTEGA A,OBRADOR E.Glutathione in cancer biology and therapy[J].Critical Reviews in Clinical Laboratory Sciences,2006,43(2):143-181.
[5]SHAHROKHIANS.Lead phthalocyanine as a selective carrier for preparation of a cysteine-selective electrode[J]. Analytical Chemistry,2001,73(24):5972-5978.
[6]GRYNKIEWICZG,POENIEM,TSIEN R Y.A new generationofCa2+indicatorswithgreatlyimproved fluorescenceproperties[J].TheJournalofBiological Chemistry,1985,260(6):3440-3450.
[7] ZHAO N,WU Y H,SHI L X,et al.A sensitive phosphorescent thiol chemosensor based on an iridium (III)complex with α,β-unsaturated ketone functionalized 2,2′-bipyridylligand[J].DaltonTransactions,2010,39 (35):8288-8295.
[8] KWON H,LEE K,KIM H J.Coumarin-malonitrile conjugate as a fluorescence turn-on probe for biothiols and its cellular expression[J].Chemical Communications,2011,47(6):1773-1775.
[9]SUN Y Q,CHEN M,LIU J,et al.Nitroolefin-based coumarin as a colorimetric and fluorescent dual probe for biothiols[J].Chemical Communications,2011,47(39):11029-11031.
[10]LONG L,LIN W,CHEN B,et al.Construction of a FRET-based ratiometric fluorescent thiol probe[J].Chemical Communications,2011,47(3):893-895.
[11]DU J,HU M,FAN J,et al.Fluorescent chemodosimeters using“mild”chemical events for the detection of small anionsandcationsinbiologicalandenvironmental media[J].Chemical Society Reviews,2012(41):4511-4535.
[12]XU Z,YOON J,SPRING D R.A selective and ratiometric Cu2+fluorescent probe based on naphthalimide excimermonomer switching[J].Chemical Communications,2010,15 (46):2563-2565.
[13]DUKERM,VEALEEB,PFEFFER F M,et al. Colorimetric and fluorescent anion sensors:an overview ofrecentdevelopmentsintheuseof1,8-naphthalimide-basedchemosensors[J].Chemical Society Reviews,2010,10(39):3936-3953.
[14]DONG M,WANG Y W,PENG Y.Highly selective ratiometric fluorescent sensing for Hg2+and Au3+,respec tively,in aqueous media[J].Organic Letters,2010,22(12):5310-5313.
[15]REN J,WU Z,ZHOU Y,et al.Colorimetric fluoride sensor based on 1,8-naphthalimide derivatives[J].Dyes and Pigments,2011,3(91):442-445.
[16]IRVING H,FREISER H,WEST T.IUPAC compendium ofanalyticalnomenclature,definitive rules[M].Oxford:Pergamon Press,1981:3.
(编辑:莫婕)
The synthesis and application of a new type of naphthalimide fluorescent probe for biothiols determination
CHEN Song,WANG Jing,HOU Peng,LIU Lei,WANG Xin
(College of Pharmacy,Qiqihar Medical University,Qiqihar 161006,China)
The research used,2,4-dinitrobenzenesulfonyl group cleavage reaction induced by thiols to generate fluorophore with power supply-sucking ability,and proposed and synthesized a kind of fluorescence probe that can identify biothiols via naphthalimides.Relative to other amino acids,the probe is under physiological pH value(7.40),which has high sensitivity and selectivity on amino acids containing biothiols.The probe has a striking fluorescence enhancement effect on biothiols,which can recover fluorescence intensity to 197 times.Besides,fluorescence imaging test of biothiols in cells shows that the fluorescence probe has a potential ability of detecting biothiols in cells.
biothiols;synthesis;naphthalimide;amino acids;cleavage reaction;fluorescence probe
A
1674-5124(2016)08-0064-04
10.11857/j.issn.1674-5124.2016.08.013
2016-01-13;
2016-03-18
齐齐哈尔市科学技术计划项目(SFGG-201416)
陈颂(1983-),男,江苏连云港市人,讲师,博士,研究方向为荧光探针的合成与应用。

