不同辅助化疗方案治疗结肠癌的疗效对比分析
谢保红
不同辅助化疗方案治疗结肠癌的疗效对比分析
谢保红
目的 比较不同辅助性化疗对结肠癌根治术患者的疗效差异。方法 经术后病理检查证实为Ⅱ期或Ⅲ期的结肠癌患者213例随机分为XELOX组(n=104)和FOLFOX组(n=109),XELOX组患者术后采用卡培他滨联合奥沙利铂化疗,FOLFOX组则接受5-氟尿嘧啶联合奥沙利铂化疗,连续治疗24周,比较两组间疗效及安全性差异。结果 XELOX组口腔黏膜炎、中性细胞减少、神经毒性、腹泻等不良反应发生率显著低于FOLFOX组(P<0.05)。两组无病生存期和总生存期差异无统计学意义。结论 XELOX方案的疗效与FOLFOX方案相当,但其化疗不良反应发生率明显降低,对于耐受性差、骨髓储备功能欠佳的结肠癌患者是更好的选择。
结肠癌 辅助化疗 氟尿嘧啶 卡培他滨
结肠癌是临床常见的胃肠道恶性肿瘤之一,占恶性肿瘤发病率的第三位[1]。目前,结肠癌的治疗以手术为主,但由于Ⅱ期和Ⅲ期的结肠癌患者存在微小转移灶或亚临床病灶,手术无法完全切除,部分患者出现术后复发、转移现象。故针对高危Ⅱ期和Ⅲ期结肠癌患者临床通常建议术后进行全身辅助化疗,减少术后复发和转移,从而增加治愈机会、延长无病生存期[2,3]。FOLFOX方案、XELOX方案是目前常用的结肠癌术后辅助化疗方案[4,5],本文比较两种辅助化疗方案的疗效和安全性。
1 临床资料
1.1 一般资料 2009年11月至2012年5月本院接受结肠癌根治术患者213例,纳入标准:(1)术后病理证实符合第7 版AJCC 肿瘤分期Ⅱ期或Ⅲ期。(2)II期具备以下高危因素:分化差、脉管侵犯、肠梗阻、肠穿孔、术中清除淋巴结<12枚、切缘阳性或接近阳性。(3)肝生化、肾功能、心电图基本正常。(4)术前未进行任何放化疗或免疫治疗。(5)年龄18~80岁。排除标准:(1)发生同时或异时性转移。(2)有化疗禁忌证。(3)合并吻合口瘘、胰腺瘘或吻合口狭窄等严重术后并发症。随机分为XELOX组(104例)和FOLFOX组(109例)。XELOX组男68例,女36例;平均年龄(58.43±12.31)岁。Ⅱ期59例、Ⅲ期45例。高分化腺癌14 例、中分化腺癌 61 例、低分化腺癌 29例。N0 57例、N1 31例、N2 16例;T1~2 2例、T3 62例、T4 40例。FOLFOX组男66例,女43例;平均年龄(55.43±12.56)岁。Ⅱ期61例、Ⅲ期48例。高分化腺癌19 例、中分化腺癌 60 例、低分化腺癌 30 例。N0 59例、N1 33例、N2 17例;T1~2 4例、T3 65例、T4 40例。两组患者性别、年龄、病理分期、分化类型、N分期、T分期等基线资料差异无统计学意义,具有可比性。
1.2 治疗方法 所有患者化疗前30min均给予止吐治疗,化疗期间给予升血治疗,并依据血常规、肝肾功能及化疗毒副反应情况调整化疗药物剂量。XELOX组:第1d,奥沙利铂130mg/m2,静脉滴注;第1~14d,卡培他滨1000mg/m2,口服,早晚各1次。完成后休息7d,开始第2个疗程,连续治疗8个疗程。FOLFOX组:第1d,奥沙利铂85mg/m2,静脉滴注;第1、2d,亚叶酸钙200mg/m2,静脉滴注;第1d、2d,5-FU 400mg/m2,静脉持续泵入22h。2周为1个疗程,连续治疗12个疗程。
1.3 观察指标 统计治疗期间两组患者不良反应发生情况。观察恶心呕吐、口腔黏膜炎、中性细胞减少、神经毒性、腹泻等不良反应率及发生的严重程度,严重程度分为Ⅰ゜、Ⅱ゜、Ⅲ゜、Ⅳ゜,评价标准参照NCI.CTC3.0。
1.4 疗效评价 术后定期复查CT、MRI、B超等检查。化疗期间每2个化疗周期进行1次疗效评价,术后<2年评价1次/3个月,之后评价1次/6个月。观察患者术后复发、转移情况,统计无病生存期(DFS)和总生存期(OS)。比较两组间差异。
1.5 统计学方法 采用SPSS17.0软件。计量资料用t检验,计数资料用卡方检验,采用Kaplan-Meier法评估两组患者的DFS和OS的差异,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者不良反应发生严重程度比较 化疗期间脱落2例,剔除不符合纳入标准的患者3例,最后纳入不良反应统计的患者208例,其中XELOX组103例,FOLFOX组105例。两组恶心呕吐的发生率差异无统计学意义(P>0.05);XELOX组口腔黏膜炎、中性细胞减少、神经毒性、腹泻等不良反应发生率显著低于FOLFOX组(P<0.05)。
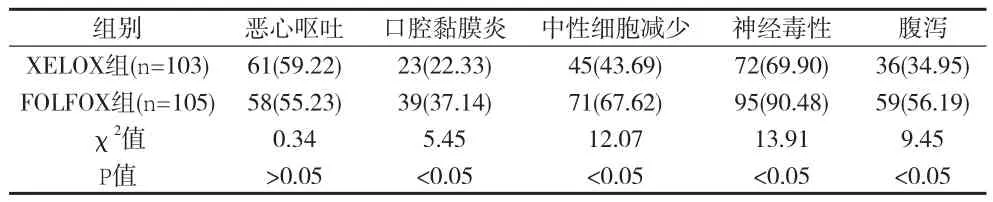
表1 化疗期间两组患者不良反应发生率比较 [n(%)]
2.2 两组无病生存期比较 至随访截止日,XELOX 组36例(34.95%)患者出现病情进展,其中包括转移25例(24.27%),局部复发11例(10.68%);FOLFOX 组31例(29.52%)患者出现病情进展,包括转移23例(21.90%),复发8例(7.62%),两组DFS差异无统计学意义(P>0.05),见图1。
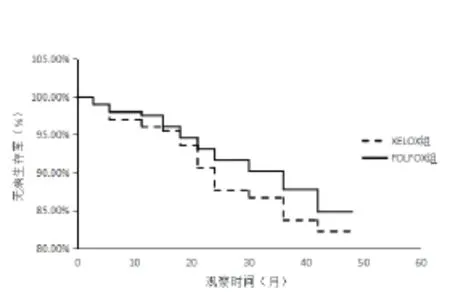
图1 XELOX组和FOLFOX组DFS生存曲线
2.3 两组总生存期比较 至随访截止日,XELOX组和FOLFOX组患者死亡分别为28例(27.18%)和24例(22.86%),两组总生存期差异无统计学意义(P>0.05),见图2。
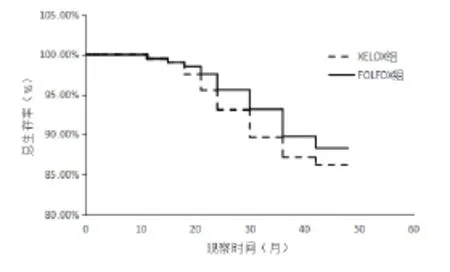
图2 XELOX组和FOLFOX组OS生存曲线
3 讨论
目前结肠癌已经成为威胁全人类生命健康的主要恶性肿瘤之一,虽然近年来随着肿瘤筛查普及和诊断率的提高、治疗个体化和规范化,其病死率有下降趋势,但在发展中国家其发病率仍呈升高趋势[6]。对于大多数结肠癌患者,手术仍是首选的治疗方式,术后辅助化疗则为结肠癌的重要治疗手段之一,大量循征医学研究显示术后辅助化疗可使Ⅲ期和高危的Ⅱ期结肠癌患者获益[7~9]。
XELOX方案和FOLFOX方案均是NCCN结直肠癌指南推荐的辅助化疗方案。FOLFOX方案以5-FU为基础,5-FU进入人体后先被代谢为5-氟-2-脱氧尿嘧啶核苷酸,后者通过抑制胸腺嘧啶核苷酸合成酶发挥抑制DNA生物合成的功效;奥沙利铂系顺铂、卡铂之后的第3代铂类抗癌药,其通过产生烷化结合物作用于 DNA,形成链内和链间交联,从而抑制DNA的合成及复制。因此5-FU和奥沙利铂具有协同抑瘤作用。XELOX方案以卡培他滨为基础,卡培他滨为口服氟尿嘧啶类药物,为5-FU的前药,卡培他滨进入人体后经肿瘤细胞内高表达的胸腺嘧啶磷酸化酶催化转变为5-FU发挥抗肿瘤作用,因此其在肿瘤组织局部浓度高于正常组织,具有靶向杀伤作用,避免对正常组织的损伤[10]。本资料结果显示,XELOX组和FOLFOX组DFS和OS差异无统计学意义,提示卡培他滨的抑瘤作用同5-FU。同时XELOX组口腔黏膜炎、中性细胞减少、神经毒性、腹泻等化疗副反应的发生率低于FOLFOX组。
本资料结果表明,与FOLFOX方案比较,XELOX方案用于高危Ⅱ期和Ⅲ期结肠癌术后的辅助化疗,对于延长DFS和OS无明显优势,但有效降低化疗的副反应,对耐受性差、骨髓储备功能欠佳的结肠癌患者是更好的选择。
1 Chen W. Report of incidence and mortality in China cancer registries,2012. Chinese Journal of Cancer Research, 2013, 25(1): 10~19.
2 Sargent D, Sobrero A, Grothey A, et al. Evidence for cure by adjuvant therapy incolon cancer: observations based on individual patient data from 20, 898 patients on 18 randomized trials. J ClinOncol, 2009, 27(6): 872~877.
3 罗扬, 冯奉仪. 结肠癌的辅助化疗. 临床药物治疗杂志, 2013, 11(2): 5~9.
4 Sargent DJ, Marsoni S, Monges G, et al. Defective mismatchrepair as a predictive marker for lack of efficacy of fluorouracil based adjuvant therapy in colon cancer. J ClinOncol, 2010,28(30): 4664.
5 Schmoll HJ, Cartwright T, Tabernero J, et al. Phase Ⅲ trial of capecitabine plus oxaliplatin as adjuvant therapy for stage Ⅲcolon cancer: a planned safety analysis in 1,864 patients. JClinOncol, 2007, 25(1): 102~109.
6 Siegel R.Cancer statistics,2014. CA: a cancer journal for clinicians, 2014,64(1): 9~29.
7 Andre T, Boni C, Navarro M, et al. A: Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the mosaic trial. J ClinOncol, 2009, 27(19): 3109~3116.
8 Sargent DJ, Patiyil S, Yothers G, et al. End points for colon cancer adjuvant trials: Observations and recommendations based on individual patient data from 20,898 patients enrolled onto 18 randomized trials from the accent group. J ClinOncol, 2007,25(29): 4569~4574.
9 梁后杰, 李建军. 结肠癌术后辅助化疗的共识与争议. 第三军医大学学报, 2012, 34(1): 1~4.
10 Andre T. The IDEA (International Duration Evaluation of Adjuvant Chemotherapy) Collaboration: Prospective Combined Analysis of Phase III Trials Investigating Duration of Adjuvant Therapy with the FOLFOX (F0LF0X4 orModified F0LF0X6) or XELOX (3 versus 6 months) Regimen for Patients with Stage III Colon Cancer: Trial Design and Current Status. Current colorectal cancerreports, 2013,9(3): 261~269.
430079 湖北省肿瘤医院

