急性脑梗死患者血清HIF-1α VEGF水平变化及临床意义
魏芳
急性脑梗死患者血清HIF-1α VEGF水平变化及临床意义
魏芳
目的 探讨低氧诱导因子-1(HIF-1α)、血管内皮生长因子(VEGF)在急性脑梗死患者血清中的变化及临床意义。方法 急性脑梗死患者60例(观察组)及健康体检者60例(对照组),采用双抗体夹心酶联免疫吸附法(ELISA)测定不同时间点(发病后第12h、ld、3d、5d、7d、10d)受检者血清HIF-1α、VEGF水平。分析血清 HIF-1α、VEGF水平与脑梗死病灶体积的相关性。结果 与对照组血清HIF-1α、VEGF水平比较,观察组在入院12h、1d、3d、5d、7d、10d的不同时间血清HIF-1α、VEGF水平均升高,差异有统计学意义(P<0.05);与小梗死组比较,中、大硬死组各时间点血清VEGF均升高(P<0.05);与小、中梗死组比较,大梗死组各时间点血清HIF-1α均升高(P<0.05)。分别对脑梗死组发病第 1d 血清 HIF-1α、VEGF水平与脑梗死病灶体积进行Spearman 相关性分析,两者呈显著相关性(P<0.05)。观察组患者发病后 12h、1d、3d、5d、7d、10d血清 HIF-1α 与VEGF水平变化进行 Spearman 相关性分析,两者呈正相关(P<0.05)。结论 脑梗死组患者血清 HIF-1α 、VEGF水平的动态变化,显示其参与了急性脑梗死的发生与发展,与急性脑梗死后的内源性保护机制密切相关。
急性脑梗死 低氧诱导因子-1 血管内皮生长因子
急性脑梗死是指由各种原因所导致局部或广泛脑组织血流中断及血液循环障碍,而引起脑组织缺血、缺氧导致软化、坏死,并出现不同程度神经功能缺损的疾病,是缺血性脑卒中最常见的类型,具有高发病率、高致残率、高病死率的特点[1,2]。研究表明,低氧诱导因子-1α(HIF-1α)及其下游调控因子-血管内皮生长因子(VEGF)在缺血性脑血管疾病中具有改善循环及抑制细胞凋亡从而发挥神经保护等生理功能[3,4]。本文探讨血清 HIF-1α、VEGF在脑梗死急性期的动态变化规律及其与脑梗死病灶体积的相关性。
1 临床资料
1.1 一般资料 选取2013年12月至2015年3月本院急性脑梗死患者60例(观察组)及同期健康体检者60例(对照组)。观察组中男36例,女24例;年龄47~78岁,平均年龄(61.56±8.41)岁。对照组中男32例,女28例;年龄46~76岁,平均年龄(62.18±9.12)岁。纳入标准:(1)年龄 32~81 岁,首次发病入院且入院时间 <12h。(2)疾病诊断符合第 4 次全国脑血管病会议急性脑梗死的临床诊断标准[5]。(3)头颅影像学(头颅 CT 或头颅 MRI)确诊梗死病灶位于颈内动脉系统的脑梗死患者。排除标准:(1)近期经历急性脑卒中及重大手术、外伤史等。(2)既往有神经系统器质性疾病导致神经系统功能障碍。(3)合并急慢性感染性疾病及风湿免疫性、血液系统疾病及其导致的脑梗死。(4)心、肺、肝、肾功能障碍。(5)罹患恶性肿瘤。两组在性别、年龄、吸烟史、饮酒史、高血压病史及生化指标等方面,差异无统计学意义(P>0.05),具有可比性。本项目经本院伦理委员会批准,所有受试者均签署知情同意书。
1.2 方法 分别抽取对照组及观察组患者发病12h、1d、3d、5d、7d、10d静脉血3ml,抗凝处理,3000r/ min,离心10min,取血清,-20℃的冰箱中保存,备用待测。采用双抗体一步夹心法酶联免疫吸附试验(ELISA)检测血清HIF-1α、VEGF水平。操作严格按照试剂盒说明进行。
1.3 脑梗死病灶体积计算 脑梗死病灶体积根据患者发病3d头颅MRI结果计算;参考Pullicino的方法,脑梗死体积=a×b×c×层厚×π/6(a为梗死灶的最大长径,b为与长径相垂直的直径,c为MRI扫描的阳性层数,π为圆周率)[6,7];根据脑梗死病灶体积大小分3组:小梗死组(≤ 4.0cm3)22例;中梗死组(4.1~10.0cm3)24例;大梗死组(≥ 10.0cm3)14例。
1.4 统计学方法 采用SPSS 13.0统计软件。计量资料用(±s)表示,两组间比较用独立样本t检验,相关性分析采用 Spearman 等级分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清HIF-1α水平变化比较 与对照组比较,观察组患者入院12h、1d、3d、5d、7d、10d血清HIF-1α水平均升高,差异有统计学意义(P<0.05),且观察组血清HIF-1α水平在入院1d后达峰值,以后逐渐减低。见表1。
表1 两组血清HIF-1α(ng/ml)水平变化(±s)

表1 两组血清HIF-1α(ng/ml)水平变化(±s)
注:与对照组比较,* P<0.05
时间点观察组(n=60)对照组(n=60)12h1058.35±124.17*526.47±119.76 1d2231.48±1231.97* 3d1852.31±756.45* 5d1238.19±462.46* 7d931.62±328.21* 10d719.68±263.76*
2.2 脑梗死不同体积组人群血清 HIF-1α 水平变化比较 与小、中梗死组比较,大梗死组患者在各时间点的血清 HIF-1α水平均升高,差异有统计学意义(P<0.05)。脑梗死组发病第1天血清 HIF-1α 浓度与脑梗死病灶体积进行 Spearman 相关性分析,两者呈显著相关性(P<0.05)。见表3。
表2 脑梗死不同体积组血清 HIF-1α 水平变化比较(±s)

表2 脑梗死不同体积组血清 HIF-1α 水平变化比较(±s)
注:与小梗死组比较,*P<0.05;与中梗死组比较# P<0.05
时间点小梗死组(n=22)中梗死组(n=24)大梗死组(n=14)12h912.25±136.08925.19±117.531386.11±136.47*# 1d1612.74±366.511708.26±412.373297.56±986.65*# 3d1232.69±518.611368.76±545.262323.12±805.34*# 5d892.76±334.17987.12±204.581587.48±301.51*# 7d761.18±206.35801.29±211.241208.36±285.57*# 10d603.76±105.81618.14±138.42918.64±178.12*#
2.3 两组人群血清VEGF水平变化比较 与对照组比较,观察组患者在入院12h、1d、3d、5d、7d、10d的不同时间血清VEGF水平均升高,差异有统计学意义(P<0.05),且观察组人群血清VEGF水平在入院1d后达峰值,以后逐渐减低。见表3。
表3 两组不同时间点血清VEGF(ng/ml)水平变化(±s)
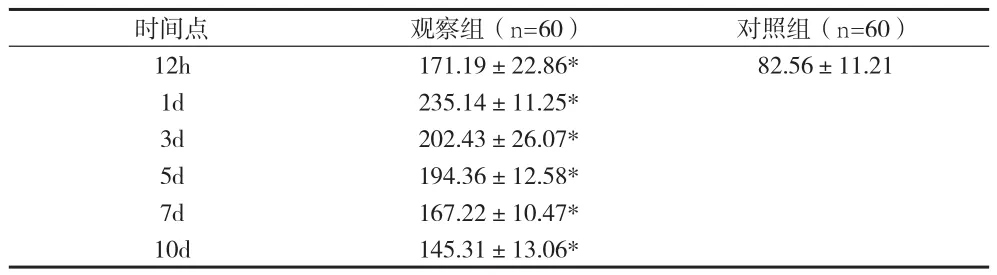
表3 两组不同时间点血清VEGF(ng/ml)水平变化(±s)
注:与对照组比较,*P<0.05
时间点观察组(n=60)对照组(n=60)12h171.19±22.86*82.56±11.21 1d235.14±11.25* 3d202.43±26.07* 5d194.36±12.58* 7d167.22±10.47* 10d145.31±13.06*
2.4 脑梗死不同体积组人群血清VEGF水平变化比较 与小梗死组比较,中梗死组、大梗死组在发病第12h、1d、3d、5d、7d、10d时的血清VEGF浓度升高,差异有统计学意义(P<0.05)。脑梗死组发病第1天血清 VEGF 浓度与脑梗死病灶体积进行 Spearman 相关性分析,两者呈显著相关性( P<0.05)。见表4。
表4 脑梗死不同体积组血清VEGF水平变化情况(±s)

表4 脑梗死不同体积组血清VEGF水平变化情况(±s)
注:与小梗死组相比较,*P<0.055
时间点小梗死组(n=22)中梗死组(n=24)大梗死组(n=14)12h142.16±13.67175.11±12.31*180.21±11.35* 1d168.26±17.43218.13±15.73*221.65±11.56* 3d182.75±14.13208.61±11.26*213.21±15.14* 5d185.45±12.76209.86±14.32*217.52±12.36* 7d151.42±16.17171.58±13.42*178.61±15.17* 10d133.086±15.29158.25±11.12*162.07±10.09*
2.5 观察组患者血清HIF-1α 与VEGF水平相关性分析 观察组患者发病后 12h、1d、3d、5d、7d、10d血清 HIF-1α 与VEGF的水平变化进行 Spearman 相关性分析,结果显示两者呈正相关(r=0.368,P<0.05)。
3 讨论
急性脑梗死是一种严重威胁人类生命健康的脑血管疾病。研究表明,其由多种因素相互作用引起,且常伴随脑组织缺血缺氧性损伤[8]。HIF-1是目前为止发现的唯一在特异性缺氧状态下发挥活性的转录因子。其在缺氧诱导的基因表达调节中起着重要的作用[9]。研究证实,在组织缺氧条件的刺激下,较高水平的HIF-1与其亚单位结合,形成有活性的HIF-1α,激活后的 HIF-1α调节多种下游基因转录,如血管内皮生长因子(VEGF)编码基因,及其它相关基因诱导的蛋白表达,从而促进机体红细胞生成、血管构架的形成以及维持细胞内环境和pH值调节等以满足缺氧细胞的基本代谢和生存需要[10~12]。本资料结果表明,与对照组患者血清HIF-1α水平比较,脑梗死组患者在发病 12h、1d、3d、5d、7d、10d后,血清HIF-1α水平增高,差异有统计学意义(P<0.05),可能的原因是与脑梗死急性发作期出现的脑组织缺血缺氧情况有关。正常脑细胞在低氧条件的刺激下,HIF-1因子 与细胞浆中稳定表达的 HIF-1 结构亚单位结合,形成有活性的 HIF-1α,从而使急性脑梗死患者血清 HIF-1α 水平升高[13]。李建军[14]研究认为,急性脑梗死患者血清HIF-1α水平在发病后的1d、3d、7d均较正常对照组升高。赵宁辉等[15]研究显示,大鼠脊髓损伤组HIF-1α 蛋白表达量在12h~2d达到高峰,2d后开始下降,直到损伤后1周。这与本资料结果一致。
脑梗死病灶体积可能影响血清 HIF-1α的水平变化。本资料通过检测6个不同时间点血清HIF-1α水平,与小、中梗死组比较,大梗死组患者在各时间点的血清HIF-1α水平均升高,差异有统计学意义(P<0.05)。对脑梗死组发病第 1d 血清 HIF-1α浓度与脑梗死病灶体积进行Spearman 相关性分析,两者有显著相关性。可能是大梗死组病灶区脑细胞及周围脑组织受压水肿程度更严重所致[16]。
VEGF是一类可通过特异性膜受体介导而发挥一系列的生物学效应,具有强烈的促血管内皮细胞的生长因子。研究证实,VEGF因子对血管内皮细胞增殖、迁移有明显的促进作用,还能诱导新生血管生成等[17,18]。研究表明,VEGF因子在脑组织缺血后期,可促进内皮细胞增殖、迁移,促进侧支循环建立,参与新生血管生成,从而保证脑组织的血液供应,而当血供恢复后VEGF表达就会缓慢减少,这提示VEGF动态变化是随着脑组织缺血缺氧的严重程度而发生改变,当局部受损脑组织血供改善后,其该因子含量会显著下降[19]。本资料结果表明,与对照组人群比较,急性脑梗死患者在发病后12h、1d、3d、5d、7d、10d的血清平均VEGF水平均有不同程度的增高,表明血清VEGF在脑梗死急性期随病程呈动态变化,脑缺血发生后,低氧可诱导VEGF及VEGFR呈高表达,认为可能是急性期的自我保护机制。脑梗死后1 d 是血管增长最活跃的时期,VEGF 表达显著升高。VEGF 在脑缺血缺氧损伤后作为修复血管的因子,在缺血性脑血管病中起神经保护作用[20]。
此外,本资料还发现,梗死灶体积越大,血清VEGF浓度越高,与小梗死组脑梗死不同体积组患者血清VEGF水平比较,中梗死组、大梗死组患者在发病第 12h、1d、3d、5d、7d、10d时血清VEGF浓度升高,差异有统计学意义(P<0.05);而中梗死组与大梗死组患者间血清VEGF水平在各时间点差异无统计学意义(P>0.05)。对脑梗死组发病第 1d 血清 VEGF 浓度与脑梗死病灶体积进行 Spearman 相关性分析,两者有显著相关性。Yang等[21]利用VEGF拮抗剂阻断大鼠缺血区脑组织VEGF的表达,结果梗死灶体积增大,神经细胞损伤明显加重,由此认为VEGF可抗细胞凋亡,具有神经保护作用。本资料结果显示,急性脑梗死患者在发病后12h、1d、3d、5d、7d、10d的各个时间点血清HIF-1a与VEGF水平变化呈正相关。HIF-1α 水平显著升高时作用于VEGF 基因,并通过加强VEGF mRNA的稳定性从而使VEGF 表达上升,HIF-1α 还可使VEGF 受体Flt-1 转录上调,使VEGF 作用明显加强。
1 李慧英,蒋初明,高永红,等.急性脑梗死早期认知功能与脑血流灌注相关关系的临床分析.中华老年心脑血管病杂志,2015,17(4):385~388.
2 褚雪菲,刘道龙,周军怀,等.大剂量疏血通注射液治疗老年急性脑梗死患者102例.中国老年学杂志,2015,35(12):3418~3419.
3 Ma Y1, Lovekamp-Swan T, Bekele W, et al. Hypoxia-inducible factor and vascular endothelial growth factor are targets of dietary soy during acute stroke in female rats. Endocrinology, 2013, 154(4): 1589~1597.
4 Chen CI, Ostrowski RP, Zhou C, et al. Suppression of hypoxiainducible factor-1alpha and its downstream genes reduces acute hyperglycemia-enhanced hemorrhagic transformation in a rat model of cerebral ischemia. J Neurosci Res, 2010, 88(9):2046~2055.
5 刘艳,严爱龙,胡亚丹,等.依达拉奉治疗急性脑梗死的疗效及安全性研究.神经损伤与功能重建,2014,9(2):167~167.
6 卫锐,蒲传强.血浆凝血因子ⅩⅢ、IL-17水平与脑梗死相关性及预后的研究分析.中国实验诊断学,2014,18(10):1638~1641.
7 文果,邓奕辉,刘文华.等.急性脑梗死与MCP-1、NF-κB相关性的研究进展.中国中医急症,2014,23(7):1304~1306.
8 李雪梅.前列地尔治疗急性脑梗死疗效分析.中国实用神经疾病杂志,2014,17(14):104~105.
9 Ergorul C, Ray A, Huang W, et al. Hypoxia inducible factor-1α (HIF-1α) and some HIF-1 target genes are elevated in experimental glaucoma. J Mol Neurosci, 2010, 42(2):183~191.
10 Zhang TY, Yang JL, Huo BJ. Effect of overexpression of hypoxiainducible factor-1α induced by hyperoxia in vivo in LNCaP tumors on tumor growth rate. Asian Pac J Trop Med, 2015, 8(10):813~820.
11 André H, Tunik S, Aronsson M, et al. Hypoxia-Inducible Factor-1α Is Associated With Sprouting Angiogenesis in the Murine Laser-Induced Choroidal Neovascularization Model. Invest Ophthalmol Vis Sci, 2015, 56(11):6591~6604.
12 Lee CS, Choi EY, Lee SC, et al. Resveratrol Inhibits Hypoxia-Induced Vascular Endothelial Growth Factor Expression and Pathological Neovascularization. Yonsei Med J, 2015, 56(6):1678~1685.
13 Huang T, Huang W, Zhang Z, et al. Hypoxia-inducible factor-1α upregulation in microglia following hypoxia protects against ischemiainduced cerebral infarction. See comment in PubMed Commons belowNeuroreport, 2014, 25(14):1122~1128.
14 李建军,杨士芝,吴茂礼,等.67例急性脑梗死患者血清HIF-1α及VEGF水平变化. 山东医药,2015,55(31):107~108.
15 赵宁辉, 毛伯镛, 周旺宁, 等. 低氧诱导因子-1α 在大鼠脊髓损伤中的表达.中华创伤杂志, 2013, 19( 9):544~547.
16 王光胜,张克忠,王元伟,等.高压氧对大鼠脑缺血再灌注损伤的保护作用及其对低氧诱导因子-1a的影响.中风与神经疾病杂志,2010, 27(4):360~362.
17 Li N, Wang P, Ma XL, et al. Effect of bone marrow stromal cell transplantation on neurologic function and expression of VEGF in rats with focal cerebral ischemia. Mol Med Rep, 2014 , 10(5):2299~2305.
18 Li YN, Pan R, Qin XJ, et al. Ischemic neurons activate astrocytes to disrupt endothelial barrier via increasing VEGF expression. J Neurochem, 2014, 129(1):120~129.
19 Ke XJ, Zhang JJ. Changes in HIF-1α, VEGF, NGF and BDNF levels in cerebrospinal fluid and their relationship with cognitive impairment in patients with cerebral infarction. J Huazhong Univ Sci Technolog Med Sci, 2013, 33(3):433~437.
20 杨健,蔡志友,王咏龙.急性脑梗死患者VEGF与炎症因子IL-18、IFN-γ的临床研究. 重庆医学,2009,38(8):928~930.
21 Yang ZJ, Bao WL, Qiu MH, et al. Role of vascular endothelial growth factor in neuronal DNA damage and repair in rat brain following a transient cerebral ischemia. J Neurosci Res, 2002,70(2):140~149.
Objective To discuss the clinical significance and change of serum Hypoxia inducible factor-1α,vascular endothelial growth factor level in the patients with acute cerebral infarction. Methods We selected 60 cases patients with acute cerebral infarction and 60 cases healthy control in the research from Dec,2013 to March,2015. Then adopting the ELISA method to determine the serum HIF-1α,VEGF levels of study Objective s at 12h,ld,3d,5d,7d,10d and Correlation analysis of HIF-1alpha,serum VEGF levels and cerebral infarction lesions volume. Results Compared to control's serum HIF-1α,VEGF levels,experimental people serum HIF-1α,VEGF levels increased at 12h,ld,3d,5d,7d,10d (P<0.05);compared to small infarction group's serum HIF-1α,VEGF levels,medium and large infarction group's serum HIF-1α,VEGF levels increased (P<0.05),however small and medium,medium and large infarction group present no signifi cant difference (P>0.05). Spearman correlation analysis showed that cerebro vascular infarction group serum HIF-1α and VEGF levels had signifi cant correlation respectively at 1d(P<0.05) and both presented positive correlation(P<0.05)at 12h,ld,3d,5d,7d,10d (P<0.05). Conclusion Dynamic changes of serum levels of HIF-1alpha and VEGF,indicating that the factors involved in the occurrence and development of acute cerebral infarction,cerebral infarction after a series of hypoxia response play important roles.
Acute cerebral infarction Hypoxia inducible factor-1α Vascular endothelial growth factor
010050 内蒙古医科大学附属医神经内科

