血清和胆汁MMP-9、TIMP-1检测在胆管癌诊断中的价值
解芳,刘鸿梅(中国医科大学,沈阳0;沈阳市第四人民医院)
血清和胆汁MMP-9、TIMP-1检测在胆管癌诊断中的价值
解芳1,刘鸿梅2
(1中国医科大学,沈阳110122;2沈阳市第四人民医院)
目的 探讨血清和胆汁基质金属蛋白酶9(MMP-9)、金属蛋白酶组织抑制剂1(TIMP-1)检测在胆管癌中的诊断价值。方法 选取45例原发胆管癌患者(胆管癌组)和52例良性胆管疾病患者(良性疾病组),采用ELISA法测定血清和胆汁MMP-9和TIMP-1水平,采用ROC曲线评估血清和胆汁MMP-9、TIMP-1及其比值的诊断效能。结果 胆管癌组和良性疾病组血清MMP-9、TIMP-1水平及MMP-9/TIMP-1值无统计学差异(P均>0.05)。胆管癌组胆汁MMP-9水平显著高于良性疾病组(P<0.01),TIMP-1水平显著低于良性疾病组(P<0.01),胆汁MMP-9/ TIMP-1值高于良性疾病组(P<0.01)。胆汁MMP-9/TIMP-1值的灵敏度(93.3%)、特异度(75%)和准确度(81.4%)均高于单项指标。结论 MMP-9和TIMP-1参与胆管癌的发生和发展,胆汁MMP-9/TIMP-1值对于胆管癌诊断有良好的价值。
胆管肿瘤;基质金属蛋白酶;金属蛋白酶组织抑制因子
胆管癌(CCA)是一种来源于胆管上皮,且具有高侵袭性的消化道恶性肿瘤。流行病学研究显示胆管癌的发病率和病死率呈逐年上升趋势。由于胆管癌发病隐匿,临床症状不明显,早期诊断较困难[1]。根治性手术是目前最有效的治疗方法,但多数患者确诊时已属晚期或已发生转移,因此患者5年生存率仅为28%~40%[2]。目前胆管癌的诊断主要依靠影像学检查,但无法对病变进行定性。肿瘤标志物种类繁多,对胆管癌术前诊断较为有效,但灵敏度和特异度各异。因此寻找理想的肿瘤相关蛋白,作为胆管癌的早期诊断标志物,是改善胆管癌患者预后的重要手段。2011年3月~2015年3月,我们对胆管癌患者血清和胆汁基质金属蛋白酶9(MMP-9)、金属蛋白酶组织抑制剂1(TIMP-1)进行检测,探讨血清和胆汁MMP-9和TIMP-1检测对胆管癌的诊断价值。
1 资料与方法
1.1 临床资料 选取沈阳市第四人民医院原发胆管癌患者45例(胆管癌组),其中男29例、女16例,年龄31~65(43.8±9.3)岁。胆管癌均经组织病理学和临床症状证实诊断。收集同期入院就诊的良性胆管疾病患者52例(良性疾病组)作为对照,其中胆囊结石32例,胆囊息肉20例。良性胆管疾病患者中男38例、女14例,年龄28~61(44.9±8.6)岁。两组性别和年龄比较具有可比性。
1.2 血清和胆汁中MMP-9和TIMP-1测定 两组均清晨空腹采集静脉血3 mL,分离血清,-80℃储存备用。两组行经内镜逆行性胰胆管造影术(ERCP)中均用无菌注射器取胆汁5 mL,3 000 r/min离心10 min,取上清液,置于-80℃储存备用。血清及胆汁中MMP-9、TIMP-1测定采用ELISA法,试剂盒购自美国R&D Systems公司,操作过程参照试剂盒说明进行。
1.3 统计学方法 采用SPSS17.0统计软件。计量资料以±s表示,两样本均数比较采用t检验,绘制受试者工作特征(ROC)曲线比较各指标的诊断效能。P<0.05为差异有统计学意义。
2 结果
2.1 两组血清和胆汁MMP-9、TIMP-1水平及其比值比较 胆管癌组和良性疾病组血清MMP-9、TIMP-1水平及MMP-9/TIMP-1值比较无统计学差异(P均>0.05)。胆管癌组胆汁MMP-9水平显著高于良性疾病组(P<0.01),TIMP-1水平显著低于良性疾病组(P<0.01),胆汁MMP-9/TIMP-1值高于良性疾病组(P<0.01),见表1。
表1 两组血清和胆汁MMP-9、TIMP-1水平及其比值比较±s)

表1 两组血清和胆汁MMP-9、TIMP-1水平及其比值比较±s)
组别n血清MMP-9 (ng/mL)胆汁MMP-9/ TIMP-1良性疾病组52323.1±114.7269.8±90.8294.5±130.7300.9胆汁MMP-9 (ng/mL)血清TIMP-1 (ng/mL)胆汁TIMP-1 (ng/mL)血清MMP-9/ TIMP-1 ±78.21.30±0.870.91±0.27胆管癌组45350.2±107.1345.0±103.2276.0±76.4213.3±76.11.50±0.811.70±0.60 P >0.05<0.01>0.05<0.01>0.05<0.01
2.2 血清和胆汁MMP-9、TIMP-1及其比值的诊断效能分析 血清和胆汁各指标的诊断效能如图1所示,血清MMP-9和胆汁MMP-9的ROC曲线下面积(AUC)分别为0.604(95%CI:0.490~0.718)和0.685(95%CI:0.5816~0.790);血清TIMP-1和胆汁TIMP-1的AUC分别为0.570(95%CI:0.455~0.684)和0.786(95%CI:0.693~0.879);血清MMP-9/TIMP-1值和胆汁MMP-9/TIMP-1值的AUC分别为0.602(95%CI:0.489~0.715)和0.936 (95%CI:0.892~0.980)。各指标对胆管癌诊断的灵敏度和特异度评价见表2。胆汁MMP-9/TIMP-1值灵敏度(93.3%)、特异度(75%)、阳性预测值(76.4%)、阴性预测值(92.8%)和准确度(81.4%)均高于其他指标。
3 讨论
由于肿瘤发生发展的异质性和多样性,单一标志物具有局限性,因此寻找灵敏度和特异度理想的肿瘤标志物是目前肿瘤诊断的重要方面。国外研究结果表明,肿瘤标志物的联合检测对于胆管癌的早期诊断及隐匿性病灶的检出有重要作用[3]。
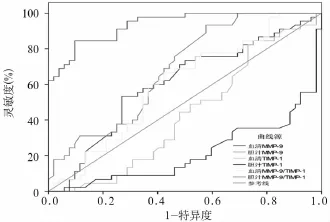
图1 各诊断指标的ROC曲线分析

表2 血清和胆汁MMP-9、TIMP-1及其比值诊断胆管癌的效能评估(%)
基质金属蛋白酶家族是降解细胞外基质的重要酶类,包括基质金属蛋白酶(MMPs)和金属蛋白酶组织抑制剂(TIMPs)。目前研究表明,MMP-2和MMP-9是惟一能降解细胞外基质和基底膜中Ⅳ型胶原的酶类,MMP-2和MMP-9破坏基底膜,促进肿瘤细胞沿基底膜缺损和基质空隙向周围浸润和转移[4]。最近研究结果发现血清MMP-9在乳腺癌、食管癌和肺癌中明显升高[5]。Itatsu等[6]采用免疫组织化学技术发现胆管癌组织标本中MMP-9表达增强。我们的研究发现,胆管癌患者血清MMP-9水平和良性胆管疾病患者未呈现统计学差异,但胆汁MMP-9水平呈显著升高。TIMPs作为MMPs的抑制剂,结合于MMPs的催化活性中心,可下调MMPs活性,抑制MMPs对基底膜的降解[7]。目前已发现四种TIMPs,分别命名为TIMP1~4。TIMP-1是MMP-9的天然抑制剂,TIMP-1以共价键的形式和MMP-9形成复合体,影响MMP-9对基底物的结合从而抑制MMP-9的催化活性[8]。研究发现,TIMP-1在成纤维细胞系和上皮细胞系中刺激细胞生长,并且与肿瘤细胞增殖和血管生成相关[9]。在结直肠癌和乳腺癌组织中TIMP-1呈高表达,且血浆TIMP-1水平是结直肠癌、肺癌和乳腺癌患者重要的预后因素[10]。我们的研究发现胆管癌患者血清TIMP-1水平和良性胆管疾病患者未呈现统计学差异,但胆汁TIMP-1水平呈显著降低。上述结果均提示MMP-9和TIMP-1可能与胆管癌的发生和发展相关。本研究中胆管癌组胆汁MMP-9/TIMP-1值显著高于良性疾病组,其可能机制:肿瘤的发生发展过程和慢性炎症密切相关,有研究发现血清MMP-9和TIMP-1在术后炎症发生过程中显著升高,TIMP-1随炎症消退而下降,而MMP-9仍保持升高状态[11]。在胆管癌发展过程中,MMP-9水平显著增高,机体通过反馈调节TIMP-1水平增高,但随着胆管癌进展,TIMP-1增高幅度下降,导致MMP-9/TIMP-1值失衡,TIMP-1不能抑制MMP-9的活性,从而导致胆管癌的发生发展。
我们采用ROC曲线评估血清和胆汁MMP-9和TIMP-1在胆管癌中的诊断价值。在单一指标的分析中,胆汁TIMP-1的准确度高于血清MMP-9、胆汁MMP-9和血清TIMP-1,达到76.3%。若采用MMP-9/TIMP-1值作为诊断标志物,胆汁MMP-9/TIMP-1值诊断准确度达到81.4%,灵敏度为93.3%,特异度为75.0%,因此胆汁MMP-9/TIMP-1值比其他指标预测胆管癌有更大潜能。
综上所述,MMP-9和TIMP-1在胆管癌的发展过程中发挥重要作用,胆汁MMP-9和TIMP-1在鉴别诊断胆管癌和良性疾病中有高灵敏度、低特异度和中等准确度。胆汁MMP-9/TIMP-1值与其他指标相比有良好的诊断效能,对于胆管癌的筛查有重要意义。在以后的研究中,我们将扩大样本含量,进一步揭示MMP-9和TIMP-1在胆管癌中的诊断价值。
[1]覃理灵,石青峰,廖维甲,等.sICAM-1、CA19-9、CEA三种肿瘤标志物联合检测在胆管癌诊断中的价值[J].中国实验诊断学,2010,14(3):413-415.
[2]韩大力,王克山,于甬华.胆管癌的诊断与治疗研究进展[J].山东医药,2013,53(42):100-102.
[3]Pattanapairoj S,Silsirivanit A,Muisuk K,et al.Improve discrimination power of serum markers for diagnosis of cholangiocarcinoma using data mining-based approach[J].Clin Biochem,2015,48 (10-11):668-673.
[4]Ricci S,Bruzzese D,DI Carlo A.Evaluation of MMP-2,MMP-9,TIMP-1,TIMP-2,NGAL and MMP-9/NGAL complex in urine and sera from patients with bladder cancer[J].Oncol Lett,2015,10 (4):2527-2532.
[5]Vandooren J,Van den Steen PE,Opdenakker G.Biochemistry and molecular biology of gelatinase B or matrix metalloproteinase-9 (MMP-9):the next decade[J].Crit Rev Biochem Mol Biol,2013,48(3):222-272.
[6]Itatsu K,Sasaki M,Yamaguchi J,et al.Cyclooxygenase-2 is involved in the up-regulation of matrix metalloproteinase-9 in cholangiocarcinoma induced by tumor necrosis factor-alpha[J].Am J Pathol,2009,174(3):829-841.
[7]Brown GT,Murray GI.Current mechanistic insights into the roles of matrix metalloproteinases in tumour invasion and metastasis[J]. J Pathol,2015,237(3):273-281.
[8]Thorsen SB,Christensen SL,Würtz SO,et al.Plasma levels of the MMP-9:TIMP-1 complex as prognostic biomarker in breast cancer:a retrospective study[J].BMC Cancer,2013,13(13):598.
[9]Ries C.Cytokine functions of TIMP-1[J].Cell Mol Life Sci,2014,71(4):659-672.
[10]Nielsen HJ,Brünner N,Frederiksen C,et al.Plasma tissue inhibitor of metalloproteinases-1(TIMP-1):a novel biological marker in the detection of primary colorectal cancer.Protocol outlines of the Danish-Australian endoscopy study group on colorectal cancer detection[J].Scand J Gastroenterol,2008,43(2):242-248.
[11]Helmersson-Karlqvist J,Akerfeldt T,Gunningberg L,et al.Serum MMP-9 and TIMP-1 concentrations and MMP-9 activity during surgery-induced inflammation in humans[J].Clin Chem Lab Med,2012,50(6):115-119.
10.3969/j.issn.1002-266X.2016.25.019
R735.8
B
1002-266X(2016)25-0056-03
2016-03-02)

