小米-藜麦饮品液化糖化及稳定剂配方研究
陈树俊,庞震鹏,刘晓娟,胡 洁,徐晓霞,仪 鑫,石 玥,李 乐
(山西大学 生命科学学院,山西太原 030006)
小米-藜麦饮品液化糖化及稳定剂配方研究
陈树俊,庞震鹏,刘晓娟,胡洁,徐晓霞,仪鑫,石玥,李乐
(山西大学 生命科学学院,山西太原 030006)
以小米、藜麦为原料,探讨了二者复配后最佳的液化、糖化条件及乳化剂、增稠剂对体系稳定性的影响。通过单因素及正交实验确定了小米-藜麦复配谷物粉的最佳液化及糖化条件,通过响应面法优化了体系稳定剂添加配方。结果表明,最佳液化条件为:α-淀粉酶添加量6 U/g,作用时间40 min,液化温度70 ℃,pH7;最佳糖化条件为:β-淀粉酶添加量120 U/g,糖化温度65 ℃,作用时间60 min,pH6.5。优化的稳定剂配方:蒸馏单硬脂酸甘油酯0.05%,蔗糖脂肪酸酯0.05%,黄原胶0.064%,CMC 0.008%,海藻酸钠0.036%。此工艺条件下的小米-藜麦饮品中还原糖含量高,稳定性好。
小米-藜麦,液化,糖化,稳定性
小米是我国北方地区常见的杂粮作物之一,营养成分丰富。小米中蛋白含量平均为9.28%,消化率达80%,生物价57,优于大米及小麦[1]。小米中碳水化合物比重高,还原糖平均为0.53%、淀粉58%,纤维素1.3%[2]。其脂肪属优质脂肪,含量均值4.5%,其中不饱和脂肪酸如亚油酸、亚麻酸的含量高于85%[3],亚油酸及亚麻酸比例为6.5∶1,在世界卫生组织推荐标准范围内[4]。国外研究发现,小米多酚对羟自由基清除率达90%以上,高于多数谷物[5-6]。藜麦原产于南美,谷粒与小米相似,其营养物质丰富[7]。藜麦氨基酸组成较均衡,藜麦蛋白中赖氨酸是推荐量的3.38倍、组氨酸及蛋氨酸是推荐量的2倍[8],藜麦亦含多种必需脂肪酸,其不饱和脂肪酸占比83%[9]。此外,藜麦富含矿物质及维生素等微量元素,铁、镁、铜可满足成人及婴幼儿每日所需,藜麦籽中VE含量约5.37%,高于小麦、大麦等常见粮食,VB1、VB2含量也较高[10-11]。
小米中限制性氨基酸为赖氨酸[12],蛋白价值较低,陈树俊等[13]通过氨基酸评价法发现,小米粉与藜麦粉按1∶2的质量比混合后,其化学评分及氨基酸评分较未复配的小米分别提高了201.52%及182.3%,二者复配后氨基酸评价指标提升明显。目前市场上关于此类复配型谷物饮品品种较少,本研究将小米粉、藜麦粉混合,采用酶解法对其液化、糖化等关键工艺进行研究,确定最佳的液化、糖化条件;采用单因素实验与响应面法探究乳化剂及增稠剂对体系稳定性的影响,并筛选出了最佳的稳定剂添加配方,为日后小米-藜麦复配谷物饮品的生产提供理论依据。
1 材料与方法
1.1材料与仪器
“沁州黄”小米、藜麦太原市美特好超市售;碘-碘化钾溶液;碱性酒石酸铜甲乙液、乙酸锌溶液(219 g/L)、亚铁氰化钾(106 g/L);0.1%葡萄糖标准溶液;石油醚(分析纯)、乙醇溶液(85%)、氢氧化钠溶液(400 g/L)、乙酸铅溶液(200 g/L)、硫酸钠溶液(100 g/L);α-淀粉酶(3700 U/g)、β-淀粉酶(100000 U/g)北京索莱宝科技有限公司;蒸馏单硬脂酸甘油酯张家港中期食品添加剂有限公司;蔗糖脂肪酸酯柳州爱格富食品科技股份有限公司;羟甲基纤维素钠(CMC)重庆力宏精细化工有限公司;黄原胶淄博中轩生化有限公司;海藻酸钠河南思远生物科技有限公司。
SC-3610低速离心机安徽中科中佳仪器有限公司;电热恒温水浴锅HRHS24青岛海尔医用低温科技有限公司;FA25高剪切分散乳化机上海弗鲁克流体机械制造有限公司。
1.2实验方法
1.2.1原料处理将小米、藜麦分别磨10 min并过60目筛,每组实验均准确称取相同质量(精确至0.001 g)的小米粉与藜麦粉,按1∶2的比例混合[13],作为复配谷物粉。
1.2.2复配谷物饮品工艺流程复配谷物粉→加水热磨30 min(料水比1∶14,80 ℃)[13]→冷却→液化(酶解)→糖化(酶解)→灭酶→调配→均质→灭菌→成品
1.2.3复配谷物粉液化的单因素实验以Dextrose Equivalent值(还原糖值,以下简称DE值)为指标,评价α-淀粉酶添加量、作用温度、作用时间及pH四因素对复配谷物浓浆液化效果影响。α-淀粉酶添加量的确定:取热磨冷却后的复配谷物浓浆150 mL,在温度70 ℃,pH6.0,加酶量分别为2、3、4、5、6、7 U/g的条件下,酶解30 min,测定DE值。时间的确定:取热磨冷却后的复配谷物浓浆150 mL,在α-淀粉酶添加量5 U/g,温度70 ℃,pH6条件下,分别酶解10、20、30、40、50 min,测定DE值。温度的确定:取热磨冷却后的复配谷物浓浆150 mL,在α-淀粉酶添加量5 U/g,pH6,温度分别为50、60、70、80、90 ℃的条件下,酶解30 min,测定DE值。pH的确定:取热磨冷却后的复配谷物浓浆150 mL,在pH分别为5.0、5.5、6.0、6.5、7.0,α-淀粉酶添加量5 U/g,温度70 ℃的条件下,酶解30 min,测定DE值。
1.2.4复配谷物粉液化正交实验在单因素实验基础上设计正交实验,选择α-淀粉酶添加量、温度、时间及pH为自变量,结果用DE值表示,因素水平表见表1。

表1 因素水平表Table 1 Table of factors and levels
1.2.5复配谷物粉糖化的单因素实验以DE值为指标,评价β-淀粉酶添加量、作用温度、作用时间及pH四因素对复配谷物浓浆的糖化效果影响。β-淀粉酶添加量的确定:取液化后的复配谷物浓浆150 mL,在温度55 ℃,pH6,加酶量分别为50、70、90、110、120 U/g的条件下,酶解40 min,测定DE值。糖化温度的确定:取液化后的复配谷物浓浆150 mL,在β-淀粉酶添加量90 U/g,pH6条件下,温度分别为40、45、50、55、60、65、70 ℃,酶解40 min,测定DE值。糖化时间的确定:取液化后的复配谷物浓浆150 mL,在β-淀粉酶添加量90 U/g,温度55 ℃,pH6条件下,分别酶解10、20、30、40、50、60、70 min,测定DE值。pH的确定:取液化后的复配谷物浓浆150 mL,在pH分别为5.0、5.5、6.0、6.5、7.0的条件下,β-淀粉酶添加量90 U/g,温度55 ℃,酶解40 min,测定DE值。
1.2.6复配谷物粉糖化正交实验在单因素实验基础上设计正交实验,选择β-淀粉酶添加量、温度、时间及pH为自变量,结果用DE值表示,因素水平表见表2。
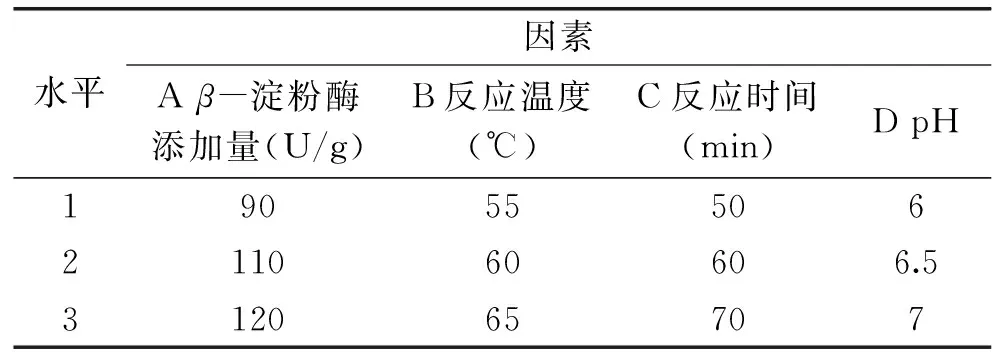
表2 因素水平表Table 2 Table of factors and levels
1.2.7液化、糖化DE值的测定不同液化、糖化条件下的复配谷物浓浆DE值公式:
式中:还原糖含量:150 mL复配谷物浓浆酶解后含有的还原糖含量;原淀粉含量:150 mL复配谷物浓浆参与酶解反应的淀粉含量。
还原糖含量测定方法:食品中还原糖的测定(GB/T 5009.7-2008);
淀粉含量测定方法:食品中淀粉的测定(GB/T 5009.9-2008)。
1.2.8不同乳化剂对体系稳定性影响的单因素实验植物蛋白饮品的稳定性是由体系亲水亲油平衡状态决定的,乳化剂亲水基团分为线性和环形,二者复配使用效果较好[14]。以液化、糖化后的小米-藜麦谷物浆液为原料,线性基团的蒸馏单硬脂酸甘油酯、环形基团蔗糖脂肪酸酯为乳化剂进行实验,以离心沉淀率为指标,评估蔗糖脂肪酸酯:蒸馏单硬脂酸甘油酯在比例为1∶5、2∶4、3∶3、4∶2、5∶1,总添加量为0%、0.05%、0.10%、0.15%、0.20%时复配谷物浓浆的稳定性。
添加乳化剂后,先均质5 min,置于60 ℃恒温水浴30 min,待冷却至室温后再均质2 min,取10 mL样液置于15 mL离心管中,于4000 r/min离心15 min,弃去上清液,用滤纸吸去残留于离心管壁的液体,准确称取沉淀重量(精确至0.001 g),计算离心沉淀率。公式:

1.2.9增稠剂对体系稳定性影响的单因素实验以添加乳化剂配方后的复配谷物浓浆为原料,以离心沉淀率为指标,分别探究黄原胶、CMC、海藻酸钠三种增稠剂在不同添加量下对体系稳定性的影响。黄原胶添加量的确定:取添加最适乳化剂的样品液100 mL,加入0.01%的CMC及0.03%的海藻酸钠后,分别添加0.01%、0.03%、0.05%、0.07%、0.09%的黄原胶,测定离心沉淀率。海藻酸钠添加量的确定:取添加最适乳化剂的样品液100 mL,加入0.01%的CMC及0.05%的黄原胶后,分别添加0.01%、0.02%、0.03%、0.04%、0.05%的海藻酸钠,测定离心沉淀率。CMC添加量的确定:取添加最适乳化剂的样品液100 mL,加入0.05%的黄原胶及0.03%的海藻酸钠后,分别添加0.005%、0.01%、0.015%、0.02%、0.03%的CMC,测定离心沉淀率。
添加增稠剂后,先均质5 min,置于60 ℃恒温水浴30 min,待冷却至室温后再均质2 min,取10 mL样液置于15 mL离心管中,于4000 r/min离心15 min,弃去上清液,用滤纸吸去残留于离心管壁的液体,准确称取沉淀重量(精确至0.001 g),计算离心沉淀率。
1.2.10增稠剂对体系稳定性影响的响应面实验依据1.2.9单因素实验结果,利用Box-Behnken中心组合实验设计原理,以离心沉淀率为响应值设计三因素三水平实验见表3。
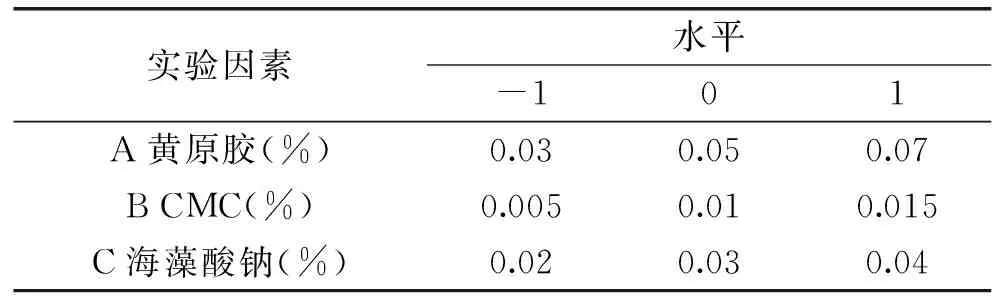
表3 Box-Behnken因素及水平编码表Table 3 Factors and levels in the Box-Behnken experiment design
1.2.11数据处理及分析每组实验均重复测定三次,数据均以平均数±标准偏差SD(±SD)表示。采用Microsoft Excel及SPSS数学分析软件对数据进行分析处理及图表编辑,采用Minitab(15.0)软件对响应面实验进行设计与数据分析。
2 结果与分析
2.1小米-藜麦复配粉最佳液化工艺条件的确定
2.1.1单因素实验结果液化、糖化是紧密关联的过程,由于糖化过程中酶与底物先络合再催化,所以要求底物在一定分子量范围内,当DE<10,淀粉颗粒会重新结合;DE>20,影响催化效果,造成最终糖化DE值变低[15]。故复配谷物粉液化至DE值在10~20内才利于糖化[16]。
由图1~图4,液化DE值随加酶量、时间及pH的变化曲线相似,均是先增大后趋于平缓。当加酶量大于5 U/g或酶解时间大于40 min时,酶解反应接近终点。pH在6~7的范围内酶解反应效果相对较好,pH中性环境不会影响α-淀粉酶的活性[17]。随温度的升高,液化DE值先升高后降低,70 ℃时达到最高值,继续升温DE值反而降低,原因可能是70 ℃以上的高温使酶的活性降低,酶解反应减弱。
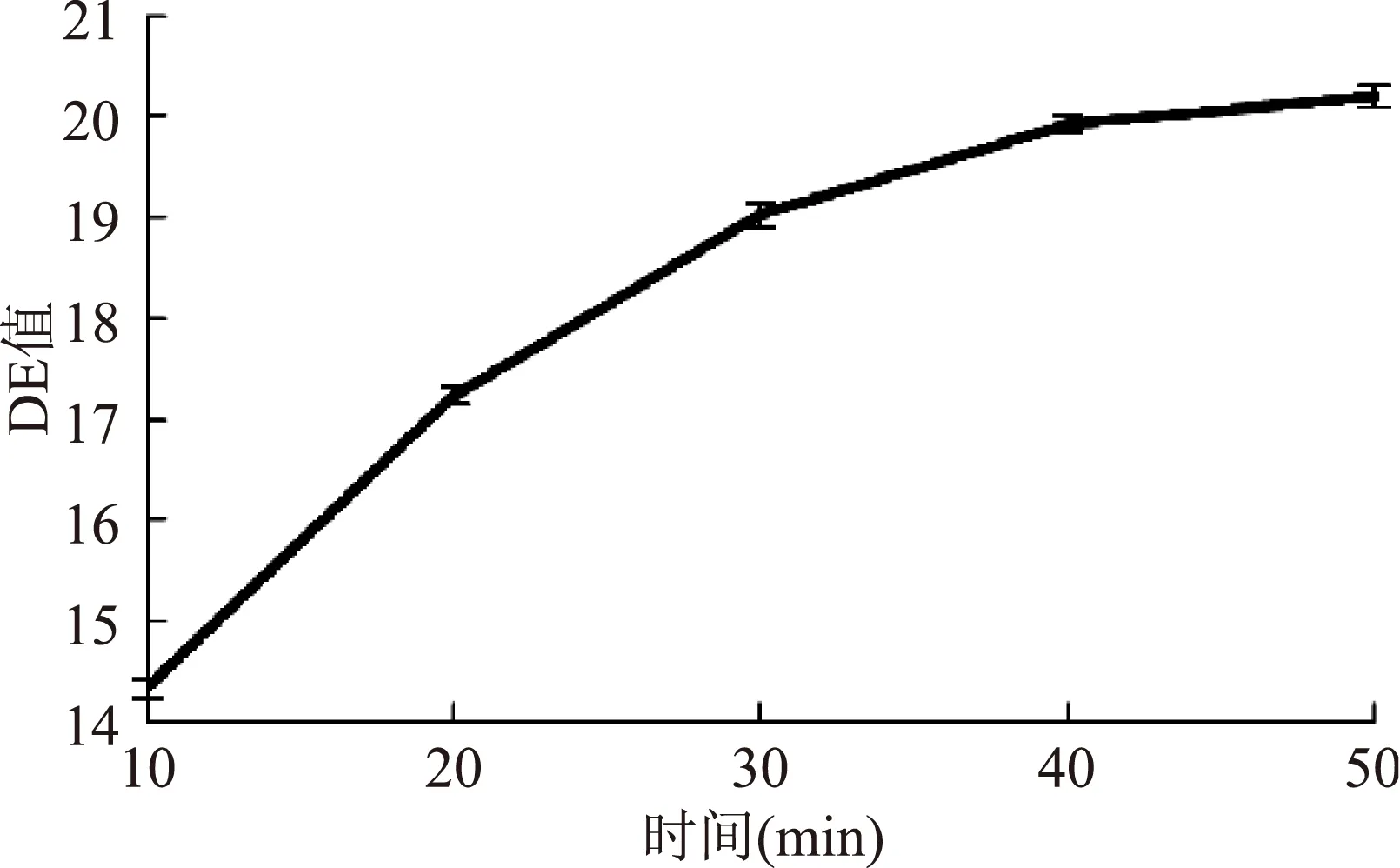
图2 作用时间对液化DE值的影响Fig.2 Effect of reaction time on DE of liquefaction
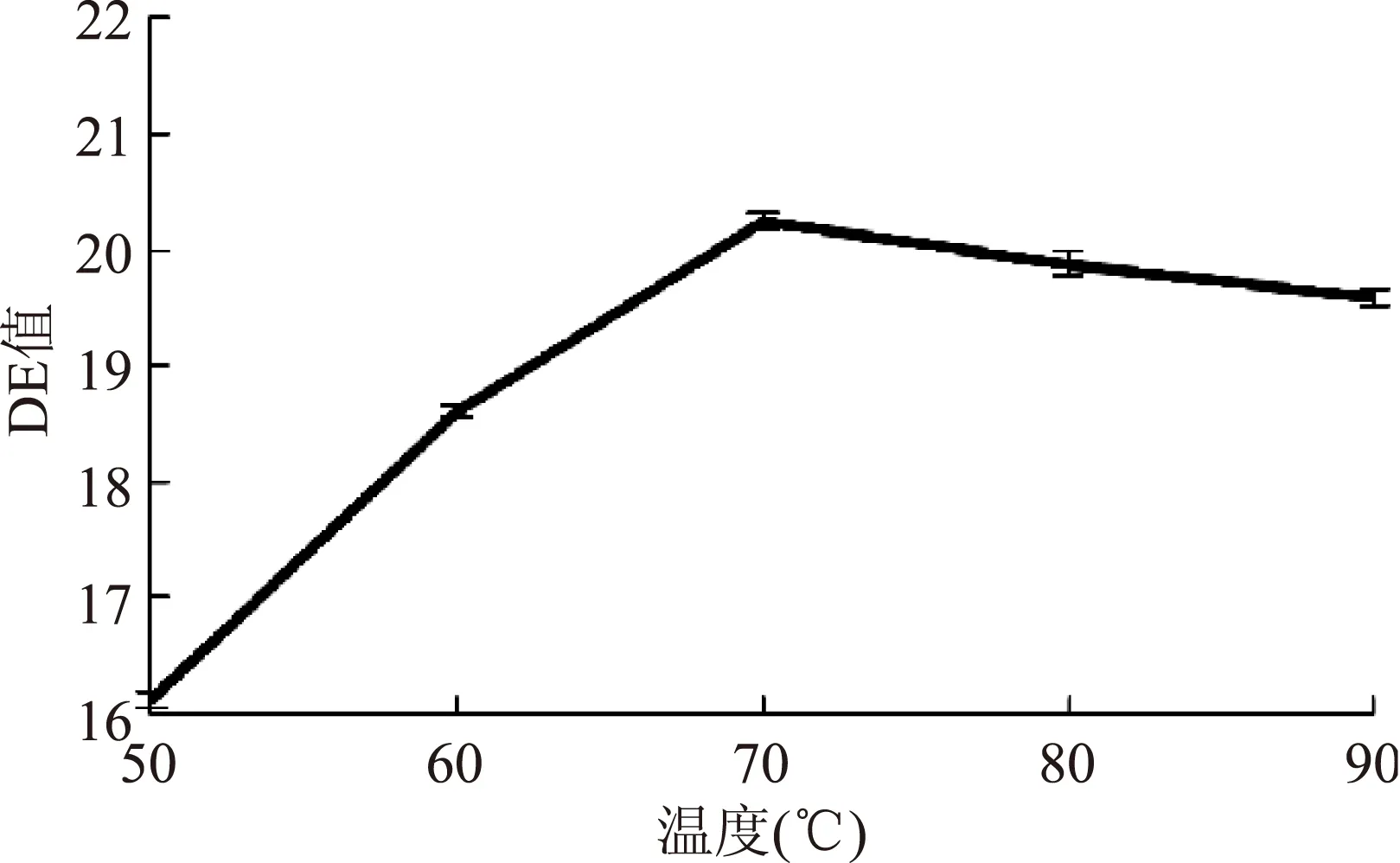
图3 作用温度对液化DE值的影响Fig.3 Effect of reaction temperature on DE of liquefaction
2.1.2液化正交实验结果由表4~表5,复配谷物浓浆最佳液化工艺条件组合为A3B2C2D3,即α-淀粉酶为6 U/g,时间40 min,温度70 ℃,pH7,在此工艺条件下进行验证实验,重复测定三次取均值,DE值为19.93±0.05,介于10~20范围内,且高于10~20范围内的其他指标值。其中,温度对液化工艺的影响最大,加酶量及pH次之,时间的影响最小。由方差分析,1号与6号实验数值间差异不显著(p>0.05),其他各组实验数值两两间均差异显著(p<0.05)。α-淀粉酶添加量和温度对液化DE值的影响显著,其他两个因素影响不显著。

表5 方差分析表Table 5 analysis of variance table

图4 pH对液化DE值的影响Fig.4 Effect of pH on DE of liquefaction
注:*表示差异显著(p<0.05)。

表4 液化正交实验结果Table 4 Orthogonal test result of liquefaction
2.2小米-藜麦谷物饮品最佳糖化工艺条件的确定
2.2.1单因素实验结果将淀粉全部酶解为葡萄糖时,其DE理论值可达100,而β-淀粉酶水解后的产物为麦芽糖,在相同质量下其还原能力为葡萄糖的一半,这使得糖化过程中DE值一般很难高于50,故糖化过程中,DE值最佳范围为20~50。
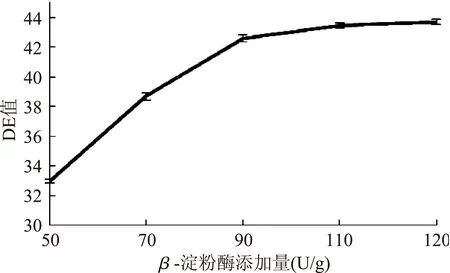
图5 β-淀粉酶添加量对糖化DE值的影响Fig.5 Effect of β-amylase amount on DE of saccharification
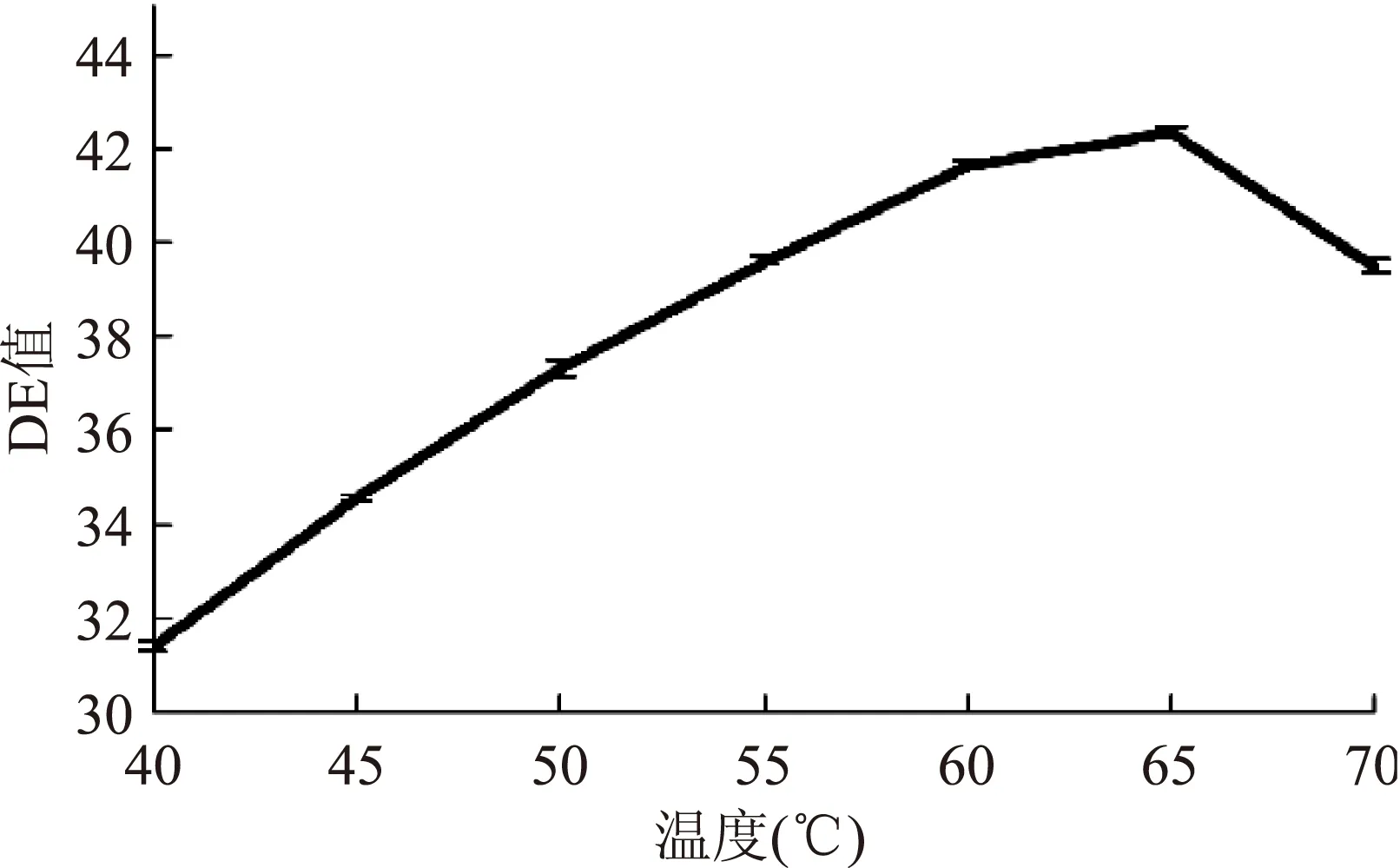
图6 作用温度对糖化DE值的影响Fig.6 Effect of reaction temperature on DE of saccharification

图7 作用时间对糖化DE值的影响Fig.7 Effect of reaction time on DE of saccharification
由图5~图8,DE值随β-淀粉酶添加量增加而增大,之后曲线趋于平缓,即酶解反应接近重点,确定β-淀粉酶最适添加量为110 U/g;当温度从40 ℃升至65 ℃时,DE值从31.42±0.13迅速增至42.33±0.13,温度超过65 ℃时,DE值降低,可能是65 ℃以上的温度破坏了β-淀粉酶的蛋白结构,降低了酶解反应能力;DE值随时间增长而增长,60 min时曲线趋于平缓,底物浓度减少,淀粉酶与底物反应变慢,故反应时间为60 min;DE值随pH的升高先升后降,在pH>6.5的反应环境下,DE值减小,故pH为6.5。

表7 方差分析表Table 7 analysis of variance table
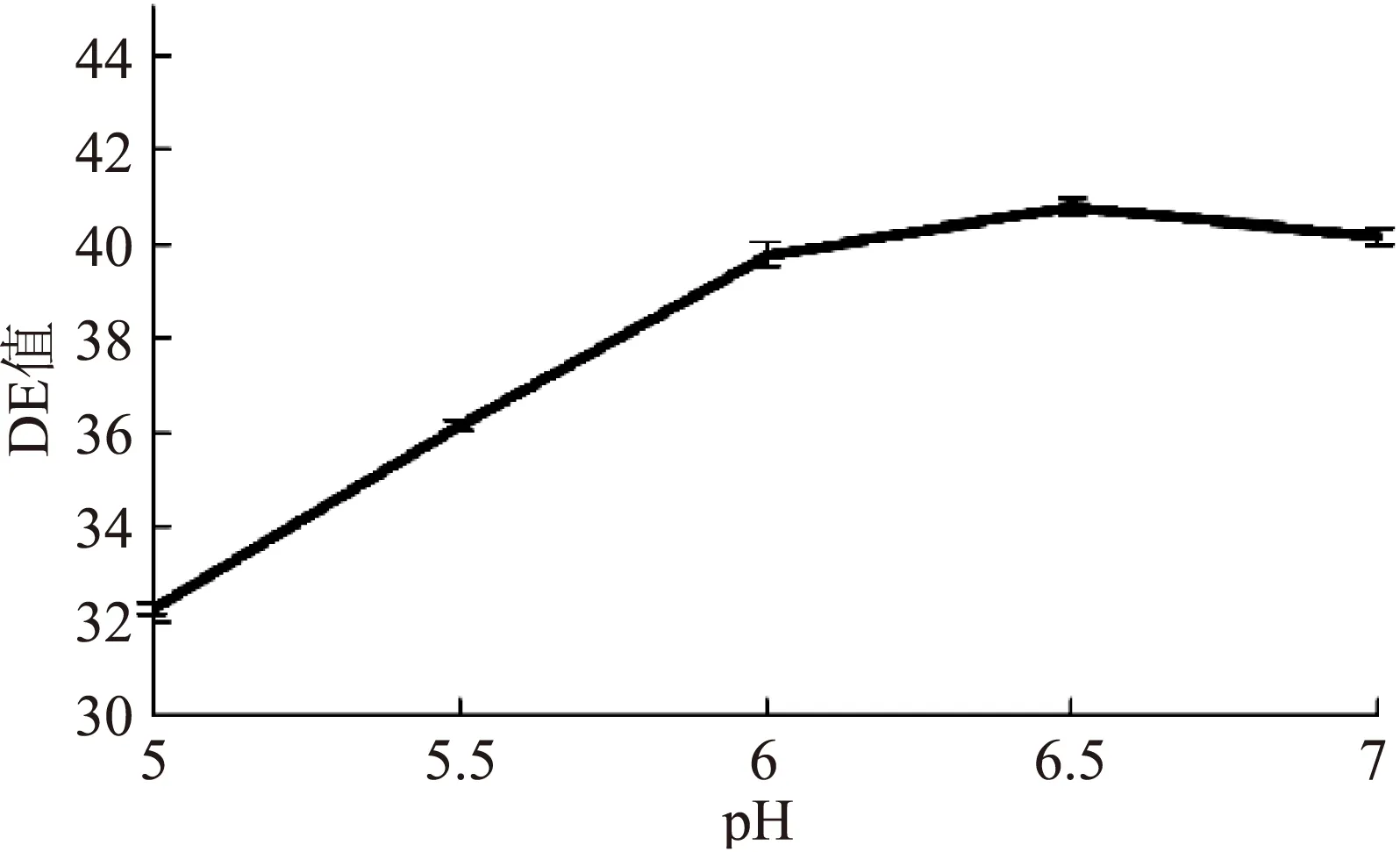
图8 pH对糖化DE值的影响Fig.8 Effect of pH on DE of saccharification
注:*表示差异显著(p<0.05)。
2.2.2糖化正交实验结果由表6~表7,小米-藜麦复配谷物浓浆最佳糖化工艺条件组合为A3B3C2D2,即β-淀粉酶为120 U/g,温度65 ℃,时间60 min,pH6.5,进行验证实验,重复测定三次后DE值达45.46±0.12,在20~50范围内最高,说明该糖化工艺效果较好,糖化产物麦芽糖含量较高。β-淀粉酶的添加量对糖化影响作用最大,其次为时间、温度,pH影响作用最小。经方差分析,3号与6号实验数值间差异不显著,2号、7号、8号实验数值两两间差异不显著,其他各组实验数值两两间均差异显著。β-淀粉酶添加量及时间对糖化DE值影响显著,其他两个因素影响不显著。

表6 糖化正交实验结果Table 6 Orthogonal test result of saccharification
2.3不同乳化剂对体系稳定性影响的实验结果
不同总添加量的乳化剂在不同复配比例下对体系沉淀率影响趋势见图9。
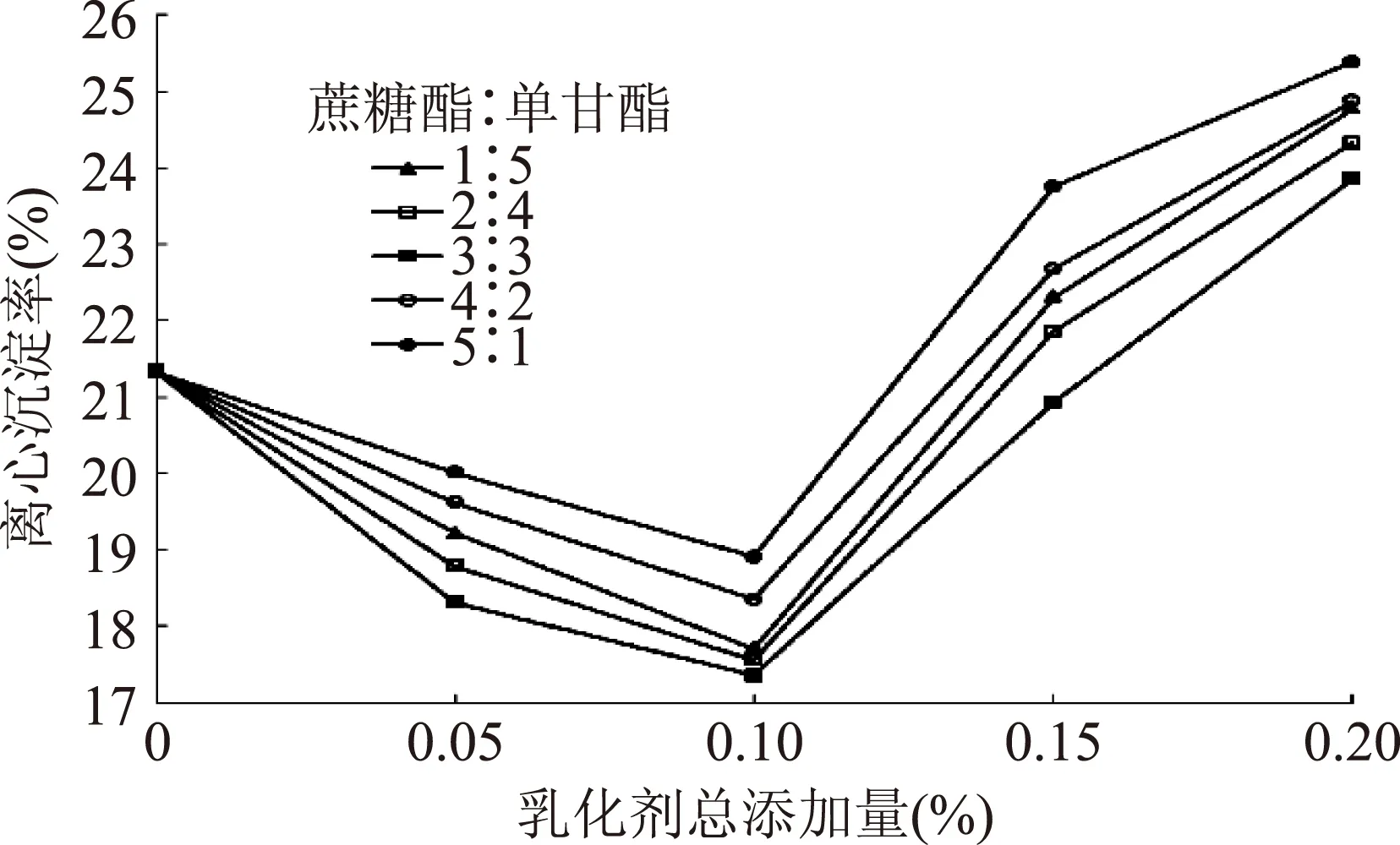
图9 不同配比的乳化剂在不同总添加量下对沉淀率的影响Fig.9 Effect of different proportion of emulsifier on the deposition rate of different additive amount注:不添加乳化剂时,沉淀率为(21.33±0.17%)。
由图9可得不同复配比例的乳化剂对沉淀率的影响均为先降低后升高,且均在总添加量为0.10%时达到最低点,当蔗糖酯∶单甘酯=3∶3时,复配谷物浓浆的离心沉淀率低至(17.36±0.11)%。当总添加量为0.15%及以上时,其沉淀率高于不添加乳化剂时的沉淀率,原因可能是乳化剂添加过量时,乳液体系泡沫增多,粘度增大,大颗粒物质因粘附作用更易发生沉淀,致使体系不稳定性增加。因此蔗糖酯:单甘酯复配比例为3∶3(即1∶1),总添加量为0.10%时,谷物浆液系统稳定性最好,且与添加乳化剂前相比,沉淀率降低了18.61%。
2.4不同增稠剂对体系稳定性影响单因素实验结果
由图10~图12,随黄原胶添加量的增加,沉淀率先降后升,添加量为0.05%时,沉淀率低至(13.57±0.06)%,当超过0.07%时,沉淀率升高,且出现分层现象,可能是较高浓度的黄原胶更易引起乳状液的絮凝[18];随海藻酸钠添加量的增加,沉淀率先降低后升高,0.03%时达到最低,为(14.68±0.07)%,超过0.03%时,沉淀率上升,原因可能是体系平衡被打破,发生了蛋白沉淀及油脂上浮;随CMC添加量的增加,沉淀率先降低后升高,0.01%时沉淀率最低,随后沉淀率一直升高。可能是高含量CMC体系中蛋白质与CMC的静电吸附作用减小,未被吸附的CMC分子使体系发生排斥絮凝,导致沉淀率上升[18]。
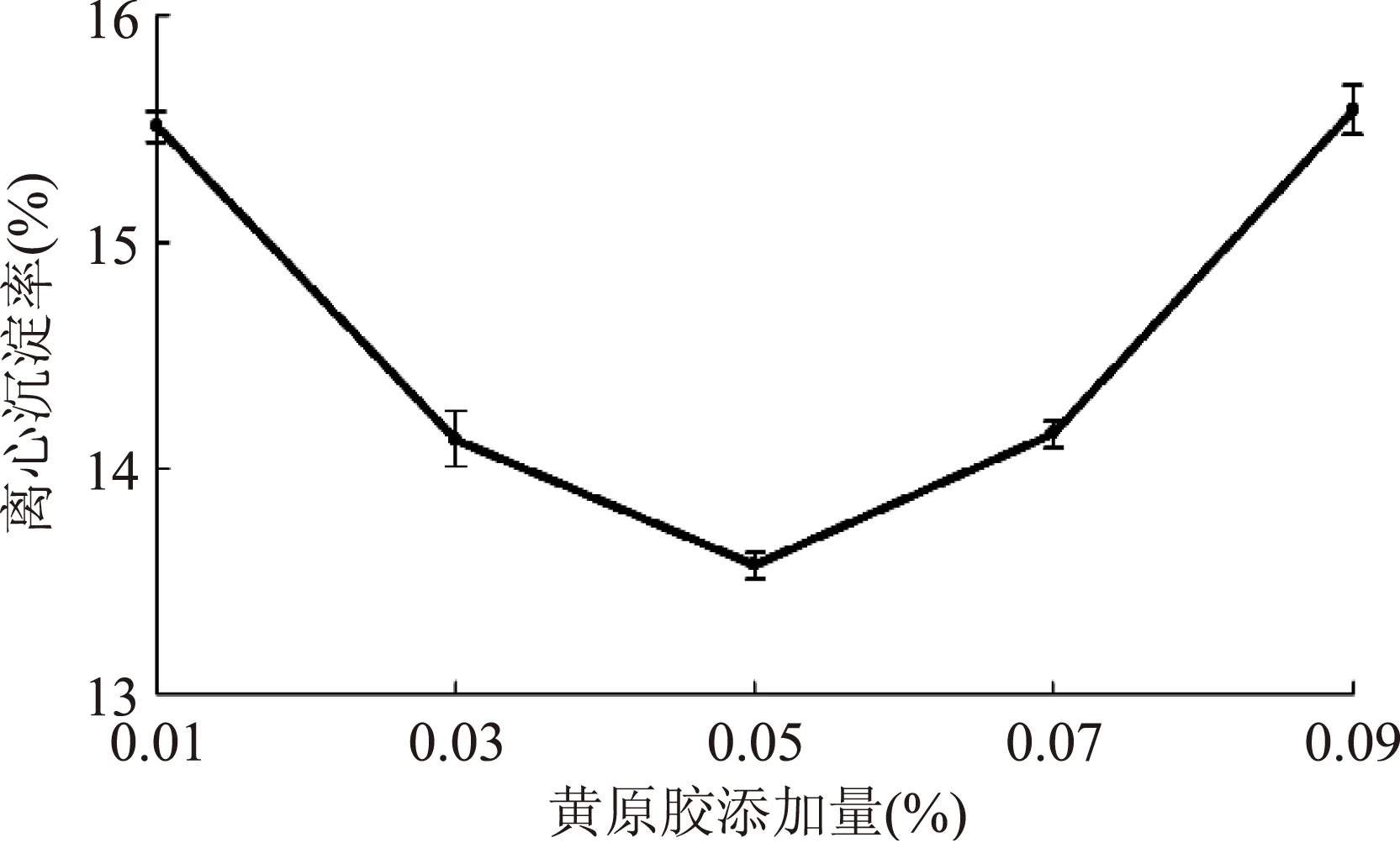
图10 黄原胶添加量对沉淀率的影响Fig.10 Effect of xanthan gum amount on sedimentation ratio
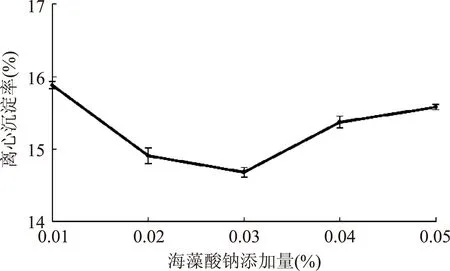
图11 海藻酸钠添加量对沉淀率的影响Fig.11 Effect of sodium alginate amount on sedimentation ratio

图12 CMC添加量对沉淀率的影响Fig.12 Effect of sodium carboxymethyl cellulose amount on sedimentation ratio
2.5不同增稠剂对体系稳定性影响的响应面实验结果
对实验结果中的数值进行多元回归分析,确定回归方程如下:
Y=12.2300-0.917500A+0.818750B-0.691250C+0.865000A2+0.937500B2+1.03750C2-0.0725000AB-0.597500AC+0.0900000BC
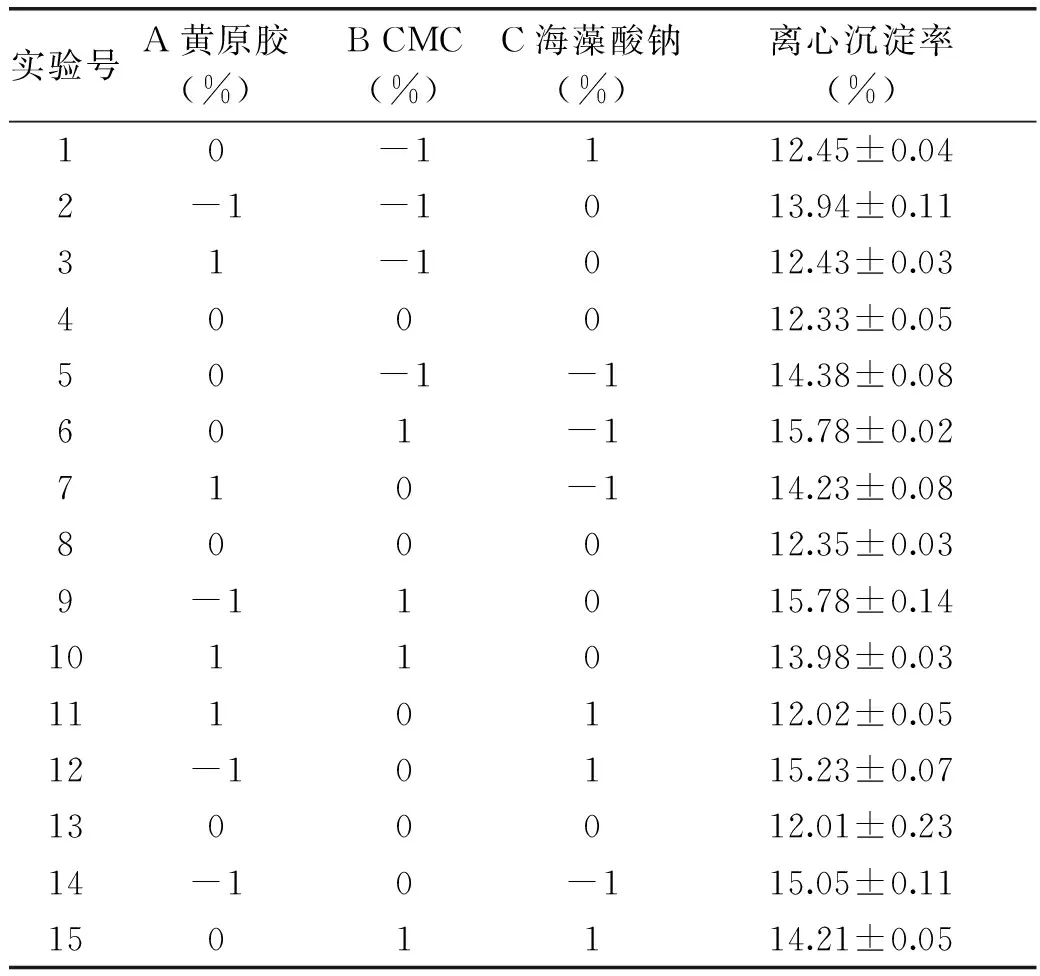
表8 Box-Behnken设计及结果Table 8 Box-Behnken experimental design and results
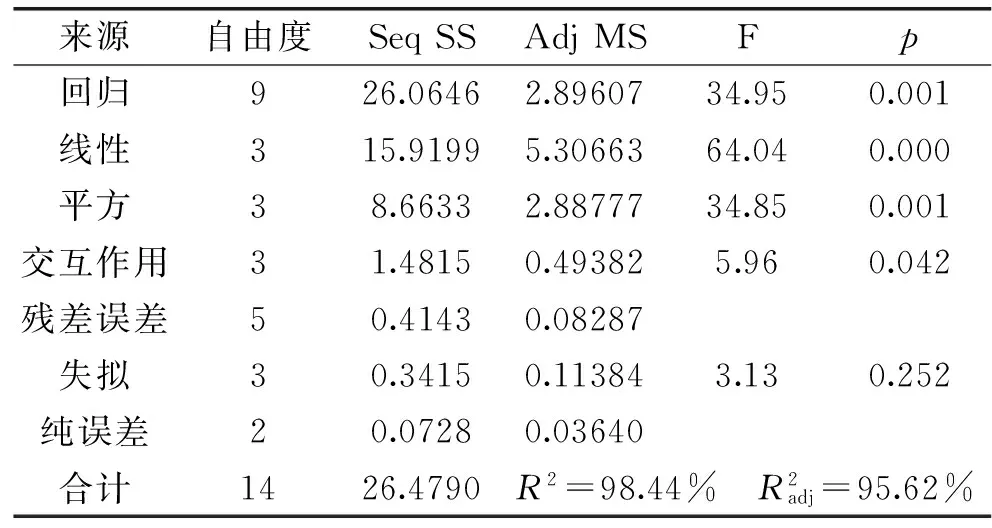
表9 回归模型方差分析及显著性检验Table 9 The variance analysis and significance test of regression model
由表10,A、B、C,A2、B2、C2,AC对响应值的影响是极显著的,表明A(黄原胶)、B(CMC)、C(海藻酸钠)三个因子对沉淀率的影响显著,且AC交互项影响大于AB与BC,各因素对响应值的影响次序为A>C>B。

表10 回归系数显著性分析结果Table 10 The significant results of autoregressive model cofficients
注:*表示差异显著(p<0.05);**表示差异极显著(p<0.01)。
响应面图是响应值对各实验因素构成三维曲面,从分析图上可找出最佳参数及各因素的交互作用。由图13~图15,在各因素水平编码范围内,随黄原胶添加量增加及CMC添加量减少,离心沉淀率趋于降低;随黄原胶及海藻酸钠添加量增加,离心沉淀率趋于降低;随海藻酸钠添加量增加及CMC添加量减少,离心沉淀率趋于降低。三者对于离心沉淀率的影响,原因可能是:蛋白与胶体吸附后再与水结合,使蛋白颗粒稳定分散在体系中;黄原胶与海藻酸钠复配产生协同作用,将大分子蛋白稳定在二者形成的网状结构中不发生沉降,使得复配谷物饮品的离心沉淀率降低并保持稳定[19]。
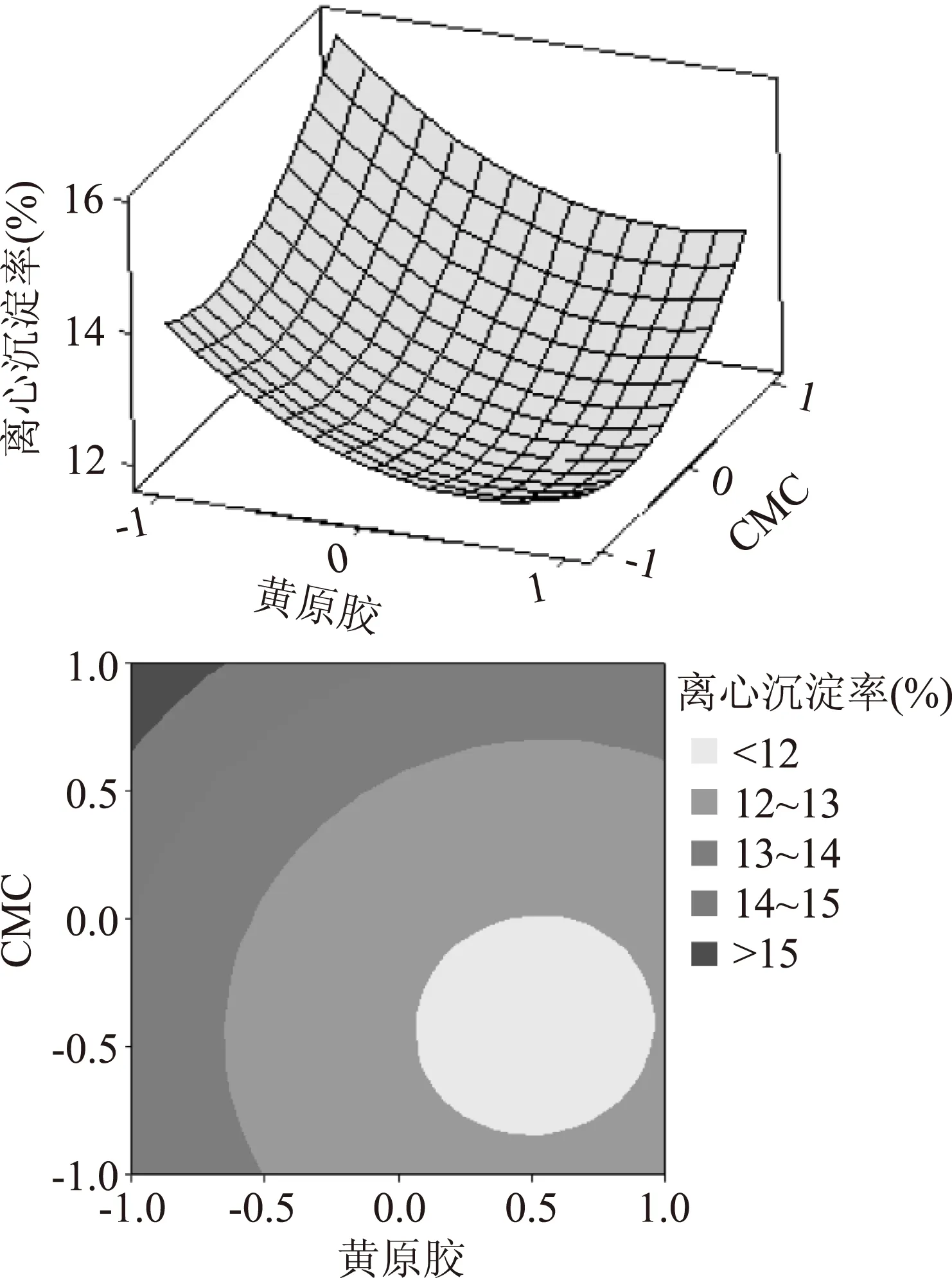
图13 黄原胶与CMC之间的等高线及响应面图Fig.13 Response surface and contour plots showing the interactive effects of xanthan gum and sodium carboxymethyl cellulose

图14 黄原胶与海藻酸钠之间的等高线及响应面图Fig.14 Response surface and contour plots showing the interactive effects of xanthan gum and sodium alginate
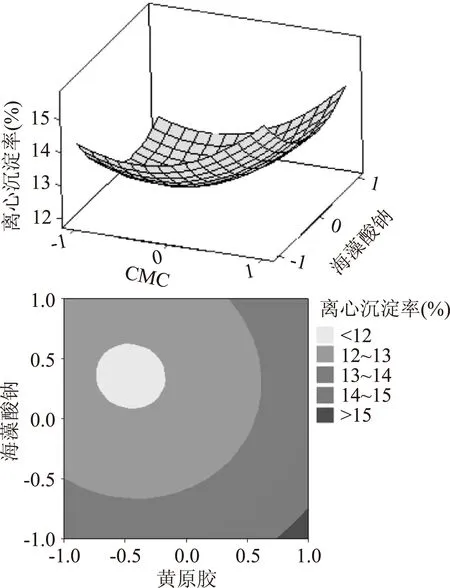
图15 CMC与海藻酸钠之间的等高线及响应面图Fig.15 Response surface and contour plots showing the interactive effects of sodium carboxymethyl cellulose and sodium alginate
由等高线及响应面图可以看出该模型存在最小值。利用Minitab软件响应优化器得到最佳工艺为:黄原胶0.0639%,CMC 0.0078%,海藻酸钠 0.0356%,离心沉淀率为11.537%。将工艺参数调整为:黄原胶添加量0.064%,CMC添加量0.008%,海藻酸钠添加量0.036%后进行验证实验,重复测定三次,离心沉淀率为(11.56±0.05)%,与预测值接近,说明实验结论准确度较高,此回归模型预测具有应用价值。
3 结论
液化、糖化及稳定剂的筛选是复配谷物浓浆饮品生产中的关键步骤,其中液化产物有助于糖化淀粉酶的进一步糖化,糖化过程可提高饮品中固形物的含量,利于营养物质溶出[20-21]。经实验,得到最佳液化条件:α-淀粉酶添加量为6 U/g、时间40 min、温度70 ℃、pH7,α-淀粉酶添加量及温度对液化影响显著。最佳糖化条件:β-淀粉酶添加量为120 U/g、温度65 ℃、时间60 min、pH6.5,β-淀粉酶添加量及时间对糖化影响显著。采用单因素实验及Box-Behnken实验设计确定了最佳稳定剂配方:蒸馏单硬脂酸甘油酯0.05%、蔗糖脂肪酸酯0.05%、黄原胶0.064%、CMC 0.008%、海藻酸钠0.036%,黄原胶与海藻酸钠的协同作用对体系沉淀率的影响作用极显著。经验证实验,添加此配方后离心沉淀率仅为(11.56±0.05)%,与原浓浆相比,沉淀率降低了45.8%。最终的小米-藜麦谷物饮品中还原糖含量较高,稳定性好。
[1]王海滨,夏建新. 小米的营养成分及产品研究开发进展[J]. 粮食科技与经济,2010,35(4):36-38.
[2]Mikulikova D,Cicovai,Antalikova G,et al. Grains of Non-traditional Crops as Sources of Retrograded Resistant Starch[J]. Czech Journal of Genetics and Plant Breedings,2005,41(3):96-104.
[3]王勇. 小米的营养价值及内蒙古小米生产加工现状[D]. 呼和浩特:内蒙古大学,2010.
[4]Fernandez D R,Vanderjagt D J,Millson M,et al. Fatty Acid,Aminoacid and Trace Mineral Composition of Eleusine Coracana(pwana)Seeds from Northern Nigeria[J]. Plants Foods for Human Nutrition,2003,58(3):258-259.
[5]Choi Y,Jeong H S,Lee J. Antioxidant Activity of Methanolic Extracts from Some Grains Consumed in Korea[M]. Food Chemistry,2006,Article in Press.
[6]Sripriya G,Chandra sekharan K,Murty V S,et al. ESR Spectrosopic Studies on Freeradical Quenching Action of Finger Millet(Eleusine Coracana)[J]. Food Chemistry,1996,57(4):
537-540.
[7]魏爱春,杨修仕,么杨. 藜麦营养功能成分及生物活性研究进展[J]. 食品科学,2015,36(15):272-275.
[8]Abugoch J L E. Quinoa(Chenopodium Quinoa Willd.):Composition,Chemistry,Nutritional and Functional Properties[J]. Advances in Food and Nutrition Research,2009,58:21-31.
[9]王黎明,马宁,李颂. 藜麦的营养价值及其应用前景[J]. 食品工业科技,2014,35(1):381-384.
[10]National Academy of Sciences. Comprehensive DRI Table for Vitamins,Minerals and Macronutrients,Organized by Age and Gender[R]. Beltsville,Institute of Medicine,Food and Nutrition Board,2004.
[11]Hogg J C,Sciurba F C,Peters D G,et al. Comprehensive Gene Expression Profiles Reveal Pathways Related to the Pathogenesis of Chronic Obstructive Pulmonary Disease[J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(41):14895-14900.
[12]杨春,田志芳,卢健鸣,等. 小米蛋白质研究进展[J]. 中国粮油学报,2010,25(8):123-126.
[13]庞震鹏,陈树俊,康俊杰,等. 氨基酸互补性复合小米粉配方筛选的研究[J]. 食品工业科技,2015(17):104-108. Doi:10.13386/j.issn1002-0306.2015.17. 013
[14]王春霞,高鹏,王晓梅,等. 调配型大豆植物蛋白饮料的稳定性研究[J]. 中国食品添加剂,2014(8):121-127.
[15]Owen R Fennema. Food Chemistry[M]. 北京:中国轻工业出版社,2003:161.
[16]孙蕾,沈群. 小米饮料的最佳液化、糖化及稳定性条件研究[J]. 食品工业科技,2012,33(13):220-223.
[17]Souza P M D. Application of Microbialα-amylase in Industry[J]. Brazilian Journal of Microbiology,2010,41(4):850-861.
[18]林小琴,钟彬林,蔡福带. 响应面法优化黑芝麻谷物浓浆复合稳定剂配方[J]. 中国食品添加剂,2014(5):76-83.
[19]赵容钟,周雪松,曾建新. 响应面法优化豆乳稳定剂配方研究[J]. 现代食品科技,2009,25(10):1196-1199.
[20]胡静,孟芮羽,张盈,等. 红小豆粉液化及糖化条件研究[J]. 中国酿造,2013,32(6):97-100.
[21]齐希光,张晖,王立,等. 紫薯饮料的液化糖化工艺研究[J]. 食品科技,2014,39(8):109-113.
Study on the conditions of liquefaction,saccharification and stabilizer formula in millet-quinoa beverage
CHEN Shu-jun,PANG Zhen-peng,LIU Xiao-juan,HU Jie,XU Xiao-xia,YI Xin,SHI Yue,LI Le
(College of Life Science,Shanxi University,Taiyuan 030006,China)
With millet,quinoa as raw materials,the best conditions of liquefaction,saccharification and the effects of emulsifier,thickener on the stability of the system were discussed. The best conditions of liquefaction and saccharification were determined by single factor experiments and orthogonal test. Using the response surface methodology to optimize the prescription of stabilizer of the beverage. Results showed that,the best conditions of starch liquefaction were 6 U/gα-amylase,40 min,70 ℃,pH7.0. The best conditions of saccharification were 120 U/gβ-amylase,65 ℃,60 min,pH6.5. The optimized formulation were 0.05% glycerin monostearate,0.05% sucrose ester of fatty acid,0.064% xanthan gum,0.008% sodium carboxymethyl cellulose and 0.036% sodium alginate. Under this condition,the beverage contains higher reducing sugar and better stability.
millet-quinoa;liquefaction;saccharification;stabilization
2016-01-27
陈树俊(1964-),男,本科,副教授,研究方向:食品新工艺及功能食品,E-mail:chenshujun515@163.com。
TS213.2
A
1002-0306(2016)15-0249-08
10.13386/j.issn1002-0306.2016.15.040

