响应面法优化双酶提取仿刺参卵粗多糖工艺及其抗氧化性研究
刘 昕,张 健,2,刘京熙,赵云苹,王共明,乔瑞光
(1.山东省海洋资源与环境研究院,山东烟台 264006;2.山东省海洋生态修复重点实验室,山东烟台 264006)
响应面法优化双酶提取仿刺参卵粗多糖工艺及其抗氧化性研究
刘昕1,张健1,2,刘京熙1,赵云苹1,王共明1,乔瑞光1
(1.山东省海洋资源与环境研究院,山东烟台 264006;2.山东省海洋生态修复重点实验室,山东烟台 264006)
以仿刺参卵为原料提取多糖,在单因素实验的基础上,通过响应面分析优化双酶提取仿刺参卵多糖工艺,并对其体外抗氧化活性进行初步研究。结果表明:仿刺参卵多糖的最佳提取条件为复合蛋白酶与木瓜蛋白酶配比1∶2、加酶量2.78%、酶解温度60 ℃、酶解时间6 h,在此条件下卵多糖的预测得率为8.84‰,实际得率为8.76‰;仿刺参卵多糖的自由基清除活性呈明显的剂量依赖关系,对DPPH自由基的IC50为1.71 mg/mL,是一种良好的天然抗氧化剂。
仿刺参卵多糖,双酶,响应面法,抗氧化
海参是珍贵的海珍品之一。近年来随着人们对海参的保健认识日渐增强,市场需求海参的数量也逐年增加。据2015年中国渔业年鉴统计,我国海参年产量超过20万t,产值在300亿元以上,海参产业已成为我国水产品主导产业之一。海参卵是海参加工过程中产生的主要副产物之一。研究表明,海参卵中含有丰富的营养物质,其中粗多糖含量为干质量的26.98 g/100 g,粗蛋白含量达51.80 g/100 g[1]。目前由于人们对这部分资源认识不够充分,使得海参卵这一原料没有得到有效的开发利用。
海参多糖一般以糖肽键的形式与蛋白质连接在一起,通过氢键和疏水作用进一步形成具有一定空间结构的大分子物质[2]。通过酶解断裂蛋白质与糖链的共价键从而释放出多糖是制备海参多糖的有效手段。当前有关海参卵的研究多集中于酶解法制备海参多肽[3-4],有关海参卵多糖的制备及活性研究还较少。本文以仿刺参卵为原料,通过双酶复合水解以充分断裂糖肽键释放多糖,结合单因素实验及响应面分析得到最佳提取工艺条件,并对卵多糖的抗氧化性进行初步研究,为海参资源的高值化利用及海参多糖相关产品的开发提供理论依据。
1 材料与方法
1.1材料与仪器
仿刺参卵烟台山水海产有限公司;木瓜蛋白酶(活力80×104U/g,最适温度50~55 ℃)南宁庞博生物工程有限公司;复合蛋白酶(活力1.5 AU/g,最适温度50 ℃)丹麦诺维信公司;DPPH(1,1-二苯基-2-三硝基苯肼)美国sigma;其余试剂均为国产分析纯。
电子天平美国Ohaus公司;电热恒温水浴锅烟台龙口市先科仪器公司;TU-1810SPC紫外-可见分光光度计北京普析通用仪器有限公司;TGL-16M台式高速冷冻离心机湖南湘仪仪器有限公司;傅里叶变换红外光谱仪(Nicolet iS10)美国Thermo Fisher公司。
1.2实验方法
1.2.1仿刺参卵多糖的酶法提取工艺取新鲜的仿刺参卵用胶体磨研磨匀浆,按设定的酶解条件在恒温水浴锅中酶解。酶解完成后升温至100 ℃灭酶10 min[5]。将酶解液经过离心、取上清加入TCA除蛋白、离心去除蛋白沉淀后,即得粗多糖溶液。向粗多糖溶液中加入95%乙醇使其终体积分数为70%,4 ℃静置过夜,离心,将沉淀用无水乙醇洗2~3次,于60 ℃烘干即为仿刺参卵粗多糖。
1.2.2多糖含量的测定采用苯酚硫酸法[6],以葡萄糖为标准品测定粗多糖样品溶液中卵多糖的含量。以葡萄糖质量浓度为横坐标,吸光度为纵坐标绘制葡萄糖标准曲线。
测定粗多糖样品溶液中多糖含量,并计算多糖得率。
多糖得率(‰)=样品溶液多糖浓度×稀释倍数/样品质量×样品溶液体积×1000
1.2.3单因素实验选取木瓜蛋白酶与复合蛋白酶对仿刺参卵进行双酶水解。考察加酶量(0.5%,1%,2%,3%,4%)、酶解时间(0.5、1、2、4、6 h)、酶解温度(30、40、50、60、70 ℃)、双酶配比(木瓜蛋白酶与复合蛋白酶配比1∶4、1∶2、1∶1、2∶1、4∶1)四个因素对仿刺参卵多糖得率的影响。
1.2.4响应面实验设计依据单因素实验结果,在木瓜蛋白酶与复合蛋白酶配比2∶1条件下,以多糖得率为响应值,选择加酶量、酶解温度、酶解时间为自变量,根据Box-Behnken设计,进行三因素三水平的响应面分析实验,得出最佳酶解条件。实验因素水平见表1。

表1 响应面实验因素与水平表Table 1 Factors and levels used in response surface design
1.2.5光谱分析紫外光谱分析:将多糖配成1 mg/mL的水溶液,利用紫外分光光度计在190~600 nm范围内扫描检测。红外光谱分析:将少量多糖样品与KBr混合,研磨均匀后压片,在4000~400 cm-1范围内扫描检测。
1.2.6仿刺参卵多糖的体外抗氧化性分析
1.2.6.1DPPH自由基清除能力取2 mL不同浓度的多糖溶液与2 mL 1 mmol/L的DPPH乙醇(95%)溶液混合均匀,暗处30 ℃反应30 min,以95%乙醇做空白对照,测其在517 nm处的吸光度为Ai,以VC取代多糖溶液做阳性对照[7]。多糖对DPPH清除率的计算公式为:
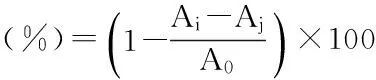
其中,Aj为多糖与95%乙醇混合测得的吸光度,A0为DPPH与95%乙醇混合测得的吸光度。
1.2.6.2羟自由基清除能力采用Fenton体系法测定多糖对·OH的清除能力[8-9]。取1 mL不同浓度的多糖溶液,依次加入1 mL 6 mmol/L的FeSO4和1 mL 6 mmol/L的H2O2溶液,静置10 min后加入1 mL 6mmol/L的水杨酸-乙醇溶液,摇匀,于37 ℃水浴30 min后510 nm测吸光度为Ai。以VC取代多糖溶液做阳性对照。多糖对·OH的清除率计算公式为:
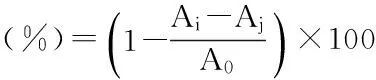
其中,Aj为蒸馏水代替水杨酸-乙醇溶液测得的吸光度,A0为蒸馏水取代多糖测得的吸光度。

1.3数据处理
采用Design-Expert和SPSS17.0进行数据分析;实验中处理均重复3次。
2 结果与分析
2.1多糖含量测定
多糖在浓硫酸作用下,脱水生成的糠醛或羟甲基糠醛能与苯酚缩合成一种橙红色化合物,在1~100 mg范围内其颜色深浅与糖的含量成正比,且在490 nm波长下有最大吸收。采用苯酚硫酸法绘制葡萄糖标准曲线的回归方程为y=6.651x-0.06718,R2=0.9935。式中:x为葡萄糖质量浓度,y为葡萄糖在490 nm出的吸光度。
2.2单因素实验
2.2.1加酶量对多糖得率的影响由图1可以看出,随加酶量的增加,卵多糖的得率逐渐上升,当加酶量达到3%时,多糖得率趋于平缓,最高得率为8.42‰。这是因为在酶浓度较低时,随着酶量的增加,更多的蛋白质被水解为多肽,多糖逐渐释放[11],当酶量超过3%时,酶与底物的接触已经趋于完全,所以多糖得率不再上升。
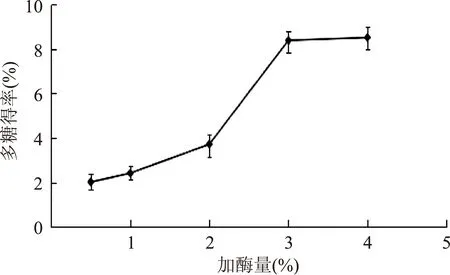
图1 加酶量对多糖得率的影响Fig.1 Effects of enzyme dosage on extraction rate of polysaccharides
2.2.2酶解时间对多糖得率的影响由图2可以看出,随着酶解时间的延长,多糖得率逐渐升高,这是因为酶与蛋白质开始反应,多糖得到逐渐释放。当时间达到4 h时,酶解反应进行完全,多糖得率趋于平缓,最高得率为8.05‰。

图2 酶解时间对多糖得率的影响Fig.2 Effects of enzymolysis time on extraction rate of polysaccharides
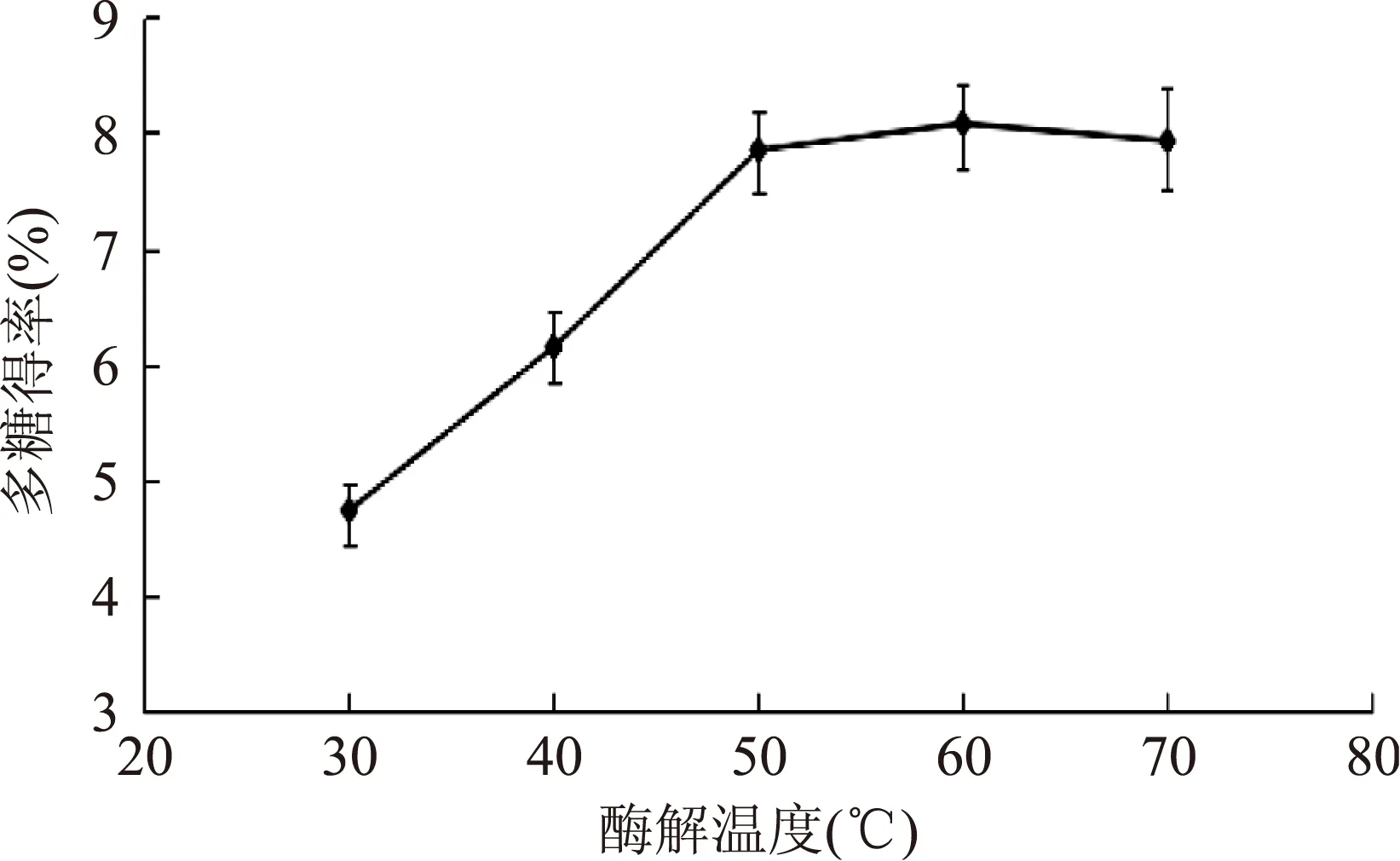
图3 酶解温度对多糖得率的影响Fig.3 Effects of enzymolysis temperature on extraction rate of polysaccharides
2.2.3酶解温度对多糖得率的影响由图3可以看出,随着温度的上升,多糖得率逐渐升高,50 ℃后趋于平缓,最高得率为8.08‰。这是因为温度的提升促使酶反应活性的增大及底物结构的展开,有利于水解反应的进行,也促使分子运动速度加快;当温度超过最适反应温度时,酶逐渐失活,多糖释放速度变缓。
2.2.4双酶配比对多糖得率的影响由图4可以看出,随着木瓜蛋白酶在双酶体系中含量的增加,多糖得率逐渐升高;当复合蛋白酶与木瓜蛋白酶比例为1∶2时,多糖得率最高为8.03‰,之后得率随木瓜蛋白酶含量的升高而降低。这可能是由于蛋白酶对肽键作用具有专一性,单酶的固定酶切位点使水解受到限制。复合蛋白酶与木瓜蛋白酶比例为1∶2复配时达到最好的互补作用,使肽键得到最大程度的水解。
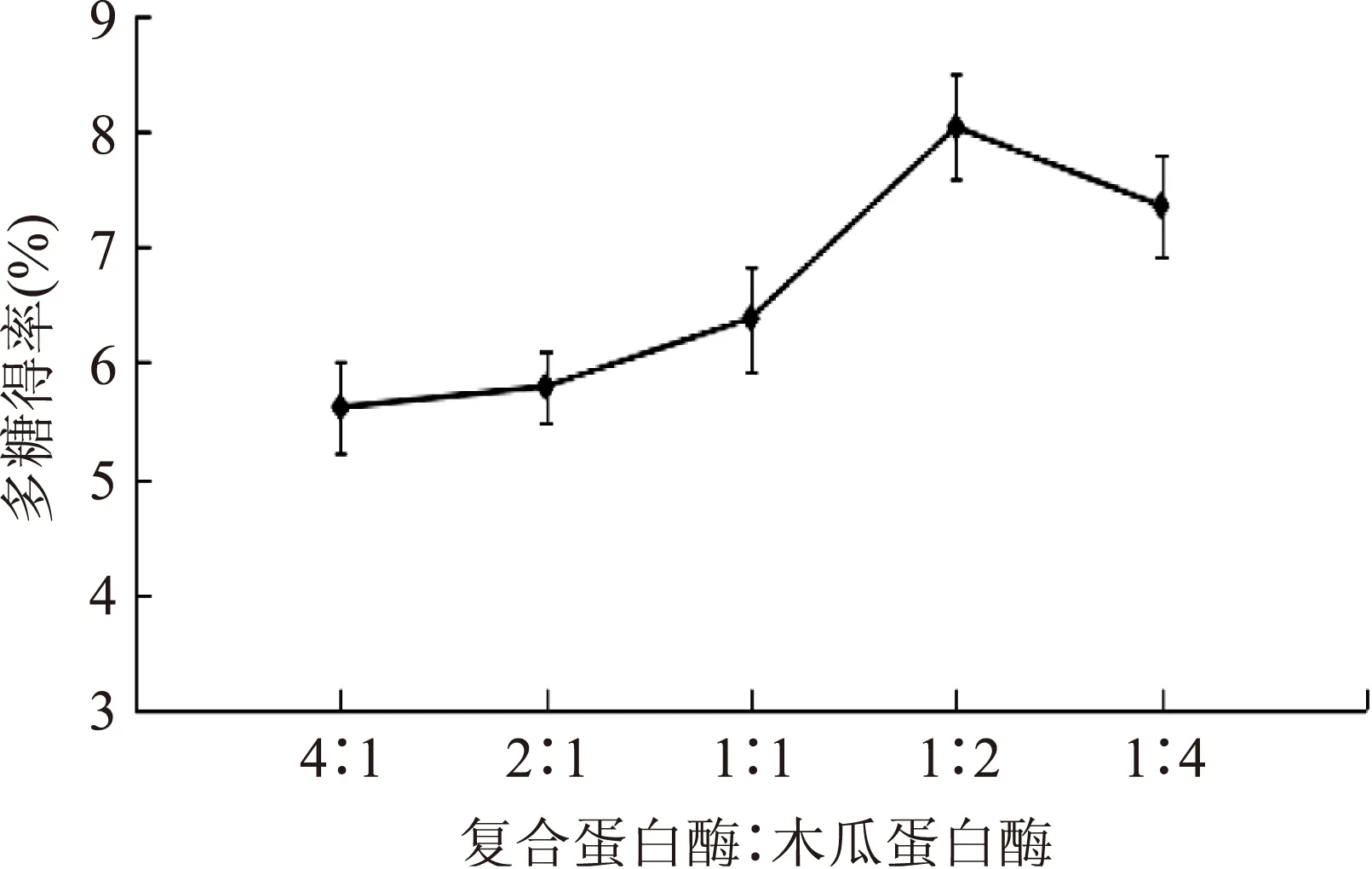
图4 双酶配比对多糖得率的影响Fig.4 Effects of the ratio of two enzyme on extraction rate of polysaccharides
2.3响应面优化
2.3.1回归模型的建立及其显著性检验应用Box-Benhnken设计3因素3水平的实验方案,实验结果如表2所示。对表中实验数据进行多元回归拟合,获得响应值多糖提取率对自变量加酶量A、酶解温度B、酶解时间C的二元多次回归模拟方程为:
多糖得率(%)=8.70-0.026A+0.017B+0.13C-0.36AB+0.18AC+0.47BC-0.45A2-0.25B2-0.26C2。

表2 响应面实验设计与结果Table 2 Response surface design and experimental results
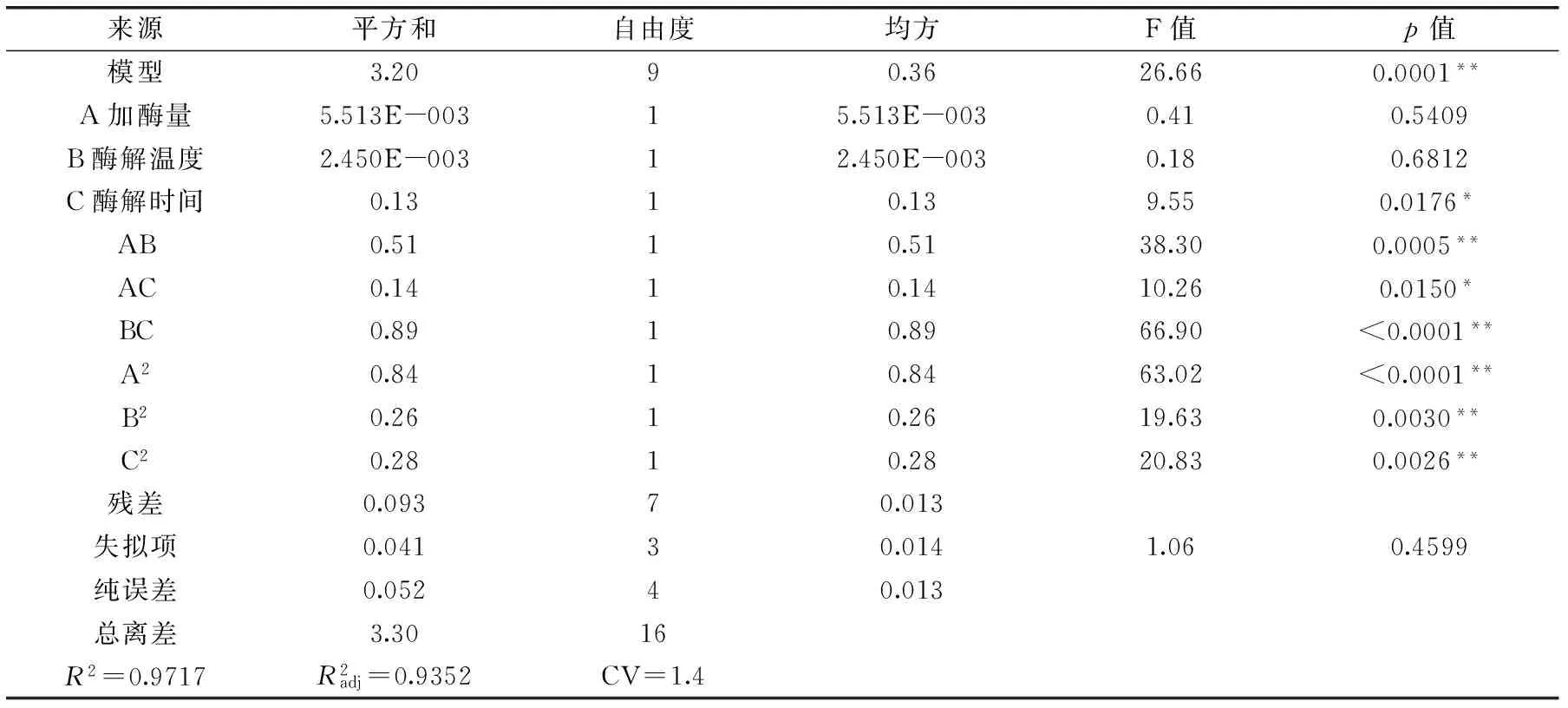
表3 回归模型方差分析Table 3 ANONA analysis of regression model
注:**:p<0.01,差异极显著;*:p<0.05,差异显著
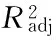
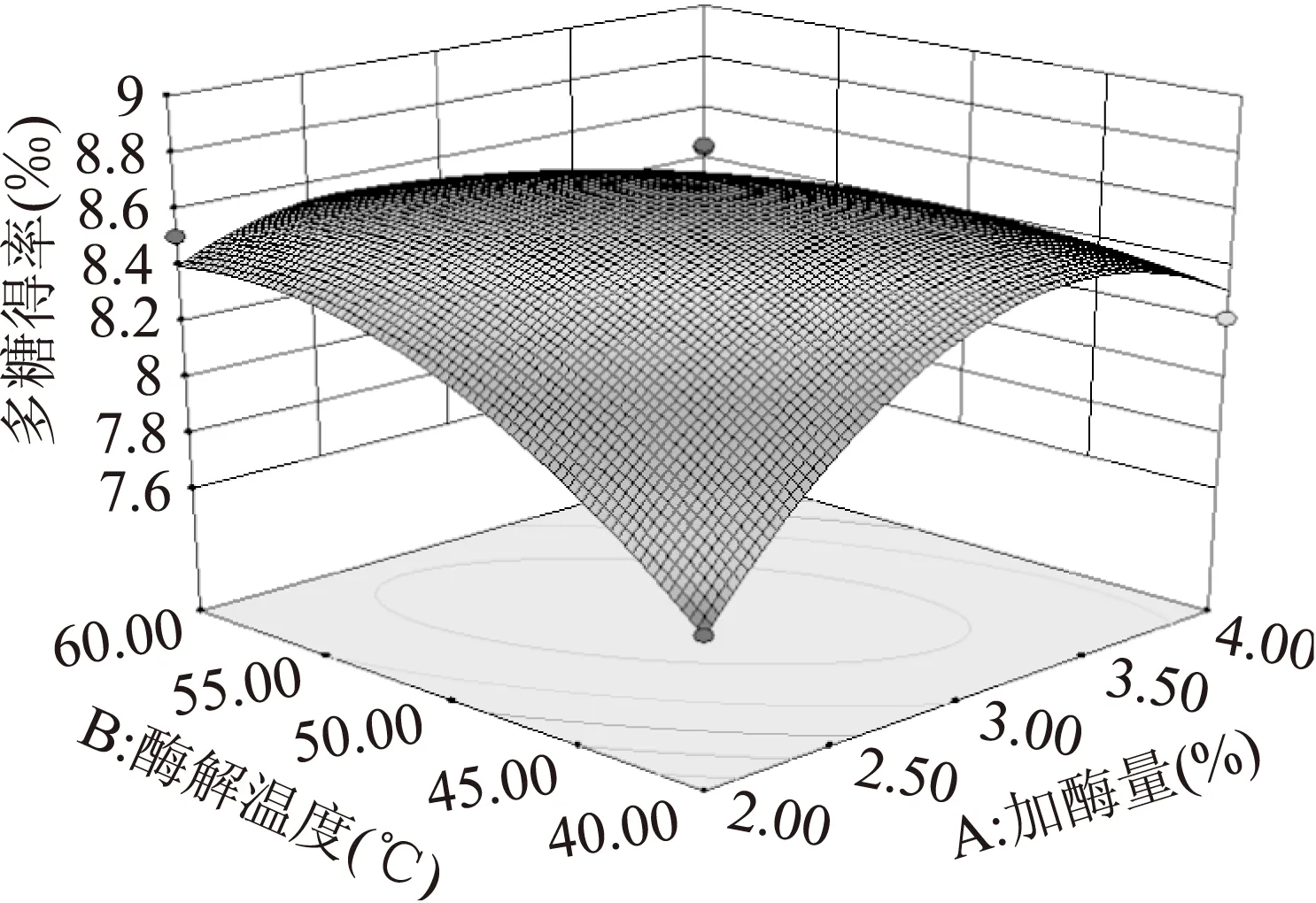
图5 加酶量和酶解温度对多糖得率交互影响的响应面Fig.5 Response surface of enzyme dosage and temperature
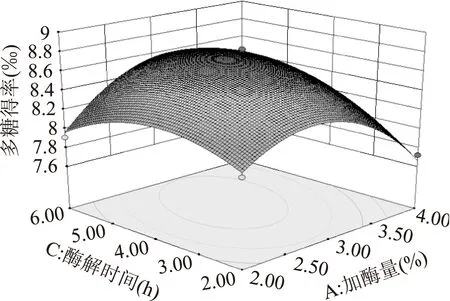
图6 加酶量和酶解时间对多糖得率交互影响的响应面Fig.6 Response surface of enzyme dosage and enzymolysis time
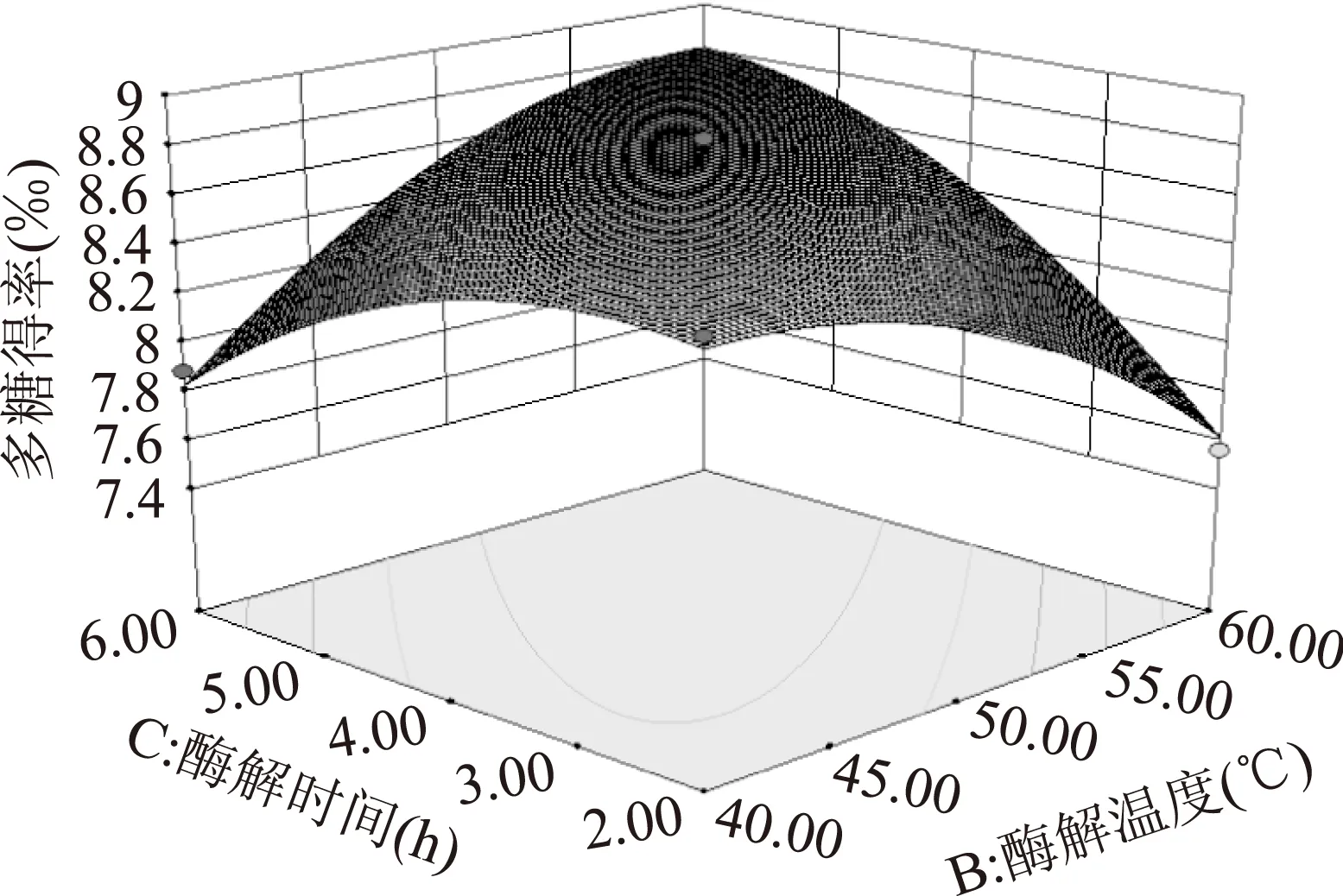
图7 酶解温度和时间交互作用对多糖得率影响的响应面Fig.7 Response surface of enzymolysis temperature and time
2.3.2响应面优化及分析加酶量和酶解温度的交互作用如图5所示。图中等高线呈椭圆形,表明二者的交互作用极显著。从响应面曲线可知,随加酶量和酶解温度的增加多糖得率呈先增大后减小的趋势,在酶解温度55 ℃左右,加酶量3%左右时,多糖得率达到最大值。加酶量和酶解时间的交互作用如图6所示。图中等高线呈椭圆形,表明二者的交互作用显著。从响应面曲线可知,随加酶量和酶解时间的增大多糖得率呈先增加后减小的趋势,在加酶量3%左右,酶解时间4 h左右时,多糖得率达到最大值。酶解时间和酶解温度的交互作用如图7所示。图中等高线呈椭圆形,表明二者的交互作用极显著。图中响应面曲线坡度较为陡峭,表明酶解时间和酶解温度对多糖得率的影响均较大。
基于以上分析,影响卵多糖得率的因素按主次顺序为:酶解时间>加酶量>酶解温度。获得双酶水解仿刺参卵制备多糖的最佳酶解条件为:加酶量2.78%,酶解温度60 ℃,酶解时间6 h。在此条件下重复实验三次获得实际仿刺参卵多糖的得率为8.76‰,与得率为8.84‰吻合情况较好,说明该模型适用于对仿刺参多糖的双酶提取工艺进行回归分析和参数优化。
2.4光谱分析
图8为仿刺参卵多糖的紫外扫描图谱。从图中可以看出在190~200 nm处有最强吸收峰,表明被测物为多糖;在260 nm和280 nm处吸收很低,表明核酸和蛋白含量很少。

图8 仿刺参卵多糖的紫外光谱图Fig.8 UV absorption spectrum of polysaccharides from A. japonicus spawn
图9为仿刺参卵多糖的红外吸收光谱图。由图中可知在3413 cm-1处的强吸收峰为多糖分子中O-H的伸缩振动,2927 cm-1附近的信号为糖环上C-H的伸缩振动,1735 cm-1附近可能为糖中乙酰基的酯基吸收峰,1650 cm-1和1380 cm-1附近的吸收峰为C=O的非对称和对称伸缩振动,以上几组吸收峰可以判定该物质为多糖类化合物[12]。1218 cm-1附近为S=O的伸缩振动,表明多糖中存在硫酸基的取代[13],844 cm-1附近为α-吡喃糖苷键的特征吸收峰。
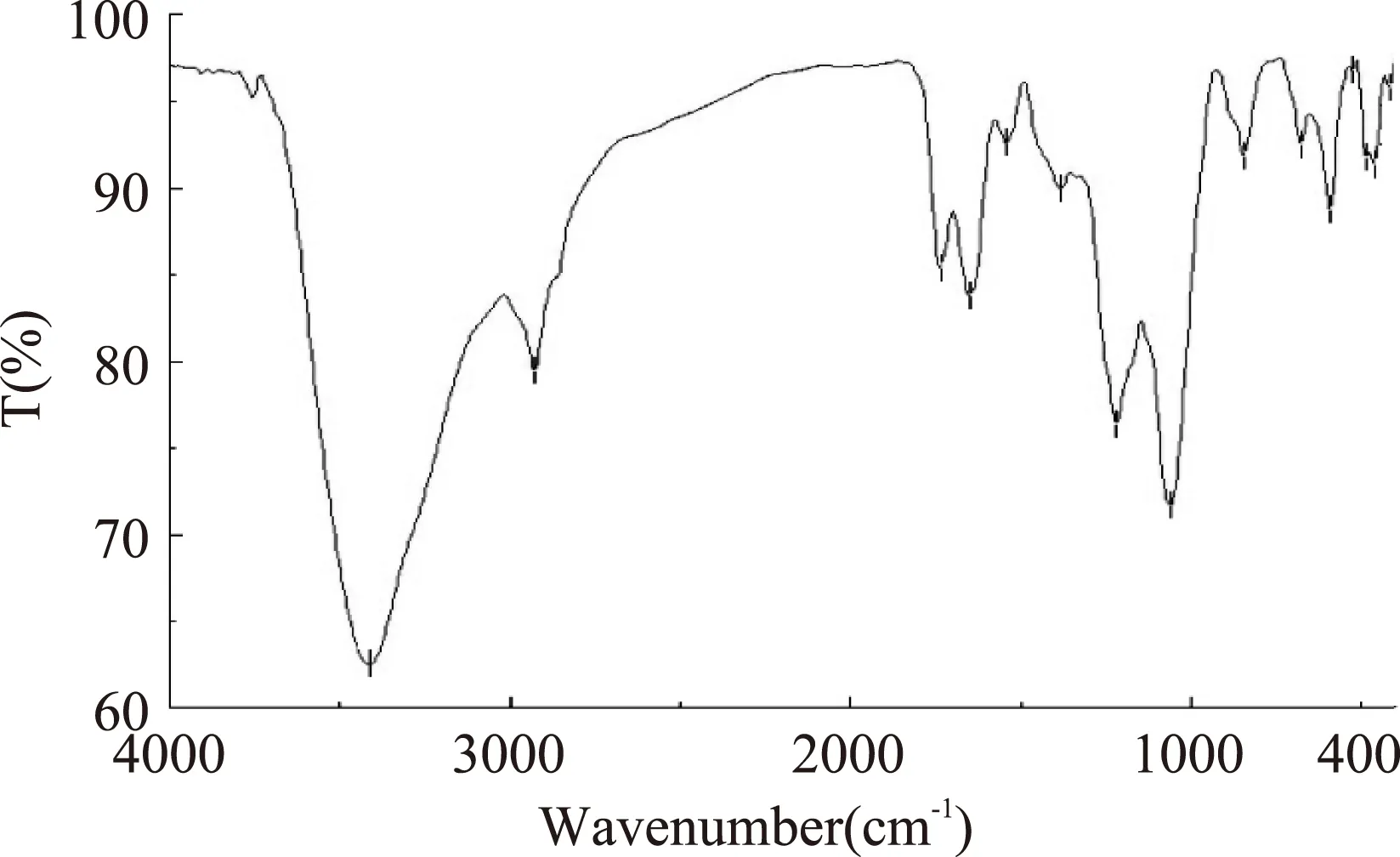
图9 仿刺参卵多糖的红外光谱图Fig.9 IR absorption spectrum of polysaccharides from A. japonicus spawn
2.5抗氧化性分析
2.5.1DPPH自由基清除能力仿刺参卵多糖对DPPH自由基清除率结果如图10所示。从图中可以看出,在设定浓度范围内,DPPH自由基清除率与多糖浓度呈明显剂量依赖关系。当多糖浓度为4 mg/mL时,清除率达66.67%。仿刺参卵多糖具有明显清除DPPH自由基的能力,其原因可能是多糖中的羟基具有供氢质体能力的结果[14]。多糖对DPPH自由基的IC50为1.71 mg/mL,VC的IC50为0.19 mg/mL。
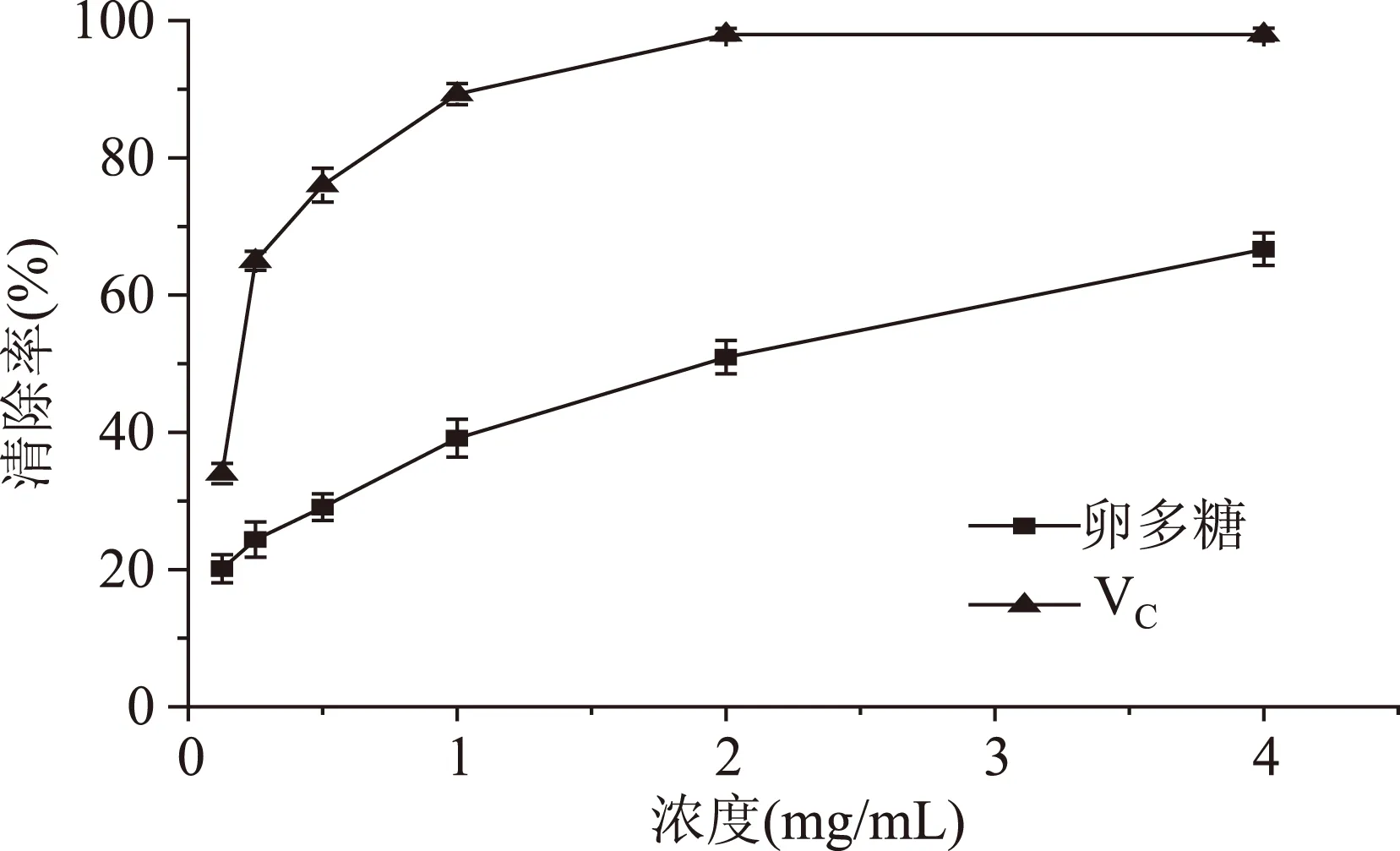
图10 仿刺参卵多糖的DPPH自由基清除率Fig.10 Scavenging effect on DPPH radical of polysaccharide from A. japonicus spawn
2.5.2羟自由基清除能力仿刺参卵多糖对羟自由基清除率结果如图11所示。从图中可以看出,在设定浓度范围内,随着卵多糖浓度的增加,对羟自由基清除率逐渐增大。当多糖浓度为4 mg/mL时,多糖对羟自由基的清除率为42.38%。
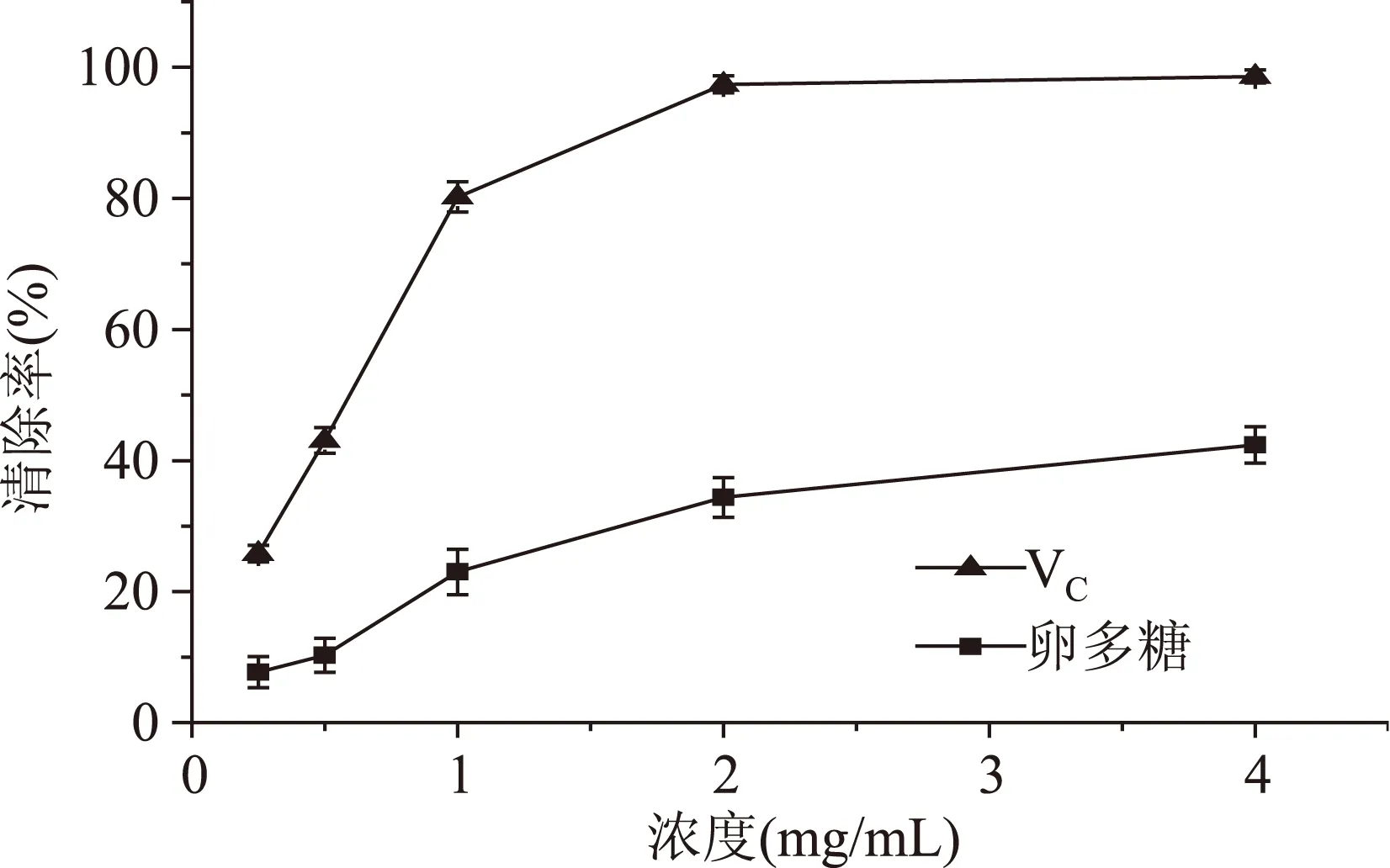
图11 仿刺参卵多糖的羟自由基清除率Fig.11 Scavenging effect on hydroxyl radical of polysaccharide from A. japonicus spawn
2.5.3超氧阴离子自由基清除能力仿刺参卵多糖对超氧阴离子自由基清除率结果如图12所示。从图中可以看出,在设定浓度范围内,超氧阴离子自由基清除率随多糖浓度的增加而逐渐增大。当多糖浓度为4 mg/mL时,多糖对超氧阴离子自由基的清除率为34.11%。
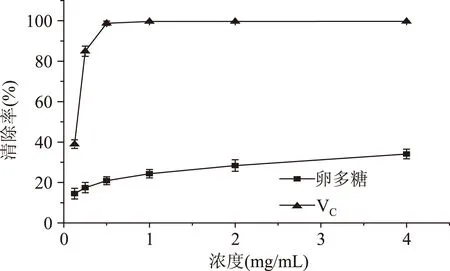
图12 仿刺参卵多糖的超氧阴离子自由基清除率Fig.12 Scavenging effect on superoxide radical of polysaccharide from A. japonicus spawn
体内存在的活性氧以及自由基反应会产生致癌、动脉硬化、DNA破坏等诸多病理学伤害。抗氧化物质可以延缓或避免细胞内易氧化成分发生变化。目前常用的合成抗氧化剂如丁基羟基茴香醚和2,6-二叔丁基对甲酚等,虽然清除自由基的效果很好,但长期服用有致毒或致癌的风险[15-16]。因此,发现并获得天然抗氧化剂对食品安全和人类健康越来越重要。仿刺参卵多糖具有明显的清除自由基活性,可能与其结构中含有硫酸基团有关。与相似结构的中性多糖相比,硫酸多糖显示出更强的清除自由基能力[17]。Hu T T等[18]从昆布中分离出两种硫酸多糖并对其进行了脱硫反应,对多糖脱硫酸根前后的抗氧化研究显示,带有硫酸根的多糖显示出更强的抗氧化活性。这可能是由于硫酸基团可以作为亲电体促进分子内脱氢反应。Tsiapali等[19]人的研究显示硫酸基团和磷酸基团两种亲电基质都可以促进碳水化合物清除自由基的能力,但是,硫酸化程度与清除自由基能力没有严格的相关性,而是与其他因素共同作用的结果,如分子量、分子组成也是影响自由基清除能力的重要因素[20]。
3 结论
本实验以仿刺参加工副产物仿刺参卵为原料,采用双酶提取法制备卵多糖。在单因素实验的基础上,通过响应面分析进行优化,获得仿刺参卵多糖的最佳提取条件为:复合蛋白酶与木瓜蛋白酶配比1∶2、加酶量2.78%、酶解温度60 ℃、酶解时间6 h,在此条件下卵多糖的实际得率为8.76‰。获得的模型适用于对仿刺参多糖的双酶提取工艺进行回归分析和参数优化。
对仿刺参卵多糖的体外抗氧化活性进行研究表明,多糖的自由基清除作用呈明显的剂量依赖关系,对DPPH自由基的IC50为1.71 mg/mL,具有良好的抗氧化活性。作为外源性抗氧化剂,多糖在生物体内发挥作用的机制除了直接参与猝灭自由基的途径外,还可能通过参与调动或激活机体的内源性抗氧化剂,使其数量增大和活性增强到机体需要的水平,从而避免或减轻自由基对机体的损伤[21]。因此,在今后的研究中,将对仿刺参卵多糖体内抗氧化作用及机理开展进一步研究,以期为海参多糖相关产品的研发提供参考和依据。
[1]张健,王茂剑,马晶晶,等. 仿刺参生殖腺营养成分分析[J]. 食品科学,2013,34(14):232-236.
[2]宿玮,常耀光,薛长湖,等. 海地瓜多糖中蛋白含量测定方法比较[J]. 食品科学,2011,32(2):201-204.
[3]赵鸿霞,周大勇,秦磊,等. 响应面法优化海参卵酶解工艺[J]. 食品与机械,2010,26(5):114-117.
[4]曹荣,刘淇,殷邦忠. 响应面法优化海参性腺酶解工艺[J].食品科学,2012,33(2):29-33.
[5]王共明,张健,王茂剑,等. 仿刺参卵酶解工艺条件优化[J]. 食品科学,2012,23:193-198.
[6]张军瑞,陈健. 木瓜蛋白酶酶解白底辐肛参提取多糖的研
究[J].现代食品科技,2009,5:542-545.
[7]蒋德旗,黄利敏,王艳,等. 响应面优化纤维素酶法提取桂花多糖工艺及其抗氧活性研究[J]. 食品工业科技,2015,36(2):271-281.
[8]吕喜茹,郭亮,常明昌,等. 姬松茸多糖抗氧化作用[J]. 食用菌学报,2010,17(1):69-71.
[9]Song H F,Zhang Q B,Zhang ZS,et al.Invitroantioxidant activity of polysaccharides extracted from Bryopsis plumosa[J]. Carbohydrate Polymers,2010,80(4):1057-1061.
[10]Liu X,Sun ZL,Zhang MS,et al. Antioxidant and antihyperlipidemic activities of polysaccharides from sea cucumber Apostichopus japonicus[J]. Carbohydrate Polymers,2012,90:1664-1670.
[11]蔡彬新,吴成业. 海参多糖的分离纯化方法及其主要生物活性[J]. 福建水产,2008,3:70-74.
[12]Li S C,Yang X M,Ma H L,et al. Purification,characterization and antitumor activity of polysaccharides extracted from Phellinus igniarius mycelia[J]. Carbohydrate Polymers,133(2015):24-30.
[13]林聪,赵春琦,李娜,等. 1种绿藻硫酸多糖的化学组成及其结构表征[J]. 中国海洋药物,2014,33(4):55-58.
[14]Chen H X,Zhang M,Xie B J. Components and antioxidant activity ofpolysaccharide conjugate from green tea[J]. Food Chemistry,2005,90:17-21.
[15]刘微微,刘旭,曹学丽,等. 白背三七多糖的结构表征及α-葡萄糖苷酶的抑制活性[J]. 食品科学,2013,34(7):115-120.
[16]Zhu L C,Bo J T,Wang C,et al. Antioxidant Activities of Aqueous Extract from Agrimoniapilosa Ledeb and Its Fractions[J]. Chemistry&biodiversity,2009,6:1716-1726.
[17]Qi H M,Zhang Q B,Zhao T T,et al. Antioxidant activity of different sulfate content derivatives of polysaccharide extracted from Ulva pertusa(Chlorophyta)invitro[J]. International Journal of Biological Macromolecules,2005,37:195-199.
[18]Hu T T,Liu D,Chen Y. Antioxidant activity of sulfated polysaccharide fractions extracted from Undaria pinnitafidainvitro[J]. International Journal of Biological Macromolecules,2010,46:193-198.
[19]Tsiapali E,Whaley S,Kalbfleisch J,et al. Glucans exhibit weak antioxidant activity,but stimulate macrophagefree radical activity[J]. Free Radical Biology & Medicine,2001,30:393-402.
[20]谢明勇,王之珺,谢建华. 多糖的硫酸化修饰及其结构与生物活性关系研究进展[J]. 中国食品学报,2015,15(2):1-8.
[21]许海顺,蒋剑平,徐攀,等. 红参多糖抗氧化活性的研究[J]. 浙江中医药大学学报,2011,35(6):909-912.
Optimization for extraction of polysaccharides fromApostichopusjaponicusspawn using double enzymetic by response surface methodology and antioxidant activity analysis
LIU Xin1,ZHANG Jian1,2,LIU Jing-xi1,ZHAO Yun-ping1,WANG Gong-ming1,QIAO Rui-guang1
(1.Shandong Marine Resource and Environment Research Institute,Yantai 264006,China;2.Shandong Provincial Key Laboratory of Restoration for Marine Ecology,Yantai 264006,China)
On the basis of single factor experiments,the double enzymetic extraction process was optimized to extract polysaccharides fromApostichopusjaponicusspawn with response surface methodology,and the preliminary antioxidant activity of polysaccharides was investigated. The results showed that the best optimum condition for the extraction of polysaccharides were as follows:the ratio of protamex and papain was 1∶2,enzyme dosage 2.78%,enzymolysis temperature 60 ℃,enzymolysis time 6h. Under such condition,the model-predicted and experimental values of polysaccharides yield were 8.84‰ and 8.76‰,respectively. Polysaccharides had ability to scavenge free radical in a dose-dependent manner,the IC50values of DPPH free radical scavenging abilities were 1.71 mg/mL. TheA.japonicusspawn polysaccharides is a good source of natural antioxidants.
Apostichopusjaponicusspawn polysaccharides;double enzymetic;response surface methodology;antioxidant activity
2016-03-01
刘昕(1988-),女,硕士,研究实习员,研究方向:天然产物及功能分析,E-mail:liuxinyz@163.com。
山东省自然科学基金培养基金项目(ZR2014CP030);山东省现代农业产业技术体系刺参产业创新团队建设项目(SDAIT-22-07);山东省农业重大应用技术创新项目;烟台市科技发展计划项目(2014ZH081)。
TS254.9
B
1002-0306(2016)15-0203-06
10.13386/j.issn1002-0306.2016.15.031

