不同分子量黑籽瓜种子多肽抗氧化能力的研究
齐希光,陆晓婷,张 晖,王 立,钱海峰
(江南大学食品学院,江苏无锡 214122)
不同分子量黑籽瓜种子多肽抗氧化能力的研究
齐希光,陆晓婷,张晖*,王立,钱海峰
(江南大学食品学院,江苏无锡 214122)
目的:研究不同分子量黑籽瓜种子多肽的抗氧化能力的差异。方法:利用超滤技术对黑籽瓜种子蛋白酶解产物(SWSPs)进行多级分离,得到不同分子量分布的五种组分(SWSPs-L、SWSPs-1、SWSPs-3、SWSPs-5、SWSPs-10),然后以七种抗氧化能力评价体系分别对五种组分进行评价。结果:不同分子量黑籽瓜种子多肽的抗氧化能力不尽相同,分子量在1~3 ku的组分SWSPs-1对超氧阴离子自由基的清除能力最强,而分子量<1 ku的组分SWSPs-L则表现出了多重抗氧化机制,该组分与等浓度的EDTA具有相近的螯合效果。结论:黑籽瓜种子多肽的抗氧化能力与其分子量分布和氨基酸组成密切相关,是各方面综合作用的结果。
黑籽瓜种子,超滤,多肽,抗氧化

本文以碱性蛋白酶对黑籽瓜种子蛋白酶解,利用超滤技术对酶解液进行分级,用多种体外抗氧化评价体系对不同分子量的黑籽瓜种子蛋白多肽的抗氧化能力进行分析,以期为籽瓜源抗氧化肽系列产品的开发提供理论依据。
1 材料与方法
1.1材料与仪器
黑籽瓜种子(民籽1号)甘肃省民勤县金谷源农业科技有限公司;碱性蛋白酶诺维信公司;DA201-C型大孔树脂天津浩聚树脂科技有限公司;其余试剂均为化学分析纯。
紫外可见光分光光度计北京普析通用仪器有限责任公司;冷冻干燥机北京四环科学仪器厂;BSA224型电子天平北京赛多利斯仪器系统有限公司;PeLLicon-2超滤装置美国默克密理博公司;L-8900氨基酸全自动分析仪日本日立公司;Waters600 HPLC系统(配备2487紫外检测器和M32工作站)美国Waters公司;TSK 2000 SWXL(300 mm×7.8 mm):日本TOSOH公司。
1.2实验方法
1.2.1不同分子量黑籽瓜籽抗氧化肽的制备参考陆晓婷等[14]的方法,将通过碱提酸沉得到的黑籽瓜籽蛋白用碱性蛋白酶酶解,调节体系pH7.0沉淀未反应的蛋白,经4000r/min离心。在室温条件下,使用PeLLicon-2超滤装置对上清液进行超滤多步分级,依照截流分子量的大小,得到SWSPs-L(Mw<1 ku)、SWSPs-1(Mw=1~3 ku)、SWSPs-3(Mw=3~5 ku)、SWSPs-5(Mw=5~10 ku)、SWSPs-10(Mw>10 ku)五种组分,各级超滤实验的基本条件为压力0.2 MPa,当酶解液浓缩至上级超滤所得滤过液的1/10时,超滤操作停止[15]。
1.2.2分级产物脱盐用无水乙醇浸泡DA201-C型大孔树脂24 h,无水乙醇反复洗涤至220 nm无明显吸光值,再用去离子水洗至无醇味[16]。称取100 g湿树脂于500 mL锥形瓶中,加100 mL籽瓜多肽,25 ℃恒温摇床150 r/min,使其充分吸附后弃去未吸附的盐溶液,用75%乙醇依次洗脱,分别收集洗脱液并浓缩。
1.2.3分子量分布测定使用Waters 600 HPLC系统(配备2487紫外检测器和M32工作站)测定,色谱条件为:TSKgel G2000SWXL型色谱柱;柱温为30 ℃;流动相为乙腈/水/三氟乙酸(10∶90∶0.1);流速为0.5 mL/min;进样量为10 μL;检测波长为UV 220 nm。

2 结果与分析
2.1SWSPs分级产物分子量分布
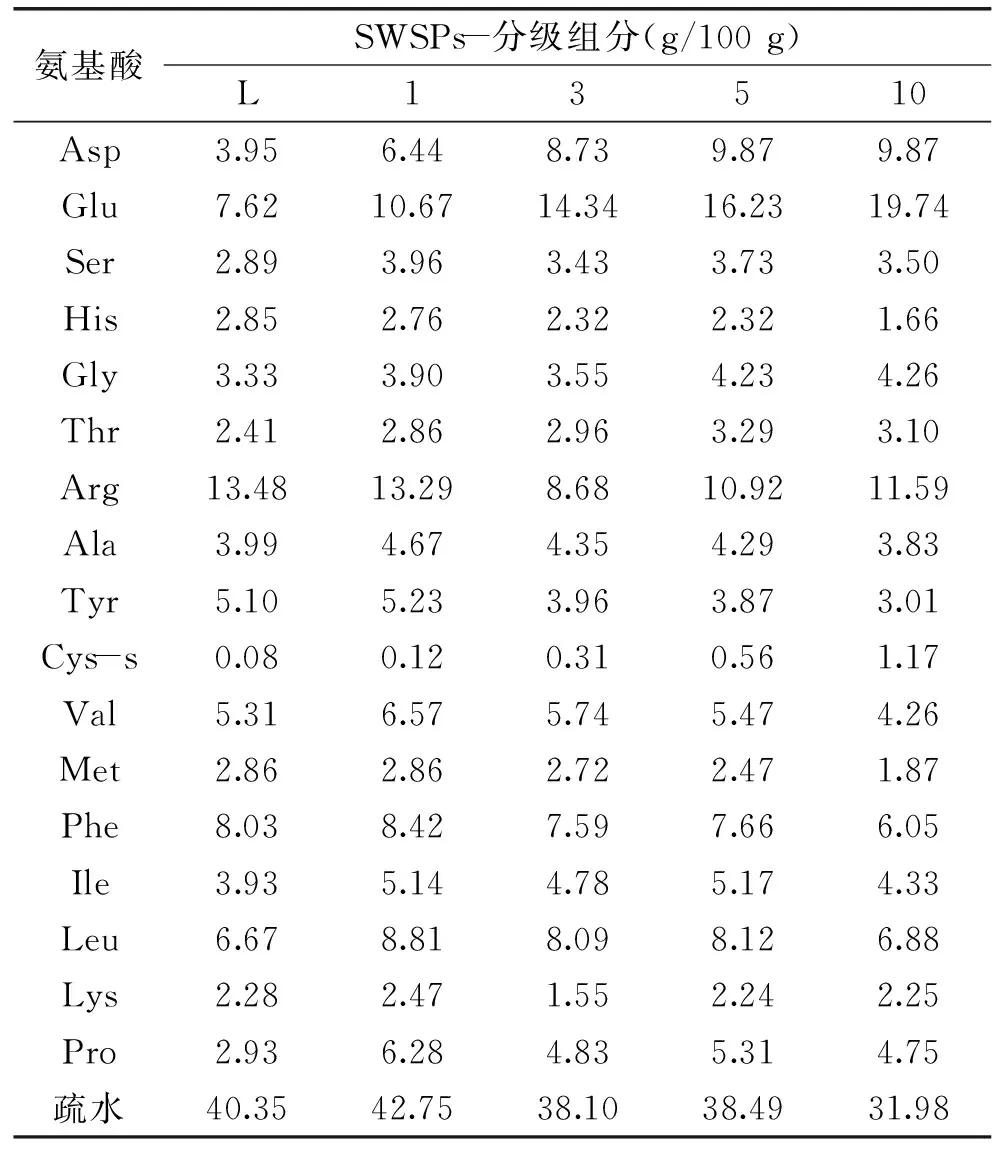
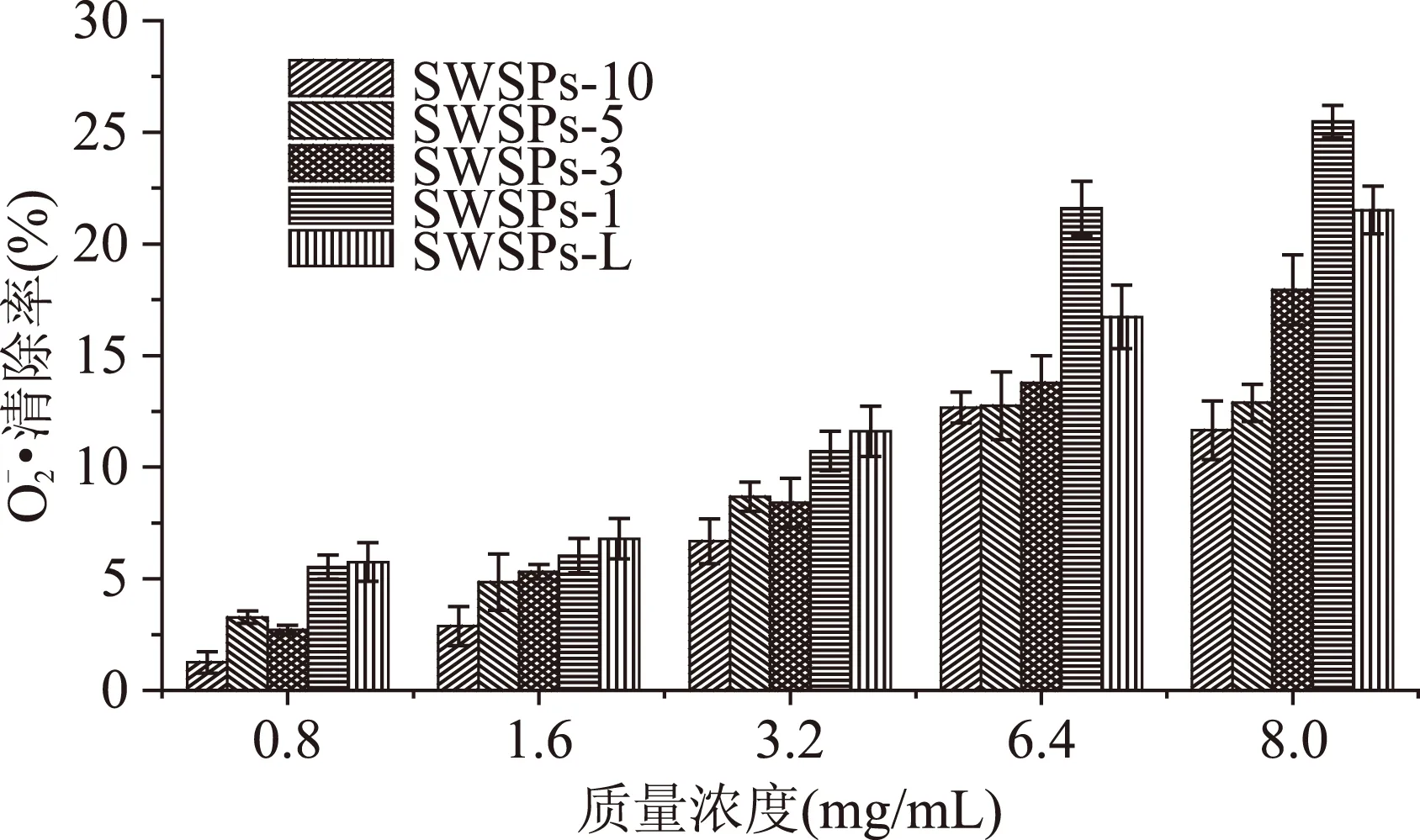
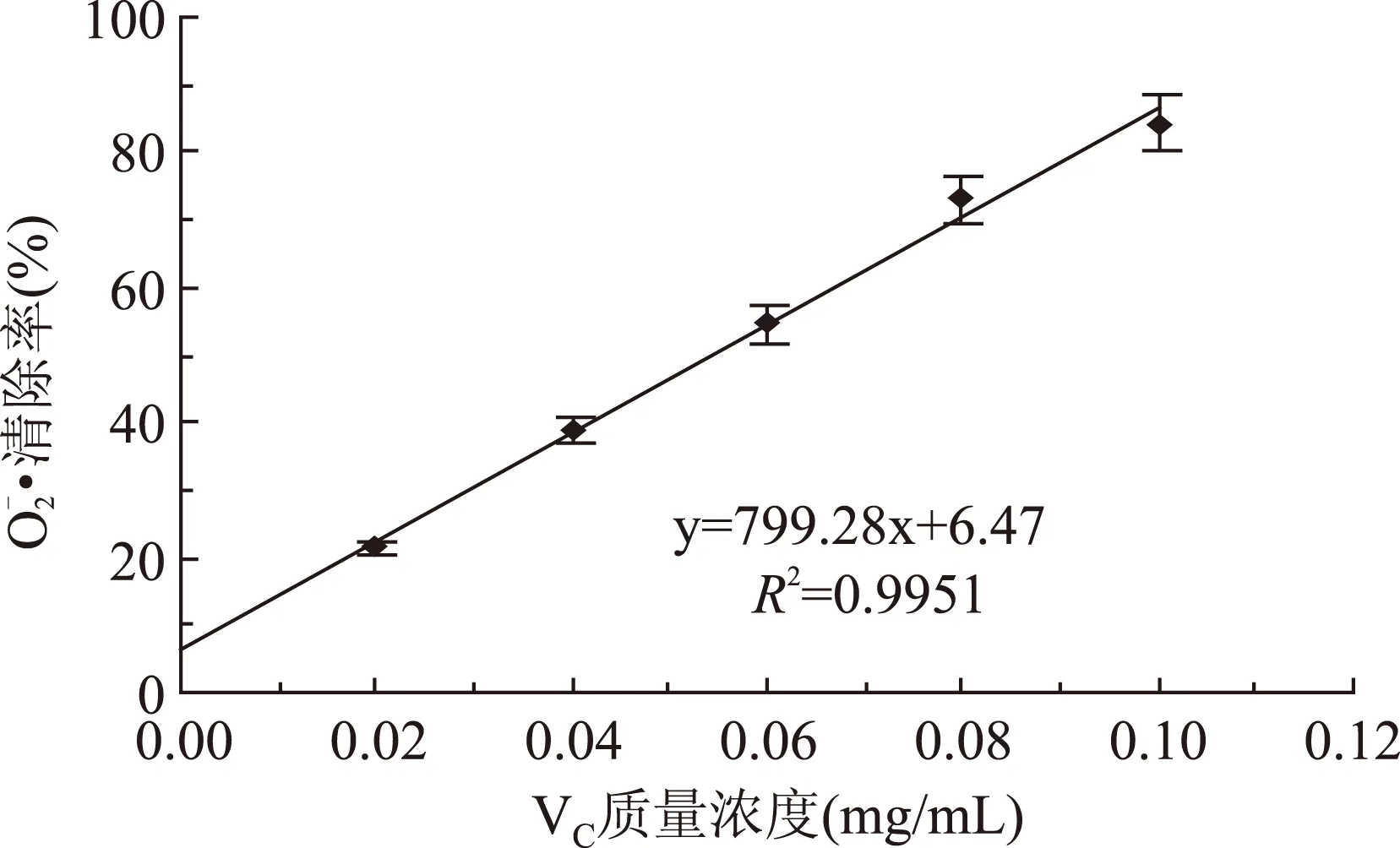
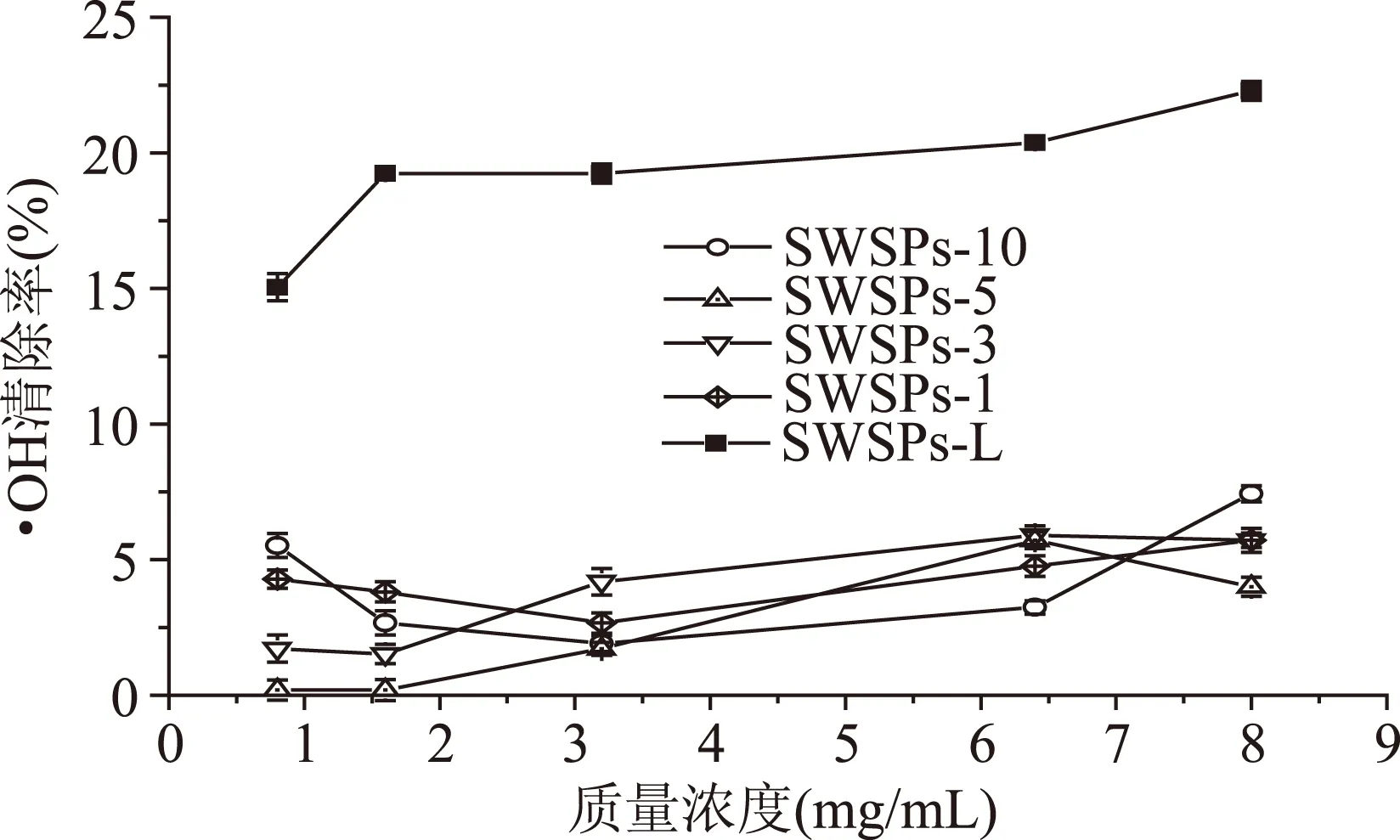
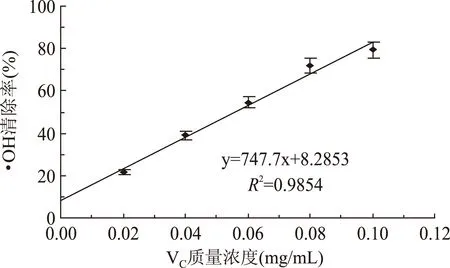
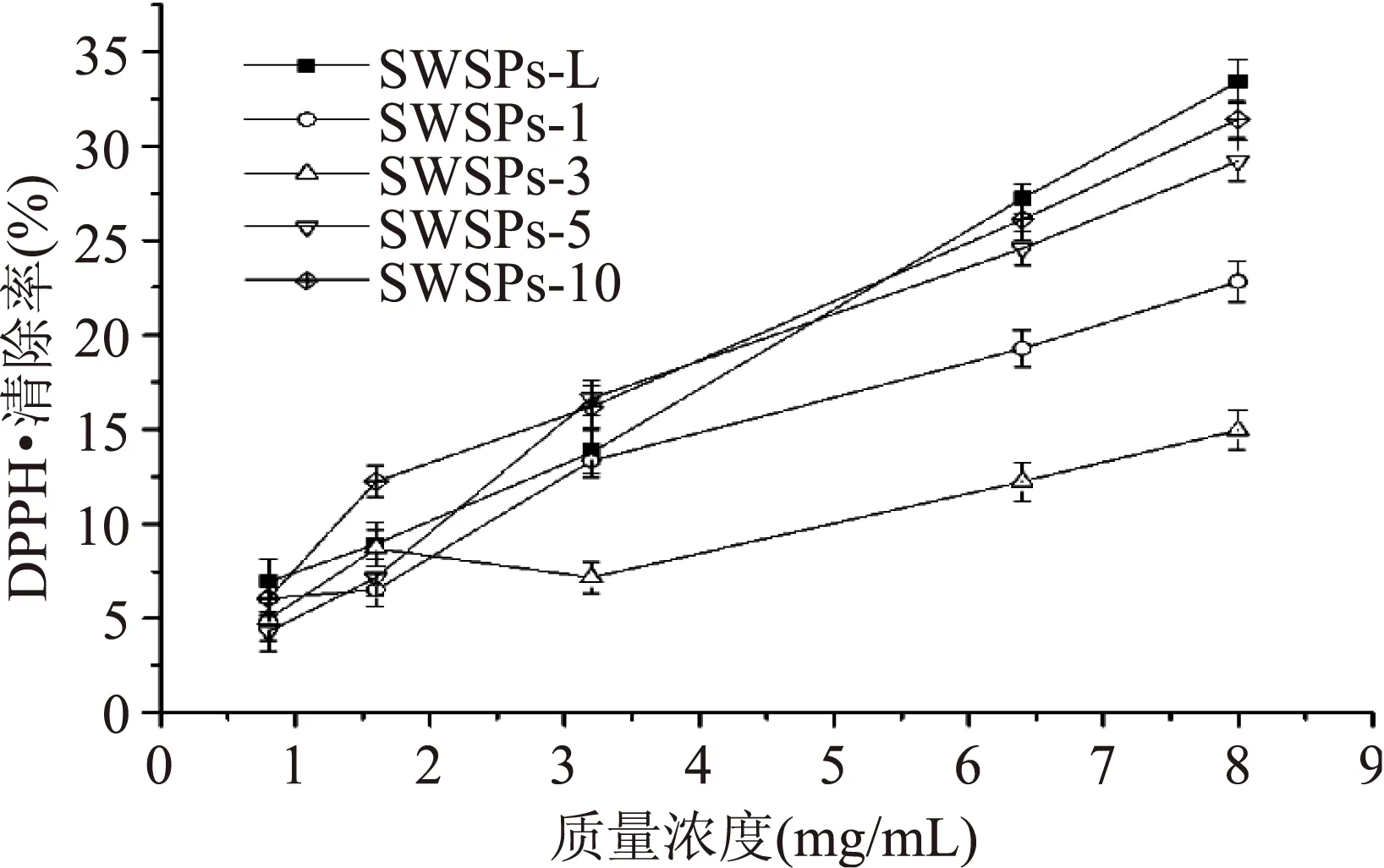
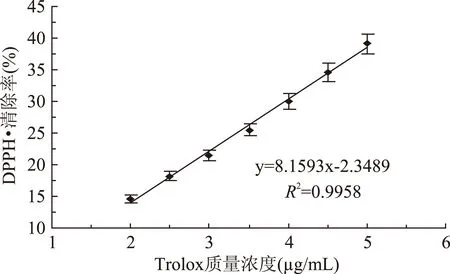
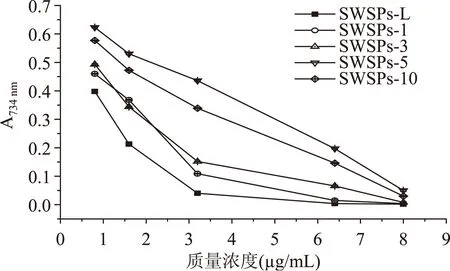
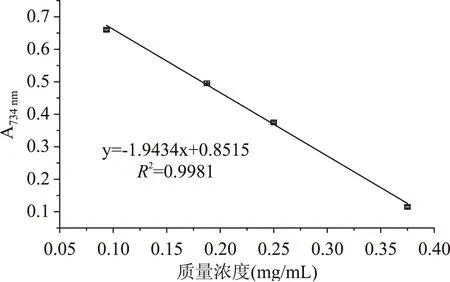
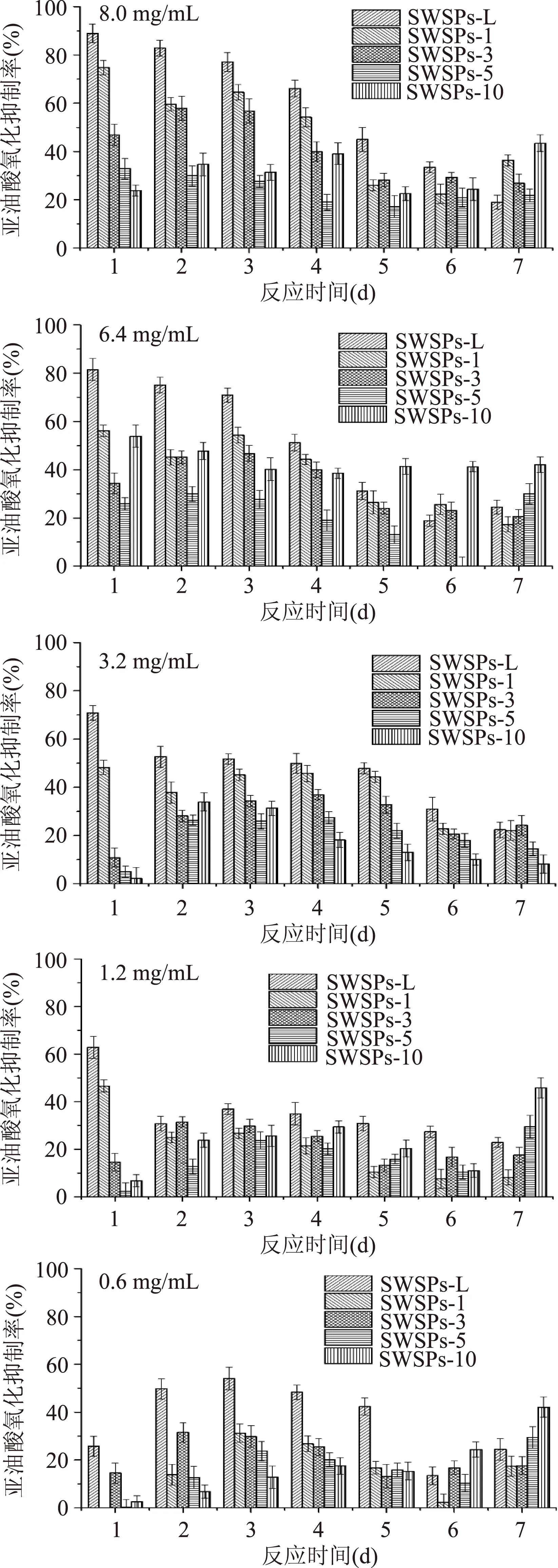
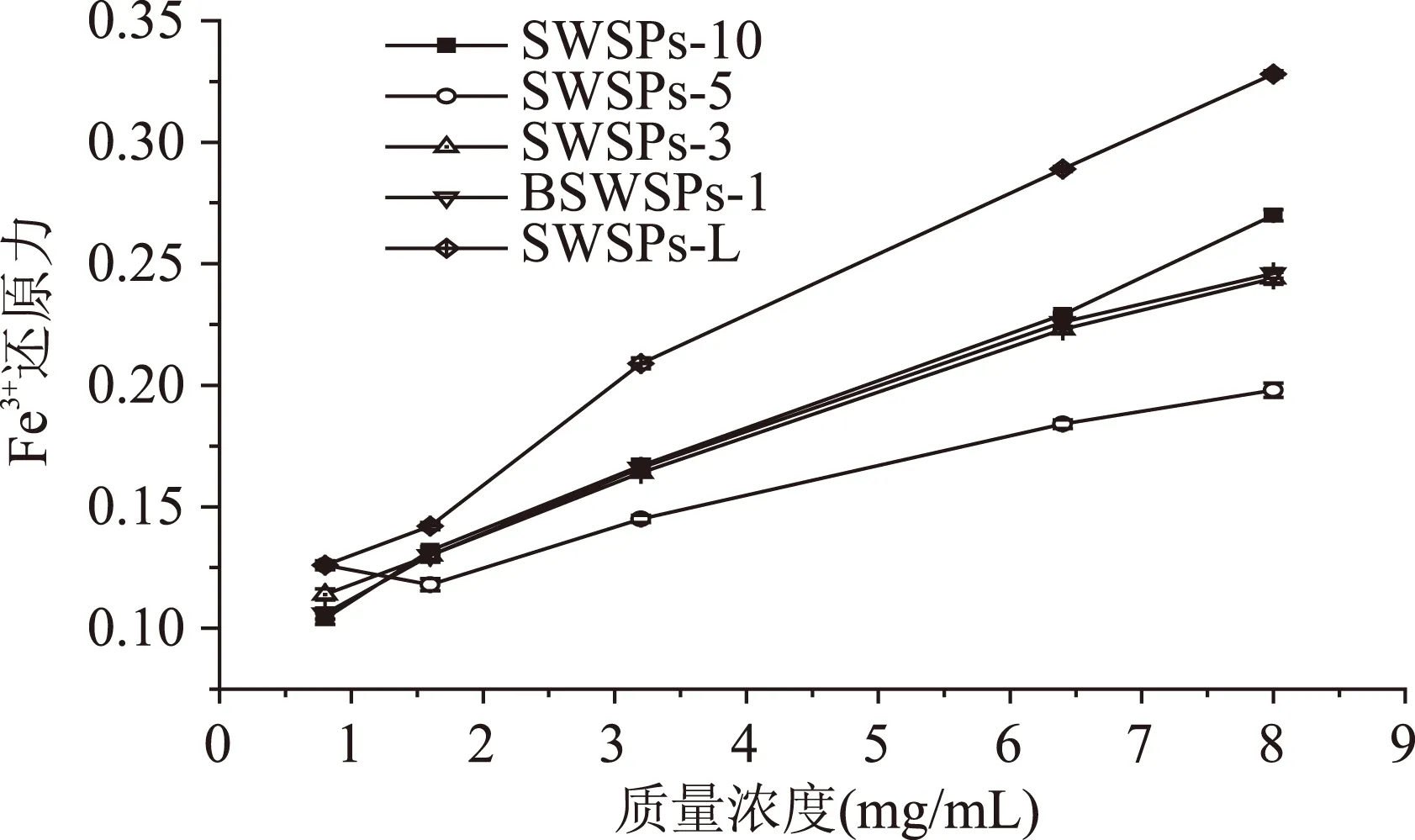
利用凝胶液相色谱对SWSPs各分级产物分子量分布进行测定,分子量分布结果如图1所示。经多级超滤操作,各组分间的分子量分布差异明显。随着超滤膜孔径的减小,各组分中分子量小于500 u的多肽逐渐增加,且差异明显,其顺序SWSPs-10 图1 各组分分子量分布Fig.1 Molecular weight distribution of each fragment注:(a)~(e)分别代表SWSPs-L、 SWSPs-1、SWSPs-3、SWSPs-5、SWSPs-10五个组分。 2.2SWSPs分级产物氨基酸组成 经全自动氨基酸分析仪测定,不同组分的氨基酸分析结果如表1所示,氨基酸的种类与组成在一定程度上决定抗氧化肽活性的大小,如具有亲核性的含硫氨基酸Cys和Met[19],以及含咪唑基的氨基酸His[20]等可作为氢受体;芳香族氨基酸参与供氢,可减慢或终止自由基链式反应;Glu等酸性氨基酸作为氢供体可提高肽类物质还原能力[21];含巯基的半胱氨酸可与自由基反应[22],此外较多抗氧化肽序列中含有疏水氨基酸,如Ala、Val、Leu等。由表1可知,低分子量组分SWSPs-L和SWSPs-1的疏水性氨基酸含量达到40%以上,碱性氨基酸(Lys、His、Arg)含量之和分别为18.61%、18.52%,His的含量均高于其他组分,由此推断,这两个组分可能具有较强抗氧化活性。此外,SWSPs-10的Cys-s含量明显高于其他组份,可能具有较好的还原能力。 表1 各组分氨基酸分析Table 1 Amino acid analysis of each fragment 图2 各组分对·清除能力Fig.2 Scavenging capacity against · of each fragment 图3 VC对清除能力Fig.3 Scavenging capacity against · of VC 2.4不同组分SWSPs清除·OH的能力 Fe2+可与邻菲罗啉(phen)生成橙红色配合物[Fe(phen)3]2+,H2O2在Fe2+催化下产生具有强氧化性的·OH,使得Fe2+氧化成Fe3+,继而生成无色或蓝色的配合物[Fe(phen)3]3+,原本的溶液褪色[24]。在多肽、氨基酸的存在下,氨基酸等物质易与·OH发生氧化修饰,捕捉·OH,从而延缓溶液的褪色变化[23],因而可以表征多肽体系的抗氧化性。由图4可知,仅SWSPs-L显示出较好的·OH清除效果,说明酶解产物中具有·OH清除能力的活性结构只存在低分子量SWSPs-L中,其中当SWSPs-L浓度为8 mg/mL时与18.72 μg/mL的VC具有同等清除效果(图5),清除率为22.28%。 图4 SWSPs-L对·OH清除能力Fig.4 Scavenging capacity against ·OH of SWSPs-L 图5 VC对·OH清除能力Fig.5 Scavenging capacity against·OH of VC 2.5不同组分SWSPs清除DPPH·的能力 DPPH·清除率是快速定量分析多肽作为电子受体、转移电子的能力的通用方法[25]。由图6可知,各分级产物均呈现一定的清除效果且均对浓度有一定的依赖性。在低浓度时,组分间对DPPH·清除效果差异不明显;但在浓度高于6.4 mg/mL时,各组分差异明显,其中SWSPs-10、SWSPs-5和SWSPs-L的清除活性明显高于其他组份,当浓度为8 mg/mL时,SWSPs-L组分对DPPH·清除效果最佳,与4.38 μg/mL Trolox等效(图7),清除率为33.39%。Bamdad等[26]报道,DPPH·清除率取决于良好的疏水性和在反应介质中良好的扩散性,由实验结果可以看出,DPPH·清除活性与分子量分布没有明显的线性关系,较高DPPH·清除活性分散于低分子量与高分子量组分中。这可能是有由于高分子量多肽具有较多电子致密的侧链基团,同时因较高的疏水性使高分子量多肽更易于与DPPH·结合。但随着水解程度不断加深,逐渐暴露的亲水性基团提高了低分子量多肽的分散性,同时低分子量多肽具有较小的空间位阻,从而具有较好的转移电子的能力。 图6 各组分对DPPH·清除能力Fig.6 Scavenging capacity against DPPH· of each fragment 图7 Trolox对DPPH·清除能力Fig.7 Scavenging capacity against DPPH· of Trolox 2.6不同组分SWSPs清除ABTS+·的能力 ABTS+·在抗氧化肽提供的电子作用下生成ABTS,这时墨绿色溶液会发生褪色,在734 nm处的吸光度下降,褪色程度可反映其抗氧化能力的大小[27]。由图8可知,随着样品浓度增加,各组分的抗氧化效果不断提高,此外,同浓度下各组分使ABTS+·转变成ABTS能力差异明显,低分子量组分的抗氧化效果明显优于高分子量组分,SWSPs-L组分表现最佳,其1.2 mg/mL浓度清除ABTS+·的能力与0.33 mg/mL Trolox等效(图9),但分子量较高的组分SWSPs-10、SWSPs-5差异不大。这可能是因为低分子量组分的酪氨酸和苯丙氨酸含量较高,其苯环可以作为极佳的氢供体[28],从而使得ABTS+·褪色。 图8 各组分对ABTS+·清除能力Fig.8 Scavenging capacity against ABTS+· of each fragment 图9 Trolox对ABTS+·清除能力Fig.9 Scavenging capacity against ABTS+· of Trolox 2.7不同组分SWSPs抑制亚油酸自氧化的能力 油脂与脂类食品的腐败变质多是由于其不饱和脂肪酸的氧化、酸败,从而缩短了食品的货架期;在生命有机体中,细胞膜中也含有大量的不饱和脂肪酸,过量自由基会损伤膜结构并生成一些脂质过氧化物,继而可能引发炎症、代谢紊乱和细胞老化等症状[29]。尤其是亚油酸含有两个不饱和双键,极易受自由基攻击,产生大量过氧化物,因此考察抗氧化剂对亚油酸自氧化的抑制是评价抗氧化剂在食品中抗氧化能力强弱的最常用方法。由图10可知,在亚油酸氧化前5 d内,随着分子量的降低,各组分抑制亚油酸自氧化能力不断提高,反应1 d时,1.2 mg/mL SWSPs-L对亚油酸自氧化的抑制率为62.35%,与119 μg/mL的BHT的抑制率相当。因为低分子量多肽中可能含有较多还原性末端的肽类物质,可以通过电子转移方式或直接参与供氢过程,有效中止自由基链式反应从而阻滞亚油酸氧化。此外,SWSPs各组分可以在一定程度上通过疏水性氨基酸残基与亚油酸中的不饱和双键发生疏水性结合,中止了脂质过氧化过程中自由基引发的链式反应,使脂质得到了有效地保护。从实验中还可以发现,随着反应时间的延长,抑制效果明显下降,到亚油酸氧化反应至第7 d,在高浓度8.0 mg/mL,低分子量组分SWSPs-L的抑制率为19.05%,在各组分中抑制率表现最差。 图10 SWSPs抑制亚油酸氧化能力 Fig.10 Inhibition of linoleic acid oxidation of SWSPs 图11 BHT抑制亚油酸氧化能力Fig.11 Inhibition of linoleic acid oxidation of BHT 2.8不同组分SWSPs还原Fe3+的能力 图12 各组分对Fe3+的还原能力Fig.12 Reduction capacity against Fe3+ of each fragment 图13 Trolox对Fe3+的还原能力Fig.13 Reduction capacity against Fe3+ of Trolox 2.9不同组分SWSP螯合Fe2+的能力 Fe2+因高效的催化活性,加速自由基的生成,从而引发氧化性的链式反应。Fe2+一方面直接通过 Fenton 反应产生·OH,另一方面可能通过催化Haber-Weiss 反应[32]引起机体细胞损伤,因此Fe2+螯合能力也是评价籽瓜源抗氧化肽的重要指标之一。 实验结果如图14所示,各组分对Fe2+螯合能力随着样品浓度的增加不断提高,但是组分间的差异明显,对Fe2+的螯合能力的顺序为SWSPs-L>SWSPs-3>SWSPs-1>SWSPs-10>SWSPs-5。据文献报道,大分子肽在水解初期,易形成类聚脯氨酸的螺旋结构,其中还包括苏氨酸、谷氨酸、天冬氨酸等,具有很好的金属螯合能力[33]。但是随着水解时间的延长,产生了更多的带电活性小肽,小分子带电活性肽由于空间位阻小,更易与金属离子直接发生化学螯合[26],从而表现出更高的螯合能力。从表1中氨基酸的分析结果发现,SWSPs-10组分中的苏氨酸、谷氨酸和天冬氨酸的总量达32.71%,由此可以推断,与其有相同来源的SWSPs-L应该具有更高的螯合能力,实验结果也正好验证了这一点,组分SWSPs-L表现出优异的螯合能力,与等浓度的EDTA具有相近的螯合效果。 图14 各组分对Fe2+螯合能力Fig.14 Chelating capacity against Fe2+ of each fragment [1]张晖,唐文婷,王立,等.抗氧化肽的构效关系研究进展[J].食品与生物技术学报,2013,32(7):673-679. [2]Krinsky N I.Mechanism of action of biological antioxidants[J].Experimental Biology and Medicine,1992,200(2):248-254. [3]Levine R L,Mosoni L,Berlett B S,et al. Methionine residues as endogenous antioxidants in proteins[J].Proceedings of the National Academy of Sciences,1996,93(26):15036-15040. [4]Neuzil J,Gebicki J M,Stocker R.Radical-induced chain oxidation of proteins and its inhibition by chain-breaking antioxidants[J]. Biochem,1993,293:601-606. [5]Traber M G.Regulation of human plasma vitamin E[J]. Advances in Pharmacology,1996,38:49-63. [6]Ren J,Zhao M,Shi J,et al.Purification and identification of antioxidant peptides from grass carp muscle hydrolysates by consecutive chromatography and electrospray ionization-mass spectrometry[J].Food Chemistry,2008,108(2):727-736. [7]刘长江,贾莎莎,许金光.响应面法优化软枣猕猴桃蛋白水解及多肽的抗氧化研究[J].食品科学,2012,33(10):33-38. [8]Sakanaka S,Tachibana Y.Active oxygen scavenging activity of egg-yolk protein hydrolysates and their effects on lipid oxidation in beef and tuna homogenates[J].Food Chemistry,2006,95(2):243-249. [9]徐亚元,周裔彬,万苗,等.脱脂米抗氧化肽的分离纯化与研究[J].食品工业科技,2014,34(24):135-139. [10]李诚,肖岚,付刚,等.猪皮胶原蛋白抗氧化肽的分离纯化及体外抗氧化活性研究[J].食品工业科技,2014,35(15):95-100. [11]郭静,姚丹丹,陈银岳,等.蛋清酶解物对小鼠血清生化指标和肝脏抗氧化指标的影响[J].食品工业科技,2015,36(19):366-369. [12]Lin S,Guo Y,Liu J,et al.Optimized enzymatic hydrolysis and pulsed electric field treatment for production of antioxidant peptides from egg white protein[J].Afr J Biotechnol,2011,10(55):11648-11657. [13]潘竟海,陈友强,林明,等.黑籽瓜产量性状的相关与通径分析[J].新疆农业科学,2013,(8):40-44. [14]陆晓婷,张超,张晖,等.黑籽瓜种子蛋白酶解工艺及抗氧化性研究[J].食品科技,2015,40(5):73-78. [15]张友维.枯草芽孢杆菌发酵花生粕制备抗氧化肽的研究[D].无锡:江南大学,2012. [16]张敏,周梅.不同分子量米糠多肽的抗氧化活性[J].食品科学,2013,34(3):1-6. [17]李春生.红籽瓜种仁分离蛋白特性研究与抗氧化肽制备[D].呼和浩特:内蒙古农业大学,2011. [18]Li X.Improved Pyrogallol Autoxidation Method:A Reliable and Cheap Superoxide-Scavenging Assay Suitable for All Antioxidants[J].Agric Food Chem,2012,60(25):6418-6424. [19]Udenigwe C C,Aluko R E.Chemometric analysis of the amino acid requirements of antioxidant food protein hydrolysates[J].International Journal of Molecular Sciences,2011,12(5):3148-3161. [20]Elias R J,Kellerby S S,Decker E A.Antioxidant activity of proteins and peptides[J].Food Science and Nutrition,2008,48(5):430-441. [21]Ahn C B,Lee K H,Je J Y. Enzymatic production of bioactive protein hydrolysates from tuna liver:effects of enzymes and molecular weight on bioactivity[J].International Journal of Food Science & Technology,2010,45(3):562-568. [22]Qian Z J,Jung W K,Kim S K. Free radical scavenging activity of a novel antioxidative peptide purified from hydrolysate of bullfrog skin,Rana catesbeiana Shaw[J].Bioresource Technology,2008,99(6):1690-1698. [23]凌关庭.抗氧化食品与健康[M].北京:化学工业出版社,2004. [24]Dai Y,Li F,Ge F,et al. Mechanism of the enhanced degradation of pentachlorophenol by ultrasound in the presence of elemental iron[J]. Journal of Hazardous Materials,2006,137(3):1424-1429. [25]Bondet V,Brand-Williams W,Berset C.Kinetics and mechanisms of antioxidant activity using the DPPH free radical method[J].LWT-Food Science and Technology,1997,30(6):609-615. [26]Kaur R,Arora S,Singh B.Antioxidant activity of the phenol rich fractions of leaves of Chukrasia tabularis A. Juss[J]. Bioresource Technology,2008,99(16):7692-7698. [27]Miller N J,Rice-Evans C A.Factors influencing the antioxidant activity determined by the ABTS+· radical cation assay[J].Free Radical Research,1997,26(3):195-199. [28]Qian Z J,Jung W K,Kim S K.Free radical scavenging activity of a novel antioxidative peptide purified from hydrolysate of bullfrog skin Rana catesbeiana Shaw[J].Bioresource Technology,2008,99(6):1690-1698. [29]Wiseman H,Halliwell B. Damage to DNA by reactive oxygen and nitrogen species:role in inflammatory disease and progression to cancer[J].The Biochemical Journal,1996,313:17-29. [30]Bamdad F,Wu J,Chen L.Effects of enzymatic hydrolysis on molecular structure and antioxidant activity of barley hordein[J]. Journal of Cereal Science,2011,54(1):20-28. [31]Xia Y,Bamdad F,Gänzle M,et al.Fractionation and characterization of antioxidant peptides derived from barley glutelin by enzymatic hydrolysis[J].Food Chemistry,2012,134(3):1509-1518. [32]Haber F,Weiss J.The catalytic decomposition of hydrogen peroxide by iron salts proceedings of the Royal Society of London A:Mathematical,Physical and Engineering Sciences[J].The Royal Society,1934,147(861):332-351. [33]孙珍.生物质谱技术和方法在蛋白类药物序列鉴定中的应用研究[D].上海:复旦大学,2011. 因本刊已被《中国知网》(包括“中国知网”优先数字出版库)独家全文收录, 所以所付稿酬中已包含该网站及光盘应付的稿酬。 Study on theinvitroantioxidant capacity of different molecular weight polypeptides of black seed-watermelon seeds QI Xi-guang,LU Xiao-ting,ZHANG Hui*,WANG Li,QIAN Hai-feng (School of Food Science and Technology,Jiangnan University,Wuxi 214122,China) Objective:To study the differences between antioxidant abilities of polypeptides with different molecular weights extracted from black seed-watermelon seeds.Methods:Multi-stage separation and ultrafiltration techniques were used to treat the enzymatic hydrolysates(SWSPs)of black seed-watermelon seeds protein,and five constituents(SWSPs-L,SWSPs-1,SWSPs-3,SWSPs-5,SWSPs-10)were separated and collected.Then the antioxidant abilities of these constituents were investigated through seven evaluation systems.Results:The antioxidant abilities were obviously different in these five constituents separated from black seed-watermelon seeds.SWSPs-1 with 1~3 ku molecular weights showed the highest superoxide anion radical-scavenging activity while SWSPs-L with molecular weights lower than 1 ku showed multiple antioxidant capacities and it had the similar metal ion chelating activity with EDTA under the same concentration.Conclusions:The antioxidant abilities of polypeptides extracted from black seed-watermelon seeds were closely related to their molecular weight distributions and amino acid compositions,and it was the result of comprehensive effect of all aspects. black seed-watermelon seeds;ultrafiltration;peptide;antioxidation 2015-09-21 齐希光(1968-),男,硕士,实验师,主要从事谷物功能成分的研究,E-mail:qxguang97@hotmail.com。 张晖(1966-),女,博士,教授,研究方向:谷物功能成分,E-mail:zhanghui@jiangnan.edu.cn。 国家高技术研究发展计划“863计划”项目(2013AA102207);江苏高校优势学科建设工程项目(PAPD)。 TS255.1 A 1002-0306(2016)09-0074-07 10.13386/j.issn1002-0306.2016.09.006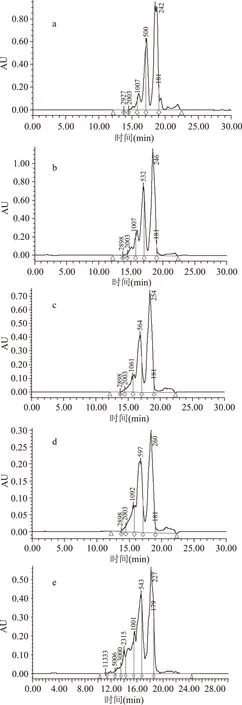



3 结论


