双发射荧光探针在F-离子检测中的应用
张志秋,张纪梅,张 坤,马庆运
(天津工业大学 环境与化学工程学院,天津 300387)
双发射荧光探针在F-离子检测中的应用
张志秋,张纪梅,张坤,马庆运
(天津工业大学 环境与化学工程学院,天津 300387)
利用Turkevich-Frens法制备金纳米粒子,然后利用Stöber法将水热条件下制备的掺杂Zn的CdTe量子点(CdTe∶Zn QDs)修饰在SiO2微球上得到一种荧光微球。利用AuNPs和荧光微球构建双发射荧光探针,基于F-能够使荧光探针的荧光恢复的原理,实现对F-的检测。同时研究了平衡时间和pH值对该探针的影响。结果表明该探针具有较好的抗干扰性且在pH值=7.0的HEPES缓冲溶液中检测限低达149 nmol/L。
量子点;微球;氟离子;荧光探针
0 引 言
荧光共振能量转移(fluorescence resonance energy transfer, FRET) 是一种非辐射的能量转移,当两个基团之间的距离在1~10 nm以内时,通过分子间的电偶极相互作用,将给体激发态能量转移到受体激发态[1]。量子点由于其独特的光学性能及尺寸效应和较高的量子产率等优点,使其在生物、环境、医学等方面有广泛的应用前景[2-3],尤其是量子点独特的荧光性能,使其在FRET广泛应用[4]。金纳米粒子(AuNPs)是一种优良的淬灭剂,具有高的淬灭系数,其吸收光谱与量子点的发射光谱有较大范围的重叠[5],因此,利用AuNPs对量子点的荧光淬灭效应可构建一个荧光共振能量转移体系,实现对某种离子的检测[1, 6-7]。为了解决量子点在水溶液中与目标分析物相互作用的问题,通常将量子点功能化修饰来提高检测的灵敏度。Guo等[8]合成了表面带正电荷CdTe QDs和带负电荷AuNPs,实现了对Pb2+的检测。
阴离子的检测在化学监测中占有重要的地位,其中氟离子检测尤为重要[9]。氟离子广泛地存在自然界中,且是人体必须的微量元素之一。但是,过量的氟使得釉原蛋白在成熟阶段存留时间延长,从而抑制釉质晶体生长,对人体造成危害。近年来已有不少关于氟离子化学传感器的报道,但存在灵敏度低,便捷性差等缺点[10-11]。Tao Wu等将 NBDAE共聚合成新的荧光聚合物,用于构建荧光探针来检测F-1,其检测限接近0.8 μmol/L。
本文通过水热法合成了高荧光量子产率和光稳定的掺杂Zn的CdTe QDs,降低了CdTe QDs的毒性,减少了对环境的污染。以此为基础利用Stöber法合成一种修饰量子点的SiO2荧光微球[13],讨论并优化了影响荧光微球与AuNPs之间的体系的条件。同时基于F-能够恢复荧光微球的荧光的原理,构建了双共振能量转移荧光探针,实现了对水溶液中F-1的灵敏检测,在环境监测中具有重要的意义。
1 实 验
1.1金纳米粒子的合成
采用Turkevich-Frens法[14-15]制备AuNPs。即向烧瓶中加入98 mL的二次水和1 mL氯金酸(1%(质量分数)),加热回流至95 ℃,加入2 mL的柠檬酸钠(1%(质量分数)),反应25 min,冷却后得到AuNPs溶液。
1.2红色量子点的合成和表面修饰
采用水热法合成CdTe∶Zn QDs[16-17]。取40 mL乙醇和1 mL红色(650 nm)CdTe∶Zn QDs溶液及0.5 mL TEOS加入烧瓶中,搅拌30 min后,加入1 mL25%的氨水,密封搅拌24 h。然后,再加入50 μL APTES和25 μL TEOS,反应12 h。离心分离后,得到包覆红色量子点的SiO2微球,将其溶解在二次水中,超声分散备用。
1.3双发射荧光微球的制备
取1 mL绿色CdTe∶Zn QDs溶液和0.5 mL修饰氨基的红色量子点[18]及8 mL PBS缓冲液加入烧瓶中,再加入2 mg EDC·HCl和2 mg NHS,避光搅拌12 h,离心分离。最后将沉淀溶于二次水中,超声分散备用。
1.4氟离子的检测
为了研究荧光微球与AuNPs之间的能量转移,在荧光微球溶液中加入不同浓度的AuNPs,用缓冲溶液(pH值=7)稀释至2 mL,反应30 min后,测定混合液的荧光强度。
在AuNPs与荧光微球的能量体系中加入不同浓度的F-1,然后稀释至2 mL,反应10 min后,测量体系的荧光强度,研究体系能量转移的关系,从而实现对F-1的检测。
2 结果与讨论
2.1金纳米粒子的TEM图
从图1可以看出,合成的AuNPs的粒径分布比较均一,粒子间稳定分散且没有团聚,经测定其粒径为15 nm。
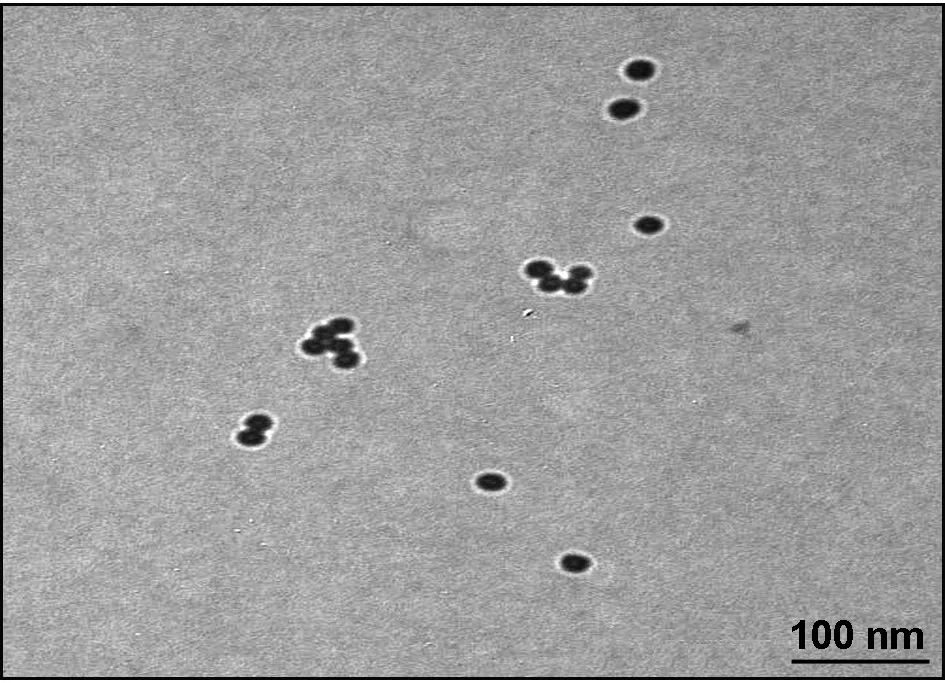
图1 AuNPs的TEM图
2.2双发射荧光微球的TEM图
图2(a)为SiO2包裹红色量子点荧光纳米微球(QDs红色-SiO2)的TEM图,图2(b)为外包绿色量子点的SiO2红色量子点荧光纳米微球(QDs红色-SiO2-QDs绿色)的TEM图。

图2 荧光微球TEM图
由图2可看出,合成的荧光纳米粒子颗粒较均匀,QDs红色-SiO2大小约为100 nm,QDs红色-SiO2-QDs绿色大小约为101 nm,表明外包绿色量子点并没有引起SiO2球粒径太大的变化。同时,从图2(a)可知,红色量子点已经被均匀地包进了SiO2微球且图2(b)显示微球表面由于连接绿色量子点变得粗糙。TEM图表明成功合成了双发射荧光微球。
2.3双发射荧光微球的发射光谱与AuNPs的吸收光谱
荧光微球的荧光发射光谱与AuNPs的紫外吸收光谱如图3所示。从图3可知,荧光微球的荧光发射光谱与AuNPs的紫外吸收光谱有较大范围的重叠,尤其是量子点在530 nm左右的发射峰几乎完全重叠,因此AuNPs能够使双发射量子点发生荧光淬灭,故AuNPs与该量子点能构建一个能量共振转移体系。
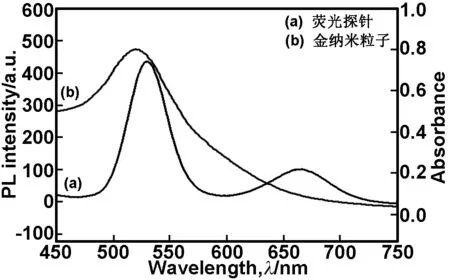
图3荧光微球的荧光发射光谱与AuNPs的紫外吸收光谱
Fig 3 The fluorescence emission spectrum of fluorescent microspheres and UV absorption spectrum of AuNPs
2.4双发射荧光微球与AuNPs体系的相互作用平衡时间的选择
本文在pH值=7.0,10 mmol/L HEPES缓冲液中研究了平衡时间对双发射荧光微球和AuNPs能量体系的影响。结果如图4所示,从图4可知,随着平衡时间的增加,AuNPs的淬灭效率逐渐增强,25 min后基本不变,在后续实验中可以选择30 min作为二者相互作用的时间。

图4 不同时间下荧光微球的淬灭效率
Fig 4 The effect of the time on the quenching efficiency of fluorescent microspheres
2.5双发射荧光微球与AuNPs体系的相互作用pH值的选择
维持体系中AuNPs的浓度为1 nmol/L,pH值对双发射荧光微球与AuNPs能量体系的影响如图5所示。
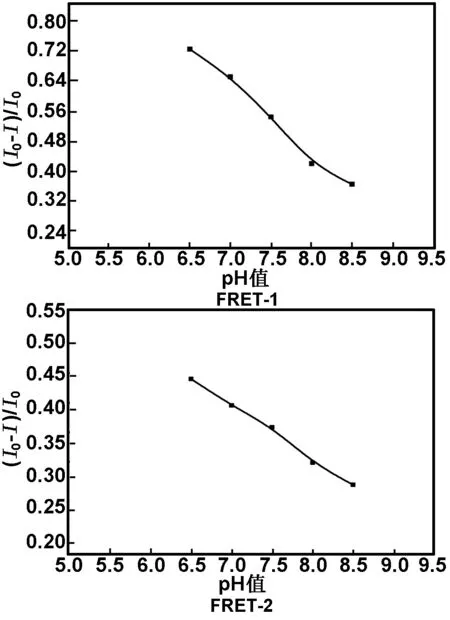
图5 不同pH值下荧光微球的淬灭效率
从图5可看出,不同pH值下荧光微球的淬灭效率明显不同,在pH值<7.0时,AuNPs对荧光微球有较好的淬灭效率,随着pH值的增大,淬灭效率逐渐降低。考虑到荧光微球与AuNPs的稳定性选择pH值=7.0。
2.6双发射荧光微球与AuNPs体系的相互作用
本文研究了pH值=7.0时AuNPs浓度对双发射荧光荧光探针体系的影响得到图6(a),图6(b)为对应的淬灭效率曲线。其中,I0和I分别为AuNPs不存在和存在时荧光微球稳定的荧光强度,(I0-I)/I0表示荧光淬灭效率。
由图6可知,随着AuNPs浓度的增加,荧光微球的淬灭效率逐渐增强,当AuNPs浓度达到1 nmol/L后,淬灭效率的变化趋于平缓且溶液颜色由粉红色逐渐变紫,AuNPs浓度越高,颜色变化越明显。
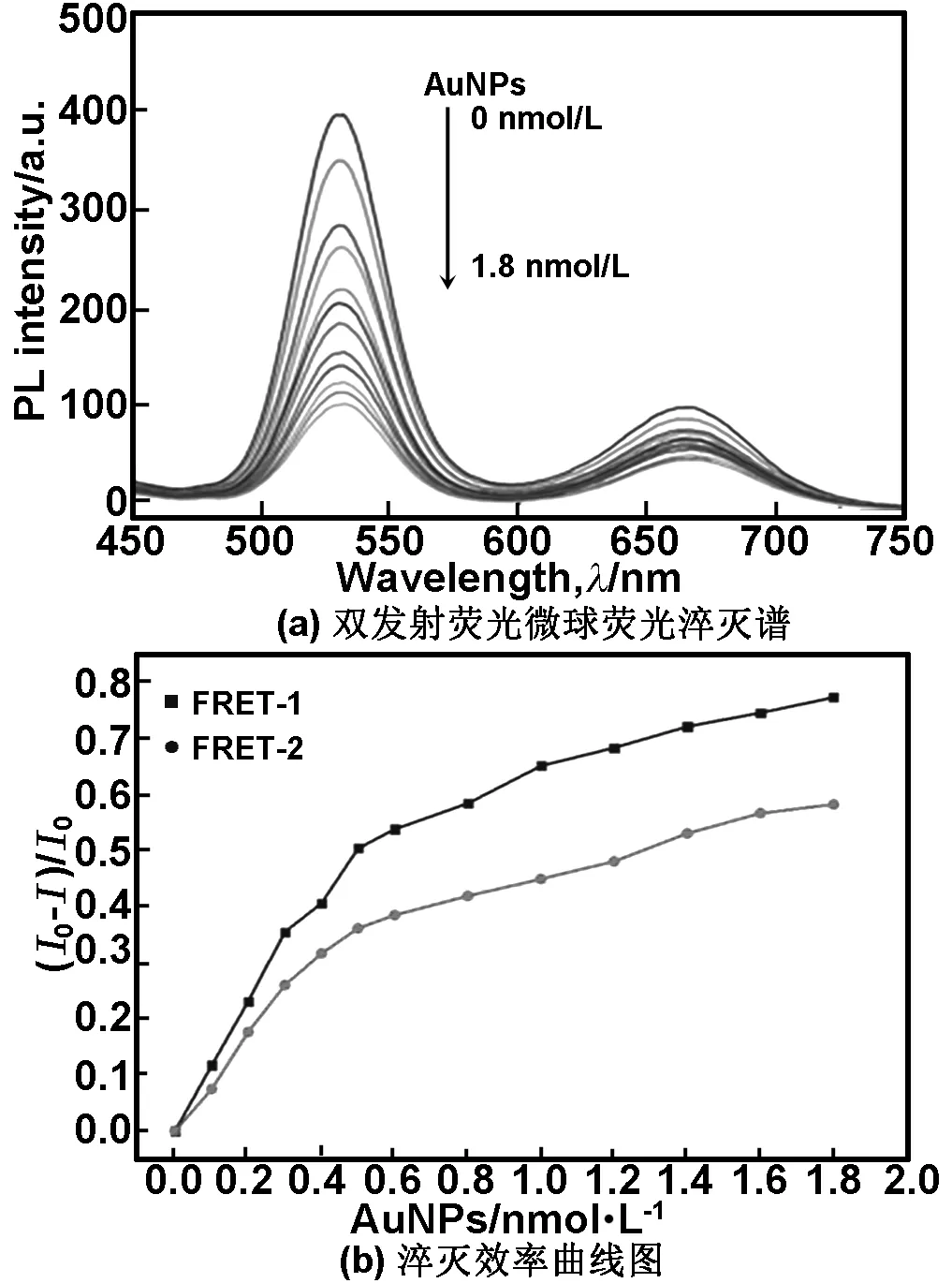
图6 不同AuNPs浓度下双发射荧光微球荧光淬灭谱和淬灭效率曲线图
2.7双发射荧光探针对F-的检测
不同浓度F-对荧光体系荧光强度恢复的影响如图7(a)所示,并以(I-I0)/I0的值对F-浓度作图,得到图7(b)所示的恢复效率曲线,其中,I0和I分别为F-不存在和存在时双发射荧光探针稳定的荧光强度,(I-I0)/I0表示荧光恢复效率,图7(c)为荧光探针荧光恢复效率的拟合直线。
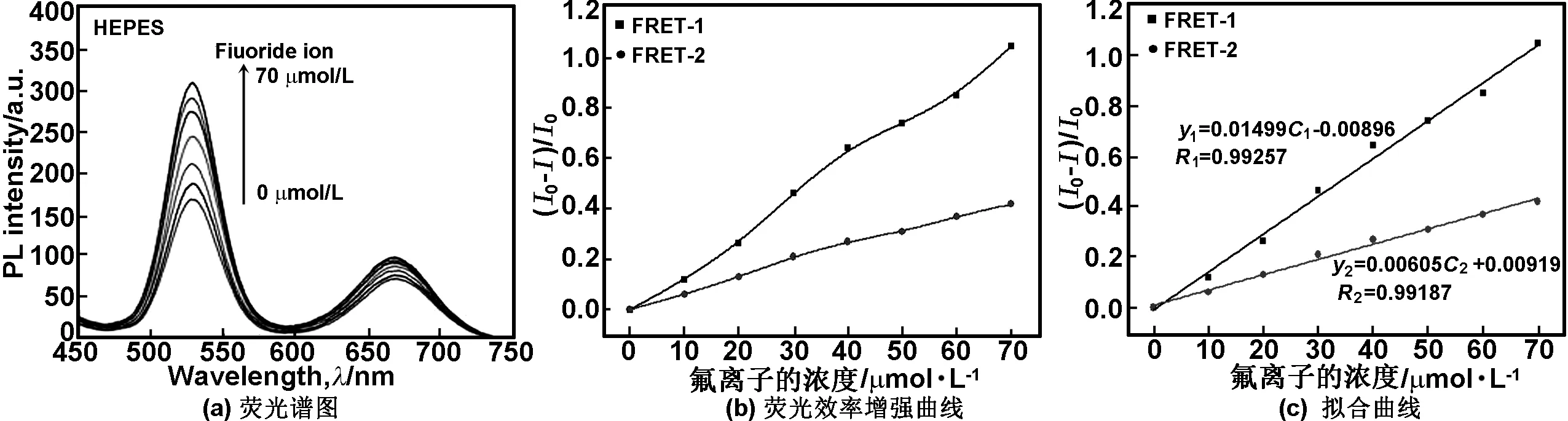
图7 不同F-浓度下探针的荧光谱图和荧光效率增强曲线及拟合曲线
Fig 7 The fluorescence spectra of fluorescence probe; the curves of fluorescence efficiency enhancement; the fitting lines at different concentrations of F-
从图7(a)和(b)可以看出,当F-加入探针体系后,探针的荧光强度增强且荧光增强效率也逐渐提高,外层量子点(FERT-1)的增强效率要高于内层量子点(FRET-2)。由图7(c)的直线方程可算出未知的F-浓度C(C=(C1+C2)/ 2)。实验中选取10 μmol/L,F-标液做11组平行实验,根据所得数据算出增强效率的标准方差(SD),根据下列公式
可计算出该荧光探针的检测限(LOD)。
表1荧光探针的检测限
Table 1 The detection limit of the fluorescence probe
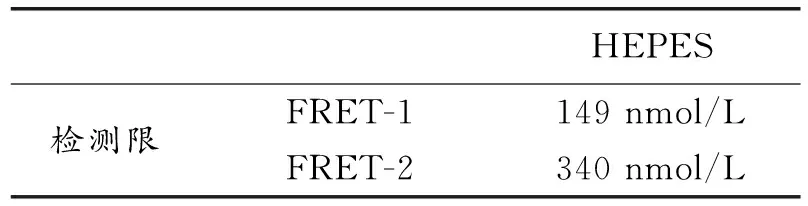
HEPES检测限FRET-1FRET-2149nmol/L340nmol/L
2.8特异性实验
在特异性实验中,分别向体系中加入50 μmol/L Cl-、Br-、I-、SO42-、NO3-、HPO4-和Ag+、Hg+、Pb2+、K+、Na+等干扰离子,测量对应的荧光强度值,用(I-I0)/I0的比值作图。得到图8所示的荧光增强(淬灭)效率图,其中I0和I分别为离子不存在和存在时荧光探针的荧光强度,(I-I0)/I0表示荧光增强效率,负值表示探针的荧光强度减弱。结果表明该荧光探针具有较好的特异性,在阴离子溶液中可以实现对F-的特异性检测。
2.9F-离子的检测机理
在检测F-的体系中,随着AuNPs的加入,荧光微球的荧光强度逐渐减弱,两者之间发生了图9中所示的荧光共振能量转移(FRET-1和FRET-2),其作用机理是荧光微球表面的巯基丙酸与AuNPs表面的柠檬酸之间形成氢键[19],其相应的O—H键(dO-H=1.08,WBI=0.116)和氢桥键(dOH…O=1.41,WBI=0.053) 使得在巯基丙酸和柠檬酸之间存在高的结合能,最终导致荧光淬灭。当加入F-后, 由于F-与柠檬酸的结合能及其与巯基丙酸的结合能远远高于巯基丙酸与柠檬酸之间的结合能,所以F-迅速与桥氢反应,同时结合AuNPs,使得荧光微球与AuNPs之间的氢键断裂,即FERT被终止,导致荧光微球的荧光得到恢复,从而实现对F-的检测。
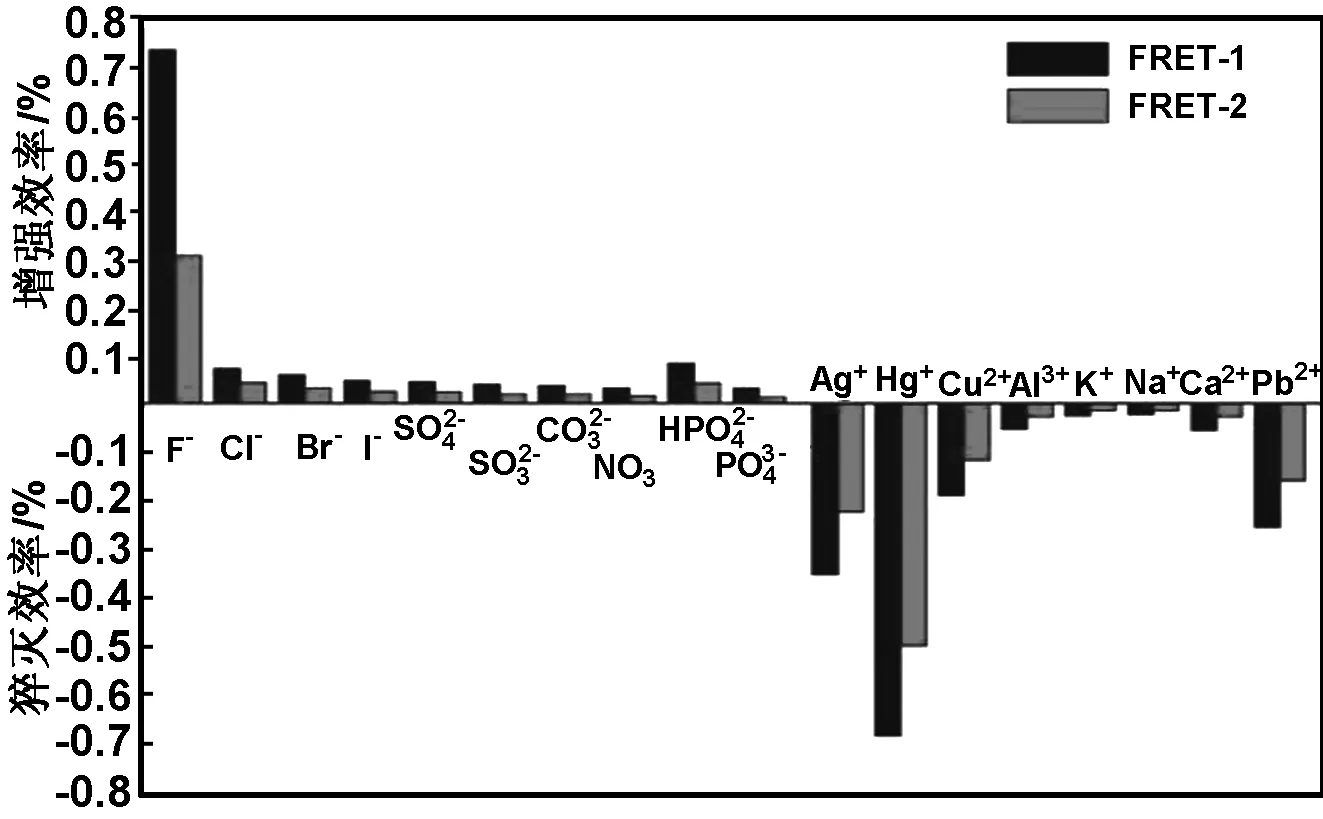
图8 不同离子作用下的荧光增强(淬灭)效率图
Fig 8 Schematic of fluorescent probes enhancement (quenching) efficiency in different ions
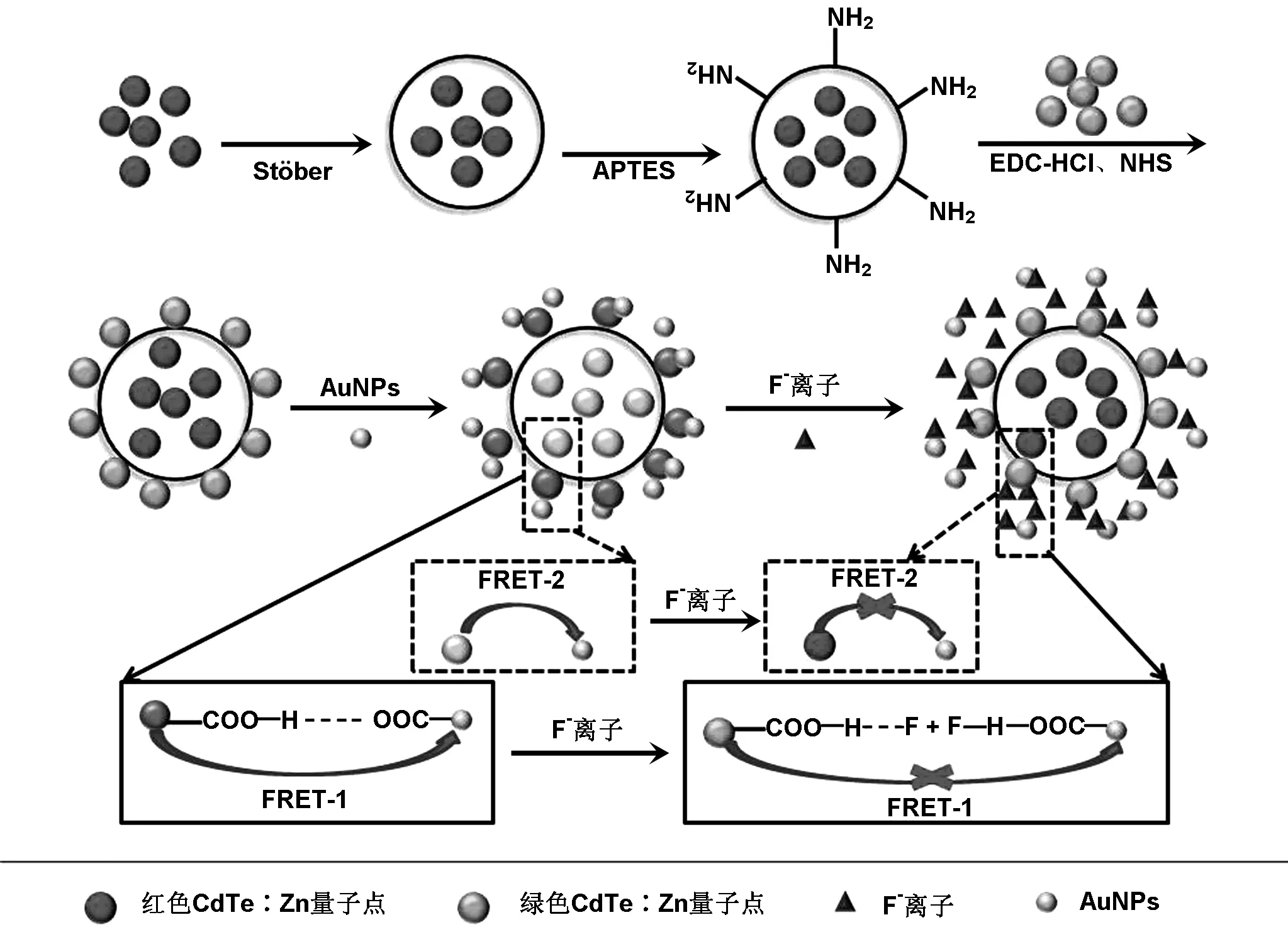
图9 双发射荧光探针对F-检测的过程示意图
3 结 论
利用Stöber法合成了一种修饰量子点的双发射的荧光微球,探讨了荧光微球与AuNPs之间的相互作用,由于荧光微球表面的巯基丙酸与AuNPs表面的柠檬酸之间形成氢键,从而发生荧光共振能量转移(FRET)。而F-能够和荧光微球与AuNPs之间的桥氢反应,恢复荧光微球的荧光,从而实现对F-的检测。通过特异性实验可知该该荧光探针具有很强的抗干扰性且检测限低达149 nmol/L。
[1]Chen G, Song F, Xiong X, et al. Fluorescent nanosensors based on fluorescence resonance energy transfer (FRET) [J]. Industrial and Engineering Chemistry Research, 2013, 52 (33): 11228-11245.
[2]Biju V, Itoh T, Anas A, et al. Semiconductor quantum dots and metal nanoparticles: syntheses, optical properties, and biological applications [J]. Analytical and Bioanalytical Chemistry, 2008, 391 (7): 2469-2495.
[3]Chen L, Han H. Recent advances in the use of near-infrared quantum dots as optical probes for bioanalytical, imaging and solar cell application [J]. Microchimica Acta, 2014, 181 (13-14): 1485-1495.
[4]Wang X, Sheng P, Zhou L, et al. Fluorescence immunoassay of octachlorostyrene based on forster resonance energy transfer between CdTe quantum dots and rhodamine B [J]. Biosensors and Bioelectronics. 2014, 60: 52-56.
[5]Aldeek F, Ji X, Mattoussi H. Quenching of quantum dot emission by fluorescent gold clusters: what it does and does not share with the forster formalism [J]. Journal of Physical Chemistry C, 2013, 117(29): 15429-15437.
[6]Lim K R, Ahn K S, Lee W Y. Detection of concanavalin a based on attenuated fluorescence resonance energy transfer between quantum dots and mannose-stabilized gold nanoparticles [J]. Analytical Methods, 2013, 5 (1): 64-67.
[7]Zhang S, Wu H, Huan S, et al. Gold nanoparticle based fluorescence resonance energy transfer immunoassay for the detection of the histone deacetylase activity using a fluorescent peptide probe [J]. Analytical Letters, 2013, 46 (13): 2029-2039.
[8]Wang X, Guo X. Ultrasensitive Pb2+detection based on fluorescence resonance energy transfer (FRET) between quantum dots and gold nanoparticles [J]. Analyst, 2009, 134 (7): 1348-1354.
[9]Chetia B, Iyer P K. Selective fluoride anion sensing by simple benzimidazolyl based ligand [J]. Sensors and Actuators B Chemical, 2014, 201: 191-195.
[10]Wade C R, Broomsgrove A E, Aldridge S, et al. Fluoride ion complexation and sensing using organoboron compounds [J]. Chem Rev, 2010, 110(7): 3958-3984.
[11]Liu B, Tian H. A ratiometric fluorescent chemosensor for fluoride ions based on a proton transfer signaling mechanism [J]. Journal of Materials Chemistry, 2005, 15 (27-28): 2681-2686.
[12]Wu T, Zou G, Hu J, et al. Fabrication of photoswitchable and thermotunable multicolor fluorescent hybrid silica nanoparticles coated with dye-labeled poly(N-isopropylacrylamide) brushes [J]. Chemistry of Materials, 2009, 21 (16): 3788-3798.
[13]Wang C G, Ma Z F, Su Z M. Synthesis and self-assembly of silica-coated anisotropic gold nanoparticle films [J]. Nanotechnology, 2006, 17(8):1819-1824.
[14]Turkevich J, Stevenson P C, Hillier J. A study of the nucleation and growth processes in the synthesis of colloidal gold [J]. Discussions of the Faraday Society, 1951, 11: 55-75.
[15]Frens G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions [J]. Nature, 1973, 241(105): 20-22.
[16]Zhang H, Wang L, Xiong H, et al. Hydrothermal synthesis for high-quality CdTe nanocrystals [J]. Advanced Materials, 2003, 15 (20): 1712-1715.
[17]Zhao D, Fang Y, Wang H, et al. Synthesis and characterization of high-quality water-soluble CdTe∶Zn2+quantum dots capped by N-acetyl-l-cysteine via hydrothermal method [J]. Journal of Materials Chemistry, 2011, 21(35): 13365-13370.
[18]Wang Y Q, Zhao T, He X W, et al. A novel core-satellite CdTe/silica/Au NCs hybrid sphere as dual-emission ratiometric fluorescent probe for Cu2+[J]. Biosensors and Bioelectronics, 2014, 51: 40-46.
[19]Chen S J, Chang H T. Nile red-adsorbed gold nanoparticles for selective determination of thiols based on energy transfer and aggregation [J]. Analytical Chemistry, 2004, 76 (13): 3727-3734.
Dual emission fluorescent probefor the detection of F-
ZHANG Zhiqiu, ZHANG Jimei, ZHANG Kun, MA Qingyun
(School of Environment and Chemical Engineering, Tianjin Polytechnic University, Tianjin 300387,China)
The AuNPs were first synthesized by turkevich-frens method and SiO2fluorescent microspheres modified Zn doped CdTe QDs (CdTe∶Zn) were prepared using Stöber process. Next, we built fluorescent probes using AuNPs and fluorescent microspheres. Because of the ability to restore the fluorescence intensity of fluorescent probes, the F-ion could be detected by such probes. At the same time, the fluorescence intensity might be influenced by pH value and equilibrium time in the detect process. The results showed that fluorescent probes have good anti-interference and detection limit was as low as 149 nmol/L in HEPES buffer solution at pH=7.0.
quantum dots; microspheres; fluoride ions; fluorescent probe
1001-9731(2016)08-08128-05
国家自然科学基金资助项目(21106101);天津市应用基础及前沿技术研究计划资助项目(12JCZDJC29500);天津市青年基金资助项目(13JCQNJC06300)
2015-05-12
2015-07-05 通讯作者:张纪梅,E-mail: zhangjimei6d311@163.com
张志秋(1991-)男,山东郓城人,在读硕士,师承张纪梅教授,从事荧光纳米材料方面研究。
O657
A
10.3969/j.issn.1001-9731.2016.08.022

