石墨烯的改性及其在电化学检测方面的研究新进展
万红利,万 丽,王贤保,吕美娇,王世敏
(1. 有机化工新材料湖北省协同创新中心,武汉 430062;2. 湖北大学 材料科学与工程学院,功能材料绿色制备与应用教育部重点实验室, 武汉 430062;3. 中国科学院宁波材料技术与工程研究所,浙江 宁波 315201)
石墨烯的改性及其在电化学检测方面的研究新进展
万红利1,2,3,万丽1,2,王贤保1,2,吕美娇2,王世敏1,2
(1. 有机化工新材料湖北省协同创新中心,武汉 430062;2. 湖北大学 材料科学与工程学院,功能材料绿色制备与应用教育部重点实验室, 武汉 430062;3. 中国科学院宁波材料技术与工程研究所,浙江 宁波 315201)
介绍了石墨烯的基本性质,综述了石墨烯的表面改性及其在电化学检测方面的应用,并对不同改性方法的优缺点进行了讨论,另外比较了基于石墨烯的检测手段与传统的检测手段,最后对基于石墨烯的材料在未来的发展进行了展望。
石墨烯;表面改性;电化学检测;峰电流
0 引 言
随着环境问题的日益严重,水污染和空气污染等已引起了人们的密切关注,因此对污染物的检测是及其重要的。然而,目前所采用的检测手段仍存在一些明显的不足,从而极大地限制了这些技术的应用范围。如:荧光标记费用高[1];SPR传感器[2]难以区分非特异性吸附,并对温度和样品组成等干扰因素敏感等。寻求高灵敏度、高稳定性、较低的设备及人员要求,操作简便的手段是目前污染物检测研究领域中最具挑战性的课题之一。
石墨烯高比表面积,高导电性,高稳定性等优异的物理化学性质[3]使得其在电化学检测,电能存储器,超级电容器等方面有了极大的应用[4],也给物质的检测领域带来了变革,使检测的灵敏度,操作性提高。本文重点对石墨烯和氧化石墨烯的改性及其在电化学检测方面的应用和最新进展进行了综述。
1 石墨烯及氧化石墨烯的表面改性
1.1氧化还原法改性
传统的氧化还原法主要是改良的Hummers法,对石墨烯的改性所用的还原剂主要为强酸和强碱,如:联氨、硼氢化钠、硫化氢和水合肼等。这一类还原剂危险性比较高。因此环境友好型、毒性低的还原剂将在石墨烯的制备领域引起越来越多的关注。
最近Satheesh等利用硫脲为还原剂[5]实现了低毒性的还原剂在石墨烯制备领域的应用。即:先利用改性的H法制备了氧化石墨烯;再将100 mg氧化石墨烯分散于100 mL去离子水中超声分散1 h;然后加入0.5 mol硫脲,升温至95 ℃,在搅拌条件下反应12 h,直至溶液颜色变为黑色;再将反应得到的石墨烯用去离子水和无水乙醇洗涤,过滤;最后将过滤后的石墨烯在60 ℃的真空干燥箱中干燥12 h。同时Liu等采用邻苯二胺作为还原剂来还原氧化石墨烯[6],主要因为硫脲和邻苯二胺中都含有氨基,可以用来还原氧化石墨烯中的含氧基团。通过各种表征手段如透射电子显微镜(transmission electron microscopy, TEM),X射线衍射分析(X-ray diffraction analysis, XRD)等证明石墨烯被成功制备,并且其表面仍保留了一些含氧基团,能增加石墨烯的亲水性。通过热重分析(Thermogravimetry, TG)和循环伏安法(cyclic voltammetry, CV)表明制备的石墨烯具有良好的热稳定性和电化学特性。
这一类低毒性还原剂的成功应用说明石墨烯的绿色生产将会在不久的未来得以实现。而最近报道的有关石墨烯的绿色生产即:Vc和氨基酸代替水合肼作为还原剂[7]使石墨烯的大规模绿色生产成为可能。
1.2纳米粒子修饰
氧化石墨烯和石墨烯表面的羟基,羧基等含氧基团对纳米粒子的引入起到了重要的作用,一方面,这些含氧基团与纳米颗粒之间形成配位键使石墨烯表面被改性;另一方面,由于纳米粒子具有很高的比表面积,能进一步提高被检测物质在石墨烯或氧化石墨烯表面的吸附,而提高电化学响应。

图1 Au-GR/GCE电极的制备以及其对Cu2+的检测[8]
Wang等制备了金纳米粒子修饰的石墨烯[8],即:先采用改性的H法制备氧化石墨烯,然后将25 mg氧化石墨烯溶于25 mL DMF中,超声分散1 h;再以所得到的氧化石墨烯溶液作电解质,玻碳电极作阳极,铂电极作阴极,在120 V电压下电泳沉积3 min,即得到氧化石墨烯/玻碳电极;最后通过电化学还原得到石墨烯/玻碳电极;再以制备的石墨烯/玻碳电极作为工作电极,并将其置于含有0.01 g/L HAuCl4的0.1 mol/L的KNO3溶液中,在-0.2 V的电位下反应90 s,即得到金纳米粒子修饰的石墨烯/玻碳电极。其对Cu2+的检测(图1)表现出很高的电化学灵敏度,检测极限达到了0.028 nmol/L。Rajkumar等也利用电化学沉积技术制备了钯纳米粒子/石墨烯复合材料[9],并实现了对多巴胺和双氯高灭酸的同时检测。
Zhao等利用水热法合成了CuO纳米颗粒/孔状石墨烯复合物[10]。在无酶条件下,该复合物电极实现了对葡萄糖的检测。由于单一的氧化铜的机械稳定性和导电性较差,而且将活性铜基体暴露在环境中较长时间会使其失去催化性能,因此多元复合物材料被提出。在本工作中,所制备的复合物具有较大的比表面积,而且该复合物电极的稳定性和重现性好,除此之外,该复合物电极的应用不仅局限于标准样品的检测,而且对人体血液中葡萄糖的检测结果与当地医院的检测结果一致。这一结果表明,该复合物电极在实际样品的检测中将具有很大的发展空间。
1.3DNA酶表面修饰
Li等利用DNA酶修饰的金纳米颗粒在Pb2+存在的条件下组装到石墨烯表面,从而实现了对Pb2+的检测,且检测极限可以达到0.1 nmol/L[1]。将所制备的改性氧化石墨烯应用到比色传感器中,对重金属离子的检测可以达到100 pmol/L,很大程度上降低了检测极限。该方法对石墨烯的表面改性不需要严格的温度控制,并且在对离子的检测时不需要在核苷酸链上进行荧光标记,极大地减化了实验步骤。
Zhang等利用多巴胺还原氧化石墨烯[11],得到聚多巴胺修饰的氧化石墨烯,然后利用Michael加成使探测DNA分子键连到石墨烯表面,而目标DNA分子和探测DNA分子通过Hg2+形成配位连接,导致了峰电流的增加,验证了探测DNA分子成功地对石墨烯进行了表面修饰(图2)。DNA酶对石墨烯的表面改性与其它改性方法相比具有更突出的优势,即通过改变DNA酶可以实现对其它多种金属离子的检测。但由于DNA酶的引入使得其对所检测的环境的温度,pH值要求较高[12],限制了该方法在实际中的应用范围。
零维材料石墨烯量子点由于其独特的物理,化学性能,使其在不同领域都有相关应用,Ting等利用金纳米粒子功能化的石墨烯量子点(GQD-AuNP)实现了对Hg2+和Cu2+的超低量检测(对Hg2+的检测极限为0.02 nmol/L, 对Cu2+的检测极限为0.05 nmol/L)[13]。在该复合物电极中,Hg2+与石墨烯量子点上的羧基相互作用,形成R-COO-(Hg2+)-OOC-R;同时, 金纳米粒子对Hg2+也具有吸引力。与GQD-AuNP改性后的玻碳电极相比,金纳米粒子改性后的玻碳电极的氧化峰较弱。这一现象说明石墨烯量子点和金纳米颗粒之间的协同效应对于离子的检测是非常重要的。
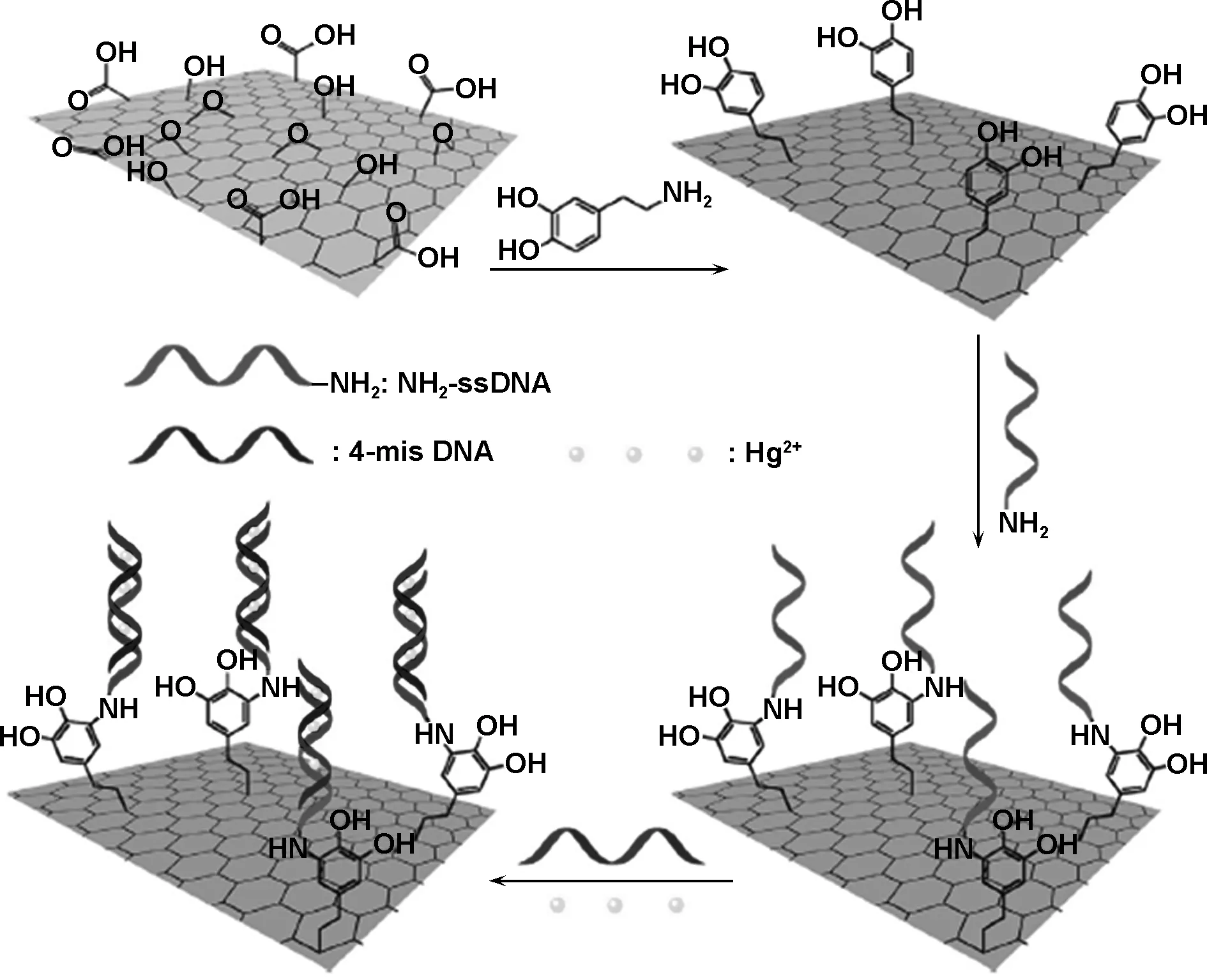
图2 DNA/石墨烯复合材料的制备过程及其对Hg2+的检测[11]
1.4有机高分子等修饰
一方面,石墨烯表面的一些活性位点可以作为高分子的聚合位点;另一方面,石墨烯表面的含氧基团可以与高聚物中的氨基,羟基等基团形成氢键;此外,石墨烯自身结构中的大π键也能与高聚物中的π键相互作用,以上各种作用使高分子链组装到石墨烯表面[14],实现石墨烯的表面修饰。
Si等利用聚(3,4-乙烯二氧噻吩)修饰氮掺杂的石墨烯[15],成功地应用于邻苯二酚和对苯二酚的同时检测。高分子的引入使石墨烯表面的粗糙度增加,有利于离子在电极和电解液之间的交换和物质在电极表面的吸附,同时使电活性增加,这加强了被检测物质在电极上的氧化还原,从而提高峰电流,降低检测极限,最终提高检测的灵敏度。然而,高分子对石墨烯的修饰会受到聚合度,PH值等因素的影响。因此,对水溶液中离子的检测,若高聚物是亲油性的,则要选择聚合度较低的高分子;若是亲水性的,如:含有大量能与水形成氢键的羟基,氨基等基团的高聚物,聚合度选择要适中,一方面,聚合度很大,则高聚物与水之间的作用力很强,大于其与石墨烯分子之间的作用力,导致高聚物从石墨烯表面脱落;另一方面,太强的氢键作用会使自由水变成束缚水,不利于离子的迁移,使检测的灵敏度降低。而解决检测受PH值限制的问题,可以选择两性高分子来扩大检测范围。
同时,氧化石墨烯在高分子领域的应用,会改变或改善高分子的性能。聚三羟基丁酸盐生物降解性能好,熔点、玻璃化转变温度和柔韧性能与合成高分子相媲美,但其在熔点以上不稳定,且在室温时会脆性断裂。为改善聚三羟基丁酸盐的缺点,Arza等采用溶液流延法实现了石墨烯与聚三羟基丁酸盐(PHB)的复合[16]。即:先采用改性的H法制备氧化石墨烯;然后于130 ℃下,将PHB粉末溶解到γ-羟基丁酸内脂(GBL)中,再速冷至65 ℃,加入氧化石墨烯,搅拌7 min;最后将氧化石墨烯分散物投射到培养皿中,并在130 ℃真空干燥箱中干燥16 h,得到石墨烯/聚三羟基丁酸盐复合物。该复合物不仅保留了高分子原有的性能,而且由于氧化石墨烯的网状结构,使其动态剪切模量增加。
2 改性的石墨烯及氧化石墨烯在电化学检测方面的应用
在整个电化学检测过程中,石墨烯复合材料修饰的玻碳电极作为工作电极,铂等惰性材料作为对电极,参比电级大多为甘汞电极。工作电极的各方面性质如:灵敏度、选择性和稳定性等对于物质的检测具有极其重要的影响。比较未利用石墨烯和利用石墨烯后被检测物的峰电流来判断检测的灵敏度,发现峰电流增大,则灵敏度提高;引入其它离子对被检测物峰电流的位置的影响来判断改性石墨烯的选择性,表明位置基本不变,选择性强;将改性石墨烯修饰的玻碳电极在室温条件下放置一段时间后,再将其用于相同条件下同一离子的检测,比较前后峰电流的强度来判断电极的稳定性,结果显示强度变化很小,说明稳定性好。
以上均说明石墨烯在电化学检测方面的应用使检测的灵敏度、选择性和稳定性提高。但单独使用石墨烯所达到的检测极限远不能满足现代环境监测的要求,因此,改性石墨烯的应用是必然趋势。上文已经谈及了不同的物质对石墨烯的改性,以下则综述了改性的石墨烯在检测方面的应用。
2.1对重金属离子的检测
2.1.1对Pb2+的检测
工业废水的排放使环境中Pb2+离子增多,Pb2+对全身各器官和系统均有毒性,会导致头痛、腹痛、焦虑和易怒等疾病[17]。因此实现Pb2+的有效检测刻不容缓。
Yang等通过微波加热[6],以邻苯二胺为还原剂还原氧化石墨烯,而自身在氧化石墨烯表面原位聚合,制得聚邻苯二胺修饰的氧化石墨烯。由于氧化石墨烯的高比表面积使其成为一个很好的吸附剂,为聚邻苯二胺在其上的附着提供了很好的支撑,从而提高了检测效率。最终的各种表征手段也反映了制备出的氧化石墨烯复合物表现出良好的环境稳定性,较高的吸附能力和较好的电化学特性。Lokman等利用金纳米粒子/聚氨基葡萄糖/石墨烯复合材料对SPR传感器[2]进行改进,克服了传统的SPR技术难以区分非特异性吸附等缺点。这一类物质的成功使用主要因为邻苯二胺和聚氨基葡萄糖上的氨基和羟基能很好地使金属离子吸附,成为Pd2+的配位点和氧化还原反应的活性位点。本研究组采用微波辅助的方法合成了羟丙基--环糊精功能化石墨烯(HP--CD-RGO),以HP--CD-RGO和Nafion的混合物为感应材料,通过同位沉积Bi膜的方法制备了一种灵敏度高、稳定性好、可用于Pb2+和Cd2+同时检测的电化学传感器。其检出限分别为9.42×10-11mol/L和6.73×10-11mol/L[18]。
Lee等利用金纳米颗粒/石墨烯复合物电极实现了醋酸盐缓冲溶液中微量Pb2+的检测[19]。实验中发现电化学沉积薄膜的量对电极性能有很大影响。当沉积量不足以覆盖玻碳电极表面时,峰电流随着覆盖量的增大而升高,但峰电流达到最高值后会下降(由于覆盖量过大时,电极上的金纳米颗粒会团聚,导致电极的稳定性降低)。除此之外,富集时间和富集电势都对电极的性能有一定影响,因此,通过调控各种影响因素,可以使电极的性能达到最佳状态。与未改性的玻碳电极相比,该复合物电极在0.1 mol/L醋酸盐缓冲溶液中(pH值=5.3),对Pb2+的检测极限为0.8 nmol/L。
2.1.2对Hg2+的检测
Hg2+离子对环境和生物有害,会造成肾脏衰竭和脑组织损伤等严重疾病[11,20]。根据US环境保护局规定,环境中的Hg2+浓度不能超过10 nmol/L。2012年,Park等报道了利用DNA酶/石墨烯复合材料(图3)实现对Hg2+的有效检测[21],检测极限可以达到1 nmol/L。

图 3利用氧化石墨烯作为电化学检测材料对Hg2+的电化学检测[21]
Fig 3 Electrochemical detection of Hg2+ions by employing GO as an electrochemical indicator[21]
Wang等报道的聚吡咯功能化的石墨烯多孔电极具有高灵敏度,高选择性,并实现了对Hg2+的有效检测[22]。其检测极限为0.03 nmol/L,远低于世界健康组织标准。检测的机理是Hg2+与N原子以1∶4的形式形成配位化合物,但由于其紧密的形态,限制了目标原子在其表面的聚集,从而影响检测的精度。但Wang等利用电化学沉积技术形成了相互连接的三维微观结构的石墨烯修饰电极,解决了这一问题。即:以Au作为工作电极,Pt作为对电极,含有0.1 mol/L LiClO4的3 mg/mL的氧化石墨烯分散液作为电解质;在-1.2 V的连续电位下,氧化石墨烯还原为石墨烯并沉积到金电极上;经洗涤和干燥形成三维石墨烯多孔电极。最后再利用电化学沉积,将聚吡咯沉积到该电极上,得到聚吡咯功能化的石墨烯多孔电极。这一电极增加了Hg2+的附着位点,并且石墨烯的垂直定向结构提高了该电极的电活性。
最近氮掺杂的石墨烯量子点在研究领域得到了广泛的关注(由于其独特的化学、电学和光学性能)。Shi等以柠檬酸为碳源,3,4-二羟基-L-苯丙氨酸(L-DOPA)为氮源,通过一步固相合成法合成了富氧的N掺杂的石墨烯量子点(N-OGQDs)[23]。该合成方法不需要其它特殊设备,而且实验条件能通过调控温度和时间来进行简单控制。N原子的引入,使N-OGQDs在346 nm的激发波长下的量子效率为18%,金属离子的淬灭效应使得N-OGQDs能被用于Hg2+的检测。最终实验结果表明,N-OGQDs对Hg2+的检测极限为8.6 nmol/L。另外,由于含氧基团和含氮基团的同时存在,使得N-OGQDs能在PH值为3-8的范围内实现对离子的检测,从而进一步扩大了该物质的应用范围。
Yang等将聚苯胺(PANI)/石墨烯复合物作为DNA的吸附剂来实现对Hg2+的检测[24]。复合物中的氨基基团对DNA中的胸腺嘧啶(T)具有很强的吸引力,而Hg2+和胸腺嘧啶之间可以形成T-Hg2+-T的配位化合物,从而实现对Hg2+的检测。在该复合物中,PANI是一种导电聚合物,其成本低,环境稳定性好;而石墨烯的加入能够进一步增大复合物的比表面积,从而使电化学性能提高。除此之外,PANI中高浓度的氨基基团能够使足够的DNA吸附在其表面,从而提高对重金属离子的检测灵敏度。
2.1.3对Cu2+的检测
Cu2+离子是人体的必需元素,但通过污染的食物和饮用水进入人体的过量的Cu2+会对人体造成危害,诸如破坏蛋白质的活性,造成组织坏死,从而危害肝脏和肾脏等组织,导致严重疾病[8]。检测Cu2+离子的传统手段主要基于原子吸收光谱,但这种技术所需设备昂贵,且其它离子会对Cu2+的检测造成干扰。
为了寻求更有效的检测方法,Gupta等利用对氨基苯基/石墨烯复合材料修饰玻碳电极,实现了对Cu2+的检测,且检测极限达到了3.3×10-12mol/L[25]。为了制备改性的石墨烯,该研究组先制备了对硝基苯基修饰的玻碳电极(NP/GC),然后将负电位作用于该玻碳电极上,使硝基还原为氨基,得到对氨基苯基修饰的玻碳电极(AP/GC),最后将该电极置于含有1-乙基-3-(3-二甲基氨基丙基)碳二亚胺的石墨烯溶液中得到对氨基苯基修饰的石墨烯。实验测定了不同离子对Cu2+检测的干扰,证明其它离子的引入不影响Cu2+的氧化还原电位,说明该检测手段能排除其它离子的干扰。而Wang等则利用石墨烯量子点实现了对Cu2+的检测[26]。石墨烯量子点,即:一层或几层横向尺寸小于100 nm的石墨烯片,由于其量子限域效应和边界效应将会在生物、医药和材料等领域有诱人的应用前景,而低毒性、高稳定性、稳定的光致发光效应和高导电导热性会使其在荧光探测器,光电装置,传感器等方面有广泛的应用,并使传统的检测手段得到改进[27]。
2.2对过氧化物的检测
过氧化物是一种强氧化剂,具有较强的漂白和防腐功能,是食品和环境分析中一种重要的中介物,但过量的过氧化氢进入人体后会和体内有关物质进行自由基反应,从而导致一系列疾病如:人体遗传物质DNA的损伤,眼部疾病和胃肠道疾病等[28]。因此对过氧化物的有效检测有利于监测食品安全。
近来已报道了一系列将DNA酶修饰的石墨烯用于对过氧化物类物质的检测。但正如上面已介绍到的DNA酶的使用会限制这类检测手段在环境中的适用范围。基于这一缺点,Chen等制备了一种具有过氧化氢酶催化性质的物质—PtPd枝晶修饰的石墨烯(PtPdNDs/GNs),并成功地实现了对过氧化氢的催化,从而达到对过氧化氢检测的目的[29]。在实验过程中以3,3,5,5-四甲基联苯胺(TMB)作为过氧化氢酶底物,当过氧化氢发生反应时,溶液颜色变为绿色,这一现象证明改性的石墨烯具有催化过氧化氢的功能(图4)。

图4TMB-H2O2-PtPdNDs/GNs体系对H2O2的催化机理[29]
Fig 4 Catalytic mechanism in the TMB-H2O2-PtPdNDs/GNs[29]
Wang等利用TiO2纳米管/Ag纳米颗粒/石墨烯复合物实现了对H2O2的检测[30],石墨烯能有效地阻止银纳米颗粒的聚集,而且改变复合物沉积的纳米颗粒能实现对其它物质的检测。
Qian等利用Fe3O4纳米粒子修饰的石墨烯实现了对乙酰胆碱的检测,检测极限可以达到0.25 mmol/L[31]。早期对乙酰胆碱的检测主要利用气相色谱分析,但该方法仪器设备昂贵,样品体积大,需要复杂的样品前处理过程以及对人员的操作技能要求较高[30]。这类过氧化物酶的成功应用说明改性石墨烯在未来可能会取代基于DNA催化的探测器,且由于这类物质制备和保存简便等优点,将会使其在食品和医药等领域有很大的应用前景,同时也会促进生物化学、生物材料和生物科技[32]等领域的进一步发展。
Yu等[33]利用NiO/石墨烯复合物实现了对过氧化氢较低计量的检测(0.7664 μmol/L)。石墨烯和NiO之间的协同效应使该复合物对过氧化氢的氧化具有较好电催化性能和线性响应。同时该复合物电极具有较好的稳定性和重现性,这一性能使得该复合物在生物传感器领域有很大的应用潜力。
2.3对气体的检测
Liang等发现将α-Fe2O3/石墨烯复合材料应用于气体传感器[34]中,能增强传感器的检测灵敏度,并且以乙醇为被检测气体,发现石墨烯的质量分数在2%时检测效率最高。Zhou等研究了基于石墨烯的材料对氨气的检测,利用铜酞菁与石墨烯的π-π相互作用成功地制备了铜酞菁/石墨烯复合材料,并发现该复合材料对氨气的检测灵敏度是纯石墨烯的5倍,且响应速度,选择性,可逆性更强[35]。
Cagliani等利用可扩展的纳米图案化技术实现了对NO2的有效检测,检测极限低于空气质量的国际标准[36]。结构缺陷的引入能增加NO2的吸附位点。而该技术结合了高单位面积的边缘长度,以及可控的结构点缺陷。石墨烯在该技术中的成功应用,说明石墨烯在超敏感的NO2气体传感器领域将得到应用。
1.4对其它物质的检测
Huang等报道了功能化的石墨烯对苦味酸的检测[37];Luo等利用金纳米团簇/石墨烯复合材料成功实现了对五氯化苯酚的有效检测[38];Ye等制备了Cu2O和聚乙烯吡咯酮修饰的石墨烯,并将其应用于除草剂百草枯的检测[39]。最近Li等利用聚吡咯嫁接氮掺杂石墨烯(PPY-g-NGE)修饰的玻碳电极同样实现了对百草枯的检测[40]。首先,利用尿素作为还原剂和氮源得到氮掺杂的石墨烯;再将得到的氮掺杂的石墨烯与SOCl2进行酰化作用;然后,吡咯与氮掺杂的石墨烯通过共价键结合,同时吡咯进行原位聚合反应形成聚吡咯;最终得到了PPY-g-NGE。Oliveira 等利用多酚氧化酶/金纳米粒子/壳聚糖混合膜/石墨烯复合材料实现了对氨基甲酸酯的检测[41]。He等利用石墨烯量子点实现了对苯二酚的检测[42]。Wu等通过两步法(氧化石墨烯的直接电沉积和间氨基苯硼酸的电化学聚合)合成了聚间氨基苯硼酸/石墨烯纳米复合物[43]。在检测过程中,聚间氨基苯硼酸的硼酸基团与氟化物的相互作用,会使铁氰化钾的还原峰电流发生变化,从而实现对氟化物的探测。实验结果表明,还原峰电流随着氟化物的浓度增大而降低。本研究组合成了水溶性的卟啉功能化石墨烯(porphyrin-RGO)并将其用于多巴胺(DA)的选择性灵敏检测。由于porphyrin-RGO带负电荷,与带正电荷的DA之间存在强烈的π-π重叠和静电吸引作用,能有效促进它们之间的电子转移。而抗坏血酸(AA)和尿酸(UA)带负电荷与porphyrin-RGO之间存在排斥作用,所以porphyrin-RGO能够在AA和UA存在的条件下实现对DA的选择性灵敏检测[44]。基于石墨烯的材料对不同物质的检测,说明石墨烯在化工[45],医药[46],生物[47],食品[48],农业[39]等各个领域都会有重要的应用价值。
3 结 语
目前所用的表面改性方法大多是通过氧化还原法,这一方法会破坏石墨烯的原有特性,影响石墨烯原有的结构及形态,从而对检测造成一定的影响。因此未来将在保持石墨烯本身的结构的同时对石墨烯进行改性。而要使石墨烯得到广泛的应用,则必须要实现石墨烯的高质量,大规模生产。虽然近来报道了利用商业搅拌器来提供足够的剪切力实现石墨烯的大规模剥离[49],但其仅使用了100 mL的石墨溶液,离商业化生产还有一定的距离。因此继续探求石墨烯的大规模生产是毋庸置疑的。在电化学检测方面,检测效率受工作电极的稳定性,表面吸附作用和环境等因素的影响。虽然表面增强拉曼散射技术(SERS)因其高灵敏度而在化学检测与分析领域得到了广泛应用,但传统的金属与氧化石墨烯复合物在SERS方面的应用中,在合成复合物过程时需要使用大量还原剂和稳定剂,并且大多有毒。最近报道了采用色氨酸作为还原剂和稳定剂合成的银/氧化石墨烯复合物在表面增强拉曼散射方面得到了应用,并实现了对结晶紫的有效检测[50]。但对于其它物质的同时检测尚未得到证实。因此寻求一种能很好地与石墨烯复合,并且对检测溶液的PH值等不敏感,毒性小的材料是未来发展的迫切需要。
[1]Li C, Wei L, Liu X, et al. Ultrasensitive detection of lead ion based on target induced assembly of DNAzyme modified gold nanoparticle and graphene oxide[J]. Anal Chim Acta, 2014, 831(23): 60-64.
[2]Lokman N F, Bakar A A A, Suja F, et al. Highly sensitive SPR response of Au/chitosan/graphene oxide nanostructured thin films toward Pb (Ⅱ) ions[J]. Sensor Actuat B-Chem, 2014, 195(5): 459-466.
[3]Rozhkov A V, Giavaras G, Bliokh Y P, et al. Electronic properties of mesoscopic graphene structures: charge confinement and control of spin and charge transport[J]. Phys Rep, 2011, 503(2-3): 77-114.
[4]Chakrabarti M H, Low C T J, Brandon N P, et al. Progress in the electrochemical modification of graphene-based materials and their applications[J]. Electrochim Acta, 2013, 107(10): 425-440.
[5]Satheesh K, Jayavel R. Synthesis and electrochemical properties of reduced graphene oxide via chemical reduction using thiourea as a reducing agent[J]. Mater Lett, 2013, 113(1): 5-8.
[6]Yang L, Li Z, Nie G, et al. Fabrication of poly(o-phenylenediamine)/reduced graphene oxide composite nanosheets via microwave heating and their effective adsorption of lead ions[J]. Appl Surf Sci, 2014, 307: 601-607.
[7]Sealy C. Graphene production goes green[J]. Mater Today, 2014, 17(7): 318.
[8]Wang S, Wang Y, Zhou L, et al. Fabrication of an effective electrochemical platform based on graphene and AuNPs for high sensitive detection of trace Cu2+[J]. Electrochim Acta, 2014, 132(3): 7-14.
[9]Rajkumar M, Devadas B, Chen S M, et al. Single step electrochemical fabrication of highly loaded palladium nanoparticles decorated chemically reduced graphene oxide and its electrocatalytic applications[J]. Colloid Surface A, 2014, 452(15): 39-45.
[10]Zhao Y, Bo X, Guo L, et al. Highly exposed copper oxide supported on three-dimensional porous reduced graphene oxide for non-enzymatic detection of glucose[J]. Electrochim Acta, 2015, 176: 1272-1279.
[11]Zhang Y, Zhao H, Wu Z, et al. A novel graphene-DNA biosensor for selective detection of mercury ions[J]. Biosens Bioelectron, 2013, 48(2): 180-187.
[12]Gao L, Lian C, Zhou Y, et al. Graphene oxide-DNA based sensors[J]. Biosens Bioelectron, 2014, 60: 22-29.
[13]Ting S L, Ee S J, Ananthanarayanan A, et al. Graphene quantum dots functionalized gold nanoparticles for sensitive electrochemical detection of heavy metal ions[J]. Electrochim Acta, 2015, 172, 7-11.
[14]Hu K, Kulkarni D D, Choi I, et al. Graphene-polymer nanocomposites for structural and functional applications[J]. Prog Polym Sci, 2014, 39: 1934-1972.
[15]Si W, Lei W, Han Z, et al. Selective sensing of catechol and hydroquinone based on poly(3,4-ethylenedioxythiophene)/nitrogen-doped graphene composites[J]. Sensor Actuat B-Chem, 2014, 199(4): 154-160.
[16]Arza C R, Jannasch P, Maurer F, et al. Network formation of graphene oxide in poly(3-hydroxybutyrate) nanocomposites[J]. Eur Polym J, 2014, 59: 262-269.
[17]Ramesha G K, Sampath S. In-situ formation of graphene-lead oxide composite and its use in trace arsenic detection[J]. Sensor Actuat B-Chem, 2011, 160(1): 306-311.
[18]Lv M, Wang X, Li J, et al. Cyclodextrin-reduced graphene oxide hybrid nanosheets for the simultaneous determination of lead(Ⅱ) and cadmium(Ⅱ) using square wave anodic stripping voltammetry[J]. Electrochim Acta, 2013, 108(10): 412-420.
[19]Lee P M, Wang Z, Liu X, et al. Glassy carbon electrode modified by graphene-gold nanocomposite coating for detection of trace lead ions in acetate buffer solution[J]. Thin Solid Films, 2015, 584: 85-89.
[20]Gong J, Zhou T, Song D, et al. Monodispersed Au nanoparticles decorated graphene as an enhanced sensing platform for ultrasensitive stripping voltammetric detection of mercury(Ⅱ)[J]. Sensor Actuat B-Chem, 2010, 150(2): 491-497.
[21]Park H, Hwang S J, Kim K, et al. An electrochemical detection of Hg2+ion using graphene oxide as an electrochemically active indicator[J]. Electrochem Commun, 2012, 24(10): 100-103.
[22]Meng W, Yuan W, Yu X, et al. Picomolar detection of mercury (Ⅱ) using a three-dimensional porous graphene/polypyrrole composite electrode[J]. Anal Bioanal Chem, 2014, 406(27): 6953-6956.
[23]Shi B, Zhang L, Lan C, et al. One-pot green synthesis of oxygen-rich nitrogen-doped graphene quantum dots and their potential application in pH-sensitive photoluminescence and detection of mercury (Ⅱ) ions[J]. Talanta, 2015, 142: 131-139.
[24]Yang Y, Kang M, Fang S, et al. Electrochemical biosensor based on three-dimensional reduced graphene oxide and polyaniline nanocomposite for selective detection of mercury ions[J]. Sensor Actuat B-Chem, 2015, 214: 63-69.
[25]Gupta V K, Yola M L, Atar N, et al. A novel sensitive Cu(Ⅱ) and Cd(Ⅱ) nanosensor platform: Graphene oxide terminated p-aminophenyl modified glassy carbon surface[J]. Electrochim Acta, 2013, 112: 541-548.
[26]Wang F, Gu Z, Lei W, et al. Graphene quantum dots as a fluorescent sensing platform for highly efficient detection of copper(Ⅱ) ions[J]. Sensor Actuat B-Chem, 2014, 190(1): 516-522.
[27]Roushani M, Abdi Z. Novel electrochemical sensor based on graphene quantumdots/riboflavin nanocomposite for the detection of persulfate[J]. Sensor Actuat B-Chem, 2014, 201(4): 503-510.
[28]Khan S B, Rahman M M, Asiri A M, et al. Fabrication of non-enzymatic sensor using Co doped ZnO nanoparticles as a marker of H2O2[J]. Physica E, 2014, 62(8): 21-27.
[29]Chen X, Su B, Cai Z, et al. PtPd nanodendrites supported on graphene nanosheets: a peroxidase-like catalyst for colorimetric detection of H2O2[J]. Sensor Actuat B-Chem, 2014, 201(4): 286-292.
[30]Wang W, Xie Y, Xia C, et al. Titanium dioxide nanotube arrays modified with a nanocomposite of silver nanoparticles and reduced graphene oxide for electrochemical sensing[J]. Microchem Acta, 2014, 181(11-12): 1325-1331.
[31]Qian J, Yang X, Jiang L, et al. Facile preparation of Fe3O4nanospheres/reduced graphene oxide nanocomposites with high peroxidase-like activity for sensitive and selective colorimetric detection of acetylcholine[J]. Sensor Actuat B-Chem, 2014, 201(4): 160-166.
[32]Ying W, Li Z, Wang J, et al. Graphene and graphene oxide: Biofunctionalization and applications in biotechnology[J]. Trends Biotechnol, 2011, 29(5): 205-212.
[33]Yu Z, Li H, Zhang X, et al. NiO/graphene nanocomposite for determination of H2O2with a low detection limit[J]. Talanta, 2015, 144, 1-5.
[34]Liang S, Zhu J, Wang C, et al. Fabrication of α-Fe2O3@graphene nanostructures for enhanced gas-sensing property to ethanol [J]. Appl Surf Sci, 2014, 292, 278-284.
[35]Zhou X, Wang X, Wang B, et al. Preparation, characterization and NH3-sensing properties of reduced graphene oxide/copper phthalocyanine hybrid material[J]. Sensor Actuat B-Chem, 2014, 193(3): 340-348.
[36]Cagliani A, Mackenzie D, Tschammer L K, et al. Large-area nanopatterned graphene for ultrasensitive gas sensing[J]. Nano Res, 2014, 7(5): 743-754.
[37]Huang J, Wang L, Shi C, et al. Selective detection of picric acid using functionalized reduced graphene oxide sensor device[J]. Sensor Actuat B-Chem, 2014, 196(6): 567-573.
[38]Luo S, Xiao H, Yang S, et al. Ultrasensitive detection of pentachlorophenol based on enhanced electrochemiluminescence of Au nanoclusters/graphene hybrids[J]. Sensor Actuat B-Chem, 2014, 194(4): 325-331.
[39]Ye X, Gu Y, Wang C, et al. Fabrication of the Cu2O/polyvinyl pyrrolidone-graphene modified glassy carbon-rotating disk electrode and its application for sensitive detection of herbicide paraquat[J]. Sensor Actuat B-Chem, 2012, 173: 530-539.
[40]Li J, Lei W, Xu Y, et al. Fabrication of polypyrrole-grafted nitrogen-doped graphene and its application for electrochemical detection of paraquat[J]. Electrochim Acta, 2015, 174: 464-471.
[41]Oliveira T M, Barroso M F, Morais S, et al. Sensitive bi-enzymatic biosensor based on polyphenoloxidases-gold nanoparticles-chitosan hybrid film-graphene doped carbon paste electrode for carbamates detection[J]. Bioelectrochemistry, 2014, 98(2): 20-29.
[42]He Y, Sun J, Feng D, et al. Graphene quantum dots: highly active bifunctional nanoprobes for nonenzymatic photoluminescence detection of hydroquinone[J]. Biosens Bioelectron, 2015, 74: 418-422.
[43]Wu S, Han T, Guo J, et al. Poly(3-aminophenylboronic acid)-reduced graphene oxide nanocomposite modified electrode for ultrasensitive electrochemical detection of fluoride with a wide response range[J]. Sensor Actuat B-Chem, 2015, 220: 1305-1310.
[44]Lv M, Mei T, Zhang C, et al. Selective and sensitive electrochemical detection of dopamine based on water-soluble porphyrin functionalized graphene nanocomposites[J]. Rsc Adv, 2014, 4(18): 9261-9270.
[45]Sitko R, Zawisza B, Malicka E, et al. Graphene as a new sorbent in analytical chemistry[J]. Trac-Trend Anal Chem, 2013, 51(11): 33-43.
[46]Liu J, Cui L, Losic D, et al. Graphene and graphene oxide as new nano-carriers for drug delivery applications[J]. Acta Biomater, 2013, 9(12): 9243-9257.
[47]Singh J, Khanra P, Kuila T, et al. Preparation of sulfonated poly(ether-ether-ketone) functionalized ternary graphene/AuNPs/chitosan nanocomposite for efficient glucose biosensor[J]. Process Biochem, 2013, 48(11): 1724-1735.
[48]Ma X, Chao M, Wang Z, et al. Electrochemical determination of Sudan I in food samples at graphene modified glassy carbon electrode based on the enhancement effect of sodium dodecyl sulphonate[J]. Food Chem, 2013, 138: 739-744.
[49]Paton K R, Varrla E, Backes C, et al. Scalable production of large quantities of defect-free few-layer graphene by shear exfoliation in liquids[J]. Nat Mater, 2014, 13(6): 624-630.
[50]Yang B, Liu Z, Guo Z, et al. In situ green synthesis of silver-graphene oxide nanocomposites by using tryptophan as a reducing and stabilizing agent and their application in SERS[J]. Appl Surf Sci, 2014, 316: 22-27.
Recent new development status of modification of graphene and its application in electrochemical detection
WAN Hongli1,2,3, WAN Li1,2, WANG Xianbao1,2, LV Meijiao2, WANG Shimin1,2
(1. Hubei Collaborative Innovation Center for Advanced Organic Chemical Materials,Wuhan 430062, China;2. Key Laboratory for the Green Preparation and Application of Functional Materials, Ministry of Education;Faculty of Materials Science and Engineering, Hubei University, Wuhan 430062, China;3. Ningbo Institute of Materials Technology and Engineering, Ningbo 315201, China)
This article has introduced some basic properties of graphene. It summarizes the surface modification of graphene and its application in the electrochemical detection. This is followed by the discussion of the advantages and disadvantages of different modifying methods. In addition, the comparison between the detection methods using graphene and the traditional methods is also included. The future development of the graphene is also provided.
graphene; surface modification; electrochemical detection; peak current
1001-9731(2016)08-08035-08
国家自然科学基金资助项目(51272071,21402045);湖北省自然科学基金资助项目(2014CFB167,2015CFA118);湖北省科技厅创新群体资助项目(2013CFA005);武汉市科技局关键技术攻关计划资助项目(2013010602010209)
2015-11-10
2016-05-10 通讯作者:万丽,E-mail: wanli1983_3@aliyun.com
万红利 (1993-),女,湖北仙桃人,在读硕士,师承许晓雄研究员和万丽老师,主要从事石墨烯的功能化修饰及其电化学性能研究。
TB34;TB332;TB321
A
10.3969/j.issn.1001-9731.2016.08.006

