MiR-495通过下调PCNA抑制人血管内皮细胞增殖的作用研究
郑华峰 陶晶 张斌 王纯 吴淳
基础研究
MiR-495通过下调PCNA抑制人血管内皮细胞增殖的作用研究
郑华峰 陶晶 张斌 王纯 吴淳
目的 探讨microRNA-495(miR-495)对人血管内皮细胞增殖的作用及其分子作用机制。方法 选择人脐静脉内皮细胞(HUVECs),利用lipofectamine2000转染试剂,将 miR-495 mimics(模拟物)或miR-495 inhibitors(抑制物)转染HUVECs,分别以mimics control和inhibitors control作为对照。通过MTT实验分析过表达或干扰miR-495对HUVECs细胞增殖的影响,进而通过生物信息学软件预测,双荧光素酶报告基因系统,荧光定量PCR及Western blot,预测并验证miR-495靶基因,最后通过功能互补实验,观察提高或敲低增殖细胞核抗原(PCNA)表达对HUVECs细胞增殖的影响。结果 体外细胞增殖实验发现,过表达miR-495可明显抑制HUVECs细胞的增殖,而干扰miR-495则可促进HUVECs细胞的增殖。PCNA是miR-495的靶基因,过表达miR-495可明显下调HUVECs细胞中PCNA mRNA及蛋白表达水平。功能互补实验显示,敲低PCNA的表达亦可降低HUVECs细胞的增殖,反之促进HUVECs细胞的增殖。结论 MiR-495可抑制HUVECs细胞的增殖,其作用机制主要通过下调PCNA的表达而实现。
MiR-495; 人脐静脉内皮细胞; 增殖; 增殖细胞核抗原
缺血性疾病引起的组织缺血和功能障碍与供血不足密切相关,缺血刺激下的自然修复过程常常不足以对抗血管狭窄或闭塞引起的组织血流灌注不足。临床治疗性血管形成主要应用于不适应手术治疗的冠心病、脑及外周血管疾病等缺血性疾病[1,2]。故此,探讨生理和病理状态下血管形成和消退规律及其分子机制,将为缺血性疾病的治疗提供新的实验支持[3]。血管内皮细胞(vascular endothelial cells)是血管内膜主要的构成细胞。研究发现,多种生物活性物质可以调节血管平滑肌细胞的功能,如一氧化氮(NO)、血管紧张素Ⅱ(AngiotensinⅡ,AngⅡ)、血小板衍生生长因子(platelet-derived growth factor,PDGF)和内皮细胞生长因子(vascular endothelial growth factor,VEGF)等[4,5]。
MicroRNAs(MiRNAs)是一类内生性的、长约22个碱基的小分子RNA,主要通过转录后水平调控下游基因表达[6]。大量研究表明,miRNAs可广泛参与胚胎发育、细胞分化、血管生成、肿瘤形成及损伤修复等几乎所有生理病理过程[7,8]。近年来越来越多的研究表明,miRNAs在血管形成过程中也发挥着重要作用,如miR-107具有抑制血管内皮细胞(VSMCs)增殖作用[9];血管形成过程中表达升高的miR-21具有抑制血管内皮细胞增值和分化的作用[10,11];表达降低的miR-92a可显著抑制血管重构过程中血管生成[12]。MiR-495属于miRNAs家族成员之一,目前关于miR-495对血管内皮细胞的作用尚未见研究报道。本研究第一次通过体外细胞实验证明,miR-495具有抑制人血管内皮细胞增殖的作用,并初步探索其分子机制,为研究缺血性疾病中血管形成分子生物学机制奠定新的基础。
1 材料与方法
1.1 试剂和仪器 总RNA提取试剂 Trizol(Invitrogen,USA),反转录试剂盒 TaqMan MicroRNA Reverse Transcription Kit(Takara,Japan),荧光定量试剂盒SYBR premix Ex TaqTMⅡ PCR Kit(Takara,Japan),PCR扩增引物由上海生工公司合成。MiR-495 mimics(5′-UCUUCACGUGGUACAAACAA-3′)及mimics control(5′-UAAUGUCCAUACAAUUAA-3′),miR-495 inhibitors(5′-AGAAGUGCACCAUGUUUGUU-3′)及inhibitors control(5′-CAGUACUUUUGUGUAGUACAA-3′);siPCNA(5′-GAACUGCUUCUAAGAUGCCAGCAUA-3′)及siNC(5′-UUCUCCGAACGUGUCACGUU-3′)均购自苏州吉玛公司。鼠抗人PCNA单克隆抗体(ab29)及抗GAPDH单克隆抗体(ab8245)购自英国Abcam。双荧光素酶检测试剂盒购自Promega公司。细胞培养DMEM培养基及胎牛血清购自美国Invitrogen公司。普通PCR仪(BIO-RAD,USA),NanoDrop 2000c紫外分光光度计(ThermoScientific,USA),LightCycler480荧光定量PCR仪(Roche,Germany)等。
1.2 细胞培养及转染 人脐静脉内皮细胞(HUVECs)购自中科院上海细胞库,在超净台中将用干冰保存的细胞悬液转入含有5 ml配制好的DMEM培养基的15 ml离心管中,轻轻吹打混匀后进行1000 rpm室温下离心5 min,弃上清后再加入5 ml新的培养基轻轻吹打混匀,转入小号无菌细胞培养瓶中,在37℃,5%CO2细胞培养箱中进行培养。体外实验均分为2组,其中实验组分组如下:miR-495 mimics或miR-495 inhibitors,阴性对照组转染mimics control或inhibitors control;siPCNA或pCDNA3.1+PCNA,阴性对照组转染 siNC或 pCDNA3.1+。按照lipofectamine2000转染试剂,48 h后,按照相应实验需要进行处理。
1.3 细胞总RNA提取及cDNA合成 按Trizol试剂所明书,在每1 ml Trizol中加入适量的细胞,冰上充分裂解5 min,之后加入氯仿0.2 ml,充分混匀后室温静置5 min,以12 000 rpm离心15 min,吸去上清后转入新的Eppendorf管中,加入异丙醇0.5 ml,混勾后放置于4℃冰箱10 min。再次在4℃条件下,12 000 rpm离心10 min,去上清后留取沉淀,加入1 ml 75%已经预冷的乙醇,震荡洗涤沉淀RNA,12 000 rpm离心5 min,吸去上清后空气干燥10 min,加入4℃DEPC水以充分溶解。采用NanoDrop 2000c紫外分光光度计对RNA浓度进行测定,并按TaqMan MicroRNA Reverse Transcription Kit试剂盒说明书反转合成cDNA,保存-80℃备用。
1.4 荧光定量PCR实验 按照SYBR premix Ex TaqTMⅡPCR Kit试剂盒说明书,以合成的cDNA作为模版在LightCycler480Ⅱ荧光定量PCR仪上进行荧光定量PCR反应。MicroRNA PCR反应体系为:模版cDNA 1μl,miR-495特异性引物 0.4μl,10× miScript Universal Primer 2μl,2×SYBR premix Ex TaqTMⅡPCR 10μl,miR-495上游引物为 5′-TTCTTCACGTGGTACAAACAA-3′,下游引物为Takara公司试剂盒提供的通用引物;以U6作为内参,U6上游引物为 5′-CTCGCTTCGGCAGCACA-3′、下游引物为5′-ACGCTTCACGAATTTGCGT-3′,加RNase-free water至反应总体积为20μl。PCR反应条件为:95℃15 min,随后95℃10 s,60℃30 s,72℃30 s,共45个循环。以实验所用内参U6作为标准化对照,采用ΔΔCT分析方法计算qPCR仪所得数据[13]。
普通基因PCR反应体系为:模版cDNA 1μl,PCNA上下游引物各 0.8μl,2×SYBR premix Ex TaqTMⅡPCR 10μl,PCNA上游引物为5′-CTGCCTGTAGCGGCGTTGTTGC-3′、下游引物为5′-GGCCTCGTTGATGAGGTCCTTG-3′;以GAPDH为内参,GAPDH上游引物为5′-ACAGTCAGCCGCATCTTCT-3′、下游引物为5′-ACTCCGACCTTCACCTTCC-3′,加RNase-free water至反应总体积为20μl。PCR反应条件为:95℃2 min,随后95℃10 s,60℃20 s,72℃10 s,共45个循环。以实验所用内参GAPDH作为标准化对照,采用ΔΔCT分析方法计算qPCR仪所得数据[13]。
1.5 细胞生长实验 将培养好的HUVECs使用96孔板进行铺板,每孔细胞数约达5000个,之后进行转染 miR-495 mimics或 mimics control,miR-495 inhibitors或 inhibitorscontrol;siPCNA 或 siNC,pCDNA3.1+PCNA或pCDNA3.1+。48 h后,所培养细胞每孔连续4 d每天加入 16μl MTT(5 g/L, Sigma-Aldrich,St.Louis,MO)与细胞共孵育4 h,弃去上清,最后以150μl二甲亚砜溶解,测450 nm波长时的吸光度,各组求均值做生长曲线。
1.6 MiR-495靶基因生物信息学预测 采用mi-Randa、TargetScan和PicTar等生物信息学数据库预测miR-495的靶基因。
1.7 双荧光素酶报告基因构建 以合成的cDNA作为模板,按以下引物扩增靶基因PCNA mRNA 3′-UTR区域。利用引物分析软件Primer Premier 5.0设计针对PCNA mRNA 3′-UTR的引物,上、下游引物分别引入限制性内切酶XhoI和NotI识别位点。上游引物为 5′-GCATTCTTAAAATTCAAGAAAATAA-3′(XhoI),下游引物为5′-TGATGTTTGAAATTCAAGTAACTT-3′(NotI)。PCR扩增产物使用Xhol+Not1双酶切后,接入同样经过Xhol+Not1双酶切的双荧光素酶报告载体psiCHECK2中,将连接好的重组质粒转化大肠杆菌感受态,使用PCR鉴定菌落。将含有目的片段的菌落进行摇菌,按照质粒提取试剂盒方法提取质粒,将提取好的质粒送上海生工公司进行序列验证。PCNA mRNA 3′-UTR结合miR-495的互补序列进行AAACAA到GGGAGG点突变,此序列由上海生工生物工程有限公司制备,并经测序验证。
1.8 双荧光素酶报告基因实验 HUVECs细胞培养后,按一定细胞数进行24孔板铺板,当细胞密度达到55%~75%时,进行细胞转染,共同转染psiCHECK2-PCNA-WT(野生型)、psiCHECK2-PCNA-MUT(突变型)和miR-495 mimics到HUVECs细胞。转染6 h后换液,24 h后裂解细胞,按照Dual-LuciferaseRReporter Assay System(Promega)试剂盒说明进行实验,分别检测萤火虫及海肾的荧光值,验证靶基因是否正确。
1.9 Western blot 将提取好的蛋白使用BCA定量试剂盒定量到2.5 μg/μl,按比例加入5×SDS上样缓冲液,105℃加热15 min使蛋白完全变性。制备SDS聚丙烯酰胺凝胶,每孔上样量20μl,常规电泳、转膜、封闭,加入抗PCNA抗体(ab29,1∶1000稀释),4℃过夜孵育及相应的二抗(1∶10 000稀释)室温孵育1 h,TBST洗涤3次,ECL发光液处理后暗室内曝光胶片,于室温下自然风干,扫描仪扫描结果保存。
1.10 统计学方法 统计分析采用SPSS 17.0软件。计量数据以±s表示,两组均数比较采用两个独立样本的Student′s t检验,细胞增殖实验采用ANOVA检验。P<0.05认为差异有统计学意义。

图1 MiR-495对HUVECs细胞增殖的影响(n=3),a代表P<0.05
2 结果
2.1 MiR-495对HUVECs细胞增殖的影响 MiR-495对HUVECs细胞增殖曲线见图 1。MiR-495 mimics转染组HUVECs细胞增殖速度相对mimics control组明显下降,miR-495 mimics转染组转染1、2、3 d后 HUVECs细胞生长抑制率分别为3.35%、7.29%和11.08%;miR-495 inhibitors转染组HUVECs细胞增殖速度相对inhibitors control组明显增加,miR-495 inhibitors转染组转染1、2、3 d后HUVECs细胞生长促进率分别为4.64%、6.29%和13.32%。
2.2 MiR-495靶基因生物信息学预测结果 利用miRanda、TargetScan和PicTar等数据库分析miR-495的靶标基因,结果发现PCNA为miR-495的靶标基因之一;进一步结合相关参考文献,我们猜测PCNA是miR-495的靶基因。MiR-495与PCNA mRNA 3′-UTR结合区域预测见图2。
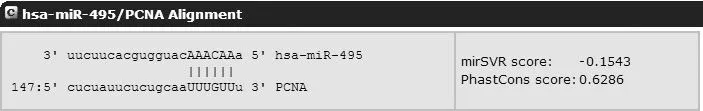
图2 MiR-495与PCNA mRNA 3′-UTR结合区域预测
2.3 靶基因PCNA荧光素酶试验 按照 lipofectamine2000说明书,miR-495 mimics和mimics control分别与psiCHECK2-PCNA-WT和psiCHECK2-PCNA-MUT转染 HUVECs细胞。24 h后利用Promega双荧光素酶报告基因检测试剂盒进行萤火虫及海肾的荧光值测定。结果见图3,发现miR-495可以与PCNA mRNA的3′-UTR结合,当结合部位突变后,上述结合能力消失。
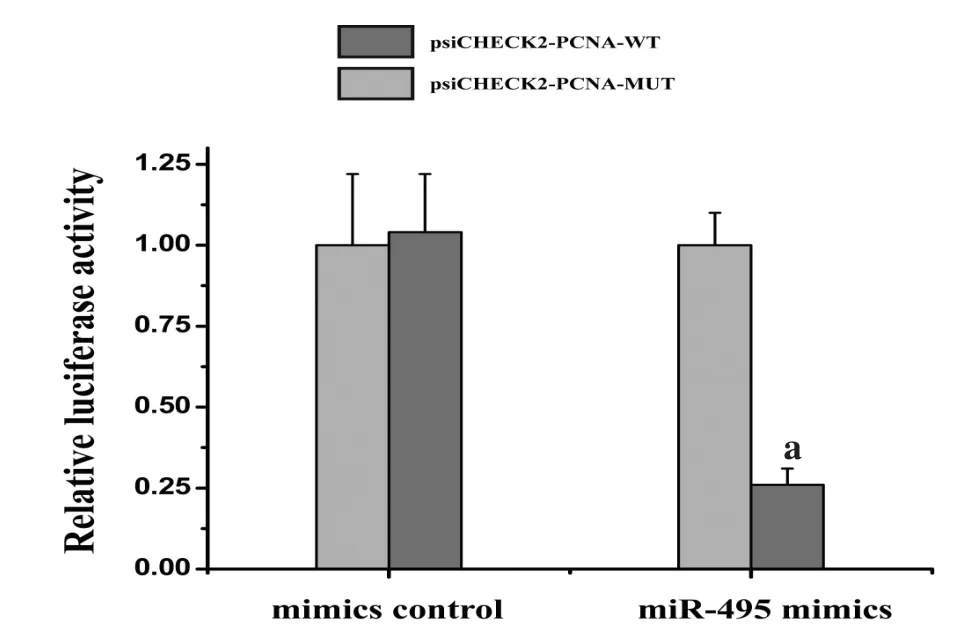
图3 靶基因PCNA荧光素酶试验(n=3),a代表P<0.05
2.4 MiR-495对靶基因PCNA mRNA及蛋白水平的调控 按上述方法转染miR-495 mimics后,经荧光定量PCR扩增得到各目的基因的Ct值,以2-ΔΔCT相对定量的方法分析各基因与GAPDH拷贝数的比值,比较miR-495 mimics和mimics control的差异,结果见图 4。HUVECs细胞中 miR-495mimics转染48 h后,靶基因PCNA mRNA表达水平明显下降;同样Western blot结果显示,miR-495 mimics组PCNA蛋白表达水平亦明显降低。
2.5 PCNA对HUVECs细胞增殖的影响 HUVECs细胞增殖曲线见图5。siPCNA转染组细胞增殖速度相对siNC组明显下降,siPCNA转染组细胞转染后1、2、3 d细胞生长抑制率分别为6.29%、8.29%和14.62%;而pCDNA3.1+PCNA转染组细胞转染后1、2、3 d细胞生长促进率分别为4.63%、9.52%和16.28%。
3 讨论
越来越多的研究表明,miRNAs参与了缺血性疾病中血管形成及重塑过程。体外实验发现,miR-135b-5p、miR-499a-3p以及miR-206等均可直接促进血管内皮细胞增殖[14,15]。相反,另一些miRNAs如miR-29c、miR-92a及miR-19b/221/222等具有抑制血管内皮细胞增殖的作用[16-18]。本研究以人脐静脉内皮细胞作为实验对象,主要因为人脐静脉内皮细胞是一种干细胞,其与人血管内皮细胞功能十分相似,但具有无限次传代能力且易于实验操作[19]。
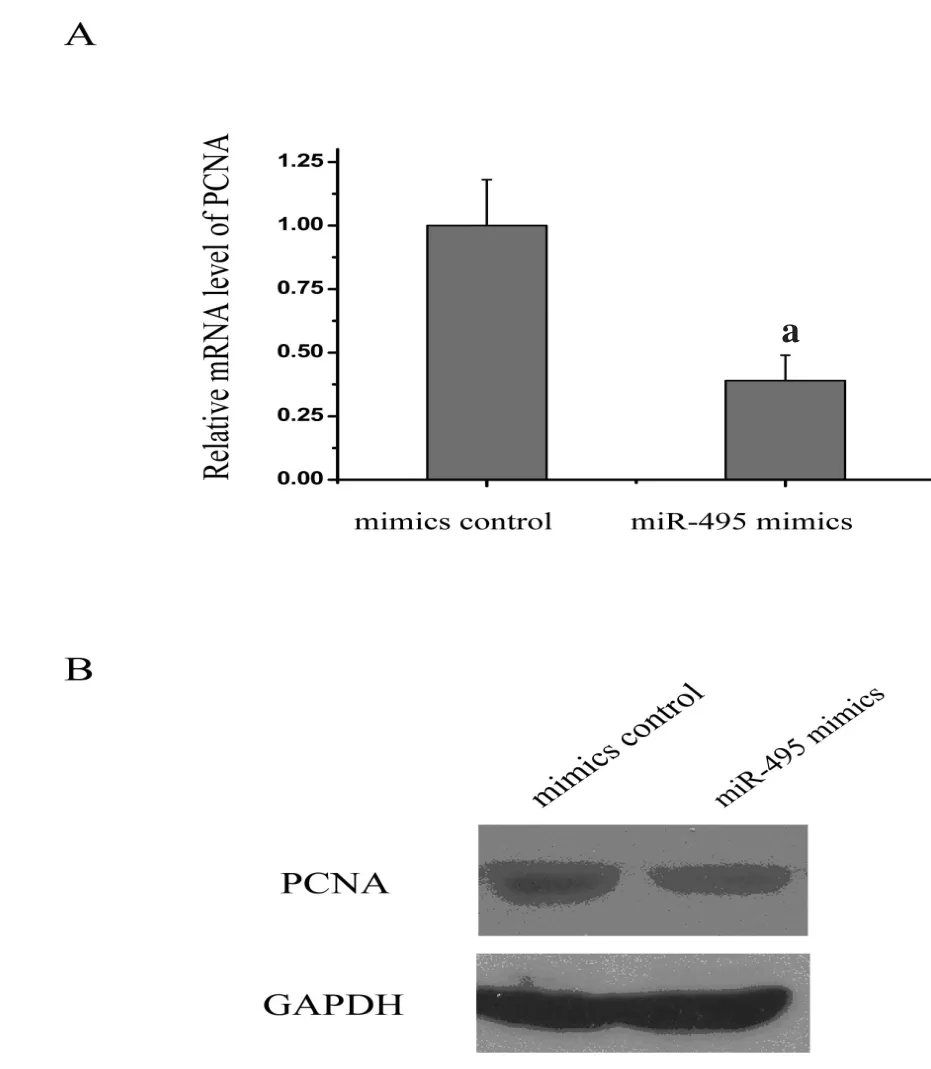
图4 MiR-495对靶基因PCNA mRNA及蛋白水平的调控(A:mRNA;B:蛋白)(n=3),a代表P<0.05
MiR-495定位于人17q11.2。到目前为止,关于miR-495的研究主要集中在肿瘤的各个方面,如miR-495在乳腺癌和淋巴瘤中明显低表达,并发挥抑癌基因的作用[20,21]。MiR-495通过下调MTA3基因可显著抑制非小细胞肺癌的增殖与迁移[22]。MiR-495可抑制胶质瘤及胃癌的迁移及侵袭能力[23,24]。目前关于miR-495在人血管内皮细胞的研究尚未见相关报道。
本研究通过体外MTT实验,首次证明miR-495具有直接抑制血管平滑肌细胞增殖的作用。实验发现,过表达miR-495可显著抑制HUVECs细胞的增殖,而干扰miR-495则具有促进HUVECs细胞增殖的作用。大量研究证实,miRNAs对靶标基因独特的作用机制主要通过与靶标基因 3′-UTR区域结合,从而抑制靶标基因表达[7]。通过分析PCNA mRNA的3′-UTR序列,并结合生物信息学分析,我们发现人PCNA mRNA 3′-UTR区域存在miR-495的结合位点。进一步双荧光素酶报告基因实验显示,转染miR-495 mimics对psiCHECK2-PCNA-WT荧光素酶活性有明显抑制作用,而对psiCHECK2-PCNA-MUT荧光素酶活性无影响。同时,荧光定量PCR和Western blot分析发现,过表达miR-495可明显降低靶基因PCNA mRNA及蛋白表达水平。
增殖细胞核抗原(PCNA)是由Miyahci等于1978年首次从系统性红斑狼疮患者的血清中发现的。经研究发现,PCNA与细胞DNA合成关系密切,在细胞增殖过程中起重要调控作用。最近研究报道,PCNA亦可参与许多其他细胞重要活动,如细胞周期调控、细胞DNA损伤修复、细胞凋亡、染色体重组及DNA甲基化等。体外功能互补实验发现,干扰PCNA的表达可降低HUVECs细胞的增殖,而过表达PCNA则促进HUVECs细胞的增殖。上述结果与过表达或干扰miR-495基本一致,表明miR-495可通过下调PCNA抑制人血管内皮细胞增殖。

图5 PCNA对HUVECs细胞增殖的影响(n=3),a代表P<0.05
综上所述,本实验首次揭示了miR-495可通过下调PCNA抑制人血管内皮细胞增殖。MiR-495为研究缺血性疾病中血管形成分子生物学机制奠定了新的基础。
[1]Zimna A,Kurpisz M.Hypoxia-Inducible Factor-1 in Physiological and Pathophysiological Angiogenesis:Applications and Therapies.Biomed Res Int,2015,2015:549412.
[2]Moon HE,Byun K,Park HW,et al.Comp-Ang1 Potentiates Epc Treatment of Ischemic Brain Injury by Enhancing Angiogenesis through Activating Akt-Mtor Pathway and Promoting Vascular Migration through Activating Tie2-Fak Pathway.Exp Neurobiol,2015,24:55-70.
[3]Sanada F,Taniyama Y,Kanbara Y,et al.Gene Therapy in Peripheral Artery Disease.Expert Opin Biol Ther,2015,15:381-390.
[4]Yi B,Ozerova M,Zhang GX,et al.Post-Transcriptional Regulation ofEndothelialNitric Oxide Synthase Expression by Polypyrimidine Tract-Binding Protein 1.Arterioscler Thromb Vasc Biol,2015,10:2153-2160.
[5]Lu W,Xiu X,Zhao Y,et al.Improved Proliferation and Differentiation of Bone Marrow Mesenchymal Stem Cells into Vascular EndothelialCellswith Sphingosine1-Phosphate.Transplant Proc,2015,47:2035-2040.
[6]Zhou X,Yang PC.Microrna:A Small Molecule with a Big Biological Impact.Microrna,2012,1:1.
[7]Lim LP,Lau NC,Garrett-Engele P,et al.Microarray Analysis Shows That Some Micrornas Downregulate Large Numbers of Target Mrnas.Nature,2005,433:769-773.
[8]Ivey KN,Srivastava D.Micrornas as Developmental Regulators. Cold Spring Harb Perspect Biol,2015,7:a008144.
[9]Meng S,Cao J,Wang L,et al.Microrna 107 Partly Inhibits Endothelial Progenitor Cells Differentiation Via Hif-1beta.PLoS One,2012,7:e40323.
[10]Guo Y,Li P,Bledsoe G,et al.Kallistatin Inhibits Tgf-Beta-Induced Endothelial-Mesenchymal Transition by Differential Regulation of Microrna-21 and Enos Expression.Exp Cell Res,2015,337:102-110.
[11]Jiang FS,Tian SS,Lu JJ,et al.Cardamonin Regulates Mir-21 Expression and Suppresses Angiogenesis Induced by Vascular Endothelial Growth Factor.Biomed Res Int,2015,501581.
[12]Iaconetti C,Polimeni A,Sorrentino S,et al.Inhibition of Mir-92a Increases Endothelial Proliferation and Migration in Vitro as Well as Reduces Neointimal Proliferation in Vivo after Vascular Injury,Basic Res Cardiol,2012,107:296.
[13]Schmittgen TD,Livak KJ.Analyzing Real-Time Pcr Data by the Comparative C(T)Method.Nat Protoc,2008,3:1101-1108.
[14]Xu Z,Han Y,Liu J,et al.Mir-135b-5p and Mir-499a-3p Promote Cell Proliferation and Migration in Atherosclerosis by Directly Targeting Mef2c.Sci Rep,2015,5:12276.
[15]Tang Y,Zhang Y,Chen Y,et al.Role of the Microrna,Mir-206,and Its Target Pik3c2alpha in Endothelial Progenitor Cell Function-Potential Link with Coronary Artery Disease.FEBS J,2015,282:3758-3772.
[16]Hu Y,Deng F,Song J,et al.Evaluation of Mir-29c Inhibits Endotheliocyte Migration and Angiogenesis of Human Endothelial Cells by Suppressing the Insulin Like Growth Factor 1.Am J Transl Res,2015,7:489-501.
[17]Zhang L,Zhou M,Qin G,et al.Mir-92a Regulates Viability and Angiogenesis of Endothelial Cells under Oxidative Stress. Biochem Biophys Res Commun,2014,446:952-958.
[18]Xue Y,Wei Z,Ding H,et al.Microrna-19b/221/222 Induces Endothelial Cell Dysfunction Via Suppression of Pgc-1alpha in the Progression of Atherosclerosis.Atherosclerosis,2015,241:671-681.
[19]Wang L,Dong Z,Zhang Y,et al.The Roles of Integrin Beta4 in Vascular Endothelial Cells.J Cell Physiol,2012,227:474-478.
[20]Wang L,Liu JL,Yu L,et al.Downregulated Mir-45 Inhibits the G1-S Phase Transition by Targeting Bmi-1 in Breast Cancer.Medicine(Baltimore),2015,94:e718.
[21]Jiang X,Huang H,Li Z,et al.Mir-495 Is a Tumor-SuppressorMicrorna Down-Regulated in Mll-Rearranged Leukemia.Proc Natl Acad Sci U S A,2012,109:19397-19402.
[22]Chu H,Chen X,Wang H,et al.Mir-495Regulates Proliferation and Migration in Nsclc by Targeting Mta3,Tumour Biol,2014,35:3487-3494.
[23]Li Z,Zhang G,Li D,et al.Methylation-Associated Silencing of Mir-495 Inhibit the Migration and Invasion of Human Gastric Cancer Cells by Directly Targeting Prl-3.Biochem Biophys Res Commun,2015,456:344-350.
[24]Nie S,Li K,Huang Y,et al.Mir-495 Mediates Metabolic Shift in Glioma Cells Via Targeting Glut1.J Craniofac Surg,2015,26:e155-158.
MiR-495 inhibits human vascular endothelial cells proliferation by down-regulating PCNA
ZHENG Hua-feng,TAO Jing,ZHANG Bin,et al.Department of Cardiology,Peking University Shenzhen Hospital,Shenzhen 518036,China
WU Chun,E-mail:wuchun2012@163.com
Objective To investigate MicroRNA-495(miR-495)inhibits human vascular endothelial cells proliferation,and clarify its molecular mechanism.MethodsWe applied human umbilical vein endothelial cells(HUVECs)and cultured in Dulbecco′s modified Eagles mediu(DMEM).MTT assay was used to explore theproliferation ability of HUVECs,after transfected with miR-495 mimics or miR-495 inhibitors,with mimics control or inhibitors control as experimental control.Bioinformatics,luciferase reporter assay,Quantitative RT-PCR and Western blot analyses were used to predict and verify miR-495 target in HUVECs.Finally,HUVECs proliferation was also detected by using MTT assay after knock-down or over-expression PCNA(proliferating cell nuclear antigen).ResultsOver-expression of miR-495 could significantly inhibit HUVECs proliferation,while interfering miR-495 expression could promote its proliferation in vitro.PCNA was a target gene of miR-495 in HUVECs and its mRNA and protein expression levels were significantly decreased after transfected with miR-495 mimics.Functions complementary experiments showed that knock-down PCNA could also arrest the HUVECs proliferation,and over-expression PCNA promoted cells proliferation.ConclusionMiR-495 could inhibit HUVECs cells proliferation,and its mechanism of action mainly executed by suppressing expression of PCNA.
MiR-495; HUVECs; Proliferation; Proliferating cell nuclear antigen
518036 广东省深圳市,北京大学深圳医院心内科
吴淳,E-mail:wuchun2012@163.com
10.3969/j.issn.1672-5301.2016.04.023
R54
A
1672-5301(2016)04-0374-06
2015-11-16)

