“问题链”教学模式在高中化学基本理论复习中的实践与应用
施小萍



[摘 要]
针对高中化学基本理论的考查情况与复习基本现状,将问题链教学模式应用到高中化学基本理论的复习中。依据“问题链”的分类、问题设计的基本原则,以"问题链"模式组织化学基本理论复习的教学,引导学生在解决问题的过程中提高学习效率,从而提高学生提出问题和解决问题的综合能力。
[关键词]
问题链;教学模式;化学基本理论复习
一、问题链教学模式
现代教育学理论认为,当学生遇到问题和挑战时,学得最好。一个好的问题必定能引起学生的深入思考,因此教师可以通过设置有一定难度,有明确目标,需要学生做出一定努力才能完成学习任务的问题,使学生处于一种急迫想要解决所面临问题的心理困境中,使学生产生强烈的探究欲望,从而创造性地解决问题。
(一)问题教学的相关理论
“学习总是从问题开始,问题总是与学习伴行,所有问题解决必定以对问题存在的认识为开始”。现代教育理论认为,问题教学,可以激发学习的动机和欲望。所谓问题教学,就是以问题为载体贯穿教学过程,使学生在设问和释问的过程中萌生自主学习的动机和欲望,进而逐渐养成自主学习的习惯,并在实践中不断优化自主学习的过程和方法,提高自主学习能力的一种教学方法。
《化学课程标准》课程目标中指出:具有较强的问题意识,能够发现和提出有探究价值的学科问题,敢于质疑,勤于思索,逐步形成独立思考的能力。在新课程深化改革化学学科倡导以问题为引领的教学,以问题解决来建构对知识的理解,从而培养学生思维水平向着高水平发展,笔者依据“课标”以及“考试说明”,在高三复习课中尝试采用了问题链教学模式,将每个考点分解并设计成富有层次性和一定思维容量的问题链,用问题激活学生原有的认知和思维,使学生积极参与课堂。
(二)问题链的概念界定
所谓“问题链”,是教师为了实现一定的教学目标,从学生的已有知识或经验出发,针对学生学习过程中将要产生或可能产生的困惑,将知识点转换成为层次鲜明、具有系统性的一连串的教学问题;是一组有中心、相互关联而又逐步递进的问题。从形式上看,“问题链”是一问接一问,一环套一环;从内容上看,它是问问相连,环环紧扣;从目标上看,它是步步深入,由此及彼。是师生双方围绕环环相扣的问题的情境,进行多元的、多角度的、多层次的共同学习。
(三)问题链的分类
从各个不同的维度,“问题链”可以有多种不同的分类。比如按其教学功能分,可以分为以旧引新性问题链,巩固性问题链,理解性问题链,归纳性问题链等;从呈现方向看可以分为正向链,逆向链,双向链;从适用过程看可以分为导入链,衔接链,发散链;从问题表现形式看,可以分为图表链,图文链等等。但是在高三的实践教学中,笔者认为,往往不是某单一类型的问题链,而是多种类型问题链的综合运用。
(四)问题链的设计的基本原则
中学化学教学“问题链”的设计立足培养学生科学素养,教学时应根据新课程的培养目标、内容特征、学生已有的经验和认知特点等方面综合考虑,在设计化学教学“问题链”时,应充分体现基础性、有序性、情境性、开放性、多维性和整体性等原则。
1.充分体现基础性的原则
奥苏贝尔认为,“影响学习者的唯一重要因素,就是学习者的已知。”问题链设计的基础性原则就是要根据学生发展的需要以及学生已有的认知特点和认知体验展开问题线索,要处理好问题的“障碍”和“基础性要求”的关系。问题的设计要符合学生的实际情况,要有一定的思维容量,要能激发学生的学习积极性,并且通过学生的努力能解决问题。问题设计的跨度太大,学生总是答不上来,会有受挫感,久而久之失去学习的积极性。问题设计太简单,学生会觉得没有挑战,专注度就会游离课堂之外。通过设置接近学生“最近发展区”的问题,让学生通过思考能够回答出来,帮助学生获得知识探索的成功,尝到成功的喜悦,由被动学习变为主动学习,从而激发学习的兴趣。对于基础较好、能力较强的学生问题设置可以宽泛,留足学生的思考和发挥的空间,知识和能力的综合程度可以高一点。对于基础薄弱的学生,问题设计的台阶铺设得更多一点,综合程度小一点,要有梯度和递进。
2.问题设计有序性和整体性原则
问题链是教学环节紧紧相扣若干个小问题的集合体,服务于教学内容的落实,因此问题要围绕一个中心整体呈现。问题表述要简洁、明了,可接受性强,避免填空式、习题化的现象,保证学生思维的深刻性和流畅性,避免把学生和教师框死,造成教学过程的僵化。问题要由易到难、由简到繁、由浅入深、环环紧扣地组成问题链,引导学生思维逐步深入,因此问题的设计要有有序性。问题的综合性体现在问题设置要有较大的思维容量,从内容呈现上来说,要能将不同模块的知识进行有机的整合,同一模块中各个知识点进行有机的整合,对知识的应用具有较高的综合性。
3.具有情境性的原则
问题链的设计必须符合客观事实,其中包括所涉及的科学事实、化学知识、化学思想和方法的真实性,在“问题链”设置过程中,要把化学学科的研究方法(如实验、模型、分类、比较、类比等)和化学思维(如守恒、绿色环保等)渗透在其中,坚持“授人以鱼不如授人以渔”的原则,在落实三维目标中培养学生的学科素养。问题链的设计要在真实或接近真实情境中,激发学生的求知欲,令学生感受到学有所用。问题情境的来源丰富,如已有的经验、生活和生产实际、与化学相关的社会热点问题、科学技术的发展前沿、化学史实等,使学生更加理解所学内容的现实意义,学会利用书本知识解决生产生活中的实际问题,体现知识的生活化,趣味性。
除上述原则以外,问题链的设计还应兼顾教学过程多样性、开放性和分层性,问题链的呈现形式多样,课堂上的问题链大多可以用教师叙述、幻灯片、讨论等形式(如实验观察分析、概念辨析、类比迁移等)。问题能使不同层次的学生通过努力而有所收获,能满足不同层次学生的需求,使学优生从中感到挑战,学困生从中感受到激励,从而让学生能体会到成功的喜悦,增强学生的合作意识和创新意识。
二、问题链教学模式在高中化学基本理论复习中的教学实践
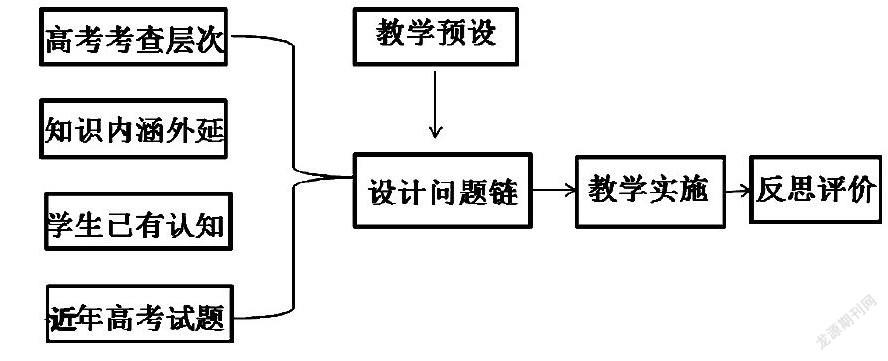
在高三化学基本理论的复习中,教师应根据不同教学内容的难度差异,学生已有的知识基础、高考的考试要求层次等方面综合分析,设计不同形式的问题链,以满足化学理论专题复习的需求。笔者在高中化学基本理论复习的教学实践中将“问题链”教学模式构想如下:
教学案例1:化学反应中的能量变化
问题1:工业上可以用氨气检验输送氯气的管道是否漏气,其反应原理是什么?请写出相关的化学方程式。
问题2:上述两个反应究竟哪一个可以用于检验,理由是什么?
问题3:2NH3+3Cl2=N2+6HCl该反应能否自发进行?你有什么事实依据吗?判断反应能否自发进行的理论依据是什么?
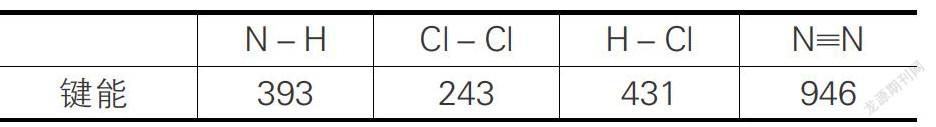
问题4:如何用下列表格中键能的数据计算2NH3+3Cl2=N2+6HCl这一反应的ΔH?
问题5:请写出该反应的热化学方程式。
问题6:归纳判断热化学方程式是否正确的角度有哪些?
问题7:已知该反应是放热反应,请判断反应物和生成物能量的相对大小?并从物质能量角度画出能量图。
学生作图展示:
问题8:假使该反应是需要催化剂的,请在第二张能量图基础上画出有催化剂时候的能量图。
问题9:请归纳总结键能角度、物质能量角度、活化能角度计算反应ΔH有什么异同?
问题10:我们已经推导出2NH3+3Cl2=N2+6HCl是自发进行的,那么8NH3+3Cl2=N2+6NH4Cl这一方程能自发进行吗?如何判断8NH3+3Cl2=N2+6NH4Cl这一反应的ΔH?
问题11:上述两个反应有什么共同点?这一类反应的本质是什么?
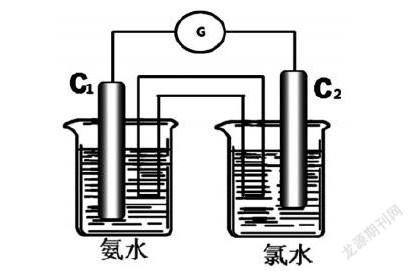
问题12:你能设计特定的装置来证明有电子转移吗?
问题13:你认为同学所画的装置图有什么优缺点?
点评归纳学生的装置图后投影展示(见下图),并按下图组建装置演示实验。
问题14:该装置中的电极名称是什么?电子如何移动?盐桥的作用是什么和阴阳离子定向移动的方向如何?写出两极的电极反应方程式。
【反思评价】:这一节课的设计主要以问题链为推手层层推进,以递进链为主,辅以发散链,将原本看似没有太大联系的元素化合物知识,与化学反应的方向,能量变化的原因,热化学方程式的书写,电化学的内容用氨气和氯气的反应整合在一起,实现了不同模块之间的有机整合。问题的设计具有综合性,这符合高三学生的特点,学生具备一定的基础知识和综合能力。问题的设计具有开放性,不同层次的学生可以画出不同类型的原电池,满足不同层次的学生的需求。能量变化的原因分析也是层层递进,环环相扣,并且巧妙地应用了盖斯定律来解决实际的问题,课堂内学生一直保持适度的紧张感。另外高三的化学课堂以做题讲题解决问题为主,相对比较枯燥,此处还增加了一个演示实验,不仅可以创设逼真的问题情境,还能增设课堂教学的兴奋点,从而有效地激发学生的学习动机,大大提高学生的学习兴趣,复习教学的效率得到有效的保证。整节课下来学生的学习积极性较好,课堂氛围较好,复习效果也不错。
教学案例2:弱电解质的电离平衡
例:已知某二元酸H2A,其电离方程式为H2A=H++HA—;HA—[]H++A2—。
问题1.H2A是强酸还是弱酸?
问题2.NaHA的水溶液呈性。(酸性、碱性、中性)
问题3.写出NaHA溶液中溶质的电离平衡常数表达式。
问题4.在温度25℃时:
①得0.1mol/L的NaHA溶液中c(H+)=0.01mol/L,该条件下HA—的电离度:______
②判断0.1mol/L的H2A的溶液中c(H+)______0.11mol/L(>,<,=),理由是______
③计算HA—[]H++A2-的电离平衡常数。
④若要使溶液中c(A2—)=c(HA-),应控制溶液的PH=______
问题5.在25℃下,加水稀释NaHA溶液,下列各项如何改变
A.n(H+) B.PH C.KW D.c(A2—)
E.c(H+)/c(HA-) F.c(A2-)/c(H+)
问题6.在温度25℃时,0.1mol/L的NaHA溶液中,加入下列物质①水②0.1mol/L的NaOH溶液③ 0.1mol/L的Na2A溶液,画出溶液的PH随着加入溶液体积的变化图。
问题7.求a点(PH=7)时c(A2-)/c(HA-)的浓度之比。
问题8.25℃时,0.1mol/L的NaHA溶液中,下列关系式正确的是:
A.c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.c(H+)=2c(A2-)+c(OH-)
D.c(HA-)+c(A2-)+c(H2A)=0.1mol/L
问题9.用NaOH调节上述溶液PH=6时,计算上述溶液中c(A2-)的精确值。
问题10.用0.1mol/LNaOH滴定20ml0.1mol/L的NaHA溶液:
①画出滴定曲线
②最好选用什么做指示剂?
③c点的离子浓度从大到小的顺序是
④e点的溶液中.c(Na+)c(HA-)+c(A2-)(填<,>,=)
【反思评价】:这一节课的问题链设计以“聚焦问题链”为主,紧紧围绕弱电解质的电离平衡这一中心,以“发散问题链”为辅,从弱电解质电离的平衡移动,平衡常数的计算,中和滴定,离子浓度大小的比较,溶液中的三大守恒关系等各个角度设计问题,以H2A这种酸及其酸式盐、正盐为载体,贯穿整节课,精选题目优化问题链设计。从课后笔者对学生的访谈来看,用H2A这一酸来设问,首先打破了学生对原有的熟悉的酸的认识,有了一个崭新的问题情境,不再有炒冷饭的感觉。其次学生认为这节课的思维容量明显增加,经过问题链的持续驱动,将相关的知识基本“连成线,结成网”,基础知识整体框架和脉络更加清晰。
四、结束语
高中化学基本理论部分注重思维品质的培养,与元素化学物部分有比较大的差异,因此在复习过程中要重点关注学生思考的力度、广度和深度,培养学生主动思维意识和探究能力。笔者应用问题链教学模式开展基本理论复习后,明显增强了学生的学习积极性和课堂参与度,取得预期的教学效果。当然针对不同专题的基本理论如何设计更加科学合理的问题链,是今后的教学中持续深入探讨的课题。
[参 考 文 献]
[1]曹旭琴.知识问题化 问题情境化[J].化学教学,2014(12).
[2]王后雄.“问题链”的类型及教学功能—以化学教学为例[J].教育科学研究,2010(5).
(责任编辑:张华伟)

