原位衍生化-分散液液微萃取-气相色谱法测定环境水样中酚类物质的含量
陈敏儿
(福建省漳州市东山县环保局,福建漳州 363400)
原位衍生化-分散液液微萃取-气相色谱法测定环境水样中酚类物质的含量
陈敏儿
(福建省漳州市东山县环保局,福建漳州 363400)
本研究建立了原位衍生化-分散液液微萃取-气相色谱测定水样中酚类化合物含量的方法,并考察了衍生化反应过程以及萃取过程的相关因素对实验结果的影响。实验结果表明最佳条件为:在5 mL 分析水样中(pH=7.00),加入800 μL衍生剂乙酸酐,置于50 ℃水浴中加热30 min,猝冷至室温后,以200 μL二氯甲烷为萃取剂,以10 μL甲醇为分散剂,密封后振荡后离心5 min,取1.00 μL萃取液进行分析。本法线性范围为0.02~4.00 μg/mL,相关系数R2≥0.9951,方法检出限为1.98 μg/L。实际水样测定的相对标准偏差≤6.90%,回收率为59.6%~119.2%。
衍生化,分散液液微萃取,气相色谱法,酚类化合物
在人类的生产生活当中,排放至水体中的多种污染物质均会对水体的水质造成损害,其中酚类物质属于常见的水体污染物之一[1-2]。酚类物质属于高毒性的化学物质,对一切生物个体都有毒害作用,它可通过皮肤及黏膜的接触而吸入或经口腔浸入生物体内,与细胞原浆中的蛋白质接触后形成不溶性蛋白质而使细胞失去活性,如果人长期饮用含酚类物质的水源,便会出现贫血、瘙痒、头昏、出疹以及神经系统障碍等多种慢性中毒症状[3-5]。
目前,多种技术被用于测定水样中的酚类化合物的含量,包括气相色谱法[6]、分光光度法[7]、比色法[8]、薄层色谱法[9]和液相色谱法[10],其中气相色谱法,是较为常用的方法。应用气相色谱法分析样品物质的含量时,样品前处理技术是关键,分散液液微萃取技术(Dispersive Liquid-liquid Microextraction,DLLME)是由Y.Assadi等[11]于2006年提出的一种新型样品前处理技术,具有操作简单、快速、成本低、富集效率高且环保等特点。另外,使用气相色谱测定酚类化合物时,有两方面的问题需要解决:一是改善酚类化合物的色谱行为,二是提高测定方法的灵敏度。由于酚类物质极性强,水溶性好,在水样中形成离子状态,不利于萃取,故一般检出限较高。为了提高测定方法的灵敏度,许多学者采用提高溶液的酸度以减小酚类化合物的电离性,或者增大样液的离子强度降低酚类化合物在水中的溶解度,改善萃取效果,但这两种方法的效果不显著,且酚羟基在色谱柱中的拖尾现象并未得到改善。衍生化技术通过衍生试剂与酚类物质发生衍生化反应并转化为更适合气相色谱分析的衍生物解决上述水溶性和分析困难等问题。鉴于衍生化技术和DLLME萃取技术的优点,本文建立了原位乙酰化-分散液液微萃取-气相色谱测定水样中酚类物质的方法,探讨和优化了测定的最佳条件。
1 材料与方法
1.1材料与仪器
标准溶液1 mg/mL 酚类化合物(苯酚,邻苯二酚,间苯二酚,对苯二酚,邻硝基苯酚,间硝基苯酚,对硝基苯酚)的乙醇储备液置于0 ℃冷藏,使用时配制成一定浓度的混合标准溶液;实验用水超纯水;其他试剂均为色谱纯。
Shimadzu 14C气相色谱仪FID检测器,日本岛津公司;Rtx-50 毛细管色谱柱 30 m×0.25 mm×0.25 μm美国Rtstek公司;80-2型离心机上海手术器械厂;Mili-Q超纯水系统美国Milipore公司。
1.2色谱参数
载气和尾吹气:N2(99. 999%);进样口温度300 ℃,柱前压200 kPa;色谱柱升温程序:40 ℃(4.0 min)→20 ℃/min→280 ℃(4.0 min);FID温度:300 ℃;Air压力50 kPa,H2压力60 kPa;采用无分流进样(4 min),进样体积:1.00 μL。
1.3实验步骤
1.3.1衍生化反应准确移取5 mL浓度为0.1 mol/L的Na2HPO4水溶液(pH=7.00)于离心管中,用微量进样器加入5.00 μL 1.00 mg/mL酚类混合标准乙醇溶液,混匀,得1.00 μg/mL的混合标准水溶液,后加入800 μL乙酸酐,密封后振荡1 min,于50 ℃水浴中加热30 min。
1.3.2分散液液微萃取猝冷至室温后,往离心管中加入200 μL二氯甲烷作为萃取剂,10 μL甲醇作为分散剂,密封后剧烈振荡1 min,使之形成乳浊液体系,离心5 min,使萃取剂二氯甲烷与水相完全分层,取1.00 μL二氯甲烷进行GC分析,所得谱图如图1所示。
1.3.3实验条件优化本实验固定其他条件不变,采取单因素选优法,考察了衍生化试剂乙酸酐添加量分别为400~900 μL,反应温度40~90 ℃,反应时间30~60 min 时酚类的衍生化效果。并且考察了不同萃取剂种类(二氯甲烷、氯仿、四氯化碳、氯苯)、不同种类的分散剂(甲醇、乙醇、丙酮、乙腈)、萃取剂用量为200~400 μL、分散剂用量分别为0~15 μL及盐度为0~20%的萃取效率。
2 结果与讨论
2.1酚类混标乙酰化后DLLME的色谱图
根据步骤1.2的色谱参数设定和步骤1.3所描述的实验方法,所得谱图如图1所示。可见其萃取效果十分良好,色谱分离效果也符合分析检测要求。
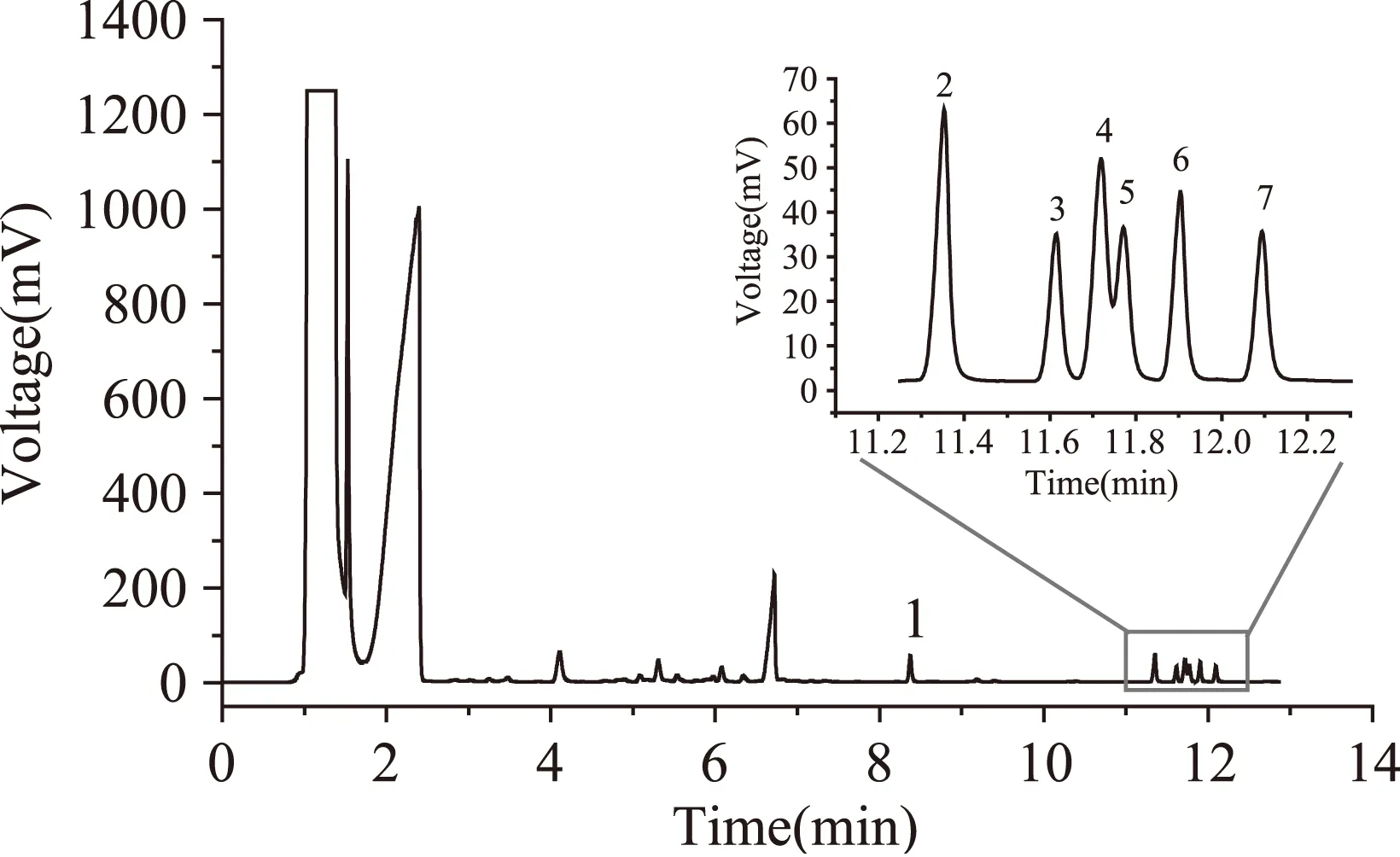
图1 1.00 μg/mL酚类化合物混标乙酰化后DLLME的色谱图Fig.1 Chromatograms of GC obtained by derivatization-DDSME with 1.00 μg/mL aqueous mixture of Phenols注:1-苯酚,2-邻苯二酚,3-邻硝基苯酚,4-间苯二酚, 5-对苯二酚, 6-间硝基苯酚,7-对硝基苯酚。
2.2衍生化效果
本实验分别在同一浓度下对比了酚类物质在酸化前后与衍生化前后的萃取效果和在气相色谱分析中的分离行为。
苯酚类化合物酸化前后的实验结果如图2所示。对比曲线a、b可知,相同浓度下,取1 μL 100 μg/mL混标水溶液直接进样分析,气相色谱未检测出以上七种酚类物质,而水样经过DLLME萃取后,苯酚和硝基酚的三种异构体得到了一定的检出,但检出水平很低;对比曲线b、曲线c可知,酸化(pH=2)前后,酚类物质的响应值与酸化前变化不大;对比曲线b、c、d可知,水样若只是经过酸化技术处理后进行DLLME萃取分析,检出能力十分低下。
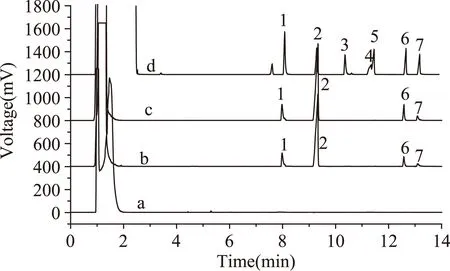
图2 酚类化合物DLLME处理前后及酸化前后的色谱图Fig.2 Chromatograms of GC obtained by non-or DLLME and non-or acidification process注:a)100 μg/mL混标水溶液直接进样的色谱图;b)100 μg/mL混标水溶液经过DLLME技术处理后进样的色谱图;c)100 μg/mL混标水溶液经过酸化(pH=2)和DLLME技术处理后进样的色谱图;d)1.00 mg/mL混标乙醇溶液直接进样的色谱图。其中,1-苯酚,2-邻硝基苯酚,3-邻苯二酚,4-间苯二酚,5-对苯二酚,6-间硝基苯酚,7-对硝基苯酚。
苯酚类化合物衍生化前后的实验结果如图2所示。对比曲线a、b可知,衍生化前后,生成的酯类化合物与原来的酚类化合物保留时间不同,衍生化后,除邻硝基苯酚的响应值变化略有降低外,其他酚类化合物的响应值都大大提高,并且能够检测的苯二酚的三种异构体,此外,酚类化合物衍生化后拖尾现象明显改善。
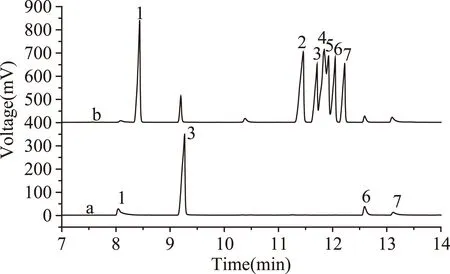
图3 50 μg/mL酚类混标水溶液衍生化前后 DLLME的进样色谱图Fig.3 Chromatograms of GC obtained by non-or derivatization DDSME with 50 μg/mL aqueous mixture of Phenols注:a)无衍生化DLLME;b)衍生化后DLLME; 其中,1-苯酚,2-邻苯二酚,3-邻硝基苯酚,4-间苯二酚, 5-对苯二酚, 6-间硝基苯酚,7-对硝基苯酚。
2.3衍生化DLLME条件的优化
2.3.1衍生化试剂用量的选择酚类与乙酸酐在碱性条件下发生乙酰化反应生成酯类,若乙酸酐的用量过少,则不能使酚类化合物充分衍生化,导致方法的灵敏性降低。此外,由于衍生化试剂乙酸酐在碱性条件可发生水解,同时降低碱度,因此一般实际衍生化试剂的用量远大于理论用量。若乙酸酐的用量过量,将影响溶液的pH,且过量的乙酸酐会损坏色谱柱。其中,酚类物质在乙酸酐用量为800 μL时,衍生化后色谱响应值最大。故本实验选择乙酸酐用量为800 μL。
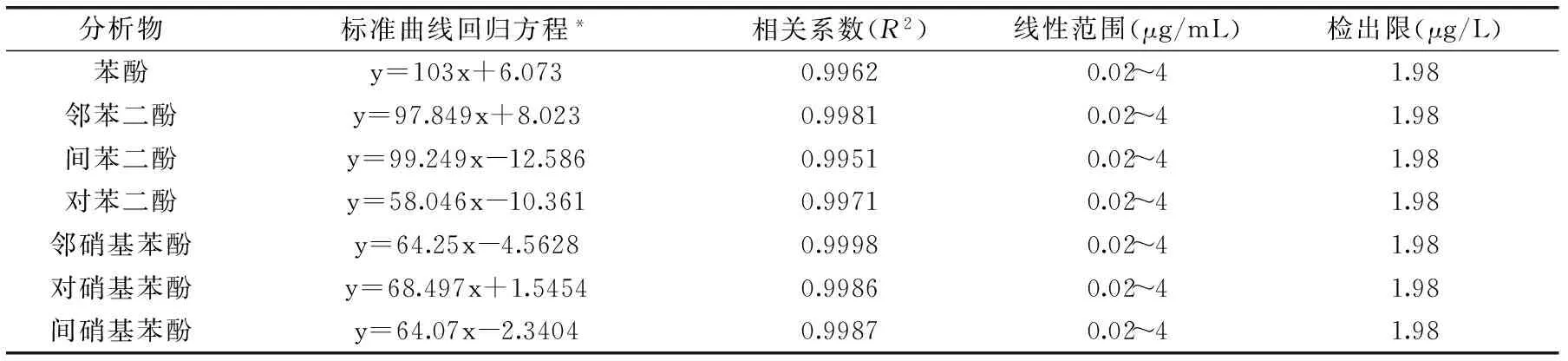
表1 原位乙酰化-分散液液微萃取法测定水样中酚类化合物的相关性能参数Table 1 The linear equation,correlation coefficients,linear range and LOD of the method
注:*:方程中浓度x的单位为μg/mL,y为色谱峰面积。
2.3.2衍生化反应温度的优化反应温度将影响衍生化反应过程,体系温度应保证易挥发性物质如苯酚等在溶液中仍有较大的溶解度。本实验衍生化的最佳温度为50 ℃。
2.3.3衍生化反应时间的优化衍生化反应时间应保证体系内的酚类化合物与乙酸酐充分反应,当反应时间达到一定条件后,进一步的延长衍生化时间后峰面积的增加将不明显,也可能因为酯的水解,峰面积反而降低。衍生化反应效果和反应时间呈非线性变化,当衍生化反应时间为30 min时,酚类物质的衍生化效果较好。
2.3.4萃取剂种类的选择实验结果表明,二氯甲烷对被分析的七种酚类化合物所生成的酯类有较好的萃取、富集效果。
2.3.5分散剂种类的选择实验结果表明,甲醇作为分散剂时萃取效果最佳,故本实验选择甲醇作为分散剂。
2.3.6萃取剂用量的选择实验表明,萃取效率随着萃取剂量的增大而降低,由于当萃取剂用量小于200 μL时,萃取剂体积太小,不利于取液进样,所以本实验的萃取剂用量选择200 μL。
2.3.7分散剂体积的选择实验结果表明,当甲醇用量小于10 μL时,随着分散剂的用量的增大,萃取剂形成微球分散于水样中,萃取剂的表面积增大,萃取效果显著提高;但甲醇的用量大于10 μL时,目标待测物过多地溶于水相,富集效果较差,且萃取剂也会部分分散于水样中,导致离心后,有机相的体积太小不利于取样分析。所以本实验的分散剂用量选择10 μL。
2.3.8盐度的影响结果表明,沉积相体积随氯化钠溶液质量浓度增加而增大,但富集倍数降低,且萃取效率也降低,故该实验选择不加盐。
2.4工作曲线的绘制
准确配制一系列浓度的混合标液,固定上述最佳实验条件,按上述实验操作方法,每个样品平行测定5次,得出其线性回归方程、相关系数、检出限(以3倍S/N计)如表1所示。
2.5实际水样分析
实际水样分别取自漳州市九龙江水样、东山县某饮用水库水样、东山县自来水水样。将三种水样分别用0.45 μm滤头过滤得洁净滤液,并按该法进行测定分析,加标回收实验的加标量为1.00 μg/mL,结果如表2所示,其中,漳州九龙江水样的色谱图如图4所示。
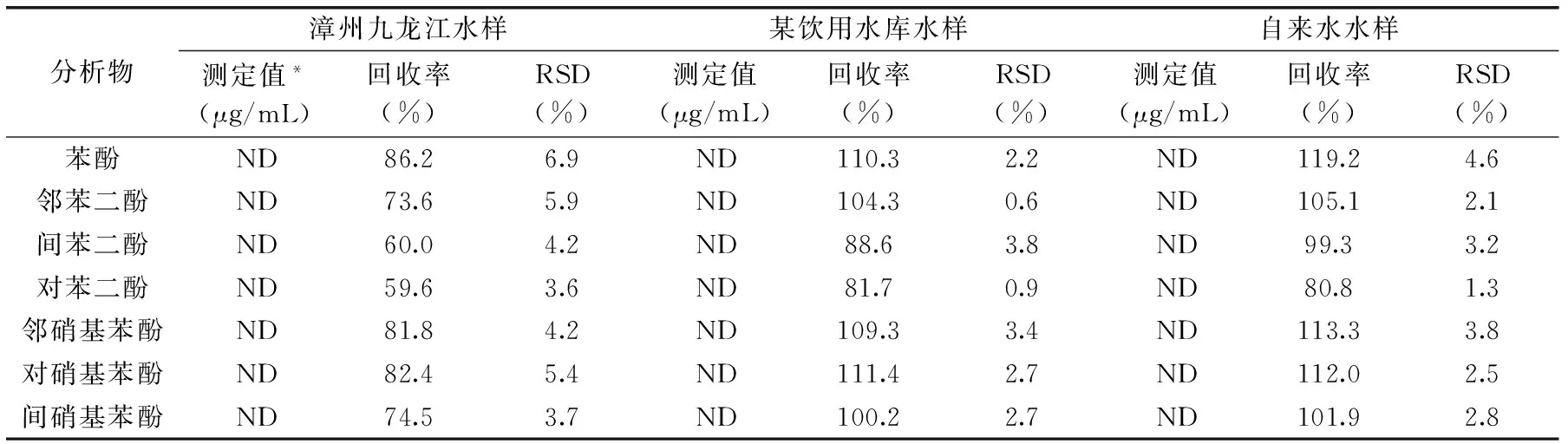
表2 实际水样测定结果分析(n=6)Table 2 Determination results of Phenols in real samples(n=6)
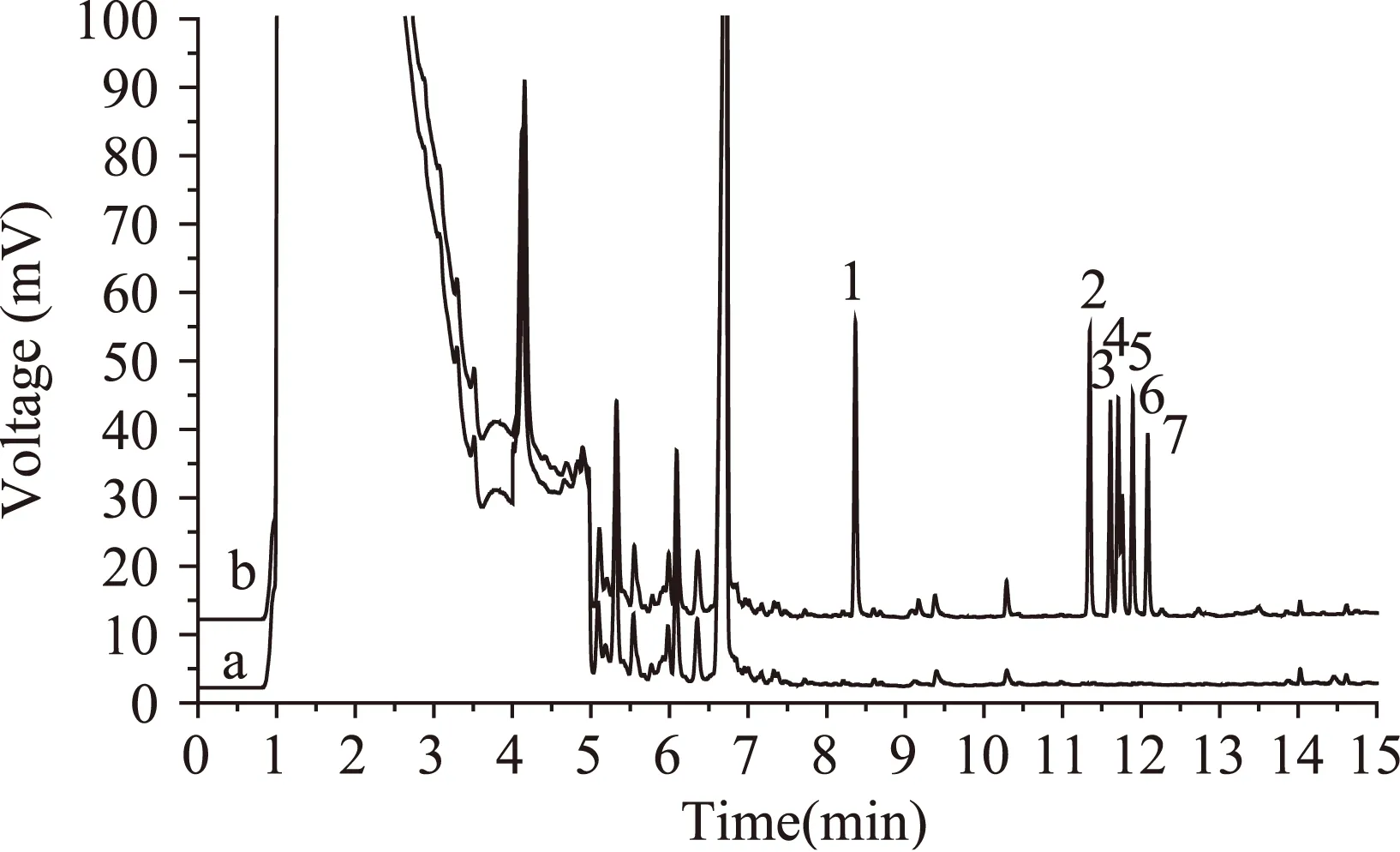
图4 漳州九龙江水样原位乙酰化-DLLME进样色谱图Fig.4 Chromatograms of Phenols in the water sample of Jiulong river of Zhangzhou and spiked with 1.00 μg·mL-1 of PAEs mixed standard solution注:a:空白水样;b:加标量为1.00 μg/mL的加标样; 其中,1-苯酚,2-邻苯二酚,3-邻硝基苯酚, 4-间苯二酚,5-对苯二酚, 6-间硝基苯酚,7-对硝基苯酚。
注:*:ND-小于方法检出限。
3 结论
本文建立了原位乙酰化-分散液液微萃取-气相色谱测定水样中酚类物质的方法,探讨和优化了测定的最佳条件。实验证明,通过衍生化技术处理,苯酚类化合物在水样中易离子化和在色谱上严重拖尾的现象得到显著改善,方法的检出限降低,使定性及定量分析更加精确化。衍生化技术与分散液液微萃取(DLLME)技术相结合用于测定水样中酚类物质是一种高效、简便、快速和低成本的分析测定方法。
[1]农永光,胡刚. 水中挥发酚的环境监测方法[J].科技资讯,2011,30(10):152.
[2]Claude S,Christine G,Jamal A C,et al. Analysis of phenols and nitrophenols in rainwater collected simultaneously on an urban and rural site in east of France[J]. Sci Total Environ,2009,407(21):5637-5643.
[3]林华宝. 含酚废水治理技术现状与展望[J]. 化学工程与装备,2010,10(7):131-133.
[4]United State Enviromental Protection Authority.Toxic Substances Control ACT(TSCA)[M]. USEPA Washington DC,1979.
[5]Tremp J,Mattrel P,Fingler S,et al. Phenol and nitrophenols as tropospheric pollutants:emissions from automobile exhausts and phase transfer in the atmosphere[J]. Water Air Soil Poll. 1993,68(1):113-123.
[6]王京平. 气相色谱-邻苯二甲酸二甲酯内标法同时测定硝基苯酚的三种异构体[J]. 色谱,2004,22(5):562.
[7]袁月明. 直接分光光度法测定水中挥发酚[J]. 中国热带医学,2005,5(3):558-559.
[8]肖纯,张凯农. Folin Denis试剂测定茶中酚类化合物[J]. 茶叶,2003,29(1):28-32.
[9]Kushnir I,Barr P,Chortyk T. An improved quantitative method for volatile phenols[J]. Anal Chem,1970,42(13):1619-1621.
[10]Czuczwa J,Leuenberger C,Tremp J,et al. Determination of trace levels of phenol and cresols in rain by continuous liquid-liquid extraction and high performance liquid chromatography[J]. J Chromatogra A,1987,403:233-241.
[11]Rezaee M,Assadi Y,Ahmadi F,et al. Determination of Organic Compounds in Water Using Dispersive Liquid-liquid Microextraction[J]. J Chromatogra A,2006,1116(1-2):1-9.
Determination of phenols in water samples using simultaneous derivatization and dispersive liquid-liquid microextraction followed by gas chromatography
CHEN Min-er
(Dongshan Environmental Protection Bureau,Zhangzhou 363400,China)
A simple,rapid and sensitive derivatization and microextraction technique for the determination of Phenols in water samples was developed using simultaneous derivatization and dispersive liquid-liquid microextraction followed by gas chromatography-flame ionization detection(GC-FID). In this method,800 μL acetic anhydride(derivatization agent)was injected rapidly into 5 mL water samples(pH=7.00)in a test tube with conical bottom and derivatized 30 min under the temperature of 50 ℃. Then,200 μL dichoromethane(extraction solvent)and 10 μL methanol(disperser solvent)was injected into the solution and the mixture was gently shaken. After centrifugation of the cloudy solution,the derivatized analytes in the sedimented phase were determined by GC-FID. Under optimized conditions,the approach was applied to the determination of Phenols in water samples with a linearity range of 0.02~4.00 μg/mL. Correspondingly,the determination limit at an S/N of 3 were 1.98 μg/L.The recoveries of real samples at different spiked levels of Phenols ranged from 59.6% to 119.2% and the relative standard deviations less than 6.90%.
derivatization;dispersive liquid-liquid microextraction;gas chromatography;phenols
2016-02-22
陈敏儿(1969-),女,中专,助理工程师,研究方向:环境水质分析,E-mail:Zhangmsh704@163.com。
福建省自然科学基金(2013J01062)。
TS207
A
1002-0306(2016)15-0300-04
10.13386/j.issn1002-0306.2016.15.049

