拟干酪乳杆菌发酵生产L-乳酸过程中在线生理参数CER和RQ用于指导发酵过程优化
张 悦,田锡炜,王永红,储 矩,庄英萍,张嗣良
(华东理工大学国家生化工程技术研究中心,上海 200237)
拟干酪乳杆菌发酵生产L-乳酸过程中在线生理参数CER和RQ用于指导发酵过程优化
张悦,田锡炜,王永红*,储矩,庄英萍,张嗣良
(华东理工大学国家生化工程技术研究中心,上海 200237)
生理参数二氧化碳释放速率(CER)和呼吸商(RQ)对于深入理解生物过程的变化具有非常重要的意义。本研究以拟干酪乳杆菌发酵生产L-乳酸过程为研究对象,解析了发酵过程中CER和RQ变化与细胞生长和代谢之间关系,结果表明,CER与细胞生长速率密切相关,能够有效表征菌体的生长状态,而RQ值能很好地反映过程中代谢途径的变化。将CER和RQ作为在线指导参数,通过分阶段氮源添加策略,使得L-乳酸产率和转化率较原始发酵工艺分别提高了5.9%和3.0%,而且副产物乙酸和乙偶姻的浓度分别下降了31.3%和24.7%。因此,通过生理参数CER和RQ的变化对发酵过程进行优化,能够有效地提高L-乳酸的发酵产量和质量。
拟干酪乳杆菌,乳酸,二氧化碳释放速率(CER),呼吸商(RQ)
乳酸是一种天然存在的有机酸,在食品、化妆品、医药和化工行业具有非常广泛的应用。近年来,聚乳酸产品作为传统化石来源塑料的替代品,更是大大带动了全球范围对乳酸的需求[1-2]。
氧摄取速率(OUR)、二氧化碳释放速率(CER)和呼吸商(RQ)分别表示细胞代谢过程中O2的消耗速率、CO2的释放速率和两者的比值,它们的水平能够有效地反映细胞生理代谢状态以及代谢通量分布,因此可以作为衡量发酵水平的重要指标[3-4]。通过OUR、CER和RQ的变化趋势来确定细胞的代谢情况,是从宏观和微观尺度指导发酵过程优化的纽带[5]。李强等人研究了不同微生物(霉菌、酵母菌和细菌)在不同发酵体系(单液相体系、双液相体系、纯种发酵和混合发酵)下,CER的变化规律,结果表明CER的变化与体系状态的变化有着密切的联系,因此能够有效、准确地把握发酵过程[6]。Zeng等人在微耗氧的2,3-丁二醇发酵过程研究中发现,RQ控制在4.46对产物合成最有利,同时转化率也最高,而且这个值可以通过途径的反应方程直接计算得到[7]。
虽然在过去凝结芽孢杆菌生产L-乳酸的过程中,已经引入了CER和RQ来对发酵过程的特征进行表征和分析[8],但是在乳杆菌生产乳酸的研究中仍未有报道。本研究以拟干酪乳杆菌发酵生产L-乳酸过程为研究对象,通过多参数分析过程中CER和RQ的变化规律,并将其作为监控参数跟踪整个发酵过程,从而揭示可能存在的潜在限制因素,指导L-乳酸产量、产率和转化率的提高。
1 材料与方法
1.1材料与仪器
拟干酪乳杆菌(Lactobacillusparacasei)为实验室保藏菌株;葡萄糖上海惠兴生化试剂有限公司;蛋白胨(Peptone)、酵母提取物(Yeast Extract)Oxoid;牛肉提取物(Beef Extract)上海生工生物有限公司;葡萄糖试剂盒上海科华生物工程股份有限公司;蒸馏水实验室自制;其它试剂来源于国药集团化学试剂有限公司。
5 L搅拌式生物反应器上海国强生化工程装备有限公司;pH和溶氧(DO)电极美国梅特勒-托勒多公司;752紫外可见分光光度计上海菁华科技仪器有限公司;SBA-40D生化分析仪山东省科学院;冰点渗透压仪上海医科大学仪器厂;MAX300-LG过程质谱仪美国Extrel质谱公司。
1.2实验方法
1.2.1培养基成分种子培养基(g/L):蛋白胨 10,牛肉提取物 10,酵母提取物 10,柠檬酸氢二铵 2,磷酸氢二钾 2,乙酸钠 4,硫酸镁 0.2,硫酸锰 0.2,氯化钠 0.03,硫酸铁 0.01,碳酸钙 25,吐温-80 1 mL/L,氢氧化钠调节上述溶液pH至6.0,115 ℃灭菌20 min,葡萄糖(40 g/L)与上述其它成分分开配制,115 ℃灭菌20 min;发酵培养基(g/L):葡萄糖 200,蛋白胨 13.33,酵母提取物 13.33,乙酸钠 0.67,硫酸镁 0.0133,硫酸锰 0.0133,氯化钠 0.0133,硫酸铁 0.0133,摇瓶发酵时,氢氧化钠调节上述溶液pH至6.0,115 ℃灭菌20 min。
1.2.2培养条件种子培养:用50 mL无菌水将新鲜茄子瓶斜面中的菌体悬浮,取15 mL悬浮液接种于85 mL种子培养基中,在37 ℃,110 r/min培养箱中培养12 h;摇瓶发酵培养:将20 mL种子培养液接种于80 mL发酵培养基中,接种量为20%,250 mL三角摇瓶置于37 ℃,110 r/min培养箱中,培养24和48 h,发酵初始加入一定量碳酸钙调节过程pH;5 L罐发酵培养:发酵过程中工作体积为4 L,接种量为20%,温度和转速分别为37 ℃和150 r/min,通气量为0.125 vvm[9];氮源分阶段添加实验:将发酵初始添加所有氮源(13.33 g/L酵母膏和13.33 g/L蛋白胨)作为对照组,分阶段补加策略为实验组,实验组条件为:发酵初始和发酵8 h分别添加50%对照组初始氮源浓度(6.67 g/L酵母膏和6.67 g/L蛋白胨)。上述所有实验均进行三次平行。
1.2.3细胞生物量测定用稀盐酸稀释发酵液至一定浓度,在紫外可见分光光度计下测定620 nm波长时的吸光值,使得测定的光密度值(OD)处于0.2~0.8之间。细胞生物量通过细胞干重(DCW)来表示,两者关系为:1 OD相当于0.41 g/L DCW。
1.2.4发酵液中L-乳酸、葡萄糖和乙酸、甲酸、乙偶姻的测定取一定量发酵液在5000 r/min条件下离心10 min,弃去菌体,稀释上清液使得葡萄糖和L-乳酸浓度分别处于1和0.5 g/L以下。L-乳酸浓度通过SB-40C生物传感分析仪进行测定,葡萄糖浓度通过试剂盒进行测定,副产物通过Agilent 1100高效液相色谱进行测定。检测条件:色谱柱为Varian Metacarb H Plus柱(300 mm×7.8 mm),流动相为5 mmol/L硫酸,流速为0.4 mL/min,检测温度为50 ℃,检测器为紫外检测器,检测波长为210 nm,进样量为 10 μL。
1.2.5发酵过程中OUR、CER和RQ测定OUR、CER和RQ计算通过对发酵尾气的分析数据计算得到。以进气和尾气中惰性气体N2维持恒定建立平衡方程,求得OUR、CER和RQ的计算公式如下[10]:
式中,Fin:进气流量(L/min);V:发酵液体积(L);Cinert in、CO2in、CCO2in:分别为进气中惰性气体、氧气及二氧化碳的质量分率;CO2out、CCO2out:分别为排气中氧气和二氧化碳的质量分率;Pin:进气的绝对压强(Pa);tin:进气的温度(℃);h:进气的相对湿度(%)。
1.2.6生长速率根据下述公式,选取0.2 h为时间间隔,可计算得到整个发酵过程中菌体的生长速率:
dX/dt=μ×X
1.3数据处理
生长曲线采用Origin 8.5进行拟合。
2 结果与分析
2.1拟干酪乳杆菌发酵生产L-乳酸过程中生理代谢特性的变化
在拟干酪乳杆菌发酵生产L-乳酸的过程中,菌体的生长期为12 h左右,同时L-乳酸的合成与菌体生长表现出非常良好的相关性,这也证实了乳酸合成是一个生长相关系数非常高的过程(图1A)。由于乳酸发酵过程为微耗氧发酵过程,而且菌体一直处于氧限制状态,因此其OUR水平保持在同一水平(图1B)。但是值得注意的是,过程中CER和RQ的变化趋势却明显不同于OUR,图1(B)可以看出,CER值在发酵4 h左右开始迅速上升,并在11 h 左右达到顶峰,此后CER值开始下降,并随着发酵的进行,其下降趋势开始变缓。RQ是微生物CER和OUR的比值,因此其变化趋势与CER非常相似,从初始的1.3逐渐上升至最高的9.4(9 h左右),然后再渐渐下降到发酵结束时的1.8。
CER是细胞释放CO2的速率,它综合表征了细胞内产生CO2途径通量的比例,其中碳代谢主要包括磷酸戊糖途径、柠檬酸循环以及一些涉及CO2的回补途径等。而RQ值的变化主要受到4个因素影响,包括微生物生长、微生物维持、产物合成以及副产物合成。一般来说,有氧条件下,微生物利用葡萄糖作为碳源生长时的RQ在1左右,而且葡萄糖完全氧化时其RQ也为1。具体结合到拟干酪乳杆菌微耗氧发酵生产L-乳酸的过程,由于乳酸菌在缺少外界添加血红素的情况下,电子传递链无法行使完全的功能,因此细胞在生长和维持时需要的能量更多是依赖于底物水平磷酸化而获得,同时乳酸合成过程是一个生长非常相关的过程,表明发酵过程中CER和RQ值的变化更多受到产物和副产物途径通量比例的影响。
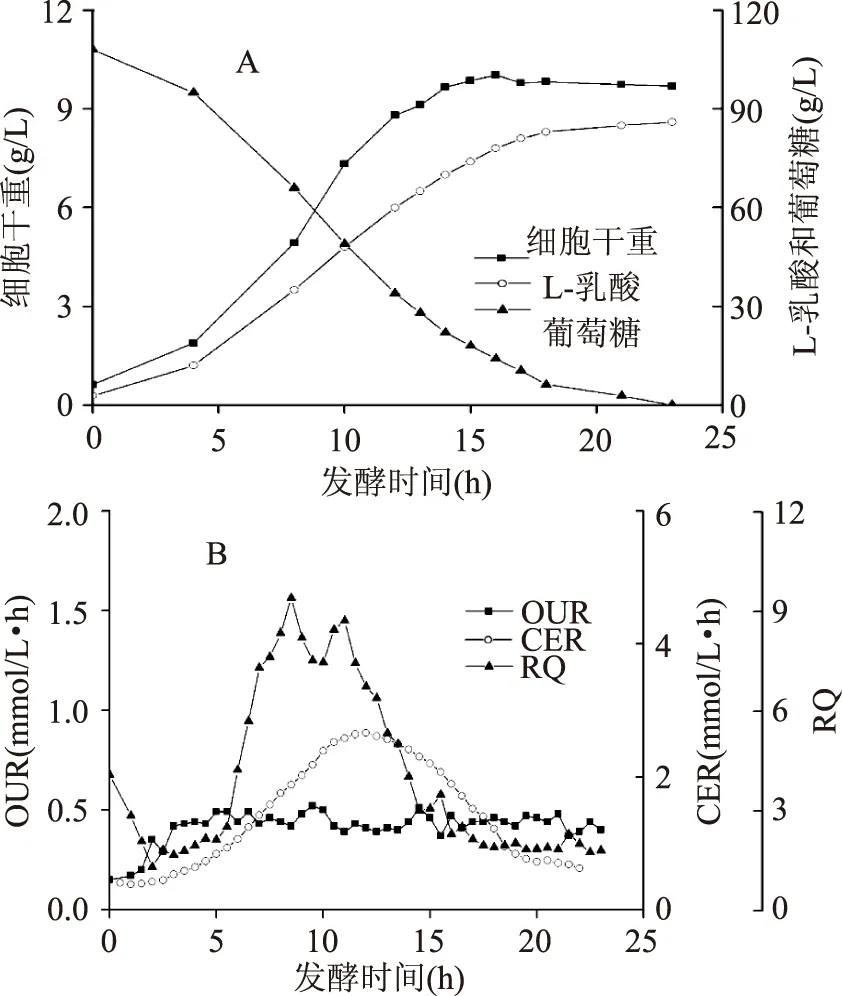
图1 拟干酪乳杆菌发酵生产L-乳酸过程中菌体生长、产酸和耗糖的变化(A)以及生理参数OUR、CER和RQ的变化(B)Fig.1 Time courses of cell growth,L-lactic acid production and glucose consumption(A),and physiological parameters OUR,CER and RQ(B)by L. paracasei
2.2生理参数CER和RQ用于指导拟干酪乳杆菌生长和代谢的分析
通过分析发酵过程中菌体生长的变化曲线(图1A),发现其非常符合S型变化。运用Origin 8.5中S型拟合曲线(Doseresp)进行拟合后,R2能够达到0.996。
此外,以0.2 h为间隔,计算整个发酵过程中菌体的生长速率,并将生长速率和CER进行对比(图2),可以看出两者的变化趋势基本一致,都呈现先上升后下降的趋势,而且在8.5 h左右达到顶峰。这就说明发酵过程中CER变化与菌体生长密切相关,并能有效地反映菌体生长状态。
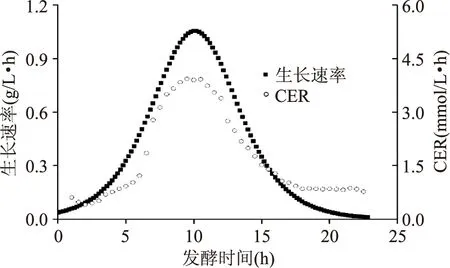
图2 拟干酪乳杆菌发酵生产L-乳酸过程中,菌体生长速率和CER的比较Fig.2 Comparison of cell growth rate and CER in L-lactic acid production by L. paracasei
表1列出了葡萄糖代谢生成产物和副产物时的反应式和对应RQ值以及产生的ATP值。当1 mol葡萄糖经过同行乳酸转化后理论上能产生2 mol乳酸,并伴随2 mol ATP生成。同时这个过程既不需要氧气也不生成CO2,所以不存在RQ值。但是当生成副产物乙酸时,其过程产生的ATP量是生成乳酸时的2倍,但也会伴随产生4 mol NADH,从而造成还原力的不平衡,需要通过氧气将其氧化再生成NAD+。结合胞外副产物图谱可以发现,拟干酪乳杆菌发酵生产L-乳酸过程中,测得的主要副产物为乙偶姻、乙酸和甲酸(图3)。值得注意的是,在快速生长期(0~8 h),虽然细胞会积累少量的副产物乙偶姻,但是此阶段主要产生的副产物为乙酸和甲酸,其中乙酸更多积累于0~12 h快速生长期,而甲酸则基本上在4 h后开始积累。发酵初始阶段,发酵液存在氧,此时丙酮酸甲酸裂解酶活性会受到严重抑制[11-12],因此丙酮酸更多通过丙酮酸脱氢酶体系生成乙酰辅酶A,再转化为乙酸。当发酵4 h以后,发酵液中溶氧已经降为0,此时会有甲酸通过丙酮酸甲酸裂解酶生成,同时产生的氧气乙酰辅酶A在转化为乙酸的同时,可能会伴随乙醇的合成,因此在RQ曲线上表现为RQ值迅速上升,并远远大于1。相比之下,稳定期是细胞大幅度合成和积累乙偶姻的阶段。有报道指出,乙偶姻作为一种中性物质,在细胞代谢中具有防止发酵液酸化,参与调解NADH/NAD+平衡以及储存碳源的生理作用[13]。
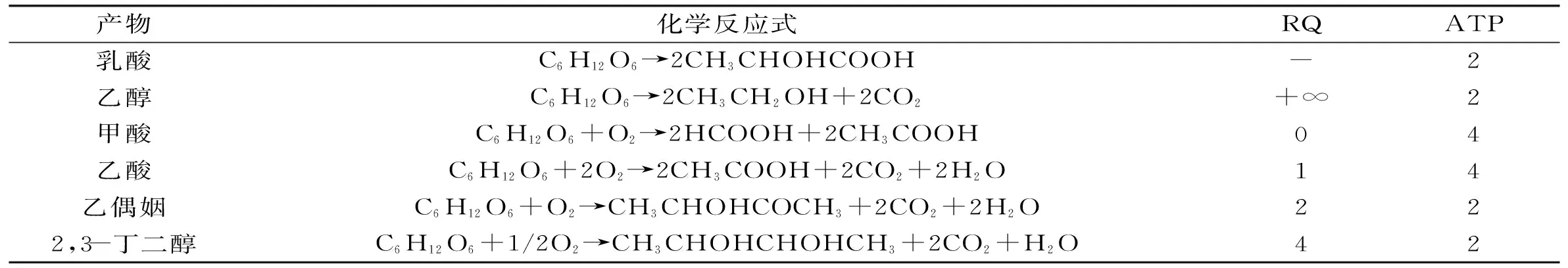
表1 拟干酪乳杆菌发酵生产L-乳酸过程中,葡萄糖代谢生成相关产物的化学反应式

图3 拟干酪乳杆菌发酵生产L-乳酸过程中,胞外副产物随时间的变化Fig.3 Time courses of extracellular byproducts in L-lactic acid production by L. paracasei
>2.3分阶段氮源添加策略对拟干酪乳杆菌生成L-乳酸的影响
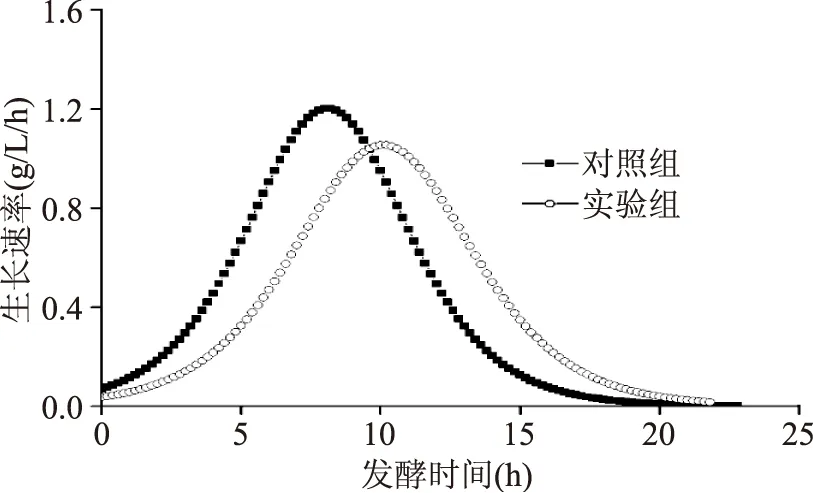
图4 不同氮源补加策略下,过程菌体生长速率的比较Fig.4 Comparison of process cell growth rate with different nitrogen source addition strategies
综合上述分析,菌体在快速生长期需要更多的能量供给,通过乳酸合成途径产生的ATP已经不能完全满足生长的需求,进而部分通量转向高产ATP的乙酸途径。同时宏观生理参数CER和RQ能够有效地表征菌体生长和代谢途径的变化。因此,为了提高发酵过程中乳酸发酵的效率,在接下来的实验中,以CER和RQ的在线监测为指导,分阶段氮源添加为控制菌体生长的策略(详见1.2.2),从而达到发酵过程优化的目的。表2列出了实验组和对照组各发酵参数的对比情况。两种条件下,菌体能达到的最大生物量相差不大,分别为9.82、10.04 g/L。但是实验组较之对照组的乳酸产量、产率和转化率均有不同程度的提高。通过比较实验组和对照组的过程生长速率变化(图4),可以发现实验组生长速率较对照组来得更为平缓,其达到生长速率最大值的时间要落后于对照组,同时最大值也更小,但是其生长时间要大于对照组,因此从侧面解释了乳酸作为生长非常相关型产物在实验组条件下产量、产率和转化率高的原因。相对应的,实验组条件下CER和RQ的最大值都要明显小于对照组,分别下降了32.5%和29.3%(表2),这也就说明在生长过程中副产物的合成也可能会少于对照组。胞外副产物的测定结果证实了实验组条件下,虽然最终甲酸转化率基本不变,但是乙酸和乙偶姻的转化率分别下降了31.3%和24.7%,分阶段添加氮源策略控制了菌体的快速生长,延长了生长期,使得乳酸整体产率和转化率分别提高了5.9%和3.0%(表2)。
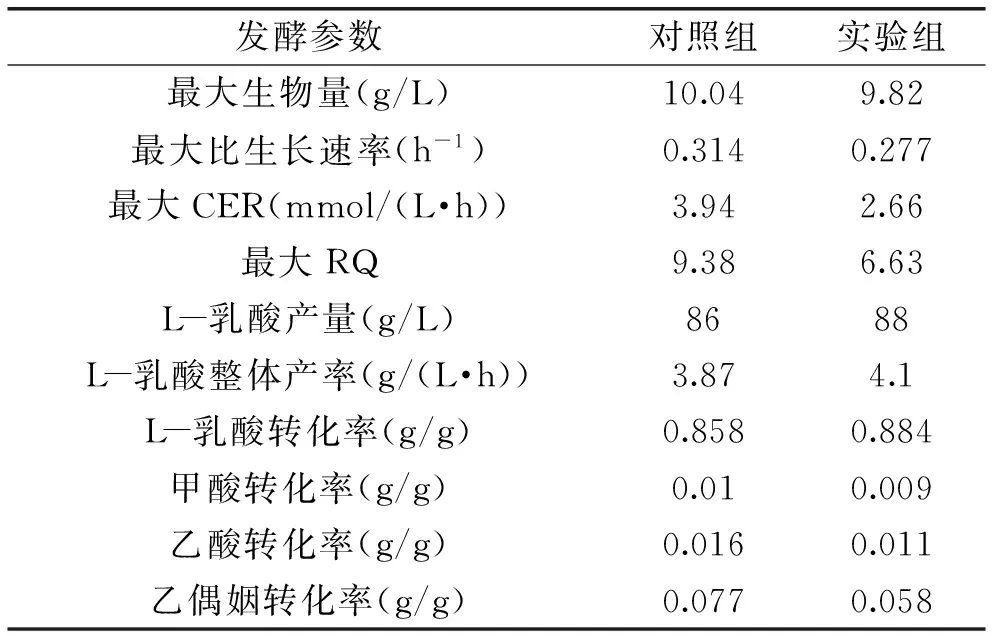
表2 不同氮源补加策略下,各种发酵参数的比较
3 结论
本实验研究了拟干酪乳杆菌发酵生产L-乳酸过程中CER和RQ的变化,发现CER与菌体生长密切相关,能够有效表征发酵过程中菌体的生长状态,同时RQ能够有效解析发酵过程中代谢途径的变化。通过以CER和RQ为在线指导参数,分阶段添加氮源后,能够有效控制菌体的快速生长,并延长生长期,使得整体产率和转化率分别提高了5.9%和3.0%,而主要副产物乙酸和乙偶姻含量则分别下降了31.3%和24.7%,最终达到降低副产物合成,提高发酵效率的目的。本研究将CER和RQ作为发酵指导参数应用于乳酸发酵过程优化的策略也希望能为其它发酵的生物过程提供借鉴。
[1]John RP,Nampoothiri KM,Pandey A. Fermentative production of lactic acid from biomass:an overview on process developments and future perspectives[J]. Appl Microbiol Biotechnol,2007,74:524-534.
[2]Okano k,Tanaka T,Ogino C,et al. Biotechnological production of enantiomeric pure lactic acid from renewable resources:recent achievements,perspectives,and limits[J]. Appl Microbiol Biotechnol,2010,85:413-423.
[3]Wang Y,Chu J,Zhuang Y,et al. Industrial bioprocess control and optimization in the context of systems biotechnology[J].
Biotechnol Adv,2009,27:989-995.
[4]张嗣良. 发酵过程对水瓶问题及其生物反应器装置技术研究——基于过程参数相关的发酵过程优化与放大技术[J].中国工程科学,2001,3:37-45.
[5]Zhang S,Chu J,Zhuang Y. A multi-scale study of industrial fermentation processes and their optimization[J]. Adv Biochem Eng Biotechnol,2004,87:97-150.
[6]李强,曹竹安. 微生物发酵中二氧化碳释放速率变化规律[J]. 生物工程学报,1996,S1:237-242.
[7]Zeng AP,Deckwer WD. Bioreaction techniques under microaerobic conditions:from molecular to pilot plant reactors[J]. Chem Eng Sci,1996,51:2305-2314.
[8]王然明,王泽建,田锡炜,等. 生物过程尾气质谱仪在乳酸发酵工艺控制中的应用[J]. 华东理工大学学报,2013,39:289-295.
[9]Xu G,Chu J,Wang Y,et al. Development of a continuous cell-recycle fermentation system for production of lactic acid by Lactobacillus paracasei[J]. Process Biochem,2006,41:2458-2463.
[10]Wang Z,Wang H,Li Y,et al. Improved vitamin B(12)production by step-wise reduction of oxygen uptake rate under dissolved oxygen limiting level during fermentation process[J]. Bioresour Technol,2010,101:2845-2852.
[11]Leibig M,Liebeke M,Mader D,et al. Pyruvate formate lyase acts as a formate supplier for metabolic processes during anaerobiosis inStaphylococcusaureus[J]. J bacteriol,2011,193:952-962.
[12]Melchiorsen CR,Jokumsen KV,Villadsen J,et al. Synthesis and posttranslational regulation of pyruvate formate-lyase in Lactococcus lactis[J]. J bacteriol,2000,182:4783-4788.
[13]Xiao Z,Xu P. Acetoin metabolism in bacteria[J]. Crit Rev Microbiol,2007,33:127-140.
Optimization of L-lactic acid fermentation process inLactobacillusparacaseithrough on-line physiological parameter CER and RQ
ZHANG Yue,TIAN Xi-wei,WANG Yong-hong*,CHU Ju,ZHUANG Ying-ping,ZHANG Si-liang
(State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai 200237,China)
Carbon dioxide evolution rate(CER)and respiratory quotient(RQ)are two important physiological parameters for deep understanding of bioprocesses. In this study,on the basis of L-lactic acid production byLactobacillusparacasei,the relationships of CER and RQ with cell growth and metabolism were investigated. The results indicated that CER was closely related to cell growth rate,and it could characterize the cell growth status effectively. Furthermore,during the fermentation,intracellular metabolic pathway change could be well reflected by macroscopical RQ level. Through adoption of CER and RQ as online indicative parameters,and applying rational step wise nitrogen source addition strategy,overall L-lactic acid productivity and yield improved by 5.9% and 3.0%,respectively,while the primary byproducts acetic acid and acetoin decreased by 31.3% and 24.7%. On the basis of these results,both of L-lactic acid quantity and quality could be efficiently improved through on-line monitoring physiological parameters CER and RQ.
Lactobacillusparacasei;lactic acid;carbon dioxide evolution rate(CER);respiratory quotient(RQ)
2015-10-10
张悦(1985-),女,硕士,实验师,研究方向:发酵工程,E-mail:zhangyue@ecust.edu.cn。
王永红(1966-),女,教授,研究方向:发酵工程、代谢工程,E-mail: yhwang@ecust.edu.cn。
国家重点基础研究发展计划(973计划)(2013CB733600);国家高技术研究发展计划(863计划)(2012AA021201)。
TS201.3
A
1002-0306(2016)12-0233-05
10.13386/j.issn1002-0306.2016.12.036

